| 头颅柔性线圈改善MRS图像质量的可行性 |
MRS是目前唯一能够无创性研究人体组织代谢、生理生化改变的定量分析方法[1],在临床中应用广泛,尤其在中枢神经系统疾病中可协助疾病定性。但MRS为多参数成像技术,扫描过程复杂,对成像技术要求严格,其中,射频线圈的稳定性是保证MRS图像质量可靠的重要因素之一[2]。本课题组设计的头针专用柔性12通道头颅线圈(AHC12),可在不提升线圈通道的前提下,通过降低线圈与成像目标间的距离,提高成像性能[3-4]。本研究通过比较使用AHC12线圈、硬质16通道常规头颅线圈(HNC16)和硬质24通道正交头颅线圈(HC24)时MRS的图像质量,进一步探讨AHC12线圈改进MRS图像质量的可行性。
1 资料与方法 1.1 一般资料于2018年3—5月招募30例健康受试者,男4例,女26例;年龄21~30岁,平均(25.83±1.93)岁。所有受试者均签署试验知情同意书。本研究通过医院伦理委员会批准。
1.2 纳入标准① 无精神及神经疾病史;②无脑器质性疾病及颅脑外伤史;③无高血压及糖尿病病史;④颅脑常规MRI检查正常。
1.3 仪器与方法采用联影uMR 560 1.5 T MRI扫描仪,受试者取仰卧位,用海绵垫固定头部,嘱其在扫描过程中制动。头颅线圈分别采用HNC16、HC24及AHC12,按顺序抽签随机安排。每个线圈采用的成像序列及定位方法完全一致:先行常规MRI横断面T2WI序列扫描,扫描参数:FSE序列,TR 5 000 ms,TE 81.1 ms,带宽190 Hz,翻转角150,层厚5 mm,层距1 mm,视野200 mm×230 mm,矩阵331×448。后行1H-MRS序列扫描:先以T2WI横断面图像定位,再采用单体素点分辨率波谱成像(PRESS)序列行三维定位线扫描,ROI放置于左侧丘脑,注意避开脑室、血管和钙化等区域,在ROI上下、左右及前后分别添加饱和带以抑制周围干扰信号;在ROI内进行匀场、水抑制,使水峰的半高全宽<10 Hz后自动进行波谱采集,体素内匀场、水抑制均由自动扫描程序完成。扫描参数:TR 1 700 ms,TE 144 ms,视野200 mm×230 mm,体素大小20 mm×20 mm×20 mm,层厚5 mm,ROI大小约50 mm2,翻转角90°,带宽1 000 Hz,采样数1 024,矩阵222×320,扫描时间221 s。获得谱线后进行基线校正和相位校正,每个线圈成像参数及ROI保持完全一致。
1.4 MRS图像质量客观评价及主观评价 1.4.1 客观评价采用联影uWS-MR(SW 001.003版本)工作站处理MRS数据,使用Spectroscopy功能分析模块进行基线调整、代谢物识别,自动获取代谢物的波谱图像,包括N-乙酰天冬氨酸(NAA)及肌酸(Cr)的半高全宽值、SNR值、浓度积分值及NAA/Cr积分比值。再将波谱图像文件导入LCModel波谱后处理软件(版本6.3-1J),进行自动线性拟合后分析3个线圈所获得的图像质量参数,包括各代谢产物[NAA、N-乙酰天冬氨酰谷氨酸(NAAG)、NAA+ NAAG、Cr、磷酸肌酸(PCr)、Cr+PCr、谷氨酸(Glu)、谷氨酰胺(Gln)、Glu+Gln、乳酸(Lac)]与Cr+PCr的浓度比值及其估计标准差(SD%),以及数据位移、相位值。
1.4.2 主观评价由2位具有5年以上影像诊断经验且有MRS后处理经验的放射科医师对3种线圈所获得的谱线基线、谱线线型分别进行半定量评分:首先应用LCModel软件读取MRS谱线(图 1,2),再对其进行李克特量表(Likert评分)5级评分:1分表示基线质量极差,无法进行诊断;5分表示基线质量最佳,可获得准确诊断,1~5分程度依次增加。最后取2位医师的均值作为该基线质量评分。MRS图像伪影识别也进行Likert评分:1分为图像伪影多,图像质量不满意;5分为图像无伪影,图像质量非常满意,1~5分程度依次增加。
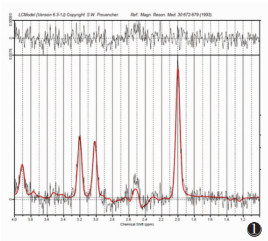 |
| 图 1 女,25岁,头颅柔性线圈MRS谱线LCModel后处理图像,谱线基线、谱线线型李克特量表评分均为5分 |
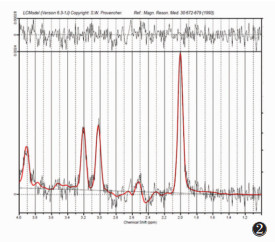 |
| 图 2 女,25岁,头颅16通道硬质线圈MRS谱线LCModel后处理图像,谱线基线、谱线线型李克特量表评分均为4分 |
1.5 统计学分析
采用组内相关系数(ICC)评价2名观察者间图像质量主观评价分析的一致性,ICC值>0.80为一致性较好,0.61~0.80为中等,0.41~0.60为一般,0.11~0.40为较低。对计量资料进行正态分布检验,如果呈正态分布,采用方差分析,数据以x±s表示;如果呈非正态分布,采用非参数检验,数据用中位数(最小值,最大值)表示。图像质量主观评价采用单因素非参数检验Kruskal-Wallis H检验进行分析,Nemenyi检验用于两两组间比较。以P<0.05为差异有统计学意义。
2 结果 2.1 MRS图像质量客观评价(表 1,2)| 表 1 3种线圈MRS成像的LCModel后处理图像质量参数比较 |
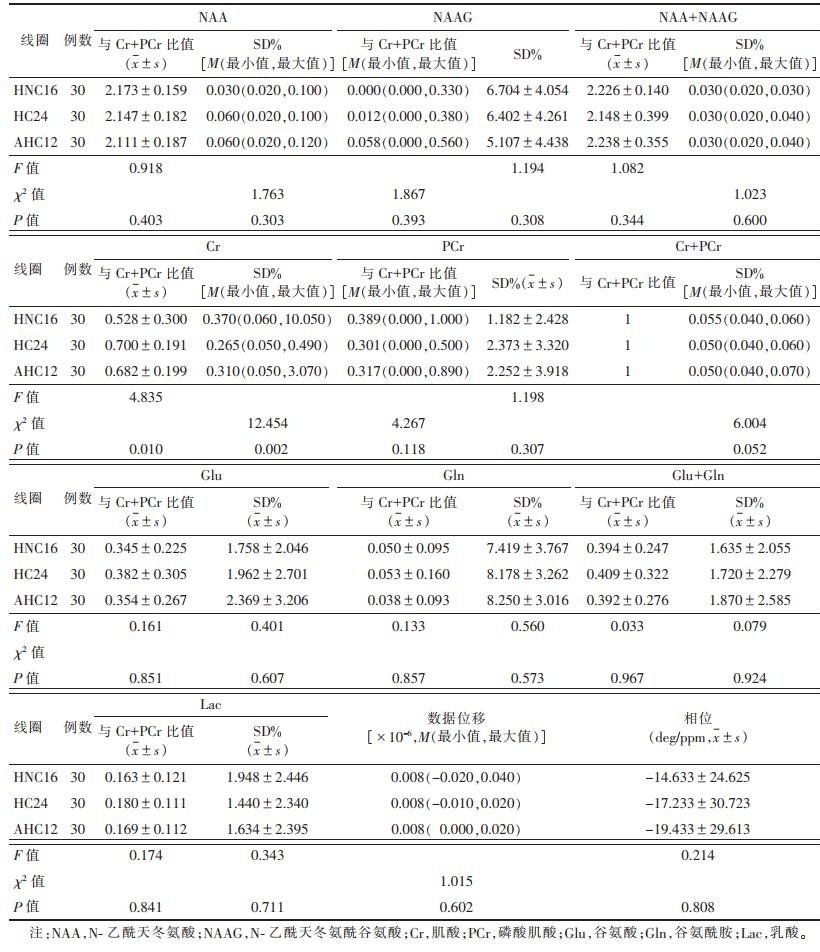 |
| 表 2 3种线圈MRS成像获得代谢物参数比较(x±s) |
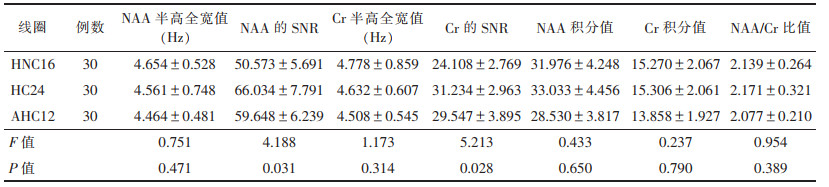 |
使用3种线圈MRS成像时,Cr与Cr+PCr比值及Cr的SD%值组间比较差异有统计学意义(F=4.835,χ2=12.454;均P<0.05),进一步两两比较,HC24及AHC12线圈的SD%值均小于HNC16线圈、Cr与Cr+PCr比值均大于HNC16线圈(均P<0.05),HC24、AHC12间差异无统计学意义(P > 0.05)。
3种线圈的NAA半高全宽值、Cr半高全宽值、NAA积分、Cr积分及NAA/Cr比值比较差异均无统计学意义(均P > 0.05);而在NAA的SNR及Cr的SNR组间比较差异均有统计学意义(均P<0.05),两两进一步比较HC24及AHC12线圈的NAA及Cr的SNR均高于HNC16线圈(均P<0.05),HC24、AHC12组间差异无统计学意义(P > 0.05)。
2.2 MRS图像质量主观评价(表 3)| 表 3 3种线圈MRS图像主观评价比较 |
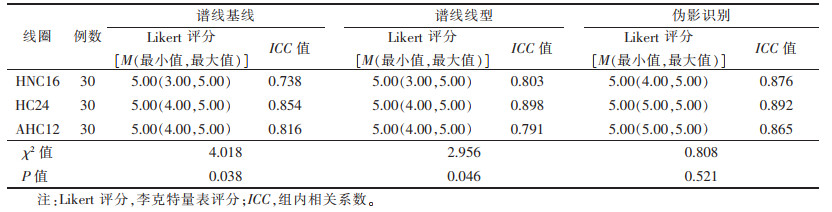 |
对HNC16、HC24及AHC12 3种线圈在谱线基线、谱线线型及伪影识别方面进行主观评分,所有评分项的ICC值为0.738~0.898,其可靠性为中等至较好。其中谱线基线、谱线线型3组间比较差异均有统计学意义(均P<0.05),两两比较,HC24及AHC12线圈评分均高于HNC16线圈(秩均值分别为17.541、10.098,均P<0.05),HC24、AHC12组间差异无统计学意义(秩均值为2.987,P > 0.05)(图 3,4)。伪影识别3组间比较差异无统计学意义(P > 0.05)。
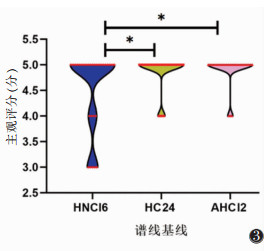 |
| 图 3 3种线圈谱线基线主观评价积分图 |
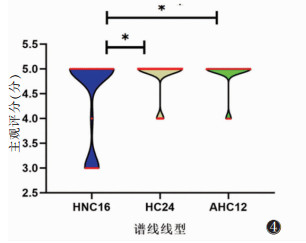 |
| 图 4 3种线圈谱线线型主观评价积分图(*P<0.05)主观评分 |
3 讨论
MRI是一种多参数检查技术,影响图像质量的因素较多,包括磁场强度、成像序列、重建算法及射频线圈等,而射频线圈发出并接收射频信号,对图像质量起关键作用,也是较易改进的硬件之一。柔性线圈可改变其形状从而紧贴成像部位,降低与成像物体之间的距离,具有硬质线圈不具备的优点[3, 5]。当扫描范围固定多个单元组成阵列时,可提高其SNR。但随单元数增加,其噪声也增多,增加单元数目,SNR不会无限增加,而是在一定限度上提升[6]。单元数较多的线圈,均匀性会降低,因此单纯增加线圈单元数并不能完全解决SNR低的问题。目前,有学者[7-8]采用头颅柔性线圈进行婴儿头颅成像,发现在皮质部位可提升122%的SNR,但其仅行结构像扫描,如常规T1WI、T2WI,作为神经影像不可缺少的影像诊断序列,MRS的图像质量情况未见报道。
MRS检查过程较复杂,影响谱线图像质量的因素很多,谱线质量不佳,则不能准确反映组织中的代谢物含量,从而降低诊断可靠性。因此,如何进行质量控制、获得满意的图像对疾病诊断尤为重要。目前国内外在MRS图像质量控制方面的研究较少,仍无统一标准。梁丰丽[9]报道MRS图像质量评价主要有客观及主观评价两方面,客观评价主要有SNR、半高全宽值、水抑制等,主观评价主要有谱线基线、谱线线型及伪影识别等。
SNR是指一定范围内波谱信号振幅值与噪声的比率,噪声过大导致低SNR,会造成谱线基线质量不佳,但目前仍无统一的评价标准。Graaf等[10]报道1.5 T MRI设备上SNR > 10才能获得较好的谱线精确度。Oz等[11]建议脑内肿瘤的代谢物胆碱峰(Cho)及NAA峰SNR值应 > 3,Lac峰SNR值应 > 2。而MRS序列为获得更稳定的代谢物浓度水平,常通过增大每个体素所包含的成像物体体积提升SNR,但这种方法使得正常组织与异常组织共同处于同一体素内的概率升高,影响临床诊断的准确性,因此提升MRS图像的SNR对临床具有重要意义。本课题组前期研究[3-4]发现表面柔性线圈缩短了成像目标与线圈的距离,使得噪声远小于接收到的电压,提升了图像SNR。本研究结果也显示,HNC16、HC24及AHC12 3种线圈NAA峰及Cr峰的SNR值均 > 10,AHC12的NAA和Cr的SNR明显高于HNC16,与具有更高通道数的HC24线圈相近,提示通过缩短成像目标与线圈距离的柔性线圈可媲美更高通道数的硬质线圈。代谢物半高全宽定义为峰高1/2处的线宽,峰线过宽,会导致谱线分析的结果不准确,Bartha[12]报道在4 T MRI设备下半高全宽值在8~14 Hz时谱线质量最佳。本研究3种线圈在1.5 T磁场中,NAA峰及Cr峰半高全宽值为3.5~5.5 Hz,可能是磁场强度不同导致其较低,三者间半高全宽值差异无统计学意义。
LCModel是一款用于活体质子MRS量化的软件,被公认为是量化MRS波谱的“金标准”[13],其质量参数主要由SNR、半高全宽、相位、SD%等,在其他参数均符合标准的情况下,SD以百分比的形式评估代谢物的估计浓度,SD%小的代谢物含量值被认为是可靠的,其标准是<20%。如MRS成像结果中Cho、NAA及Cr等重要代谢物的SD%值符合标准,则认为该波谱质量较好[14]。本研究中,HC24及AHC12线圈的SD%值均小于HNC16线圈,且HC24与AHC12线圈间无差异,因此柔性线圈MRS成像可取得与24高通道线圈相同的图像质量。
本研究主观评价主要基于谱线基线、谱线线型及伪影识别这三方面进行Likert评分。MRS谱线应具有平稳的基线,如基线不稳呈锯齿状会造成代谢物定量不精确。谱线线型是指波谱的形状,线型应服从特定函数分布,且左右对称。线型扭曲提示数据受污染,会影响代谢物峰及其比值的精确性。本研究中,HNC16、HC24及AHC12的MRS图像的谱线基线及线型评分显示,HC24及AHC12线圈的Likert评分均高于HNC16线圈,提示头颅柔性线圈通过提高SNR改善了MRS的图像质量,可更可靠地评估大脑代谢水平。在伪影识别方面3种线圈结果无明显差异,这也符合本研究的假设,头颅线圈的设计本身并无法改变外在环境引起的图像变化。
本研究选择健康志愿者作为受试者进行MRS图像质量的控制,健康志愿者与病理状态下的受试者代谢物存在一定差异,未来需在临床实践中进一步观察病理状态下代谢物的变化情况。另外本研究仅在单一MRI机型上进行,需进行多中心研究进一步验证所获得的结果。
总之,AHC12线圈通过降低受检部位与线圈之间的距离,提升图像SNR,从而改善MRS图像质量,各项指标与24通道硬质头颅线圈相似,为临床改善MRS图像提供了一种新的解决方案。
| [1] |
KRAHE J, BINKOFSKI F, SCHULZ J B, et al. Neurochemical profiles in hereditary ataxias:A meta-analysis of Magnetic Resonance Spectroscopy studies[J]. Neurosci Biobehav Rev, 2020, 108: 854-865. |
| [2] |
TOGNARELLI J M, DAWOOD M, SHARIFF M I, et al. Magnetic resonance spectroscopy:principles and techniques:lessons for clinicians[J]. J Clin Exp Hepatol, 2015, 5(4): 320-328. DOI:10.1016/j.jceh.2015.10.006 |
| [3] |
谭文莉, 詹松华, 康英杰, 等. 头颅柔性线圈与硬质线圈成像质量的比较研究[J]. 中国医学计算机成像杂志, 2017, 23(6): 575579. |
| [4] |
詹松华, 谭文莉, 马文, 等. 头颅柔性线圈在功能性磁共振成像中的应用[J]. 中国医学工程, 2018, 26(12): 1-5. |
| [5] |
王轶楠. 核磁共振成像系统射频线圈设计要求及优化方案[J]. 中国设备工程, 2019(14): 55-56. |
| [6] |
KAZA E, KLOSE U, LOTZE M. Comparison of a 32-channel with a 12-channel head coil:are there relevant improvements for functional imaging?[J]. J Magn Reson Imaging, 2011, 34(1): 173-183. DOI:10.1002/jmri.22614 |
| [7] |
LOPEZ R N, FOIAS A, LODYGENSKY G, et al. Size-adaptable 13-channel receive array for brain MRI in human neonates at 3 T[J]. NMR Biomed, 2018, 31(8): e3944. DOI:10.1002/nbm.3944 |
| [8] |
FRASS-KRIEGL R, NAVARRO L, PICHLER M, et al. Flexible 23-channel coil array for high-resolution magnetic resonance imaging at 3 Tesla[J]. PLoS One, 2018, 13(11): e0206963. DOI:10.1371/journal.pone.0206963 |
| [9] |
梁丰丽. 中枢神经系统MRS图像质量控制的研究进展[J]. 实用放射学杂志, 2018, 34(2): 303-305. DOI:10.3969/j.issn.1002-1671.2018.02.036 |
| [10] |
GRAAF M, JULIA-SAPE M, HOWE F A, et al. MRS quality assessment in a multicentre study on MRS-based classification of brain tumours[J]. NMR Biomed, 2008, 21(2): 148-158. DOI:10.1002/nbm.1172 |
| [11] |
OZ G, ALGER J R, BARKER P B, et al. Clinical proton MR spectroscopy in central nervous system disorders[J]. Radiology, 2014, 270(3): 658-679. DOI:10.1148/radiol.13130531 |
| [12] |
BARTHA R. Effect of signal-to-noise ratio and spectral linewidth on metabolite quantification at 4 T[J]. NMR Biomed, 2007, 20(5): 512-521. |
| [13] |
RASCHKE F, FUSTER-GARCIA E, OPSTAD K S, et al. Classification of single-voxel 1H spectra of brain tumours using LCModel[J]. NMR Biomed, 2012, 25(2): 322-331. |
| [14] |
FLEISCHER C C, ZHONG X, MAO H. Effects of proximity and noise level of phased array coil elements on overall signal-tonoise in parallel MR spectroscopy[J]. Magn Reson Imaging, 2018, 47(4): 125-130. |
 2021, Vol. 19
2021, Vol. 19


