| 乳腺囊实混合性肿块的多模态超声特征分型及良恶性鉴别 |
2. 上海交通大学医学院附属第九人民医院黄浦分院乳腺外科, 上海 200011
2013版乳腺影像报告和数据系统(breast imaging reporting and data system,BI-RADS)超声回声模式中有一类为囊实混合性回声[1],此类病灶的良恶性较难鉴别[2],误诊率较高。本研究分析了108个不同病理性质的乳腺囊实混合性肿块,术前运用多种模态超声技术对肿块进行分型,并综合多种分型模式校正常规超声BI-RADS分类的结果,以提高临床对此类乳腺肿块的超声诊断效能。
1 资料与方法 1.1 一般资料选取我院2020年7月至2022年10月超声检出的乳腺囊实混合性肿块的女性患者106例,共108个肿块;年龄16~97岁,平均(50.77±18.08)岁。肿块最大径6~140 mm,平均(27.60±23.28)mm。根据术后病理分为良性组61例和恶性组45例。纳入标准:①肿块内同时含有液性和实性成分;②均接受常规超声及萤火虫成像、超微血管三维成像(smart three-dimensional superb microvascular imaging,Smart 3D SMI)、应变弹性成像(strain elastography,SE)检查;③经手术或活检后取得病理结果。排除标准:①超声资料缺失或质量欠佳,或无病理学资料;②处于哺乳期和/妊娠期;③检查前有化疗、放疗、内分泌治疗史、假体植入史或近期有乳房穿刺及手术史;④超声表现为无明显瘤体感的含液病灶,如乳腺导管簇状聚集;⑤无固定实性成分的复杂囊肿。本研究经医院伦理委员会审查通过,患者均自愿参与。
1.2 仪器与方法采用Canon Aplio i900超声仪,探头型号i18LX5,频率5~18 MHz,配备超声萤火虫成像、Smart 3D SMI及SE软件。以患者乳头为中心行放射状连续扫查,当发现囊实混合性肿块时加行多切面探查,重点观察肿块位置、大小及形态学特征。除常规超声和CDFI检查外,还运用超声萤火虫成像判断肿块有无微钙化及微钙化数目和分布;在SMI的基础上启动Smart 3D SMI,三维重建肿块区微血管架构;在SE模式下,选取肿块最大切面,探头与肿块垂直进行轻压和放松操作,压力曲线稳定时行弹性成像评估。
1.3 常规超声对乳腺囊实混合性肿块的诊断标准恶性征象有[3-6]:①外形不规则;②非平行位生长;③边缘不清晰;④微小钙化;⑤后方回声衰减;⑥周围组织结构紊乱或扭曲;⑦CDFI示血流丰富;⑧高RI(≥ 0.7)。具备上述3项及以上征象者,评估为恶性病灶(BI-RADS分类为4b类及以上),否则为良性病灶(BI-RADS分类为4a类及以下)。
1.4 综合超声分型模式校正BI-RADS分类结果利用超声技术从不同角度观察肿块特征并进行分型。具体分型方法与评估标准如下:①按肿块大体形态分型[5, 7-9]。厚壁厚分隔型,有厚壁和/或厚分隔;囊内附壁型,囊状液区内见局限附壁实性回声或乳头状突起;液性为主型,液性成分>50%,实质分布较广,形态复杂;实质为主型,实性成分>50%,肿块边缘常不清晰。根据既往文献,乳腺囊实混合性肿块的恶变率随实性成分占比增大而增高[8-10],故把实质为主型归为恶性高危类型。②微钙化是公认的乳腺癌重要征象。萤火虫成像显示乳腺囊实混合性肿块内部或周边微钙化视为恶性高危类型,若病灶同时存在恶性特征钙化和良性特征钙化,也归为恶性高危类型。③Smart 3D SMI能显示肿块微血管三维架构,常见以下情况,即未检出血管,星条型,树枝型,抱球型,杂乱型。乳腺恶性肿块新生血管粗细不均,血管结构杂乱,常出现扭曲及缠绕的紊乱状态[11-12]。把具有恶性特征的杂乱型血管架构视为恶性高危型,包括类似于丛状、残根状、荆棘状、蟹足状、渔网状等不规则走行的血管形态[13]。④若SE显示乳腺混合性肿块以质硬区为主(弹性评分>3分),则归为恶性高危类型。
综合多模态分型结果对乳腺囊实混合性肿块的常规超声BI-RADS分类进行校正(升级或降级):如肿块符合上述分型模式中的3种及以上恶性高危类型,则对常规BI-RADS分类在3~4c类的肿块上调1级(但原为BI-RADS 5类则维持不变);如不符合任何恶性高危类型,则对常规BI-RADS分类在4a~5类的肿块下调1级(原为BI-RADS 3类则维持不变)。
1.5 统计学处理采用SPSS 22.0统计软件进行分析,计量资料以x±s表示,组间比较行独立样本t检验;计数资料用例(%)表示,组间比较行χ2检验。以病理结果为金标准,分别计算常规超声诊断与通过多模态超声分型校正后诊断的敏感度、特异度、准确率、阳性预测值、阴性预测值,采用ROC曲线分析诊断效能并计算AUC。以P < 0.05为差异有统计学意义。
2 结果 2.1 2组患者一般资料比较良性组61例(62个病灶),年龄16~72岁,平均(41.39±13.65)岁;病灶最大径6~140 mm,平均(23.19±19.55)mm。恶性组45例(46个病灶),年龄29~97岁,平均(63.41±15.50)岁,病灶最大径10~137 mm,平均(36.24±25.88)mm。2组年龄及病灶最大径比较,差异均有统计学意义(t=-7.827,-2.865;均P < 0.05)。
2.2 常规超声诊断符合率(表 1)| 表 1 108个乳腺囊实混合性肿块的常规超声诊断与病理结果比较 |
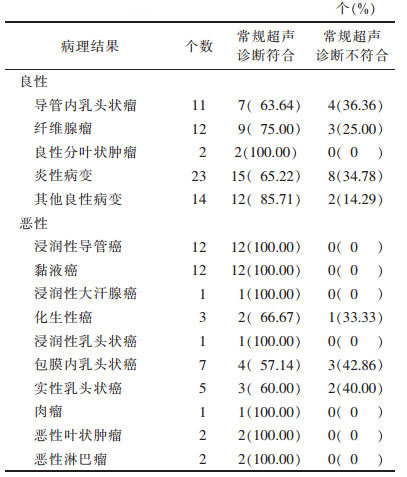 |
术前常规超声诊断与病理诊断总体符合率为78.70%(85/108),良性组72.58%(45/62),恶性组86.96%(40/46)。
2.3 多模态超声分型诊断结果与病理结果比较(表 2)| 表 2 多模态超声不同分型诊断结果与病理结果比较 |
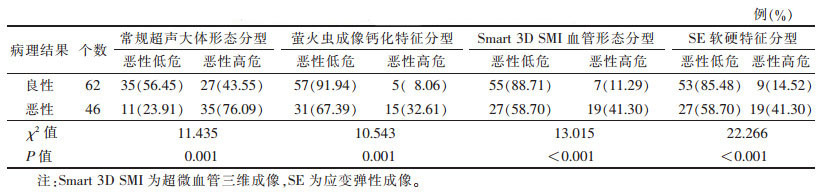 |
各超声分型判断乳腺囊实混合性肿块良恶性差异均有统计学意义(均P < 0.05)。肿块大体形态对照病理结果发现:厚壁厚分隔型多见于炎性病变(9/15,60.00%)(图 1),也可见于囊性增生伴陈旧性出血机化、脂肪坏死等良性病变;囊内附壁型多见于乳头状肿瘤(10/18,55.56%),包括导管内乳头状瘤(图 2)、导管内乳头状癌、包裹性乳头状癌、实性乳头状癌;液性为主型多见于良性病变(8/13,61.54%)(图 3);实质为主型的恶性率最高(35/62,56.45%),多见于浸润性导管癌(图 4),尤其是三阴性乳腺癌,占乳腺癌的26.83%(11/41)。另外,伴微钙化的病例恶性率也很高(15/20,75.00%)。SE分型中,恶性组整体弹性评分明显高于良性组。SMI未检出血流信号的肿块绝大多数为良性(8/10,80.00%)。恶性率最高的血管形态类型为杂乱型(19/26,73.08%)。
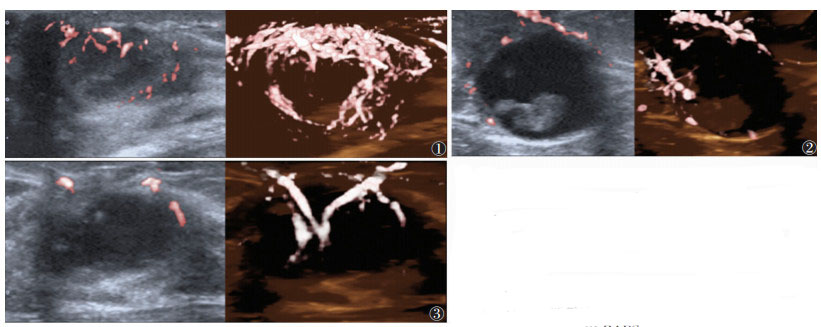 |
| 注:图1为乳腺脓肿患者,女,16岁,2D SMI示右乳乳晕区厚壁厚分隔型肿块(左图),Smart 3D SMI示血管形态架构类型为抱球型,血流主要环抱在肿块边缘,分隔区见少许血流(右图)。术前常规超声的乳腺影像报告和数据系统(BI-RADS)分类为4b类,多模态超声分型校正后降为BI-RADS 4a类。图2为导管内乳头状瘤患者,女,41岁,2D SMI示右乳乳晕区囊内附壁型肿块(左图),Smart 3D SMI示病灶血管形态架构类型为星条型,血流主要在囊壁区及实质部分边缘(右图)。图3为乳腺炎性病变患者,女,47岁,2D SMI示左乳外上象限液性为主型肿块(左图),Smart 3D SMI示血管形态架构类型为树枝型(右图)。术前常规超声评估为BI-RADS 4b类,多模态超声分型校正后为BI-RADS 4a类 图 1-3 乳腺脓肿、导管内乳头状瘤、乳腺炎性病灶的超微血管二维成像(2D SMI)及超微血管三维成像(Smart 3D SMI)图像 |
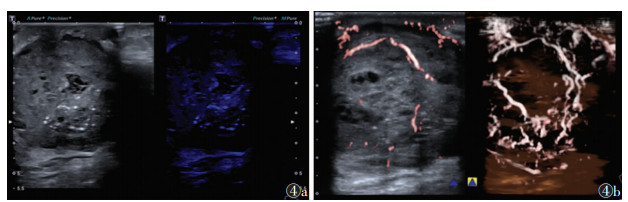 |
| 注:患者,女,69岁,实质为主型肿块。萤火虫成像见肿块内有密集微钙化点,部分微钙化成簇分布(图 4a右图);2D SMI可见肿块血流(图4b左图);Smart 3D SMI示血管形态架构类型为杂乱型,血管三维重建后显示肿块血管丰富,明显走行迂曲,交织成网(图4b右图) 图 4 浸润性导管癌的常规超声图像、超声萤火虫图像、2D SMI及Smart 3D SMI图像 |
2.4 常规超声BI-RADS分类经多模态超声分型校正后的诊断效能(表 3)
| 表 3 常规超声诊断与多模态超声分型校正后对乳腺囊实混合性肿块良恶性的诊断效能 |
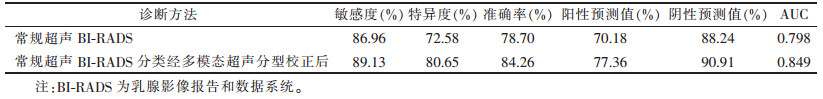 |
以病理结果为金标准,常规超声BI-RADS分类经多模态超声分型校正后的诊断效能优于单独用常规超声,AUC更大,为0.849。
3 讨论乳腺囊实混合性肿块的形成原因包括炎性改变、导管阻塞、肿瘤坏死液化、分泌性肿瘤等,超声表现复杂多样。常规超声BI-RADS分类跨度大,对乳腺囊实混合性肿块的病理诊断符合率较低。本研究采用多模态超声技术对此类肿块进行分型,并用于校正常规超声BI-RADS分类结果,以术后病理作为金标准,比较分析校正前后的诊断效能,拟构建更有效的综合诊断模式,提高对这类肿块的良恶性鉴别诊断能力。
本研究恶性组患者年龄及肿块最大径均大于良性组,提示对老年患者或较大的囊实混合性肿块,应仔细观察其超声特征,谨慎鉴别。从病灶的大体形态来看,实性为主型病灶的恶性率最高,超声诊断准确率也最高,常可表现为形态不规则、实质回声不均匀、边缘毛刺征、成角或微分叶、高回声晕等恶性特征。部分良性病灶以实性为主,如复杂性纤维腺瘤,较易误诊。混合性乳腺肿块的检查重点虽然在实性部分,但液性区有无漂浮物或沉淀物,结合患者年龄、临床表现及肿块大体形态对良恶性鉴别有参考意义:若年轻患者乳腺内短期内出现厚壁厚分隔型肿块,液性区透声差并呈现稍高回声的细点状悬浮物,有红肿、疼痛等临床表现,应首先考虑炎性肿块伴脓腔形成可能;若老年患者出现囊内附壁型肿块,囊内有沉淀物,可能是易碎肿瘤实体破裂出血导致,乳头状癌可能性较大。
乳腺恶性肿块常见微钙化,是因为癌组织生长过快,易变性坏死而导致钙盐沉积。本研究认为微钙化与恶性囊实混合性乳腺肿块也有密切关系,实质部分中如见到成簇微钙化更是显著恶性特征。良性囊实性乳腺肿块多无钙化,或偶见粗大、斑片状、弧形、环状钙化。常规灰阶超声分辨力相对较低,当微钙化与周围缺乏显著对比时,评估较困难,检出率较钼靶X线摄影和MRI低。超声萤火虫成像把原始信号重新分析处理,能更清晰地显示微钙化数量、形态及分布特点,使微钙化突显在蓝色背景中,该技术可显示直径0.5 mm以下的微钙化,同时还可鉴别钙化伪像,提高诊断符合率[14]。有研究认为,超声萤火虫成像诊断乳腺恶性肿瘤的准确率显著高于常规超声检查[15]。萤火虫技术不但有助于微钙化的检出,也能显示囊实混合性肿块中的液性区,尤其对透声较差者,对明确肿块与周围乳腺导管关系也有帮助。
SMI检测乳腺病变血流的敏感度优于CDFI,接近超声造影水平,且无需对比剂。当乳腺囊实性病变存在出血或沉积物,导致液区透声差、常规超声难以区分实性或液性成分时,SMI可高敏感、高分辨力、高帧频地显示低速血流信号,以便鉴别出无血流的非实性成分,有利于病变形态学的评估。Smart 3D SMI技术是在SMI基础上结合血管三维成像,将无数个二维平面上微血管血流信号叠加,智能化立体重建,展现微血管空间构象及与周围毗邻关系。目前,BI-RADS分类仅将肿瘤血供情况简单分为无血供、内部血供和边缘血供,未将肿瘤血管形态架构纳入评估体系。本研究采用Smart 3D SMI技术重建囊实混合性乳腺肿块的微血管架构,根据微血管形态类型鉴别病灶的良恶性,为鉴别诊断提供更多参考依据。但其也有局限性,SMI对血流的高敏感性易导致良性肿块BI-RADS评级过高,血管三维重建图像也有可能将肿块周围正常血流包含其中,存在部分假阳性;另外,该技术受患者呼吸和心跳影响较大,对操作者经验要求较高,操作时须保持稳定速度与压力,以避免重建后血管三维图像失真。
常用弹性成像技术包括SE和剪切波弹性成像(shear wave elastography,SWE)。SWE虽能提供定量信息,但在单纯液性成分中无法产生和传播剪切波,对乳腺囊实混合性肿块的评估缺乏敏感性[16]。本研究采用SE评估肿块硬度,通过手动探头对肿块施加压力,因不同组织弹性系数不同,外力作用下会产生不同大小的形变,通过彩色编码可视化反映良恶性病灶硬度差异性,进而评估肿块性质[17]。SE多用5分法评价[14],也有学者用2013版BI-RADS推荐的硬度3分法(质软、质中、质硬)进行评价[18]。本研究基于肿块“良性软、恶性硬”的特征,进一步将乳腺囊实混合性肿块分为2种类型,以质硬为主的视为恶性高危型,以质软或质中为主的视为恶性低危型,使诊断模型更具可操作性。
乳腺肿块超声评估需遵循BI-RADS分类,已为业界共识。二维超声是BI-RADS分类和鉴别诊断的基础,BI-RADS 3类与4类是临床判断病灶是否行穿刺活检的“分水岭”,有学者认为乳腺囊实混合性病变为BI-RADS 4类,应行穿刺活检[19-20]。本研究针对乳腺囊实混合性肿块,提出采用多模态分型校正BI-RADS分类的诊断新模式,该方法可提高良恶性鉴别诊断能力,降低误诊,减少非必要穿刺。
本研究存在的不足:①回顾性研究留存图像资料有限,分型或有偏差。②选择患者有偏倚,暂未把表现为混合回声的哺乳期脓肿及手术穿刺后继发改变纳入本研究。③例数较少,有待增加样本量行多样性、多角度探索。④很多超声新技术诊断手段尚未纳入,主要原因是某些技术对含液性肿块存在局限性,如SWE[21]、超声造影、自动乳腺全容积成像技术等因为有创性或价格原因,患者接受度较低,导致可研究例数少,需收集更多相关病例完善研究。
综上所述,通过多模态超声技术对乳腺囊实混合性肿块分型,并对常规超声BI-RADS分类结果进行校正,可构建一种无创、经济、有效、值得推广的鉴别诊断新模式。此方法建立在综合评估病灶不同征象的基础上,能够提高诊断效能,为临床制订治疗方案提供更具体的诊断意见。
| [1] |
SICKLES, D'ORSI C, BASSETT L, et al. ACR BI-RADS® atlas breast imaging reporting and data system[M]. Reston, VA: American College of Radiology, 2013: 293.
|
| [2] |
佟凌霞, 齐娜, 郑鹏远. 乳腺囊实性病变的超声诊断分析[J]. 中国妇幼保健, 2017, 32(5): 1080-1082. |
| [3] |
卜云芸, 赵曼曼, 杜晶, 等. 超声乳腺影像报告与数据系统诊断乳腺囊实性病变的价值[J]. 中国医学装备, 2018, 15(10): 65-68. |
| [4] |
张和庆, 彭玉兰, 赵海娜, 等. 乳腺囊实性肿块的BI-RADSUS图像特征及良恶性鉴别[J]. 中国超声医学杂志, 2015, 31(9): 777-780. |
| [5] |
毛羡仪, 邱燕生, 陆培明, 等. 超声BI-RADS分类在乳腺囊实性肿块中的应用价值[J]. 现代医院, 2019, 19(12): 1854-1856. |
| [6] |
刘尔球, 刘文慈, 徐晓红, 等. 彩色多普勒超声联合数字化乳腺X线摄影对乳腺囊实性恶性肿瘤的诊断价值[J]. 影像研究与医学应用, 2022, 6(7): 106-109. |
| [7] |
HSU H H, YU J C, LEE H S, et al. Complex cystic lesions of the breast on ultrasonography: feature analysis and BI-RADS assessment[J]. Eur J Radiol, 2011, 79(1): 73-79. DOI:10.1016/j.ejrad.2009.12.037 |
| [8] |
王玉敏, 红华, 王芳, 等. 超声对乳腺囊实性复合回声肿块的诊断价值[J]. 中国超声医学杂志, 2019, 3(12): 1127-1130. |
| [9] |
郑良斌. 超声在乳腺囊实性复合回声肿块诊断中的应用[J]. 医疗装备, 2020, 33(24): 17-18. |
| [10] |
YAO J P, HAO Y Z, CHANG Q, et al. Value of ultrasonographic features for assessing malignant potential of complex cystic breast lesions[J]. J Ultrasound Med, 2017, 36(4): 699-704. DOI:10.7863/ultra.16.05012 |
| [11] |
赵璐, 张莹, 程颢, 等. 乳腺超声造影预测模型的建立及其对乳腺良恶性病变诊断效能的分析[J/CD]. 中华医学超声杂志(电子版), 2019, 16(6): 419-425.
|
| [12] |
李伟伟, 周庆华, 吴迎, 等. 超微血管三维立体成像技术对乳腺肿块血流的评估价值[J]. 中国超声医学杂志, 2019, 35(7): 587-589. |
| [13] |
贾莉, 朱文龙, 王聪. 超微血管三维立体成像对乳腺癌的诊断价值[J]. 大连医科大学学报, 2020, 42(4): 348-351. |
| [14] |
邢博缘, 赵云. 多模态超声诊断乳腺良恶性肿块的研究进展[J]. 海南医学, 2019, 30(21): 2831-2834. |
| [15] |
王晶. 乳腺常规超声、超声"萤火虫"成像技术对乳腺肿块微钙化的诊断价值研究[J]. 影像研究与医学应用, 2019, 3(19): 117-118. |
| [16] |
LIU B, ZHENG Y, HUANG G, et al. Breast lesions: quantitative diagnosis using ultrasound shear wave elastography—a systematic review and meta-analysis[J]. Ultrasound Med Biol, 2016, 42(4): 835-847. DOI:10.1016/j.ultrasmedbio.2015.10.024 |
| [17] |
唐诗, 袁月欢, 李玉娟, 等. BI-RADS结合超声弹性成像技术对筛选可行Mammotome手术的乳腺肿块患者的价值[J]. 中国医学创新, 2020, 17(10): 141-144. |
| [18] |
赵红丽, 刘淑霞, 方红霞, 等. 乳腺超声弹性成像校正2013版BI-RADS-US分类的应用价值[J]. 齐齐哈尔医学院学报, 2020, 41(10): 1241-1243. |
| [19] |
ATHANASIOU A, AUBERT E, VINCENT SALOMON A, et al. Complex cystic breast masses in ultrasound examination[J]. Diagn Interv Imaging, 2014, 95(2): 169-179. DOI:10.1016/j.diii.2013.12.008 |
| [20] |
CIUREA A I, IACOBEN C G, HERTA H A, et al. Breast cystic lesions: not so simple after all?An ultrasonographic tactical approach[J]. Med Ultrason, 2018, 1(1): 95-99. DOI:10.11152/mu-1163 |
| [21] |
晋春春, 贡雪灏, 周鹏, 等. 超声诊断乳腺囊实性病变现状及新技术应用进展[J]. 中国医学影像技术, 2020, 36(5): 772-775. |
 2023, Vol. 21
2023, Vol. 21


