| 双能量CT评估不同Child-Pugh分级肝硬化肝脾血流动力学的初步研究 |
2. 河南中医药大学第一附属医院放射科, 河南 郑州 450003
2. Department of Radiology, First Affiliated Hospital of Henan University of Traditional Chinese Medicine, Zhengzhou 450003, China
肝硬化是全球第11大最常见的死亡原因,也是影响伤残调整寿命年和寿命损失年的前20大原因之一,每年约116万人死于该病[1]。肝硬化是诸多肝病的终末期表现,常见病因有乙型肝炎、丙型肝炎、酒精性及非酒精性脂肪性肝病[2]。其失代偿期会继发门静脉高压,导致脾大与脾功能亢进[3]。随着CT技术不断发展,双能量CT(dual-energy computed tomography,DECT)已广泛应用于肝脏扫描,其定量参数,可用于不同物质成分的鉴别。
目前,已有研究应用DECT分析肝硬化患者肝脏的血流动力学变化,但很少关注到脾脏的血流动力学改变[4]。本研究基于DECT碘图定量分析不同Child-Pugh分级肝硬化患者与健康志愿者之间肝脏、脾脏血流动力学的差异,并分析碘参数与肝硬化Child-Pugh分级的相关性。
1 资料与方法 1.1 一般资料收集河南中医药大学第一附属医院2018年8月至2020年12月临床确诊为肝硬化患者的资料。纳入标准:①临床诊断标准符合《肝硬化诊治指南》[5];②行上腹部DECT双期增强扫描。排除标准:①图像质量差或有明显伪影;②存在肝硬化以外可能影响肝脾血流动力学的病变,如肝脏良恶性肿瘤、直径 > 5 mm的肝脏囊肿、脂肪肝、肝内胆管结石或钙化、脾脏病变(脾切除或占位性病变)、门静脉病变(血栓或癌栓)等;③存在精神异常或碘对比剂过敏等禁忌证。最终纳入48例肝硬化患者,其中男32例,女16例;年龄26~81岁,平均(51.65±10.88)岁;Child-Pugh分级A级27例,B级14例,C级7例;乙型肝炎肝硬化40例,丙型肝炎肝硬化3例,酒精性肝硬化3例,其他类型2例。
同期收集23例经临床确诊无肝脏、脾脏及门静脉等病变的健康志愿者作为对照组,其中男13例,女10例;年龄35~67岁,平均(53.78±9.06)岁。本研究经医院伦理委员会批准通过(伦理批号:2022HL-471-02)。2组年龄、性别比较,差异均无统计学意义(均P > 0.05)。
1.2 肝硬化Child-Pugh分级标准Child-Pugh分级标准包括5个指标:血清总胆红素、血清白蛋白、凝血酶原时间、腹水程度和肝性脑病等级。每个指标按严重程度给予1~3分权重,总分对应3个级别:5~6分为A级,7~9分为B级,≥10分为C级。级别越高,提示肝硬化程度越严重、预后越差。
1.3 仪器与方法采用Siemens DECT(Somatom Definition,Germany)的双源模式行CT增强扫描,扫描参数:A球管80 kV,230 mAs;B球管140 kV,180 mAs。准直器64×0.6 mm,螺距0.7,旋转时间0.33 s/r,视野286 mm×286 mm,矩阵512×512,重建层厚、层距均为1.5 mm。经肘正中静脉注射对比剂碘海醇(碘浓度350 mg/mL),剂量1.5 mL/kg体质量,流率3.5 mL/s,后以相同流率注射生理盐水40 mL。动脉期采用自动触发技术,在膈顶层面腹主动脉处勾画ROI,当该处CT值达120 HU后延迟5 s开始动脉期扫描,动脉期扫描结束后延迟30 s采集门静脉期。
1.4 数据采集将所有患者动脉期、门静脉期的CT图像(包括80 kV和140 kV的图像)导入Dual Energy工作站,应用Liver VNC后处理程序获取碘图模式,并测定肝脾特定区域碘浓度。双期CT图像统一选择肝门静脉左支矢状部层面,在肝左外叶、肝左内叶及肝右叶各选取1个面积为20 mm2的圆形ROI,注意避开肝脏血管、肝内胆管、小囊肿、强化不均匀等区域,取3个ROI碘浓度的平均值为该期相肝脏碘浓度;并于同层面脾实质内选取3个20 mm2的圆形ROI,选取时注意避开脾脏血管、小囊肿等,取3个ROI碘浓度的平均值为该期相脾脏碘浓度。测算得到以下6个参数值:①肝脏动脉期碘浓度(iodine concentration in arterial phase,Ia);②肝脏门静脉期碘浓度(iodine concentration in portal venous phase,Ip);③肝门静脉碘浓度(portal venous iodine concentration,PVIC),PVIC≈Ip-Ia;④肝动脉碘分数(arterial iodine fraction,AIF),为肝脏动脉期碘浓度除以肝脏门静脉期碘浓度,即AIF=Ia/Ip;⑤脾脏动脉期碘浓度(splenic iodine concentration in arterial phase,SIa);⑥脾脏门静脉期碘浓度(splenic iodine concentration in portal venous phase,SIp)(图 1)。
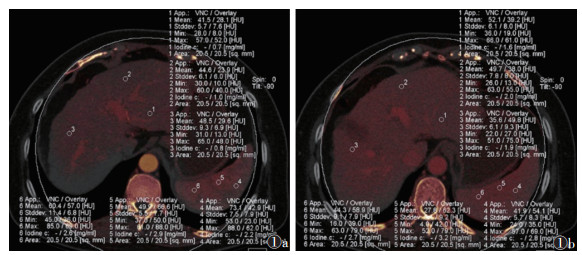 |
| 注:患者,女,56岁,Child-Pugh B级。图 1a为动脉期碘图,图 1b为门静脉期碘图,肝脏、脾脏内各取3个ROI测量碘浓度,计算平均值,肝脏动脉期碘浓度(Ia)=0.83 mgI/mL,肝脏门静脉期碘浓度(Ip)=1.83 mgI/mL,脾脏动脉期碘浓度(SIa)=2.57 mgI/mL,脾脏门静脉期碘浓度(SIp)=2.90 mgI/mL 图 1 肝硬化患者双能量CT碘图参数测量 |
1.5 统计学处理
采用SPSS 25.0软件进行统计分析。定量数据以x±s表示。多组比较采用单因素方差分析,对满足正态分布但方差不齐组间的比较采用Welch校正方差分析,组间两两比较采用LSD-t法。肝硬化组碘参数与Child-Pugh分级之间的相关性采用Spearman相关分析。检验水准α=0.05。以P < 0.05为差异有统计学意义。
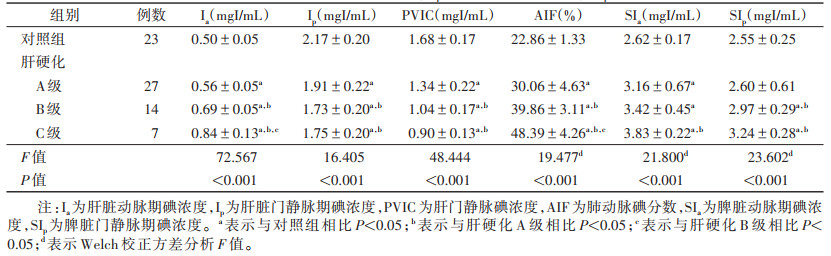
2 结果 2.1 肝脏碘参数分析结果对照组与肝硬化A、B、C级4组间Ia、Ip、PVIC及AIF差异均有统计学意义(均P < 0.001)(表 1)。肝硬化A、B、C级Ia、AIF均高于对照组(均P < 0.05),且随肝硬化分级越高,Ia、AIF越高。肝硬化A、B、C级Ip、PVIC均低于对照组(均P < 0.05),且肝硬化B、C级Ip、PVIC均低于肝硬化A级(均P < 0.05),而肝硬化B、C级之间差异均无统计学意义(均P > 0.05)。
| 表 1 肝硬化A、B、C级与对照组4组肝脏Ia、Ip、PVIC、AIF及脾脏SIa、SIp比较(x±s) |
 |
肝硬化组Ia、AIF均与Child-Pugh分级呈正相关(rs=0.856,0.832;均P < 0.001)(图 2,3),相关关系较强;而Ip、PVIC均与Child-Pugh分级呈负相关(rs=-0.362,-0.682;均P < 0.05)(图 4,5)。
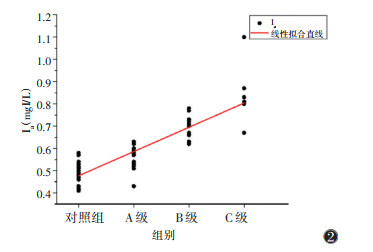 |
| 注:Ia为肝脏动脉期碘浓度 图 2 肝硬化A、B、C级与对照组肝脏Ia散点图及线性拟合直线 |
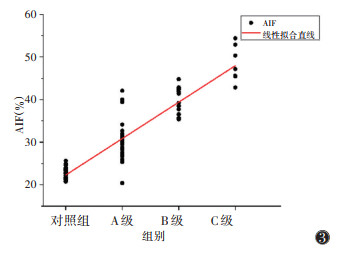 |
| 注:AIF为肺动脉碘分数 图 3 各组肝脏AIF散点图及线性拟合直线 |
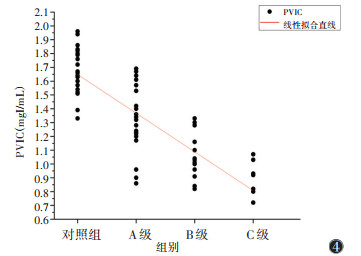 |
| 注:PVIC为肝门静脉碘浓度 图 4 各组肝脏PVIC散点图及线性拟合直线 |
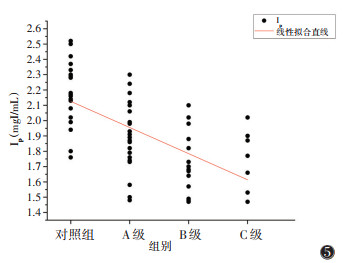 |
| 注:Ip为肝脏门静脉期碘浓度 图 5 各组肝脏Ip散点图及线性拟合直线 |
2.2 脾脏碘参数分析结果
对照组与肝硬化A、B、C级4组间SIa、SIp差异均有统计学意义(均P < 0.001)(表 1)。肝硬化A、B、C级SIa均高于对照组(均P < 0.05)。尽管肝硬化A级与B级、B级与C级之间SIa差异均无统计学意义(均P > 0.05),但随肝硬化程度的加重,SIa呈增高趋势。对照组SIp与肝硬化A级相当,均显著低于肝硬化B、C级(均P < 0.05),肝硬化B、C级之间差异无统计学意义(P > 0.05),但随肝硬化程度逐渐加重,SIp呈增高趋势。肝硬化组SIa、SIp均与Child-Pugh分级呈正相关(rs=0.413,0.468;均P < 0.05)。
3 讨论肝硬化是肝脏最常见的慢性疾病,是各种原因引发的弥漫性肝纤维化伴再生结节形成,导致正常肝小叶结构发生扭曲变形、血液循环途径被改建、肝脏变硬及肝功能受损。肝硬化失代偿期,随着肝功能持续恶化,会出现脾大与脾功能亢进、食管胃底静脉曲张、腹水等门静脉高压表现及肝性脑病、肝肺综合征、肝肾综合征等并发症,临床预后不佳[2]。因此,早发现、早诊断、早治疗,并根据不同程度给予个性化治疗对肝硬化患者预后尤为重要。目前,临床上对肝硬化严重程度的分级主要依据Child-Pugh分级,但该分级中腹水及肝性脑病等级的评估较主观,可因评估者标准不同而有差异。故本研究应用DECT从影像学角度挖掘更多反映肝硬化严重程度的定量指标,为临床提供更多诊疗信息。DECT采用2套独立的X线球管和探测器,可得到不同单能量下物质的分离数据及衰减特征曲线[6]。碘图是DECT根据物质在高低能量下衰减特征的不同实现的物质成分分离,是其对增强后碘成分提取得到的碘物质密度成像,该模式可定量测量病灶内碘浓度,测得的碘浓度不仅可直接反映组织摄碘能力,还可间接反映组织血供情况,进而评价组织血流动力学。本研究发现,Ia可直接反映肝动脉供血时肝组织摄碘能力,间接反映肝动脉供血量;Ip直接反映肝脏双重供血时肝组织摄碘能力,间接反映肝动脉、门静脉的总供血量;PVIC反映门静脉供血量;AIF反映肝动脉供血量占总供血量的百分比。同理,SIa直接反映脾动脉血供入脾时脾组织摄碘能力,间接反映脾动脉供血量;SIp则反映脾静脉血液出脾时仍残存在脾实质内的碘浓度。
肝脏血流丰富,约占心输出量的27%。正常肝脏血供由肝动脉及门静脉共同承担,其中肝动脉供血量占肝总血量的25%,门静脉供血量占75%[7]。本研究肝硬化组PVIC较对照组显著下降,且与Child-Pugh分级呈负相关,说明肝硬化患者早期门静脉供血量已开始下降,且随肝硬化程度的加重而不断下降。肝硬化时,肝内胶原合成增加及进行性沉积、肝星状细胞及肝窦内皮细胞收缩、一氧化氮生成减少、血管收缩因子释放增加均会导致肝内微循环发生改变,造成肝窦阻力增加,门静脉供血量下降[8-9]。而肝硬化组Ia较对照组显著升高,且与Child-Pugh分级呈正相关,说明随门静脉供血量逐渐下降,肝动脉供血逐渐上升,这一现象称为肝动脉缓冲效应,其可维持肝脏总血流的相对稳定[10]。然而肝硬化组Ip下降,提示即使存在肝动脉缓冲效应,肝动脉增加的供血量也不足以代偿门静脉减少的供血量,最终表现为肝脏总灌注减少。肝硬化组AIF较正常组显著升高,与Child-Pugh分级呈较强正相关。对照组AIF为(22.86±1.33)%,基本符合正常肝动脉供血比例,且肝硬化A、B、C 3级间AIF也有很好的区分度,故AIF可用来区分正常人与肝硬化患者,并预测Child-Pugh分级。上述基于DECT碘参数研究肝硬化血流动力学变化的结果与肝脏CT灌注成像的研究结果[11]一致。
随着肝硬化进入失代偿期,肝窦阻力不断增加,门静脉压力不断升高,当门静脉压力高于正常6~10 mmHg(1 mmHg=0.133 kPa)时,即为门静脉高压[12]。肝硬化和门静脉高压患者会出现高动力循环综合征,表现为心输出量及心率增高,内脏血管舒张(肾、脑血管除外)、血管阻力降低等[13-14]。在此过程中,脾脏主动充血,出脾血流对门静脉血流贡献较正常人显著增加,进一步加剧门静脉高压[15]。本研究显示:肝硬化组SIa高于对照组,且随肝硬化程度的加重,SIp有增高趋势,两者均与Child-Pugh分级呈正相关,提示:①肝硬化和门静脉高压患者脾脏血管舒张,灌注增高,发生以脾脏为中心的高动力循环状态;②门静脉期随着门静脉发生过度灌注,脾内血液瘀滞情况不断加重;③脾脏主动充血和被动瘀滞共同导致脾大、脾功能亢进。肝硬化(尤其是失代偿期)存在粗大的脾动脉和肝动脉“竞争”血流,脾脏呈高灌注和功能亢进状态[16],即肝硬化脾动脉盗血综合征通过有效控制肝硬化性脾动脉盗血,可改善肝脏缺血、缺氧状态。本研究关于脾脏碘参数的说明:①本研究SIa高于SIp,原因是动脉期代表脾动脉入脾血流,而严格控制时相的门静脉期已不存在入脾对比剂,仅为出脾的过程,因此SIp理论上低于SIa。这与谢婷婷等[17]研究结果不一致,可能与扫描期相的控制标准不同有关。②脾脏参数中未计算PVIC及AIF,原因是脾脏仅由脾动脉供血,与肝脏的双重血供不同,其计算出的PVIC与AIF无确切意义。
综上所述,不同Child-Pugh分级肝硬化组与对照组之间的肝脾碘参数存在差异,且肝硬化组肝脾碘参数与对应Child-Pugh分级间存在相关性。因此,DECT可作为临床早期发现肝硬化并评估其严重程度的无创定量工具。
| [1] |
ASRANI S K, DEVARBHAVI H, EATON J, et al. Burden of liver diseases in the world[J]. J Hepatol, 2019, 70(1): 151-171. DOI:10.1016/j.jhep.2018.09.014 |
| [2] |
单姗, 赵连晖, 马红, 等. 肝硬化的定义、病因及流行病学[J]. 临床肝胆病杂志, 2021, 37(1): 14-16. |
| [3] |
TURCO L, GARCIA-TSAO G. Portal hypertension: pathogenesis and diagnosis[J]. Clin Liver Dis, 2019, 23(4): 573-587. DOI:10.1016/j.cld.2019.07.007 |
| [4] |
魏海云, 周舟. 肝硬化患者肝脏双能CT碘图定量参数与肝脏储备功能的关系[J]. 中华实用诊断与治疗杂志, 2023, 37(1): 93-96. |
| [5] |
徐小元, 丁惠国, 李文刚, 等. 肝硬化诊治指南[J]. 临床肝胆病杂志, 2019, 35(11): 2408-2425. |
| [6] |
CHELLINI D, KINMAN K. Dual-energy CT principles and applications[J]. Radiol Technol, 2020, 91(6): 561-576. |
| [7] |
VAUPEL P, MULTHOFF G. Blood supply and oxygenation status of the liver: from physiology to malignancy[J]. Adv Exp Med Biol, 2022, 1395: 263-267. |
| [8] |
ENGELMANN C, ClÀRIA J, SZABO G, et al. Pathophysiology of decompensated cirrhosis: portal hypertension, circulatory dysfunction, inflammation, metabolism and mitochondrial dysfunction[J]. J Hepatol, 2021, 75(Suppl 1): s49-s66. |
| [9] |
WAN Y, LI X, SLEVIN E, et al. Endothelial dysfunction in pathological processes of chronic liver disease during aging[J]. Faseb J, 2022, 36(1): e22125. |
| [10] |
高志国, 王炳元. 急性重症酒精性肝炎肝动脉缓冲效应研究进展[J]. 实用肝脏病杂志, 2022, 25(5): 753-756. |
| [11] |
李贤华, 莫华梅, 郭培秀. 肝脏CT灌注成像与肝硬化程度的关系[J]. 中国中西医结合影像学杂志, 2010, 8(3): 203-205, 188. DOI:10.3969/j.issn.1672-0512.2010.03.004 |
| [12] |
REIBERGER T. The value of liver and spleen stiffness for evaluation of portal hypertension in compensated cirrhosis[J]. Hepatol Commun, 2022, 6(5): 950-964. DOI:10.1002/hep4.1855 |
| [13] |
MCAVOY N C, SEMPLE S, RICHARDS J M, et al. Differential visceral blood flow in the hyperdynamic circulation of patients with liver cirrhosis[J]. Aliment Pharmacol Ther, 2016, 43(9): 947-954. DOI:10.1111/apt.13571 |
| [14] |
BOLOGNESI M, DI PASCOLI M, VERARDO A, et al. Splanchnic vasodilation and hyperdynamic circulatory syndrome in cirrhosis[J]. World J Gastroenterol, 2014, 20(10): 2555-2563. DOI:10.3748/wjg.v20.i10.2555 |
| [15] |
高雨佳, 高知玲, 孙文杰, 等. 多层螺旋CT全肝灌注成像对不同程度脾功能亢进患者肝脾血流状态的评估[J]. 中华肝脏病杂志, 2020, 28(4): 326-331. |
| [16] |
MAO W, JIANG X, GUO S, et al. Splenic artery steal syndrome in patients with liver cirrhosis: aretrospective clinical study[J]. Med Sci Monit, 2023, 29: e938998. |
| [17] |
谢婷婷, 石桥, 张嘉瑜, 等. 采用双能量CT碘定量法研究肝硬化患者脾脏血流动力学变化[J]. 中国CT和MRI杂志, 2017, 15(5): 78-80. |
 2024, Vol. 22
2024, Vol. 22


