| 抗血管生成药物治疗肺肉瘤样癌疗效的CT灌注成像初探并案例分析 |
2ⓐ. 山东省烟台市中医医院肿瘤科,山东 烟台 264013;
2ⓑ. 山东省烟台市中医医院影像科,山东 烟台 264013
肺肉瘤样癌是一组分化差、恶性程度及侵袭度极高的具有肉瘤样分化或肉瘤样成分的非小细胞肺癌亚型,发生率极低,约占非小细胞肺癌的0.4%[1]。早期肺肉瘤样癌以手术切除为主,含铂类一线化疗方案是晚期肺肉瘤样癌的主要治疗手段之一,但有效率很低,即使化疗有效者,其生存期也仅约6个月[2]。现报道1例肺肉瘤样癌腹腔转移患者抗血管生成药物治疗后的CT灌注资料,结合文献探讨肉瘤样癌的临床及影像学表现、治疗方法。
1 资料与方法 1.1 一般资料男,66岁,因咳嗽于2019年5月2日于外院行胸部CT检查,发现右肺下叶肺门区占位性病变,考虑右肺癌可能性大,颅脑未见异常,支气管镜检查病理结合免疫组化结果倾向低分化癌。5月20日行胸腔镜右肺下叶切除+淋巴清扫术。术后病理结合免疫组化示病变符合肉瘤样癌,考虑为多形性癌,侵及支气管壁至支气管黏膜,伴大片坏死,未侵及肺脏层胸膜,支气管断端未受侵犯。免疫组化:CK(+)、Vim(部分+)、TTF-1(部分+)、CK7(+)、NapsinA(部分+)、CK5/6(-)、P40(-)、Ki-67阳性(40%~60%)。术后患者反复出现梗阻,进一步行腹部CT示右下腹肠套叠,不除外合并肿瘤性病变,病变周围肠管肠系膜走行区多发结节及团块影。6月9日行全麻下腹腔镜探查+小肠部分切除术,术中发现腹腔多发肿瘤,术后病理结合临床及免疫组化,符合肉瘤样癌,倾向肺肿瘤转移。免疫组化示CK(部分弱+)、Vim(+)、TTF-1(-)、CK7(部分弱+)、NapsinA(-)、CK20(-)、CDX-2(-)、Villin(-)、SMA(-)、S-100(-)、CD34(-)、des(-)、Ki-67阳性(80%)。7月16日入烟台市中医医院行紫杉醇联合顺铂的化疗方案:紫杉醇120 mg第1天及第8天静脉滴注,顺铂30 mg第2天至第5天静脉滴注;每3周为1个周期,化疗2个周期;9月2日依据实体瘤疗效评价标准(RECIST 1.1)评价为进展(图 1)。9月3日更换阿帕替尼250 mg每日1次口服靶向治疗,治疗前行腹腔转移瘤灌注扫描(图 1);10月9日疗效评价为稳定,行转移瘤灌注扫描(图 2)。肺肉瘤样癌及腹腔肉瘤样癌病理图片见图 3,4。
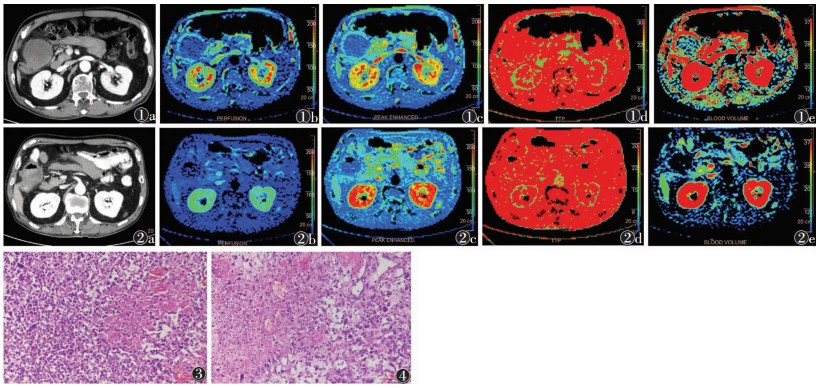 |
| 图 1~4 男,66岁,肺肉瘤样癌腹腔转移 图 1a 抗血管生成药物治疗前,CT增强扫描示右上腹腔内转移瘤,大小约7.5 cm×7.1 cm 图 1b~1e 治疗前灌注成像,分别显示灌注值、强化峰值、峰值时间和血容量 图 2抗血管生成药物治疗后,CT增强扫描示右上腹腔内转移瘤大小约6.0 cm×4.8 cm 图 2b~2e 治疗后灌注成像,分别显示灌注值、强化峰值、峰值时间和血容量 图 3,4 分别为肺内病灶病理图片(HE×200)和腹腔转移瘤病理图片(HE×200)。肿瘤伴大片凝固性坏死,肿瘤细胞黏附性差,胞浆丰富,淡嗜酸性,细胞核多形,核仁明显,可见瘤巨细胞 |
1.2 仪器与方法
采用Philips Brilliance iCT扫描仪摇篮床技术,平扫后选约16 cm(包含整个转移瘤)的灌注扫描范围。使用高压注射器经肘正中静脉团注非离子型对比剂碘海醇(碘浓度350 mg/mL)70 mL,流率5 mL/s,1.9 s后开始灌注扫描,共扫描10个序列,总灌注扫描时间约163.4 s。扫描参数:100 kV,150 mAs,矩阵512×512,准直64×1.25 mm,螺距0.796,层厚5 mm,重建层厚2 mm。
1.3 图像分析将原始数据传至Philips Intelli Space Portal工作站行后处理,使用Philips CT perfusion软件包分析。根据灌注图像选取治疗前及治疗后病灶10个不同实性成分较大层面作为分析计算层面,在病灶和主动脉上勾画ROI,避开粗大肿瘤血管、液化坏死区、含气囊腔和钙化灶。计算出ROI相应灌注参数值:①强化峰值,强化峰值=病灶的强化最大值-平扫CT值,反映对比剂在血管内的浓度。②灌注值,使用最大斜率法计算:灌注值=病灶的TDC初始最大斜率/同层主动脉强化峰值,代表单位时间内组织的血流灌注量。③血容量,代表局部区域的相对血容量。④对比剂峰值时间,代表TDC上从对比剂开始出现到对比剂达峰值的时间。
1.4 统计学方法运用SPSS 23.0统计学软件对数据进行分析。对阿帕替尼治疗前后同一病灶10组灌注参数的平均值进行比较,行配对样本t检验。以P<0.05为差异有统计学意义。
2 结果阿帕替尼治疗前,中腹部腹腔内转移瘤大小约3.2 cm×2.6 cm,治疗后约2.8 cm×2.4 cm;治疗前右上腹腔内转移瘤大小约7.5 cm×7.1 cm,治疗后约6.0 cm×4.8 cm。右上腹腔内转移瘤内部可见积气、坏死及液平。
阿帕替尼治疗前后灌注参数平均值见表 1。腹腔转移瘤的灌注值、强化峰值、峰值时间、血容量在阿帕替尼治疗前后差异均有统计学意义(均P<0.05)。治疗后腹腔转移瘤的灌注值、强化峰值及血容量均降低,峰值时间延迟。
| 表 1 阿帕替尼治疗肺肉瘤样癌前后CT灌注参数对比 |
 |
3 讨论 3.1 概述
2015年WHO肺肿瘤分类将肺肉瘤样癌定义为一组含有肉瘤形态细胞或肉瘤样分化的非小细胞肺癌,包括多形性癌、巨细胞癌、梭形细胞癌、癌肉瘤及肺母细胞瘤5种亚型[3]。目前多数学者[4]认为,肺肉瘤样癌是一组拥有相同起源的原始上皮干细胞,经上皮-间质转化及完全性间叶表型关闭后形成的一种转化性癌。因此,肺肉瘤样癌亦被认为是一种“过渡癌”。在上皮-间质转化情况下,癌与肉瘤之间可实现表型的互相转换,同时有利于肿瘤细胞摆脱束缚,更易造成侵袭邻近组织、脉管和胸壁的结果。
3.2 临床特征及影像表现研究[5]发现,吸烟史、老年男性是肺肉瘤样癌起病的重要因素,其中中央型肺肉瘤样癌多以咳嗽、咳痰、咯血为主要临床症状;周围型病变易侵及胸膜及胸壁,引起胸痛、胸腔积液等。肺肉瘤样癌在影像学中并无特征性表现,CT平扫可表现为类圆形、椭圆形或不规则型肿块,伴空泡征、胸膜凹陷征、分叶征等一般肺癌征象[6],增强扫描部分可见环形强化及中央坏死。仅从上述表现很难实现肺肉瘤样癌与其他类型肺癌等疾病的鉴别,病理及免疫组化仍是本病确诊的金标准。
3.3 治疗及预后肺肉瘤样癌在治疗方案上与其他类型的非小细胞肺癌无明显差别,目前尚无理想的治疗方案。部分研究[7-8]认为肺肉瘤样癌对放化疗均不敏感,手术是首选治疗方式。尽管手术切除治疗是肺肉瘤样癌首选的治疗方式,但不少患者就诊或发现该病时常已转移,无法手术。目前,国内外众多学者对肺肉瘤样癌术后辅助治疗及复发、转移的姑息性治疗仍有较多争议。熊伟杰等[9]对术后复发及Ⅳ期肺肉瘤样癌应用紫杉醇联合顺铂或吉西他滨联合顺铂化疗方案进行研究,认为疗效相当于同期别的非小细胞肺癌,建议术后复发或晚期肺肉瘤样癌患者可考虑使用第3代化疗药物进行全身化疗。徐文静等[10]对单纯手术及加以术后化疗组的3年生存率进行研究,发现后者的生存率高于前者。ITALIANO等[11]对转移性肺肉瘤样癌使用多柔比星和异环磷酰胺进行治疗,发现约50%患者获得了短期的生存,但最终均很快进展、死亡。本例术后经2个周期紫杉醇联合顺铂方案化疗后出现进展。
越来越多的数据[12]显示,新生血管生成在多种实体肿瘤的生长、增殖和转移中发挥着重要作用。抗血管生成药物可作用于肿瘤微环境,不但可使现有肿瘤血管退化,亦可抑制肿瘤新生血管的生成。阿帕替尼是我国自主研发的国家一类新型小分子抗血管生成药物,是针对VEGFR-2的多靶点酪氨酸激酶抑制药,Ⅱ期临床研究[13]数据表明,对于二线治疗失败后的晚期非鳞非小细胞肺癌患者,使用阿帕替尼与安慰组对比,无进展生存时间分别是4.7和1.9个月(P<0.001),阿帕替尼组患者无进展生存时间明显延长。目前阿帕替尼在肺肉瘤样癌治疗中的资料较少,本例因化疗方案无效尝试阿帕替尼抗肿瘤血管生成治疗1个月,疗效评估为稳定。
CT灌注成像在肿瘤血管生成及抗肿瘤治疗疗效评估方面显示出良好的应用前景[14-16]。治疗后肿瘤的变化说明单纯抗血管生成药物治疗并不能完全抑制肿瘤进展,但能在一定程度上控制肿瘤进展。本研究表明,可结合CT灌注参数评价肉瘤样癌微血管状态;阿帕替尼在抗血管治疗过程中,可降低肿瘤灌注量、改善肿瘤血管微环境、降低肿瘤血管渗透性。
阿帕替尼治疗肺肉瘤样癌腹腔转移的可靠性有待大样本检测;肺肉瘤样癌对阿帕替尼的耐药时间有待进一步观察。
总之,抗血管生成药物治疗为肺肉瘤样癌的治疗提供了一种新的途径。CT灌注成像能无创、准确、动态地监测肿瘤抗血管生成治疗的疗效。
| [1] |
YENDAMURI S, CATY L, PINE M, et al. Outcomes of sarcomatoid carci-noma of the lung:a surveillance, epidemiology, and end results data-base analysis[J]. Surgery, 2012, 152(3): 397-402. DOI:10.1016/j.surg.2012.05.007 |
| [2] |
VIEIRA T, GIRARD N, UNG M, et al. Efficacy of first-line chemotherapy in patients with advanced lung sarcomatoid carcinoma[J]. J Thorac Oncol, 2013, 8(12): 1574-1577. DOI:10.1097/01.JTO.0000437008.00554.90 |
| [3] |
许春伟, 张博, 林冬梅. WHO(2015)肺肿瘤组织学分类[J]. 诊断病理学杂志, 2015, 22(12): 815-816. |
| [4] |
PELOSI G, MELOTTI F, CAVAZZA A, et al. A modified vimentin histological score helps recognize pulmonary sarcomatoid carcinoma in small biopsy samples[J]. Anticancer Res, 2012, 32(4): 1463-1473. |
| [5] |
张杰, 邵晋晨, 朱蕾. 2015版WHO肺肿瘤分类解读[J]. 中华病理学杂志, 2015, 44(9): 619-624. |
| [6] |
王兰荣, 张伟, 王海存, 等. 原发性肺肉瘤样癌的CT表现与临床病理对照分析[J]. 肿瘤基础与临床, 2016, 29(6): 505-507. |
| [7] |
王丽丽, 张静, 梁小龙, 等.肺肉瘤样癌的临床病理特征及分子特点研究进展[J/OL].中华肺部疾病杂志(电子版), 2017, 10(1): 83-86[2018-05-10]. http://med.wanfangdata.com.cn/Paper/Detailid=PeriodicalPaper_zhonghfb-jbzz201701022&dbid=WF_QK. DOI: 10.3877/cma.J.issn.1674-6902.2017.01.022.
|
| [8] |
LIN Y, YANG H, CAI Q, et al. characteristics and prognostic analysis of 69 patients with pulmonary sarcomatoid carcinoma[J]. AmJ Clin Oncol, 2016, 39(3): 215-222. DOI:10.1097/COC.0000000000000101 |
| [9] |
熊伟杰, 张新星, 黄媚娟, 等. 32例晚期及术后复发肺肉瘤样癌患者的治疗及生存分析[J]. 四川大学学报(医学版), 2014, 45(2): 320-323. |
| [10] |
徐文静, 黄纯, 王柳春, 等. 47例肺肉瘤样癌的特征及预后因素分析[J]. 中国肿瘤临床, 2008, 35(18): 1045-1049. |
| [11] |
ITALIANO A, CORTOT A B, ILIE M, et al. EGFR and KRAS status of primary sarcomatoid carcinomas of the lung:implicat ions for anti-EGFR treatment of a rare lung malignancy[J]. Int J Cancer, 2009, 125(10): 2479-2482. DOI:10.1002/ijc.24610 |
| [12] |
HERBST R S, ONN A, SANDLER A. Angiogenesis and lung cancer:prognostic and therapeutic implications[J]. J Clin Oncol, 2005, 23(14): 3243-3256. DOI:10.1200/JCO.2005.18.853 |
| [13] |
TANAKA S, SAKAMORI Y, NIMI M, et al. Design paper:a phase Ⅱ study of bevacizumab and erlotinib in patients with non squamous non-small cell lung cancer that is refractory or rela psed after 1-2 previous treatment (BEST)[J]. Trials, 2011, 12: 120. DOI:10.1186/1745-6215-12-120 |
| [14] |
刘丽. 肿瘤血管生成的影像学评价及新进展[J]. 医学研究生学报, 2012, 25(10): 1102-1108. |
| [15] |
CHEN Y, ZHANG J, DAI J, et al. Angiogenesis of renal cell carcinoma:perfusion CT findings[J]. Abdom Imaging, 2010, 35(5): 622-628. DOI:10.1007/s00261-009-9565-0 |
| [16] |
YAO J, YANG Z G, CHEN H J, et al. Gastric adenocarcinoma:can perfusion CT help to noninvasively evaluate tumor angiog enesis?[J]. Abdom Imaging, 2011, 36(1): 15-21. DOI:10.1007/s00261-010-9609-5 |
 2020, Vol. 18
2020, Vol. 18


