| 运动成瘾人群的奖赏与抑制功能神经网络的fMRI研究 |
2. 湖北大学师范学院, 湖北 武汉 430062
2. Normal College, Hubei University, Wuhan 430062, China
适度锻炼是现今社会的健康导向,但如果沉迷运动,则会给人们带来负面影响。有学者对过度运动行为模式与其他成瘾行为进行比较,提出运动成瘾[1-2]或运动依赖的概念[3]。运动成瘾是一种行为发展过程,指人长期大量运动后,可能会失去对运动行为的控制,对运动行为产生依赖,进而沉迷或成瘾。有学者提出双加工模型,即奖赏系统和抑制系统,是成瘾行为发展形成的关键。成瘾刺激会阻碍个体有足够的控制能力来抑制刺激冲动[4]。双加工模型[5]将这一过程解释为自动感觉驱动行为的增加和目标导向反应的减少,其中线索反应和抑制反应异常在成瘾的发展过程中起关键作用。近期有学者通过脑电生理发现运动成瘾者的奖赏系统激活增强,抑制系统(Go/NoGo任务)激活减弱,进一步支持了运动成瘾双系统理论[6-7]。但运动成瘾的大脑机制,尤其是双加工模型涉及的具体神经网络仍不清楚。本研究结合线索任务和Go/NoGo任务,从双加工模型角度初步揭示运动成瘾的脑机制。
1 资料与方法 1.1 一般资料招募常熟本地跑步俱乐部志愿者,采用运动成瘾量表(exercise addiction inventory,EAI)[8]评估志愿者的运动情况,EAI评分≥24分为运动成瘾,最终成瘾组纳入29例,其中男19例,女10例;年龄30~52岁,平均(45.6±4.3)岁。另外,同期招募26例非运动成瘾者作为对照组,其中男15例,女11例,年龄26~51岁,平均(45.7±5.6)岁。2组年龄、性别、受教育程度相匹配,且均为右利手,无任何脑外伤、脑手术或精神疾病史。所有志愿者试验前均被告知研究内容、注意事项和可能出现的不适,均自愿签署知情同意书。本研究通过常熟市第二人民医院医学伦理委员会批准(编号:2018-68)。
1.2 相关线索刺激任务选取60张与跑步相关/不相关图片,均分为2组,每组30张。对2组图片的内容、对比度、颜色和大小进行平衡。任务包含20个组块;每一组块均由5张运动或非运动图片组成。每幅图片显示4 s,5张图片显示20 s后,黑屏10 s作为休息间距。被试者需回答是否产生跑步欲望,黄色按钮代表“是”,绿色按钮代表“无”。运动和非运动图片组随机播放,全程约10 min。
1.3 Go/NoGo试验任务视觉材料由26个黑色大写字母组成。试验开始时,屏幕中心显示(+),750 ms后消失;随后1个大写字母出现在白色屏幕上,持续250 ms;紧接着黑屏1 000 ms。黑屏过程中,被试者需作出反应:如字母为非X,按下按钮(Go条件);如字母是X,则不按(NoGo条件)。每个组块包括120个试次,其中X字母出现频率占20%,非X字母占80%。组块试验结束后休息1 min,再重复进行。全程约9 min。
1.4 fMRI数据采集采用GE 3.0 T超导型Discovery 750W MRI扫描仪。被试者取仰卧位,用泡沫垫固定头部,戴耳塞以降低机器噪音。投影屏放在MRI仪器前方,被试者通过安装在头部线圈上的反射镜观看投影屏视觉图片。结构成像采用3D-T1-BRAVO容积序列,TR 8.5 ms,TE 3.2 ms,翻转角12°,视野24 cm×24 cm,矩阵256×256,层厚1 mm,层距0 mm。fMRI扫描采用T2WI序列,TR 2 000 ms,TE 30 ms,翻转角90°,分辨率64×64,轴位33层,层距0.2 mm,层厚3.6 mm,视野24 cm×24 cm,体素大小3.75 mm×3.75 mm×3.75 mm。
1.5 fMRI数据分析数据的预处理和统计分析主要基于Matlab 2013b(http://www.mathworks.com)平台的SPM12(http://www.fil.ion.ucl.ac.uk/spm)和DPAIBI(http://rfmri.org/dpabi)工具箱[9]完成。数据预处理包括:头动校正(排除头动范围平移超过3 mm或旋转超过3°的图像),图像分割,空间配准,空间标准化[空间上归一化至蒙特利尔神经病学研究所(montreal neurological institute,MNI)坐标,并重新采样到3 mm×3 mm×3 mm体素],以及空间平滑(6 mm全宽半高的三维高斯核)。
在一阶分析完成预处理后,首先对每例被试者在3种条件下所诱发的血流动力学反应进行建模,使用箱车函数与典型的血流动力学响应函数(HRF)进行卷积,构建一般线性模型。累赘回归因子由6个头部运动参数和每次运行的恒定回归因子组成。在被试者水平上的对比反应分为2个时间窗口:视觉刺激持续250 ms和视觉刺激消失后的1 000 ms,使用非参数排列检验[9]在DPABI软件[10]中运行5 000个排列,在地图上执行二阶组级随机效应分析,再行运动与非运动线索反应,及NoGo与Go条件下的脑激活情况的组内及组间比较。体素水平阈值设置为P < 0.01,激活簇≥10个体素。根据修订后的解剖自动标记(AAL2)[11]对脑激活情况进行解剖标记。
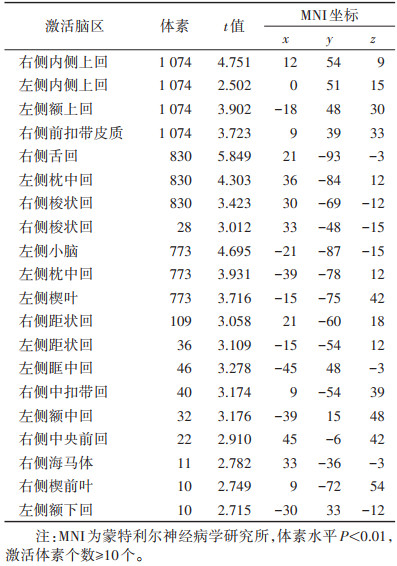
2 结果 2.1 相关线索反应运动与非运动线索刺激脑激活状态分析结果显示,成瘾组在观看运动图片时与观看非运动图片相比,大脑活动增强(P < 0.01)(表 1,图 1),脑区包括左侧额上回、左侧额中回、左侧额下回和右侧前扣带皮质等,这些脑区与奖赏神经网络有关。此外,对照组在观看运动与非运动图片时大脑活动差异无统计学意义(P > 0.05)。
| 表 1 成瘾组在观看运动图片与非运动图片时的大脑激活比较 |
 |
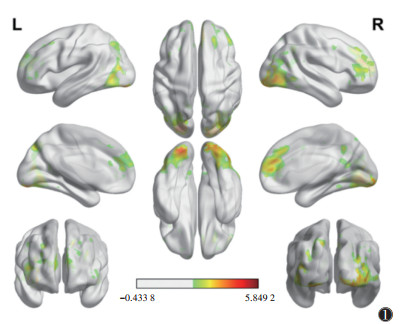 |
| 注:颜色越红,代表激活越强 图 1 成瘾组观看运动图片与非运动图片条件下的大脑激活状态差异 |
2.2 抑制控制反应
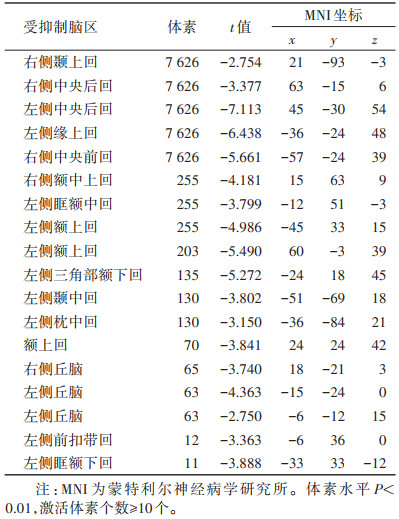
NoGo与Go任务条件下的脑激活状态对比显示,成瘾组仅左侧中央后回的活动性较低(体素=112,t=-3.510,x=-39,y=-27,z=52)(图 2);而对照组明显的负激活脑区包括右侧颞上回、右侧中央后回、左侧中央后回、左侧缘上回、右侧中央前回等(均P < 0.01)(表 2,图 3)。
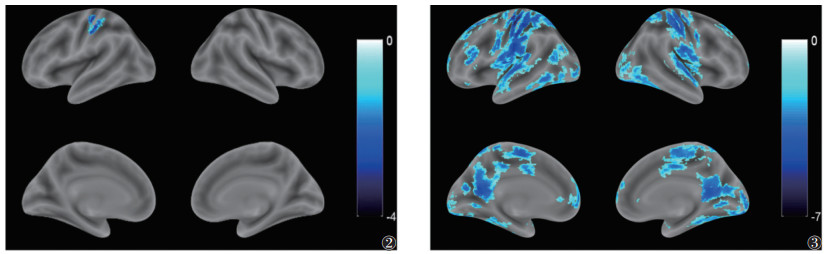 |
| 注:蓝色越深,代表抑制越强 图 2, 3 分别为成瘾组和对照组在NoGo与Go条件下的大脑激活状态差异 |
| 表 2 对照组在NoGo与Go条件下的反应差异 |
 |
3 讨论
本研究通过相关线索刺激和Go/NoGo任务研究运动成瘾人群的奖赏和执行抑制功能,结合fMRI观察大脑相关功能网络活动是否异常。研究结果支持双加工模型理论,在相关线索刺激试验中,与对照组相比,成瘾组的奖赏网络表现为与运动相关刺激导致的过度激活;在经典的Go/NoGo任务中,成瘾组与对照组相比表现为抑制功能显著减弱。
3.1 相关线索刺激运动成瘾人群的奖赏网络过度激活成瘾组在相关线索刺激下诱发大脑活动增加,主要涉及视觉信息加工奖赏脑区、情绪和动机脑区、记忆相关脑区和冲动控制脑区。上述脑区与其他成瘾类型线索反应激活的脑区重叠,如海马体、前扣带皮质、楔前叶和背外侧前额皮质[12]。
眶额皮质和背外侧额叶皮质参与了感官线索对奖赏期望的条件作用过程[13]。眶额皮质负责奖赏预期的情绪和动机特征[14]。背外侧额叶皮质与记忆、奖赏期望及目标导向有关[15-17]。脑盖部则参与了工作记忆和长期记忆的编码与识别阶段[16]。本研究中成瘾组在观看运动图片时脑盖部显著激活,表明其对运动线索识别极度敏感,该结果与针对赌博成瘾人群的线索反应研究[18]一致。且成瘾组在线索刺激下激活的脑区几乎与其他成瘾研究中涉及的脑区重叠。但本研究未观察到类似与赌博和网络游戏障碍等相关试验的背侧纹状体和岛叶的激活[19]。从前额皮质到背侧纹状体的大脑加工参与了从自愿性行为到习惯性和强迫性行为重复的过渡[20],故相较于其他类型的成瘾,运动成瘾的强迫性较弱。
3.2 运动成瘾人群的抑制功能本研究中,执行抑制功能任务时,成瘾组仅左侧中央后回(顶叶)表现出局部负激活。相反,对照组显示强烈的多脑区负激活,与之前关于网络游戏成瘾和海洛因成瘾的研究结果[21-22]一致。抑制功能受损是成瘾行为的临床症状之一。最近的一项Go/NoGo研究发现,酒精成瘾人群在神经抑制过程中前扣带回和额内侧叶激活增强[23];本研究未观察到相同区域,可能与样本量较小有关。
总之,运动成瘾的脑机制还在初步探索阶段,本研究发现运动成瘾人群对运动相关线索更加敏感,执行神经网络的抑制功能反应明显减弱,表明运动成瘾的潜在机制支持双加工模型,反映了病态过度运动的成瘾模式。但还需深入研究不同程度的运动成瘾,以推断反应抑制障碍是否为运动成瘾的主要特征。
| [1] |
丁庆国, 汤晓燕, 黄丽娜, 等. 运动依赖人群静息态默认网络和记忆网络特征[J]. 中华行为医学与脑科学杂志, 2019, 28(12): 1096-1101. |
| [2] |
丁庆国, 黄丽娜, 李琴, 等. 运动成瘾人群MRI脑功能影像特点分析[J]. 中华医学杂志, 2019, 99(35): 2773-2776. |
| [3] |
DINARDI J S, EGOROV A Y, SZABO A. The expanded interactional model of exercise addiction[J]. J Behav Addict, 2021, 10(3): 626-631. DOI:10.1556/2006.2021.00061 |
| [4] |
D'HONDT F, BILLIEUX J, MAURAGE P. Electrophysiological correlates of problematic internet use: critical review and perspectives for future research[J]. Neurosci Biobehav Rev, 2015, 59: 64-82. DOI:10.1016/j.neubiorev.2015.10.005 |
| [5] |
BERRIDGE K C, ROBINSON T E. Liking, wanting, and the incentive-sensitization theory of addiction[J]. Am Psychol, 2016, 71(8): 670-679. DOI:10.1037/amp0000059 |
| [6] |
HUANG Q, HUANG J, CHEN Y, et al. Overactivation of the reward system and deficient inhibition in exercise addiction[J]. Med Sci Sports Exerc, 2019, 51(9): 1918-1927. DOI:10.1249/MSS.0000000000001988 |
| [7] |
ZILBERMAN N, YADID G, EFRATI Y, et al. Personality profiles of substance and behavioral addictions[J]. Addict Behav, 2018, 82: 174-181. DOI:10.1016/j.addbeh.2018.03.007 |
| [8] |
SIMÓN GRIMA J S, ESTRADA-MARCÉN N, MONTERO-MARÍN J. Exercise addiction measure through the exercise addiction inventory (EAI) and health in habitual exercisers. A systematic review and meta-analysis[J]. Adicciones, 2019, 31(3): 233-249. |
| [9] |
WINKLER A M, WEBSTER M A, BROOKS J C, et al. Non-parametric combination and related permutation tests for neuroimaging[J]. Hum Brain Mapp, 2016, 37(4): 1486-511. DOI:10.1002/hbm.23115 |
| [10] |
YAN C G, WANG X D, ZUO X N, et al. DPABI: data processing & analysis for (resting-state) brain imaging[J]. Neuroinformatics, 2016, 14(3): 339-351. DOI:10.1007/s12021-016-9299-4 |
| [11] |
ROLLS E T, JOLIOT M, TZOURIO-MAZOYER N. Implementation of a new parcellation of the orbitofrontal cortex in the automated anatomical labeling atlas[J]. Neuroimage, 2015, 122: 1-5. DOI:10.1016/j.neuroimage.2015.07.075 |
| [12] |
VOLKOW N D, MICHAELIDIES M, BALER R. The neuroscience of drug reward and addiction[J]. Physiol Rev, 2019, 99(4): 2115-2140. DOI:10.1152/physrev.00014.2018 |
| [13] |
ZILVERSTAND A, HUANG A S, ALIA-KLEIN N, et al. Neuroimaging impaired response inhibition and salience attribution in human drug addiction: a systematic review[J]. Neuron, 2018, 98(5): 886-903. DOI:10.1016/j.neuron.2018.03.048 |
| [14] |
IZQUIERDO A. Functional heterogeneity within rat orbitofrontal cortex in reward learning and decision making[J]. J Neurosci, 2017, 37(44): 10529-10540. DOI:10.1523/JNEUROSCI.1678-17.2017 |
| [15] |
MELROSE R J, ZAHNISER E, WILKINS S S, et al. Prefrontal working memory activity predicts episodic memory performance: a neuroimaging study[J]. Behav Brain Res, 2020, 379: 112307. DOI:10.1016/j.bbr.2019.112307 |
| [16] |
AU J, KATZ B, MOON A, et al. Post-training stimulation of the right dorsolateral prefrontal cortex impairs working memory training performance[J]. J Neurosci Res, 2021, 99(10): 2351-2363. DOI:10.1002/jnr.24784 |
| [17] |
OVERMAN M J, SARRAZIN V, BROWNING M, et al. Stimulating human prefrontal cortex increases reward learning[J]. Neuroimage, 2023, 271: 120029. DOI:10.1016/j.neuroimage.2023.120029 |
| [18] |
LIMBRICK-OLDFIELD E H, MICK I, COCKS R E, et al. Neural substrates of cue reactivity and craving in gambling disorder[J]. Translational Psychiatry, 2017, 7(1): e992. DOI:10.1038/tp.2016.256 |
| [19] |
SUN Y, YING H, SEETOHUL R M, et al. Brain fMRI study of crave induced by cue pictures in online game addicts (male adolescents)[J]. Behavioural Brain Research, 2012, 233(2): 563-576. DOI:10.1016/j.bbr.2012.05.005 |
| [20] |
HAGGERTY D L, MUNOZ B, PENNINGTON T, et al. The role of anterior insular cortex inputs to dorsolateral striatum in binge alcohol drinking[J]. Elife, 2022, 11: e77411. DOI:10.7554/eLife.77411 |
| [21] |
时宏, 陈佳杰, 刘为, 等. fMRI观察强制戒断对海洛因成瘾者渴求任务下大型脑网络的影响[J]. 中国医学影像技术, 2019, 35(8): 1169-1174. |
| [22] |
韩旭, 李磊, 汪耀, 等. 联合运用静息态及动态功能连接分析探讨杏仁核在网络游戏成瘾中的意义[J]. 中国医学影像技术, 2017, 33(7): 969-974. |
| [23] |
STEIN M, STEINER L, FEY W, et al. Alcohol-related context modulates neural correlates of inhibitory control in alcohol dependent patients: preliminary data from an fMRI study using an alcohol-related Go/NoGo-task[J]. Behav Brain Res, 2021, 398: 112973. DOI:10.1016/j.bbr.2020.112973 |
 2024, Vol. 22
2024, Vol. 22


