| 基于图论分析法对难治性癫痫脑功能网络的研究 |
癫痫是临床常见的慢性神经系统疾病,全球发病人数超过7 000万。尽管抗癫痫药物有多种,但仍约1/3癫痫经药物治疗无效发展为难治性癫痫(intractable epilepsy,ITE)。2010年国际抗癫痫联盟(The International League Against Epilepsy,ILAE)提出了ITE诊断标准:正确选择2种可耐受的抗癫痫药物,通过足疗程、足剂量单药或联合用药仍未实现无发作,且无发作时间应为治疗前最长发作间隔时间的3倍或1年(选择时间更长者)[1]。ITE患者过早死亡、受伤、产生社会心理功能障碍及生活质量下降的风险显著增加[2-3]。癫痫患者以儿童及青少年为主,0~14岁发病率为151/10万,75%~80%的癫痫患者发病年龄<18岁,据统计,我国约600万癫痫患儿,患病率约7/10 000[4]。癫痫的反复发作不仅影响患者的学习、生活及社会交往,增加家庭和社会的负担,还可能导致大脑发育及功能进一步受损。因此,儿童及青少年ITE的诊断、早期监测及治疗尤为重要,是重要的公共卫生问题。ITE是一种涉及复杂脑网络障碍的疾病[5],基于静息态fMRI(rs-fMRI)的图论分析方法,是一种安全且广泛使用评估大脑活动的方法,其在网络拓扑结构的研究中,能量化大脑网络变化,可应用于rs-fMRI表征功能连通性,从功能数据中获得大脑的网络图,深入了解脑功能障碍的解剖学基础,从而为疾病的诊断和治疗提供重要参考。图论分析方法在创伤后应激障碍、阿尔茨海默病、精神分裂症、卒中等疾病的脑功能及神经机制研究中也具有重要意义[6]。本研究拟采用rs-fMRI结合图论分析方法从全脑水平研究ITE复杂网络改变,加深对儿童及青少年ITE神经机制的了解。
1 资料与方法 1.1 一般资料收集于我院就诊的儿童及青少年ITE患者23例为ITE组,其中男13例,女10例;年龄6~15岁,平均(11.44±2.57)岁。所有患者在MRI检测前均由专科医师采用中国修订版韦氏儿童智力量表(2版,适用年龄6~16岁)[7]进行智力测试,包括言语智商评分、操作智商评分和全量表智商评分。
同期招募23例年龄、性别、受教育年限相匹配的健康志愿者作为对照组,其中男14例,女9例;年龄7~16岁,平均(11.61±2.68)岁。
ITE组纳入标准:①儿科高年资医师参照2010年ILAE标准,诊断为ITE的右利手患者;②年龄6~16岁。排除标准:①MRI检查禁忌证;②有颅脑损伤、手术史;③有颅内器质性病变;④扫描过程中头部平移>2 mm或旋转>2°;⑤伴其他神经精神疾病;⑥心、肝、肾等重要器官功能障碍者;⑦依从性差,无法配合完成MRI检查或智力测试。
对照组纳入标准:①年龄6~16岁的右利手健康志愿者;②年龄、性别、受教育年限与ITE组相匹配。排除标准:①MRI检查禁忌证;②依从性差,无法配合完成MRI检查;③有颅内器质性病变;④扫描过程中头部平移>2 mm或旋转>2°。
本研究经医院医学伦理委员会批准,2组MRI检查前均签署知情同意书。
1.2 仪器与方法采用GE 3.0 T Signa HDxt MRI扫描仪。扫描前受试者去除金属异物,闭目平卧于检查床上,戴耳塞降噪,海绵垫固定头部减少伪影,不进行思维活动,保持清醒。扫描序列及参数:①T2-FLAIR,视野240 mm×240 mm,TE 165 ms,TR 7 826 ms,TI 2 100 ms,层厚5 mm,层距1.5 mm,翻转角90°;②3D-T1WI,视野256 mm×256 mm,TE 3.0 ms,TR 7.8 ms,TI 450 ms,层厚1 mm,无间隔,翻转角15°;③rs-fMRI,视野240 mm×240 mm,TE 30 ms,TR 2 000 ms,层厚4.0 mm,无间隔,层数33,翻转角15°,激励次数1,采集时间点210个。
1.3 数据处理及分析 1.3.1 数据预处理及脑功能网络构建利用MRIcron软件包中的dcm2nii工具将2组rs-fMRI原始DICOM图像转化为4D NIFTI格式。预处理均基于MATLAB 2013b平台下GRETNA V2.0软件包(https://www.nitrc.org/projects/gretna/)进行。主要步骤:①去除时间点,剔除前10个时间点的数据。②时间层校正,以每个时间点采集图像的中间层作为参考层进行校正,以便每个时间点采集的所有数据开始于同一时刻。③头动校正,扫描过程中被试者头部平移>2 mm或旋转>2°数据剔除。④空间标准化,校正后的rs-fMRI图像转换采用标准脑模板进行配准,体素大小为3 mm×3 mm×3 mm。⑤空间平滑,标准化后的功能像以半峰全宽为4 mm×4 mm×4 mm的平滑核进行平滑,以提高图像的SNR,并改善空间标准化效果。⑥去线性漂移。⑦采用0.01~0.08 Hz带宽对信号进行低频滤波。⑧回归协变量,回归掉全局信号、白质信号及脑脊液信号。根据脑自动解剖标记图谱构建90×90全脑功能网络矩阵。
1.3.2 脑网络拓扑属性的计算基于GRETNA V2.0软件包对脑网络的全局属性及节点属性指标进行计算,稀疏度为0.10~0.34,间隔0.01,计算每个网络矩阵的AUC。节点属性包括:介数中心度、节点聚类系数、节点中心度、节点局部效率、节点效率和节点特征路径长度。全局属性包括:①全局网络效率指标,即全局效率(global efficiency,Eglob)、局部效率(local efficiency,Eloc);②小世界参数,即聚类系数(clustering efficiency,Cp)、特征路径长度(characteristic path length,Lp)、标准化聚类系数(gamma,γ)、标准化特征路径长度(lambda,λ)和小世界标量(sigma,σ)。
1.4 统计学分析采用SPSS 18.0软件分析数据。2组性别比较行χ2检验,年龄、受教育程度比较行两独立样本t检验。脑网络分析组间比较符合正态分布且方差齐采用两独立样本t检验,不符合正态分布或方差不齐,采用Mann-Whitney U检验。将存在显著性差异的ITE患者全局及节点属性指标与韦氏智力量表中的操作智商、言语智商、全量表智商及病程行相关性分析,若2组指标均符合正态分布,行Pearson相关分析;若不符合正态分布行Spearman相关性分析。以P<0.05为差异有统计学意义。
2 结果 2.1 2组一般资料比较2组性别、年龄及受教育年限比较,差异均无统计学意义(均P>0.05)(表 1)。
| 表 1 2组一般资料比较 |
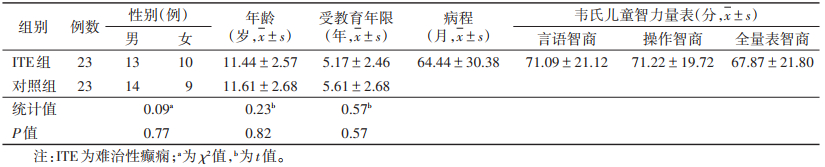 |
2.2 2组脑功能网络拓扑属性比较 2.2.1 2组全局属性比较
ITE组与对照组均具有小世界属性(满足γ=>1,λ≈1,且σ=γ/λ>1)。与对照组相比,ITE组Eloc及γ均减低(均P<0.05),而Eglob、Cp、Lp、λ、σ差异均无统计学意义(均P>0.05)(表 2,图 1)。
| 表 2 ITE组与对照组全局属性比较(x±s) |
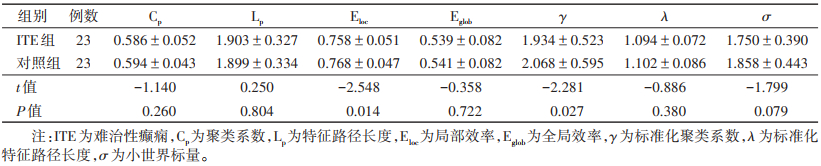 |
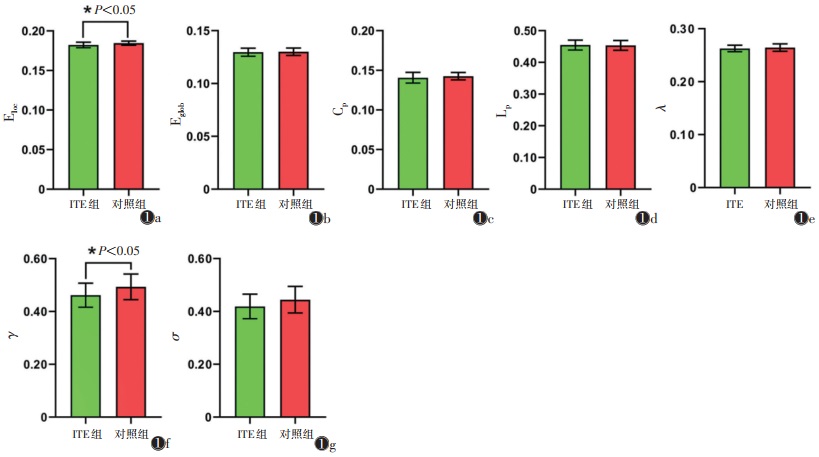 |
| 注:Eloc为 局部效率(图1a),Eglob为全局效率(图1b),Cp为聚类系数(图1c),Lp为特 征路径长度(图1d),λ为标准化特征路径长度(图1e),γ为标准化聚类 系数(图1f),σ为小世界标量(图1g) 图 1 难治性癫痫(ITE)组与对照组的脑功能网络全局属性 |
2.2.2 2组节点属性比较
与对照组相比,ITE组节点属性有差异的脑区主要位于默认网络及视觉皮质,节点属性升高的脑区位于右侧额中回眶部、右侧舌回、右侧枕上回、左侧丘脑、左侧距状裂周围皮质、左侧楔前叶、左侧梭状回(均P<0.05)。节点属性减低的脑区位于左侧额中回、左侧眶内额上回、左侧额下回眶部、右侧额下回岛盖部、双侧内侧额上回、右侧脑岛、右侧丘脑、左侧壳核、左侧苍白球(均P<0.05)(表 3,图 2)。
| 表 3 ITE组与对照组节点属性比较 |
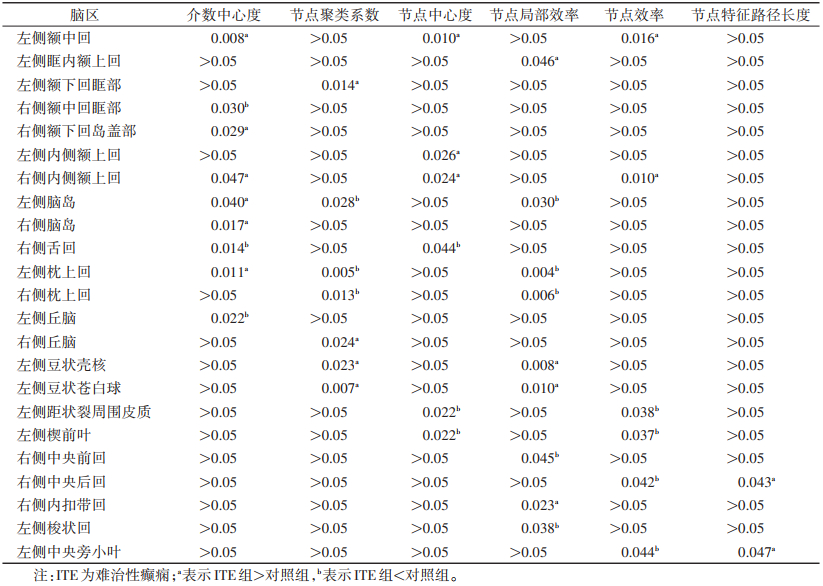 |
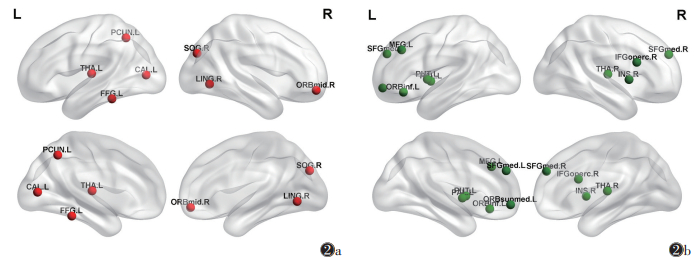 |
| 注:图2a为节点属性升高的脑区,图2b为节点属性减低的脑区。红色代表升高,绿色代表减低。L为左侧,R为右侧,ORBmid为额中回眶部,LING为舌回,SOG为枕上回,THA为丘脑,CAL为距状裂周围皮质,PCUN为楔前叶,FFG为梭状回,MFG为额中回,ORBsupmed为眶内额上回,ORBinf为额下回眶部,IFGoperc为额下回岛盖部,SFGmed为内侧额上回,INS为脑岛,PUT为壳核,PAL为苍白球 图 2 难治性癫痫(ITE)组节点属性有差异的脑区 |
2.3 相关性分析
ITE组左侧楔前叶节点中心度及左侧楔前叶节点效率与病程均呈负相关(图 3)(r=-0.564,P=0.005;r=-0.539,P=0.008)。
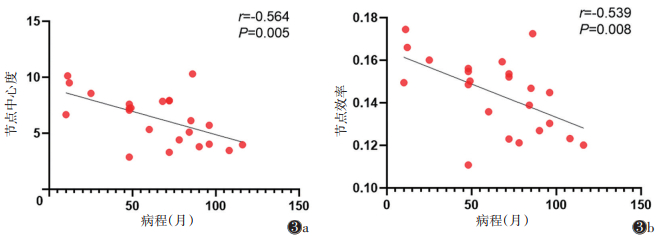 |
| 注:图3a,3b分别为左侧楔前叶的节点中心度、节点效率与病程均呈负相关 图 3 难治性癫痫(ITE)组异常的节点属性与临床变量的相关性分析 |
3 讨论 3.1 全局属性分析
正常的大脑网络具有路径长度短、传输效率高的特点,称为小世界属性。这使得大脑网络能够满足局部和全局需求,平衡功能整合和分离,从而实现不同大脑区域之间神经活动的同步。因此,小世界属性允许以低布线成本高效地传输信息[6]。具有小世界属性的脑网络需满足:γ>1,λ≈1,且σ=γ/λ>1[8]。本研究发现,ITE组与对照组功能网络均具有小世界属性。脑网络全局属性指标根据不同功能分为功能分化(Cp、Eloc)及功能整合(Lp、Eglob)两大类,既能在不同单元内进行特定信息处理,又能将网络内不同单元的信息进行整合[6]。Eloc是相邻节点相互作用构成的子网络的Eglob,网络的Eloc是网络中所有节点局部效率的平均值,反映了网络的容错能力,即当某个节点破坏或损伤后,子网络的信息处理能力受影响的程度[9]。Eloc反映了网络的功能分化能力,Eglob及Lp反映了网络的功能整合能力。γ即标准化聚类系数,值越大代表脑网络局部信息处理能力越强。与对照组相比,ITE组Eloc及γ减低,Lp及Eglob差异无统计学意义,表明ITE患者脑网络的容错能力减弱,局部信息处理能力降低,而全局信息的整合能力未受到明显影响。推测ITE组的脑网络改变以局部分离功能降低为主,对全局的整合能力影响较小。
3.2 节点属性分析本研究发现,ITE组节点属性有差异的脑区主要位于默认网络及视觉皮质。默认网络与认知功能(如执行功能)有关,是人类固有脑网络中最突出的静息态网络,在静息状态下处于激活状态并参与自发思维,在执行需要注意力的任务时或睡眠时处于去激活状态[10-11]。楔前叶、后扣带回、内侧前额叶皮质(medial prefrontal cortex,MPFC)等构成了默认网络的核心脑区,这些脑区间具有较强的相关性[12]。这些与其他节点紧密连接的区域在大脑网络内信息调节和传递功能方面起着重要作用,核心节点的破坏被证明是癫痫的病理生理机制之一[13]。本研究ITE组MPFC(双侧内侧额上回及左侧眶内额上回)、楔前叶节点属性指标均存在异常,提示ITE组默认网络受损,推测儿童及青少年ITE的认知功能障碍可能与默认网络受损相关。Jiang等[14]基于独立成分分析(independent component analysis,ICA)对19例ITE患者研究发现,ITE组默认网络双侧MPFC的功能连接值降低,而双侧楔前叶的功能连接值增加,提示MPFC功能减低的同时伴楔前叶功能增强。本研究显示,ITE组左侧楔前叶的节点中心度及节点效率增高,提示左侧楔前叶在网络中的功能增强。而ITE组MPFC的节点指标均表现为减低,说明其在网络中的功能减弱,推测楔前叶的节点指标升高可能是一种脑网络代偿性机制。
视觉的处理与距状裂周围皮质、舌回、梭状回等多个解剖区域相关。本研究发现,ITE组枕叶的距状裂周围皮质、舌回、双侧枕上回均发现节点属性存在异常,提示ITE组患者可能存在广泛的视觉功能损伤。Craciun等[15]基于立体脑电图对儿童枕叶癫痫的研究显示,11岁以上儿童中三分之二存在视觉先兆,其中单纯枕叶癫痫患者的发作区位于枕叶,舌回和楔状回是最易引起癫痫的解剖结构。本研究发现,ITE组舌回及梭状回节点属性增高,表明其在网络中的作用增强,提示ITE组可能存在视觉功能损害,且右侧舌回的介数中心度及节点中心度均增高,提示右侧舌回可能为ITE的致痫灶。
3.3 相关性分析癫痫发作过程中,脑网络拓扑结构的改变是进行性的,与癫痫发生相关的异常网络的形成会导致正常大脑网络的破坏[16-17]。本研究发现,左侧楔前叶的节点中心度及节点效率随病程的增加而减低,说明随病程的延长左侧楔前叶在网络中的中心性减低,对脑网络的影响减弱且伴随局部信息处理能力的减弱。楔前叶为默认网络的核心脑区,楔前叶功能减低进一步提示默认网络可能存在功能减弱,随时间的推移,ITE组患者认知功能损害可能不断加重。本研究未发现异常的网络属性指标与智商之间的相关性,分析原因可能为本研究中的ITE由多种类型癫痫转变而来,不同类型的癫痫其发作机制不同,对智商的影响具有差异性,后期将针对ITE进一步分类研究。
综上所述,本研究中ITE组与对照组功能网络均具有小世界属性。ITE组的脑网络改变以局部分离功能降低为主,对全局的整合能力影响较小。节点属性改变主要发生于默认网络及视觉皮质,提示儿童及青少年ITE患者认知功能及视觉功能损害可能与默认网络及视觉皮质异常相关。楔前叶为默认网络的核心脑区,左侧楔前叶的节点中心度、节点效率均与病程呈负相关,推测随时间推移,楔前叶节点指标的改变可能导致ITE患者认知功能损害不断加重,这为癫痫脑功能、脑网络研究及神经机制研究提供了新的视角。
| [1] |
KWAN P, ARZZIMANOHLOU A, BERG A T, et al. Definition of drug resistant epilepsy: consensus proposal by the ad hoc task force of the ILAE commission on therapeutic strategies[J]. Epilepsia, 2010, 51(6): 1069-1077. DOI:10.1111/j.1528-1167.2009.02397.x |
| [2] |
PONG A W, XU K J, KLEIN P. Recent advances in pharmacotherapy for epilepsy[J]. Curr Opin Neurol, 2023, 36(2): 77-85. DOI:10.1097/WCO.0000000000001144 |
| [3] |
LÖSCHER W, POTSCHKA H, SISODIYA S M, et al. Drug resistance in epilepsy: clinical impact, potential mechanisms, and new innovative treatment options[J]. Pharmacol Rev, 2020, 72(3): 606-638. DOI:10.1124/pr.120.019539 |
| [4] |
ZHAP T, YU L H, ZHANG H L, et al. Long-term effectiveness and safety of lacosamide as adjunctive therapy in children and adolescents with refractory epilepsy: a real-world study[J]. BMC Pediatr, 2023, 23(1): 249. DOI:10.1186/s12887-023-04039-5 |
| [5] |
DING Y, GUO K, LI J, et al. Alterations in brain network functional connectivity and topological properties in DRE patients[J]. Front Neurol, 2023, 14: 1238421. DOI:10.3389/fneur.2023.1238421 |
| [6] |
SONG K, LI J, ZHU Y, et al. Altered small-world functional network topology in patients with optic neuritis: a resting-state fMRI study[J]. Dis Markers, 2021, 2021: 9948751. |
| [7] |
黄熠龙, 陈敏, 杨金钢, 等. MRI检测颞叶癫痫患儿丘脑、白质体积与疾病严重程度的相关性研究[J]. 临床和实验医学杂志, 2021, 20(14): 1546-1549. |
| [8] |
黄伟康, 李志铭, 吴水天, 等. 静息态功能磁共振成像分析原发性失眠患者大脑的小世界网络[J]. 南方医科大学, 2021, 41(3): 424-429. |
| [9] |
LATORA V, MARCHIORI M. Efficient behavior of small-world networks[J]. Phys Rev Lett, 2001, 87(19): 198701. DOI:10.1103/PhysRevLett.87.198701 |
| [10] |
ZHOU X, ZHANG Z, LIU J, et al. Aberrant topological organization of the default mode network in temporal lobe epilepsy revealed by graph-theoretical analysis[J]. Neurosci Lett, 2019, 708: 134351. DOI:10.1016/j.neulet.2019.134351 |
| [11] |
ZHANG Z, ZHOU X, LIU J, et al. Aberrant executive control networks and default mode network in patients with right-sided temporal lobe epilepsy: a functional and effective connectivity study[J]. Int J Neurosci, 2020, 130(7): 683-693. DOI:10.1080/00207454.2019.1702545 |
| [12] |
LI J, CURLEY W H, GUERIN B, et al. Mapping the subcortical connectivity of the human default mode network[J]. Neuroimage, 2021, 245: 118758. DOI:10.1016/j.neuroimage.2021.118758 |
| [13] |
WANG X, JIAO D, ZHANG X, et al. Altered degree centrality in childhood absence epilepsy: a resting-state fMRI study[J]. J Neurol Sci, 2017, 373: 274-279. DOI:10.1016/j.jns.2016.12.054 |
| [14] |
JIANG L W, QIAN R B, FU X M, et al. Altered attention networks and DMN in refractory epilepsy: a resting-state functional and causal connectivity study[J]. Epilepsy Behav, 2018, 88: 81-86. DOI:10.1016/j.yebeh.2018.06.045 |
| [15] |
CRACIUN L, TAUSSIG D, FERRAND-SORBETS S, et al. Investigation of paediatric occipital epilepsy using stereo-EEG reveals a better surgical outcome than in adults, especially when the supracalcarine area is affected[J]. Epileptic Disord, 2018, 20(5): 346-363. DOI:10.1684/epd.2018.1000 |
| [16] |
PARK K M, LEE B I, SHIN K J, et al. Progressive topological disorganization of brain network in focal epilepsy[J]. Acta Neurol Scand, 2018, 137(4): 425-431. DOI:10.1111/ane.12899 |
| [17] |
JIANG W, LI J, CHEN X, et al. Disrupted structural and functional networks and their correlation with alertness in right temporal lobe epilepsy: a graph theory study[J]. Front Neurol, 2017, 8: 179. DOI:10.3389/fneur.2017.00179 |
 2024, Vol. 22
2024, Vol. 22


