| PET/CT-MRI三模式对头颈部肿瘤的诊断价值 |
头颈部肿瘤包括颈部肿瘤、耳鼻喉肿瘤及口腔颌面部肿瘤,占全身恶性肿瘤的5%~8%[1]。头颈部肿瘤位置表浅,易穿刺获得病理结果,但头颈部解剖结构复杂,神经及血管分布丰富,易因穿刺位置误差或观察者间的差异导致病理诊断不准确[2]。PET/CT-MRI三模式作为PET/CT和MRI的结合,既能提供骨骼信息,辨别重要器官[3],又能提供病变的代谢情况,一定程度上弥补了PET/CT在头颈部肿瘤应用中的不足,在头颈部肿瘤的检出、分期、范围确定、疗效评估,以及在肿瘤复发的长期监测中具有重大价值。
1 资料与方法 1.1 一般资料搜集2014年3月至2017年3月于我院行PET/CT-MRI三模式检查并在检查后2周内行穿刺活检、手术治疗有明确病理结果的47例头颈部病变患者,其中男32例,女15例;年龄13~77岁。所有患者均无PET/CT、MRI检查禁忌证,无糖尿病史,检查前均未行穿刺、放化疗及手术。
1.2 仪器与方法 1.2.1 PET/CT扫描47例空腹血糖<8.10 mmol/L,静脉注射18F-FDG(标准剂量3.70~4.44 MBq/kg体质量)。采用GE Discovery PET/CT行全身扫描,层厚3.75 mm,层距3.27 mm。PET扫描层厚3.30 mm,层距3.27 mm,采集时间3 min/床位,床位6~7个。
1.2.2 MRI扫描47例PET/CT检查后使用GE 3.0 Discovery MRI扫描仪检查。扫描序列及参数:采用T2WI抑脂、T1WI序列,视野420 mm×380 mm,层厚6.6 mm,无间隔,TE 84 ms。45例能继续配合的患者行多b值DWI序列:b值分别为0、50、100、150、200、300、500、800、1 000、1 300、1 500、1 700、2 000、2 500、3 000、3 500、4 000和4 500 s/mm2。
1.3 图像处理① 标准摄取值(standardized uptake value,SUV)值获得:利用GE的Advantage Windows 4.6工作站融合软件融合PET/CT图像,后将PET图像和MRI图像进行融合和显示。由2位有经验的影像学医师在未知病理的情况下对病变SUV的平均值(SUVmean)和最大值(SUVmax)进行测量,取两者测量的平均值作为最终值。②视觉分析:在未知病理结果的情况下,由2位有经验的影像诊断医师根据临床经验独立、随机阅读PET/CT、MRI图像,2周后再阅读PET/CT-MRI三模式图像,并对病灶行良恶性诊断,诊断不一致时讨论取得一致结果。③多b值DWI图像处理:由2位有经验的影像学医师在未知病理情况下利用AW 4.6工作站的MADC和AQP软件对多b值图像进行处理,测量病变的快速、慢速及水通道蛋白(AQP)的ADC值,即ADCfast、ADCslow及ADCAQP,取两者测量的平均值作为最终值。
1.4 统计学分析采用SPSS 16.0统计软件进行数据分析。以病理为金标准,比较PET/CT、MRI、PET/CT-MRI三模式对头颈部良恶性病变的诊断敏感度、特异度、阳性预测值、阴性预测值及准确率,计量资料以x±s表示,对良恶性病变组的SUV、ADC行独立样本t检验。根据良恶性病变的SUVmax、ADCAQP绘制ROC曲线,确定鉴别良恶性病变的最佳SUVmax、ADCAQP界值,2组间AUC比较行Z检验。以P<0.05为差异有统计学意义。
2 结果 2.1 手术病理结果47例中,颈部转移瘤11例,淋巴瘤10例,鳞状细胞癌5例(下咽癌2例,喉癌3例),甲状腺腺癌4例,促结缔组织增生性小圆细胞瘤1例,甲状腺腺瘤5例,炎症4例,腮腺多形性腺瘤4例,炎性淋巴结3例。
2.2 PET/CT、MRI及PET/CT-MRI三模式视觉分析(表 1)| 表 1 PET/CT、MRI与PET/CT-MRI三模式对头颈部病变诊断结果比较 |
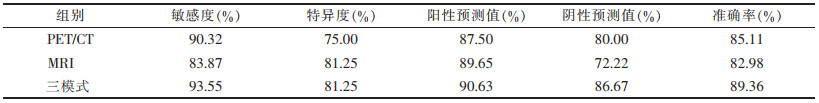 |
与PET/CT、MRI相比,PET/CT-MRI三模式在诊断敏感度、阳性预测值、阴性预测值及准确率上有一定程度的提高(图 1)。
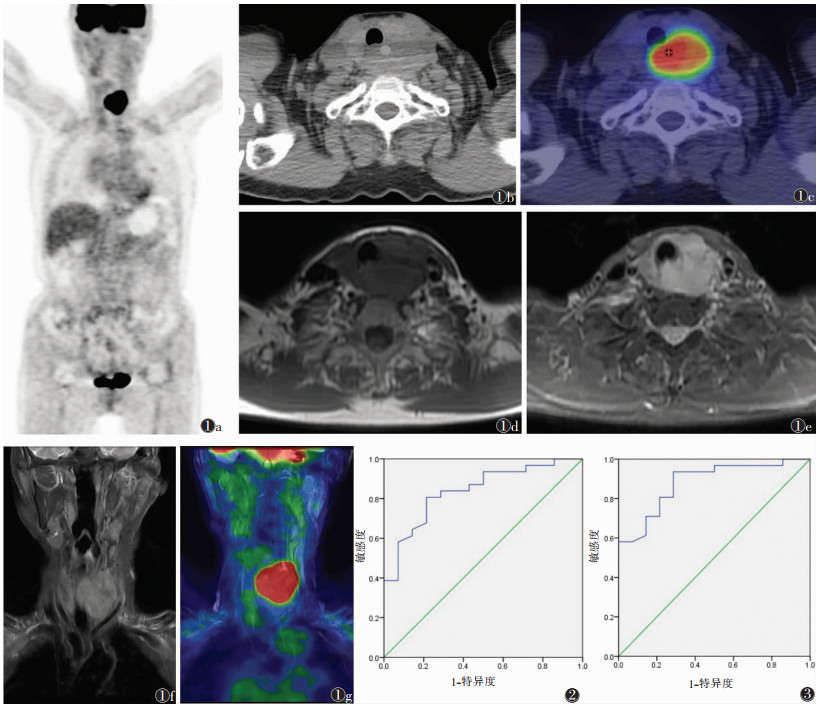 |
| 图 1 男,70岁,甲状腺腺癌 图1a~1c 分别为PET、CT和PET/CT融合图像,甲状腺左侧叶明显增大,密度均匀,邻近气管受压右移,病变表现为明显的高代谢,良恶性无法定性 图1d T1WI呈低信号 图1e~1g 分别为T2WI横断面、冠状面及PET/MRI图像,表现为甲状腺左侧叶占位性病变,T2WI呈高信号,周围无明显肿大淋巴结影,FDG高摄取。结合PET/CT、MRI表现,PET/CT-MRI三模式诊断为恶性肿瘤 图2 标准提取值的最大值鉴别头颈部良恶性病变ROC曲线 图3 水通道蛋白ADC值的平均值鉴别头颈部良恶性病变ROC曲线 |
2.3 良恶性病变的SUV值、ADC值比较(表 2)
| 表 2 良恶性病变SUV、ADC值比较(x±s) |
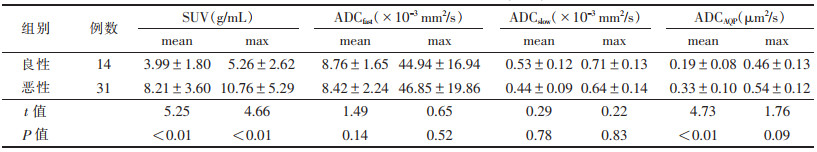 |
头颈部良恶性病变的SUVmax、SUVmean及ADCAQP(mean)比较,差异均有统计学意义(均P<0.05)。
2.4 良恶性病变SUVmax、ADCAQP(mean)的临界值以病理诊断为金标准,45例SUVmax的AUC为0.839,95%置信区间(95%CI)(0.718,0.959),6.65 g/mL为最佳诊断界值(图 2),其诊断的敏感度、特异度分别为80.6%、78.6%。45例头颈部病变的ADCAQP(mean)的AUC为0.881,95%CI(0.780,0.983),0.212 5 μm2/s为最佳诊断界值(图 3),其诊断敏感度、特异度分别为93.5%、71.4%。
3 讨论头颈部肿瘤是第六大常见的恶性肿瘤,男性多见,尤其是年龄 > 50岁,其治疗方式主要包括手术切除和放化疗[4]。头颈部解剖结构复杂,血管神经丰富,肿瘤一旦侵犯邻近器官或血管、神经,则会影响呼吸、吞咽、咀嚼、发声等,影响患者的生活质量。尽早发现、准确定位及分期对治疗方案的制订尤为重要。
PET/CT、MRI虽已广泛应用于头颈部病灶的诊断中,但其在肿瘤检出、良恶性淋巴结鉴别及肿瘤复发的检出中具有一定局限性:MRI检查主要依靠肿瘤的形态、大小及ADC值对原发灶、肿大淋巴结及肿瘤复发进行分析,对一些小结节或微小结节,不能准确检出,尤其是术后或放疗后肿瘤患者,正常解剖结构破坏,MRI在鉴别治疗后反应和肿瘤残余或复发上更困难。而PET/CT虽在原发灶、转移性淋巴结、远处转移及复发的检出上敏感度较高[5],但治疗过程中炎症引起的假阳性使其应用受到一定限制,当肿瘤较小、出现坏死时,由于代谢降低,也易出现假阴性[6],这时MRI检查更易发现。PET/CT-MRI三模式作为MRI、PET/CT的结合,一定程度上弥补了MRI、PET/CT单独使用时的缺点。本研究中,与PET/CT、MRI相比,PET/CT-MRI三模式对头颈部病变的诊断敏感度、特异度、阳性预测值、阴性预测值及准确率均较PET/CT、MRI有一定提高。CALABRIA等[7]利用18F-choline PET/CT、MRI对1例前列腺癌复发伴颅内脑膜瘤患者进行分析,并对PET、MRI图像进行融合,在PET及MRI上均能发现该病灶,但在相同层面的CT图像上并未发现异常,表明MRI在颅脑影像检查中的重要性。
PET/CT-MRI三模式在头颈部疾病的诊断上不仅能够提供PET、CT及MRI常规图像,还能获得病灶的SUV及ADC值。以往研究[8-9]多采用SUVmax进行分析,因其不依赖ROI的大小,而SUVmean可能会随ROI的变化而有所改变。大部分研究认为良恶性肿瘤的SUVmax差异有统计学意义,在肿瘤的良恶性鉴别上有一定价值:BOEEKMANN等[10]研究认为,SUVmax=4.2 g/mL时对甲状腺良恶性结节有一定的鉴别能力,敏感度、特异度分别为64.3%、78.0%。而LEE等[11]认为,鼻咽癌与鼻咽部良性病变的SUVmax=6 g/mL时有一定的鉴别能力,敏感度、特异度分别为88.1%、91.7%。本研究中31例恶性肿瘤与14例良性病灶的SUVmax及SUVmean差异均有统计学意义,与之前的研究相同。本研究认为SUVmax=6.65 g/mL为头颈部良恶性病变的诊断界值,较以往的研究稍高,可能与本研究选择的肿瘤类型、解剖结构有关。也有研究认为,SUVmax不足以对良恶性进行鉴别,DE GEUS-OEI等[12]的研究指出良恶性病变的SUVmax差异无统计学意义,在肿瘤的鉴别上无价值。目前,关于SUVmax对肿瘤良恶性的鉴别还存在争议,需进一步研究。
在头颈部肿瘤的DWI研究中多利用单指数信号衰减模型或单一b值测量ADC值对头颈部良恶性病变进行鉴别。PERRONE等[13]对32例颈部淋巴结行b=0、500、1 000 s/mm2的DWI检查,利用单指数信号衰减模型测量ADC值发现,在b=1 000 s/mm2时转移性淋巴结、淋巴瘤淋巴结的ADC值比良性淋巴结低,差异有统计学意义,提示DWI在良恶性肿瘤的鉴别上有一定价值。本研究基于多指数模型的研究基础,即当b值<200 s/mm2时,反映微循环灌注[14],获得ADCfast;当b值> 1 000 s/mm2时,活体水分子信号衰减与ADCfast、ADCslow有关,反映水分子在细胞外和细胞内的扩散运动[15-16],获得ADCslow;当b值> 1 700 s/mm2时,反映的是水分子通过细胞膜AQP的信息,得到水通道蛋白分子成像[15],获得ADCAQP。研究[17-18]指出,高b值反映细胞膜AQP功能和数量,与良性病灶相比,恶性肿瘤的肿瘤细胞膜AQP表达增高,导致ADC值升高。本研究恶性病变的ADCAQP(mean)大于良性病变,差异有统计学意义,有助于头颈部肿瘤良恶性的诊断。同时本研究认为ADCAQP(mean)=0.212 5 μm2/s为头颈部良恶性病变的诊断界值,敏感度、特异度分别为93.5%、71.4%。
综上所述,SUV与ADC在良恶性疾病的诊断中具有重要价值,但具体的诊断界值仍存在争议。原因可能是研究部位及比较的病灶病理类型不同。随着PET/CT-MRI三模式在临床上的广泛应用,会有越来越多学者基于SUV联合ADC对疾病诊断、分期进行研究。同时,本研究尚存在一定的局限性:例数较少,仅将病变分为良性及恶性,未对具体病理类型进行分组分析,未对多种恶性病变之间的定量数据差异进行分析;未对病灶组织行AQP免疫组化分析;未对病例进行TNM分期的比较。这些将在后续研究中搜集更多病例进一步研究。
| [1] |
JEMAL A, SIEGEL R, WARD E, et al. Cancer statistics, 2006[J]. CA Cancer J Clin, 2006, 56(2): 106-130. DOI:10.3322/canjclin.56.2.106 |
| [2] |
ALAM K, KHAN R, JAIN A, et al. The value of fine-needle aspiration cytology in the evaluation of pediatric head and neck tumors[J]. Int J Pediatr Otorhinolaryngol, 2009, 73(3): 923-927. DOI:10.1016/j.ijporl.2009.02.026 |
| [3] |
VEIT-HAIBACH P, KUHN F P, WIESINGER F, et al. PET-MR imaging using a tri-modality PET/CT-MR system with a dedicated shuttle in clinical routine[J]. MAGMA, 2013, 26(1): 25-35. DOI:10.1007/s10334-012-0344-5 |
| [4] |
TULUNAY-UGUR O E, MCCLINTON C, YOUNG Z, et al. Functional outcomes of chemoradiation in patients with head and neck cancer[J]. Otolaryngol Head Neck Surg, 2013, 148(1): 64-68. DOI:10.1177/0194599812459325 |
| [5] |
胡瑛. PET/CT与磁共振诊断乳腺癌的结果比较[J]. 中国CT和MRI杂志, 2017, 15(12): 51-53. DOI:10.3969/j.issn.1672-5131.2017.12.016 |
| [6] |
ROH J L, PARK J P, KIM J S, et al. 18F fluoro-deoxyglucose PET/CT in head and neck squamous cell carcinoma with negative neck palpationfindings:a prospective study[J]. Radiology, 2014, 271(1): 153-161. |
| [7] |
CALABRIA F, CALABRIA E, CHIARAVALLOTI A, et al. A case of intracranial meningioma detected by 18F-choline PET/CT and examined by PET/MRI fusion imaging[J]. Rev Esp Med Nucl Imagen Mol, 2014, 33(5): 306-307. |
| [8] |
BURGER I A, HUSER D M, BURGER C, et al. Repeatability of FDG quantification in tumor imaging:averaged SUVs are superior to SUVmax[J]. Nucl Med Biol, 2012, 39(5): 666-670. DOI:10.1016/j.nucmedbio.2011.11.002 |
| [9] |
FRUEHWALD-PALLAMAR J, CZERNY C, MAYERHOEFER M E, et al. Functional imaging in head and neck squamous cell carcinoma:correlation of PET/CT and diffusion-weighted imaging at 3 Tesla[J]. Eur J Nucl Med Mol Imaging, 2011, 38(6): 10091019. DOI:10.1007/s00259-010-1718-4 |
| [10] |
BOEEKMANN J, BAT-TEL T, SIEGEL E. Comparison of CT and MRI imaging in staging of neck metastases. Can the path ology of a thyroid nodule be determined by positron emission tomography uptake?[J]. Otolaryngol Head Neck Surg, 2012, 146(6): 906-912. DOI:10.1177/0194599811435770 |
| [11] |
LEE N, YOO IER, PARK S Y, et al. Significance of incidental nasopharyngeal uptake on 18F-FDG PET/CT:patterns of benign/physiologic uptake and differentiation from malignancy[J]. Nucl Med Mol Imaging, 2015, 49(1): 11-18. |
| [12] |
DE GEUS-OEI L F, PIETERS G F, BONENKAMP J J, et al. 18F-FDG PET reduces unnecessary hemithyroidectomies for thyr oid nodules with inconclusive cytologic results[J]. J Nud Med, 2006, 47(5): 770-775. |
| [13] |
PERRONE A, GUERRISI P, IZZO L, et al. Diffusion-weighted MRI in cervical lymph nodes:differentiation between benign and malignant lesions[J]. Eur J Radiol, 2011, 77(2): 281-286. DOI:10.1016/j.ejrad.2009.07.039 |
| [14] |
LE BIHAN D, BRETON E, LALLEMAND D, et al. Separation of diffusion and perfusion in intravoxel incoherent motion MR imaging[J]. Radiology, 1988, 168(2): 497-505. DOI:10.1148/radiology.168.2.3393671 |
| [15] |
BUCKLEY D L, BUI J D, PHILLIPS M I, et al. The effect of ouabainon water diffusion in the rat hippocampal slice measured by high resolution NMR imaging[J]. Magn Reson Med, 1999, 41(1): 137-142. DOI:10.1002/(SICI)1522-2594(199901)41:1<137::AID-MRM19>3.0.CO;2-Y |
| [16] |
BUI J D, BUCKLEY D L, PHILLIPS M I, et al. Nuclear magnetic resonance imaging measurements of water diffusion in the perf used hippocampal slice during N-methyl-D-aspartate-induced excitotoxicity[J]. Neuroscience, 1999, 93(2): 487-490. DOI:10.1016/S0306-4522(99)00191-8 |
| [17] |
NIU D F, KONDO T, NAKAZAWA T, et al. Differential expression of aquaporins and its diagnostic utility in thyroid cancer[J]. PLoS ONE, 2012, 7(7): e40770. DOI:10.1371/journal.pone.0040770 |
| [18] |
VERKMAN A S, HARA-CHIKUMA M, PAPADOPOULOS M C. Aquaporins-new players in cancer biology[J]. J Mol Med (Berl), 2008, 86(5): 523-529. DOI:10.1007/s00109-008-0303-9 |
 2020, Vol. 18
2020, Vol. 18


