| 直肠癌术前原发灶及淋巴结的MRI特征对壁外血管侵犯的补充诊断价值 |
2. 中南大学湘雅医学院附属肿瘤医院 湖南省肿瘤医院放诊科,湖南 长沙 410013
壁外血管侵犯(extramural vascular invasion,EMVI)是指直肠癌侵犯到直肠固有肌层以外的血管腔内,是影响直肠癌患者预后的重要因素之一[1]。MRI是直肠癌治疗前后评估的重要方法,在无创性评估EMVI状态时也有重要作用。本研究回顾性分析与直肠癌EMVI状态相关的MRI表现,探讨术前MRI对EMVI的诊断效能,以期为直肠癌的风险分层、治疗决策及预后评估提供新的影像学方法。
1 资料与方法 1.1 一般资料从湖南省肿瘤医院住院病历检索系统中检索2019年2—11月经手术病理证实的直肠癌患者550例,其中266例于术前1周行直肠MRI检查。266例中,83例被剔除(32例临床、MRI或病理资料不完整,51例于MRI前或术前曾行抗肿瘤治疗),余183例最终纳入本研究,其中男101例,女82例;年龄29~81岁,平均(58.1±10.9)岁。纳入标准:①经手术病理证实为直肠癌;②术前1周内行MRI检查。排除标准:①临床、MRI或病理资料不完整;②MRI检查前或术前曾行抗肿瘤治疗。
1.2 仪器与方法采用GE Discovery 750W 3.0 T MRI扫描仪及腹部相控阵线圈于术前1~3 d行MRI检查。检查前,患者无需清洁灌肠或肠腔内充填液体胶状物,对无禁忌证患者肌内注射山莨菪碱10 mg以抑制肠蠕动。患者取仰卧位头先进,依次行:①直肠矢状位高分辨T2WI,TR 2 698 ms,TE 103 ms,视野200 mm×220 mm,矩阵256×288,层厚3.0 mm,层距0.5 mm,激励次数2;②直肠横轴位高分辨T2WI,TR 3 273 ms,TE 105 ms,视野200 mm×220 mm,矩阵288×256,层厚3.0 mm,层距0.5 mm,激励次数2,扫描层面垂直于直肠病变;③直肠冠状位高分辨T2WI,TR 2 049 ms,TE 105 ms,视野200 mm×220 mm,矩阵256×288,层厚3.0 mm,层距0.5 mm,激励次数2,扫描层面垂直于横轴位T2WI图像;④盆腔横轴位DWI,采用单次激发自旋回波扩散加权平面回波成像(ssSE-DW-EPI)序列,b=1 000 s/mm2,TR 2 935 ms,TE 75 ms,层厚3.0 mm,层距0.5 mm,矩阵128×128,视野320 mm×380 mm,激励次数4;⑤盆腔横轴位增强T1WI,TR 3.53 ms,TE 1.72 ms,视野320 mm×380 mm,矩阵221×224,层厚3.0 mm,层距0.5 mm,激励次数2。
1.3 图像分析由1名不知道病理结果的放射科医师(正高职称,具有20年腹部MRI诊断经验),以高分辨T2WI图像为主要依据,参考DWI及T1WI增强扫描图像,按SMITH等[2]提出的基于MRI的EMVI评分体系(简称mrEMVI)进行评分:0分,病灶穿透肠壁、非结节状,邻近无血管;1分,病灶穿透肠壁、呈条状深入直肠系膜,邻近无血管;2分,血管与病灶相邻,但轮廓、管径及信号正常;3分,血管腔内出现肿瘤信号,血管轮廓及管径轻微异常;4分,血管腔内出现肿瘤信号,轮廓及管径明显异常。0~2分为阴性;3~4分为阳性。
由另1名不知道病理结果的放射科医师(副高职称,具有12年腹部MRI诊断经验),以高分辨T2WI图像为主要依据,参考DWI及T1WI增强扫描图像,对直肠病灶的其他状态进行评估,包括肿瘤位置、肠壁累及范围、原发肿瘤临床分期(cT分期)及临床淋巴结分期(cN分期)情况。①依据肿瘤距肛缘的距离判断肿瘤位置:高位 > 10 cm;中位5~10 cm;低位 < 5 cm。②依据国立综合癌症网络(National Comprehensive Cancer Network,NCCN)直肠癌诊疗指南(版本2018.V2)行cT分期[3]。对cT3期患者,再依据其最大壁外侵犯深度进行亚分期[4]:cT3a,< 1 mm;cT3b,1~5 mm;cT3c,6~15 mm;cT3d,> 15 mm。③在直肠横轴位高分辨T2WI图像上评估肿瘤对肠壁的侵犯范围:将整圈肠壁的弧度定义为360°,肿瘤侵犯肠壁≥180°,视为肠壁累及范围≥1/2圈;< 180°则为肠壁累及范围<1/2圈。④cN分期分为cN0(无淋巴结转移)及cN+(有淋巴结转移)。区域淋巴结符合以下任一条件[5],即评估为cN+:a.短径≥9 mm;b.短径5~8 mm伴至少2个形态学异常征象;c.短径 < 5 mm伴3个形态学异常征象;d.淋巴结内含黏液(任何短径)。形态学异常征象共3个,即圆形、边缘不规则、信号不均匀。
1.4 病理分析所有患者均行全直肠系膜切除术,以术后病理检查结果作为EMVI状态的诊断金标准。其病理示直肠固有肌层外衬有血管内皮细胞、平滑肌细胞或弹力纤维管腔内出现癌细胞[6]。
1.5 统计学分析采用MedCalc软件(版本19.1.3,MedCalc Software bv,Ostend,Belgium;https://www.medcalc.org;2019)进行统计分析。计量资料以x±s表示,计数资料以频数表示。各MRI指标与EMVI状态之间的关联分析采用χ2检验。根据χ2检验结果,将与EMVI状态显著相关的MRI指标纳入评分体系[2],以便构建一种新的基于MRI的EMVI评分体系(暂称为N-mrEMVI)。采用ROC曲线及四表格诊断试验评价MRI对EMVI状态的诊断效能。采用MedCalc软件中的Comparison of ROC Curves功能模块,比较mrEMVI评分体系[2]与N-mrEMVI评分体系在预测EMVI状态方面的效能差别。以P<0.05为差异有统计学意义。
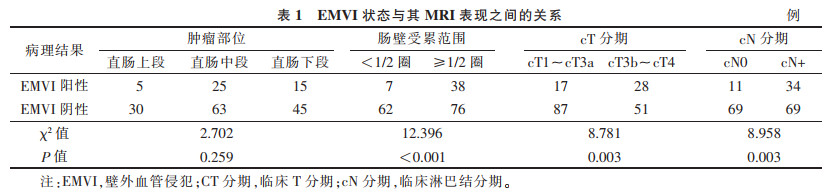
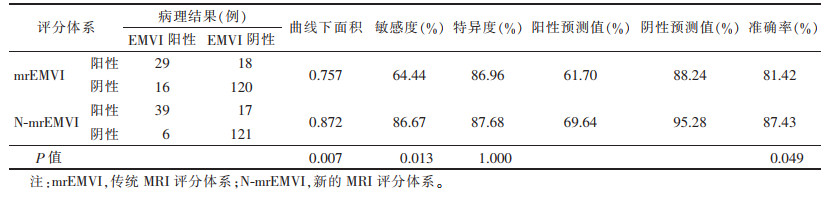
2 结果病理示EMVI阳性45例,阴性138例。肿瘤EMVI状态与其肠壁累及范围、cT分期及cN分期显著相关(均P<0.01),与肿瘤位置无明显关系(表 1)。在N-mrEMVI体系中,肠壁累及范围<1/2圈、cT1~cT3a及cN0均计0分,而肠壁累及范围≥1/2圈、cT3b~cT4及cN+均各计1分,再加上患者原有的mrEMVI评分,作为其N-mrEMVI的评分(评分范围0~7分)。分别以mrEMVI评分≥3分及N-mrEMVI评分≥5分作为上述2种MRI评估方法中EMVI阳性的诊断标准,探讨其对EMVI的诊断效能,N- mrEMVI相比于mrEMVI,具有更高的准确率、敏感度和更大的ROC曲线下面积(均P<0.05)(表 2,图 1)。1例EMVI阳性患者的MRI及病理图像见图 2。
| 表 1 EMVI状态与其MRI表现之间的关系 |
 |
| 表 2 不同MRI评分体系对EMVI状态的诊断效能 |
 |
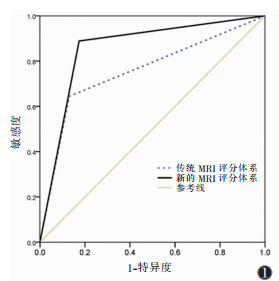 |
| 图 1 新的MRI评分体系(N-mrEMVI)及传统MRI评分体系(mrEMVI)诊断壁外血管侵犯(EMVI)的ROC曲线 |
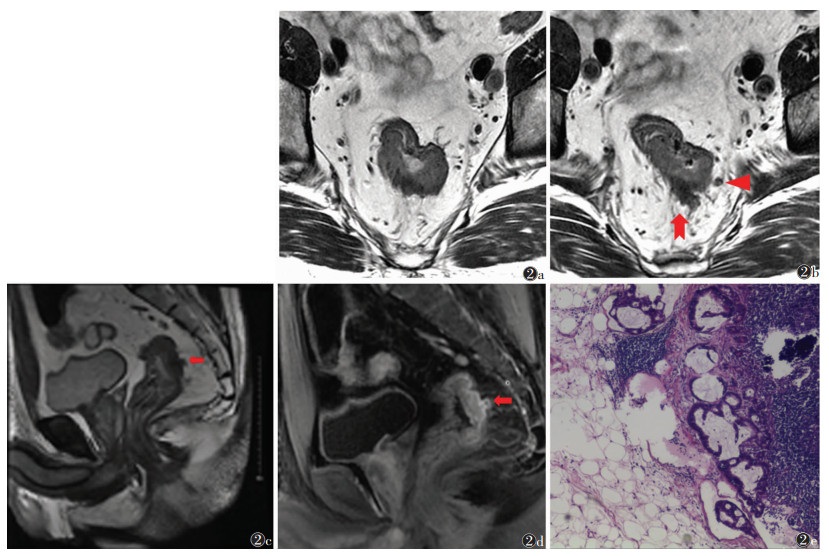 |
| 图 2 男,49岁,EMVI阳性直肠癌(中分化腺癌,pT3N1) 图 2a 直肠横轴位高分辨T2WI,示直肠中段肿块突破肌层(cT3b)、累及肠壁>1/2圈 图 2b 图 2a上方层面示瘤灶邻近血管明显增粗、轮廓不规则(燕尾箭),直肠系膜内可见形态不规整、信号不均的淋巴结(箭头) 图 2c 直肠矢状位高分辨T2WI示瘤灶后方增粗的血管(箭) 图 2d 盆腔矢状位增强T1WI示血管腔内充盈缺损(箭) 图 2e 病理切片示肌层外血管内瘤栓(HE×100)。N-mrEMVI评分为7分,mrEMVI评分为4分 |
3 讨论
直肠癌EMVI状态与其术前肠壁累及范围、cT分期及cN分期之间具有一定相关性,并据此对传统mrEMVI评分体系进行改进,且改进后的N-mrEMVI能更准确地预测直肠癌EMVI状态。本研究发现,肠壁受累范围广(≥1/2圈)的直肠癌患者更易出现阳性EMVI,一方面可能是肠壁受累范围越广,参与病灶供血及引流的直肠系膜血管越多,因而直肠癌侵犯系膜血管的概率越大;另一方面,肠壁受累范围广也可能代表病灶生长迅速(恶性度高)或存在时间长,因而出现阳性EMVI的概率更大。另外,直肠癌EMVI状态与其T、N分期显著相关,即T、N分期越高,EMVI阳性概率越大,与以往文献[7-9]相似。
以往研究[1]表明,EMVI阳性直肠癌患者的局部复发、远处复发及死亡率均显著高于EMVI阴性患者。因而,EMVI状态是直肠癌重要的预后影响因素,对治疗方式的选择也有影响[10-11]。治疗前被评估为EMVI阳性的直肠癌患者,需先行新辅助放(化)疗再行手术治疗[3, 11]。因此,须在治疗前准确评估直肠癌的EMVI状态。目前,病理检查仍是评估直肠癌EMVI状态的金标准,但也存在一定不足[12]:①病理EMVI状态仅能在术后获得,具有一定滞后性,无益于术前早期治疗决策;②新辅助放(化)疗会引起组织纤维化及血管内皮破坏,从而导致病理检查时易低估EMVI状态[2, 12],不利于作出准确的治疗决策。文献[12]报道,新辅助放(化)疗可能使得EMVI的病理诊断假阴性率达30%。因此,有必要探寻一种能够在术前准确预测直肠癌EMVI状态的新方法。
SMITH等[2]于2007年提出了mrEMVI评分体系。该体系也是评价EMVI状态的传统MRI方法,根据直肠病灶外侵的形态、病灶与直肠系膜内血管的位置关系、受累血管的粗细及血管腔内信号改变进行评分,并以此判断EMVI状态。但多项研究[2, 6, 9, 13]发现,mrEMVI在判断EMVI状态方面存在特异度高而敏感度较低的不足,其敏感度为28%~62%,提示该方法需进一步完善。mrEMVI敏感度较低的原因可能是受MRI空间分辨力的限制,尽管高分辨力成像已普遍应用于该评分体系,但该评分体系仍主要用于评估较粗(管径≥3 mm)的血管[9, 13]。本研究在传统的MRI评分体系(mrEMVI)基础上,尝试纳入与EMVI状态显著相关的其他因素(肠壁受累范围、cT分期及cN分期),以构建一种新的MRI评分体系(N-mrEMVI)。结果发现,该体系能够显著提高预测EMVI状态的敏感度、准确率及ROC曲线下面积,且不降低特异度。说明,在评估直肠癌EMVI状态方面,N-mrEMVI优于mrEMVI,原因可能为新评分体系中纳入了与EMVI状态相关的更多指标,从而提升了MRI对EMVI的诊断效能。
总之,本研究发现直肠癌术前原发灶及淋巴结MRI特征对预测其EMVI状态具有一定的补充价值,有望为治疗前准确评估直肠癌病情提供帮助。
| [1] |
LEIJSSEN L G J, DINAUX A M, AMRI R, et al. Impact of intramural and extramural vascular invasion on stage II-III colon cancer outcomes[J]. J Surg Oncol, 2019, 119(6): 749-757. DOI:10.1002/jso.25367 |
| [2] |
SMITH N J, BARBACHANO Y, NORMAN A R, et al. Prognostic significance of magnetic resonance imaging-detected extramural vascular invasion in rectal cancer[J]. Br J Surg, 2008, 95(2): 229-236. |
| [3] |
BENSON A B, VENOOK A P, AL-HAWARY M M, et al. Rectal Cancer, Version 2.2018, NCCN Clinical Practice Guidelines in Oncology[J]. J Natl Compr Canc Netw, 2018, 16(7): 874-901. DOI:10.6004/jnccn.2018.0061 |
| [4] |
SHIN R, JEONG S Y, YOO H Y, et al. Depth of mesorectal extension has prognostic significance in patients with T3 rectal cancer[J]. Dis Colon Rectum, 2012, 55(12): 1220-1228. DOI:10.1097/DCR.0b013e31826fea6a |
| [5] |
BEETS-TAN R, LAMBREGTS D, MAAS M, et al. Magnetic reso-nance imaging for clinical management of rectal cancer:Updated recommendations from the 2016 European Society of Gastroin-testinal and Abdominal Radiology (ESGAR) consensus meeting[J]. Eur Radiol, 2018, 28(4): 1465-1475. DOI:10.1007/s00330-017-5026-2 |
| [6] |
LIU L, LIU M, YANG Z, et al. Correlation of MRI-detected extramural vascular invasion with regional lymph node metastasis in rectal cancer[J]. Clin Imaging, 2016, 40(3): 456-460. DOI:10.1016/j.clinimag.2016.01.007 |
| [7] |
MCCLELLAND D, MURRAY G I. A comprehensive study of extra-mural venous invasion in colorectal cancer[J]. PLoS One, 2015, 10(12): e0144987. DOI:10.1371/journal.pone.0144987 |
| [8] |
王玉娟, 陈勇, 吕茜婷, 等. 3.0 T磁共振成像术前诊断直肠癌壁外脉管侵犯的价值及相关因素[J]. 中华肿瘤杂志, 2019, 41(8): 610-614. |
| [9] |
SOHN B, LIM J S, KIM H, et al. MRI-detected extramural vas-cular invasion is an independent prognostic factor for synchronous metastasis in patients with rectal cancer[J]. Eur Radiol, 2015, 25(5): 1347-1355. DOI:10.1007/s00330-014-3527-9 |
| [10] |
CHO M S, PARK Y Y, YOON J, et al. MRI-based EMVI posi-tivity predicts systemic recurrence in rectal cancer patients with a good tumor response to chemoradiotherapy followed by surgery[J]. J Surg Oncol, 2018, 117(8): 1823-1832. DOI:10.1002/jso.25064 |
| [11] |
HORVAT N, ROCHA C, OLIVERIRA B C, et al. MRI of rectal cancer:tumor staging, imaging techniques, and management[J]. Radiographics, 2019, 39(2): 367-387. DOI:10.1148/rg.2019180114 |
| [12] |
ALI H A, KIRSCH R, RAZAZ S, et al. Extramural venous invasion in rectal cancer:overview of imaging, histopathology, and clinical implications[J]. Abdom Radiol, 2019, 44(1): 1-10. |
| [13] |
JHAVERI K S, HOSSEINI-NIK H, THIPPHAVONG S, et al. MRI detection of extramural venous invasion in rectal cancer:correlation with histopathology using elastin stain[J]. AJR Am J Roentgenol, 2016, 206(4): 747-755. DOI:10.2214/AJR.15.15568 |
 2020, Vol. 18
2020, Vol. 18


