| 成人型神经元核内包涵体病的影像学表现 |
2. 福建省龙岩市第二医院神经内科,福建 龙岩 364000
2. Division of Second Hospital, of Longyan, Longyan 364000, China
神经元核内包涵体病(neuronal intranuclear in鄄clusion disease,NIID)是一种缓慢进行的神经退行性疾病,其特征是中枢和周围神经系统及内脏器官中存在嗜酸性透明质核内包涵体[1]。目前,国内外对该病的报道较少,且多以个案分析为主。笔者对NIID患者的临床及影像学特征进行分析,以提高临床医师对该病的诊断水平,为临床治疗方案的选择提供参考。
1 资料与方法 1.1 一般资料收集2016年1月至2019年5月我院确诊的5例NIID患者的临床及影像资料。其中,男3例,女2例;年龄32~65岁,平均(48.5±8.1)岁。1例仅行CT扫描,1例仅行MRI扫描,3例同时行CT和MRI扫描;1例初诊后6个月行MRI平扫复查。临床症状:意识障碍、癫痫、发作性脑病、精神症状、肢体无力、感觉异常、痴呆、震颤、共济失调、多发性神经病、瞳孔缩小、膀胱功能异常等。5例均经上级医院皮肤组织活检病理确诊为NIID。
1.2 仪器与方法 1.2.1 CT检查使用GE 64排128层CT扫描机进行扫描,扫描参数:120 kV,180 mAs,层厚、层距均为5 mm。利用薄层重建图像在AW4.6工作站行MPR。
1.2.2 MRI检查采用GE 1.5 T MRI扫描仪,标准头线圈。行横断位FSE T2WI、T1WI、T2 FLAIR及DWI扫描。扫描参数:TR 15.0 ms,TE 6.6 ms,层厚1 mm,层距1 mm,视野22 cm×22 cm,翻转角15°,矩阵256×256,流速编码15 cm/s。增强扫描经静脉注射对比剂钆贝葡胺,剂量0.2 mmol/kg体质量,流率2.5 mL/s,TR 7.8 ms,TE 3.0 ms,视野24 cm×24 cm,矩阵512×512,层厚1.2 mm,重叠扫描层距0.6 mm。
1.3 图像分析主要观察病变的发生部位、形状、最大径、边界、CT平扫密度(相对病变发生部位的正常组织),T1WI、T2WI、T2 FLAIR、DWI信号特征(相对病变发生部位的正常组织)、MRI增强扫描的强化程度及方式。
2 结果5例病灶位于双侧额叶、顶叶、枕叶,侧脑室周围脑白质及半卵圆中心,其中2例主要位于额叶(图 1),2例主要位于额叶、顶叶(图 2),1例主要累及额叶、顶叶、枕叶。病灶最大径4.9~23.1 mm,平均(14.3±3.2)mm。4例行CT平扫均呈低密度,部分病变密度欠均匀,边缘模糊(图 1a)。4例行MRI扫描,T1WI呈不均匀低信号(图 2a),T2WI、T2 FLAIR呈不均匀高信号(图 1b,2b,2c),T2 FLALR上病灶呈对称性不规则或卵圆形,DWI上皮髓质交界处呈U形高信号,病灶边缘模糊(图 1c,2d)。2例行MRI增强扫描示病灶内信号均匀,未见明显强化。
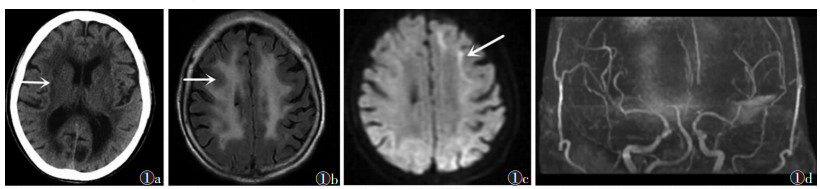 |
| 图 1 男,67岁,进行性肢体无力 图 1a 头颅CT平扫,示双侧基底节区及侧脑室周围脑白质呈对称性低密度灶(箭头) 图1b T2 FLALR示双侧半卵圆中心对称性高信号(箭头) 图 1c DWI示白质和灰质交界区U形高信号影,左侧尤为明显(箭头) 图 1d 头颅3D-TOF MRA示颅内动脉未见明显动脉瘤及狭窄、闭塞性改变 |
 |
| 图 2 女,45岁,头晕、头痛3个月 图 2a T1WI示病灶呈低信号 图 2b T2WI示双侧额顶叶脑皮髓质交界处可见U形高信号 图 2c T2 FLAIR示病灶呈高信号 图 2d DWI可见病灶呈明显U形高信号 图 2~2g 分别为6个月后复查T1WI、T2 FLAIR、DWI图像,提示病变变化不明显 |
1例初诊后6个月行MRI平扫复查,病变变化不明显(图 2e~2g)。
3 讨论 3.1 NIID的临床与病理表现NIID的病因及发病机制尚未明确,患者的皮肤和中枢神经组织细胞中找到核内包涵体是确诊的主要依据[2]。NIID可分为未成年型与成人型,未成年型又分为儿童型及青少年型,成人型分为散发型与家族型,其中成人型2种亚型症状相似,仅比例不同[3]。该病临床症状以神经系统症状为主,中枢神经系统症状表现为意识障碍、癫痫、发作性脑病、精神症状、肢体无力、感觉异常、痴呆、震颤、共济失调等,周围神经系统症状为多发性神经病,自主神经系统症状为瞳孔缩小、膀胱功能异常等。
NIID的皮肤活检示脂肪细胞、成纤维细胞和汗腺细胞中存在圆形特异性嗜酸性核内包涵体,为圆形,直径1.5~3.0 mm,泛素阳性、p62阳性,电镜下呈致密的无膜长丝纤维样物质,其光镜、电镜特征几乎与中枢神经系统中的核内包涵体相同。此外,尸检和皮肤活检样本中的核内包涵体的光镜和电镜特征在散发型与家族型NIID中几乎相同。
3.2 NIID的影像学特征近几年研究[4]表明,MRI对NIID的诊断有重要价值,成人型NIID在T1WI呈低信号,T2WI及T2 FLAIR出现白质高信号,从皮质髓质交界处到大脑皮质下可见广泛高信号区,且随病情发展出现脑萎缩,但上述表现均无特异性。DWI示皮髓交界处出现U型高信号,有文献[5]称之为皮层下火焰征、尿布征;随病情恶化,DWI高信号沿大脑皮髓交界处延伸,但未扩展到深部脑白质,即使在疾病进展至极晚期的致盲性致残患者中、T2WI可见广泛白质脑病时,DWI高信号也未延伸至深部白质[6]。这一特征性表现可能成为NIID影像诊断依据,有此表现应疑诊NIID。本研究5例影像表现均与前述文献相符,且均经皮肤组织病理活检发现特征性核内包涵体的存在。
NIID的MRI特征与其病理基础密切相关[7]。有研究[8]表明DWI异常高信号首先出现在额叶,后扩散至顶叶和枕叶,沿皮质髓质交界处对称,与U型纤维附近白质的自身变化有关;T2 FLAIR高信号虽不典型,但与弥漫性髓鞘白质海绵样变性有关。
3.3 鉴别诊断NIID应与以下疾病鉴别:①脑白质疏松症,表现为脑室周围深部脑白质、半卵圆中心、放射冠区斑片或弥漫性互相融合的低密度灶,边缘模糊,双侧对称,皮质下弓状纤维很少受累;T1WI呈低信号,T2WI及FLAIR呈高信号,DWI呈等或低信号,增强扫描未见强化。而NIID累及皮质下弓状纤维,且DWI呈高信号,年龄较大者可合并脑白质疏松症,两者鉴别不难。②异染性脑白质营养不良,又称硫脂沉积症;婴儿型常见,而少年型及成人型少见;婴儿型多于2~3岁时发病,病后3~4年死亡;成人型表现为智力差、逐渐痴呆,预后不良。MRI表现为大脑白质区广泛对称性脱髓鞘斑,在皮质下白质和侧脑室额角、枕角、颞角周围分布均匀、对称;T1WI上脱髓鞘斑呈蜂窝状低信号,重者可融合;T2WI呈高信号,外缘呈扇贝形。③肾上腺脑白质营养不良,其典型表现为双侧侧脑室三角区(枕叶、顶叶、颞叶)白质区大片对称性密度减低影,通过胼胝体压部,两侧病灶连续,呈蝶翼状分布,增强扫描活动性髓鞘脱失区或新发病灶可强化,呈花边状、狭带样,动态观察可向前发展累及额叶。NIID不累及胼胝体及侧脑室三角区脑白质,常累及皮髓质交界处,且从额叶逐渐向枕叶进展,增强扫描无强化。④多发性硬化,为多发、散在病灶,好发于侧脑室旁和邻近脑白质,其次为胼胝体和胼胝体、隔区交界处,偶尔累及脑皮质,病灶呈长圆形或圆形;T1WI呈等或低信号,T2WI呈高信号,DWI上活动病灶呈高信号,其余呈等低信号,增强扫描病灶可强化,静止或慢性病灶不强化。NIID病灶呈U形尿布征,DWI呈高信号,增强扫描无强化。⑤病毒性脑炎,早期CT可表现为正常或轻微异常;T1WI上可见两侧颞叶底面、内侧面、岛叶的低信号区,T2WI呈明显高信号区,病变迁延异常信号显示更清晰,增强扫描后病变区多不强化,局部区域可见明显强化,呈点、片状或弥漫脑回状强化。而NIID一般位于额顶叶皮髓质交界处,DWI呈特征性U形高信号,增强扫描未见强化。⑥急性播散性脑脊髓炎,好发于儿童,通常小于15岁,性别分布无偏差,多于感染或接种疫苗后数周内发生;脑脊液细胞数增多,约半数患者抗髓鞘少突胶质细胞糖蛋白(MOG)及IgG抗体阳性;临床表现为发热、头痛、癫痫、多灶性神经功能缺损和脑膜刺激征;病变呈多发性、双侧性,既可累及脑和脊髓,又可累及白质和灰质。NIID成年人多见,神经症状虽与急性播散性脑脊髓炎有重叠,但其病灶主要位于皮髓质交界处,且皮层下出现特征性的尿布征。
综上所述,NIID属罕见的中枢神经系统疾病,其影像学特征为DWI在皮髓质交界处(U型纤维)持续性高信号,即皮层下火焰征、尿布征,增强扫描未见明显强化,有助于诊断;皮肤活检发现特征性嗜酸性核内包涵体的存在,结合病理学Anti-P62免疫组化染色、HE染色及电镜下观察到细胞核内圆形包涵体结构,有助于确诊[9]。
| [1] |
ABE K, FUJITA M.Over 10 years MRI observation of a patient with neuronal intranuclear inclusion disease[J/OL]. BMJ Case Rep, 2017[2017-02-24]http://www.ncbi.nlm.nih.gov/pmc/articles/ PMC5337643/.doi:10.1136/bcr-2016-218790".
|
| [2] |
MCFADDEN K, HAMILTON R L, INSALACO S J, et al. Neuronal intranuclear inclusion disease without polyglutamine inclusions in a child[J]. J Neuropathol Exp Neurol, 2005, 64(6): 545-552. DOI:10.1093/jnen/64.6.545 |
| [3] |
SHINDO K, TSUCHIYA M, HATA T, et al. Non-convulsive status epilepticus associated with neuronal intranuclear inclusion disease: A case report and literature review[J]. Epilepsy Behav Case Rep, 2019, 11: 103-106. DOI:10.1016/j.ebcr.2019.01.007 |
| [4] |
TAKAHASHI-FUJIGASAKI J. Neuronal intranuclear hyaline inclusion disease[J]. Neuropathology, 2003, 23(4): 351-359. |
| [5] |
王晔, 郭大文, 王德生. 神经元核内包涵体病[J]. 国外医学·神经病学神经外科学分册, 2001, 28(5): 363-367. |
| [6] |
牛延良, 李建章. 神经元核内包涵体病1例报道及文献复习[J]. 中国实用神经疾病杂志, 2018, 10(21): 2304-2307. |
| [7] |
KITAGAWA N, SONE J, SOBUE G, et al. Neuronal intranuclear inclusion disease presenting with resting tremor[J]. Case Rep Neurol, 2014, 6(2): 176-180. DOI:10.1159/000363687 |
| [8] |
CHEN L, WU L, LI S, et al. A long time radiological follow-up of neuronal intranuclear inclusion disease[J]. Medicine, 2018, 97(49)e13544. |
| [9] |
NAKAMURA M, MURRAY M E, LIN W L, et al. Optineurin immunoreactivity in neuronal and glial intranuclear inclusions in adult-onset neuronal intranuclear inclusion disease[J]. Am J Neurodegener Dis, 2014, 3(2): 93-102. |
 2020, Vol. 18
2020, Vol. 18


