| 基于CT影像组学的列线图术前预测胃癌淋巴结转移的价值 |
胃癌是世界上第四大最常见的癌症,也是癌症相关死亡的第二大原因[1]。淋巴结转移是临床分期的关键,也是胃癌的重要转移途径,术中过度切除未转移淋巴结或遗漏转移性淋巴结,均会影响患者的预后[2]。术后病理是胃癌淋巴结转移的金标准,因此在术前了解淋巴结转移情况,对指导治疗具有重要意义。近年来,影像组学在医学领域的价值受到越来越多的关注[3-5],其采用自动化数据特征算法将医学图像中ROI的影像数据转化为具有特征空间的数据,并对特征空间区的数据进行分析,以综合评价肿瘤的组织形态[6]、细胞分子[7]、基因遗传[8-9]等各种表型。既往多通过临床指标[10]、病理结果[11]或单序列影像组学[12]对胃癌淋巴结转移状态进行研究。为提高临床实用性,本研究分析CT平扫、静脉期、动脉期、延迟期及多期相影像组学的纹理特征,同时纳入临床、影像学特征建立综合模型,探讨基于CT影像组学列线图术前预测胃癌淋巴结转移的价值。
1 资料与方法 1.1 一般资料回顾性收集2019年1月至2022年12月我院经手术病理证实为胃癌患者的临床和影像资料。纳入标准:①经手术病理确诊为胃癌;②术前未行放疗或化疗;③术前均行腹部平扫和增强扫描。排除标准:①临床信息及图像欠缺过多;②影像上病灶显示不清,胃充盈不佳;③术前伴远处转移。最终纳入208例,其中男113例,女95例。临床基本资料包括性别、年龄、淋巴细胞、中性粒细胞、中性粒细胞/淋巴细胞、癌胚抗原、CA19-9等。影像资料包括肿瘤部位、厚度和CT值(包括平扫、动脉期、静脉期和延迟期)。208例按7∶3的比例随机分为训练集147例和验证集61例。训练集和验证集再根据有无淋巴结转移进行分组。
1.2 仪器与方法使用Philips Brilliance 64排螺旋CT,行腹部CT平扫及3期增强扫描。患者检查前空腹4 h以上,检查前30 min口服温开水500~1 000 mL,扫描开始前再次口服200~300 mL,以保证胃腔充盈。患者取仰卧位,扫描范围从膈顶至耻骨联合。增强扫描经肘静脉注入对比剂碘佛醇,35~40 s行动脉期扫描,60~90 s行静脉期扫描,180 s后行延迟期扫描。
1.3 图像分析将PACS中平扫、动脉期、静脉期及延迟期图像导入ITK-SNAP软件,由1名低年资影像科医师及1名高年资医师采用双盲法共同阅片,明确胃癌病灶的大小、部位、边界、形态等特点,达成一致意见。在CT静脉期测量肿瘤厚度,肿瘤厚度为肿瘤最大层面与长轴垂直距离。分别在CT平扫、静脉期、动脉期、延迟期图像上逐层手动勾画ROI,避开周围的胃内容物、血管、出血等。在PACS的4期图像上同一部位分别测量3次肿瘤的CT值,取平均值,分别计算动脉期、静脉期及延迟期图像与平扫图像上CT值的差值。胃癌病灶局部区域淋巴结短径 > 10 mm,则视为CT报告淋巴结阳性。
1.4 影像组学特征提取、筛选及模型的建立将PACS中CT平扫、动脉期、静脉期及延迟期图像导入DICOM SORT软件,层厚均为5 mm,转化为DICOM格式,后导入ITK-SNAP 3.8.0软件,由2位放射科医师共同阅片,在4期图像上沿肿瘤边缘手动逐层勾画ROI,并融合成VOI(图 1),再将勾画的ROI图像和原始图像导入基于Python 3.6.8的开源组学分析平台Fe Ature Explorer (FAE v0.3.7.7Z)提取特征。采用最小冗余最大相关(minimal-Redundancy-Maximal-Relevance,mRMR)和最小绝对收缩和选择算子(least absolute shrinkage and selection operator,LASSO)算法对训练集各期(平扫、动脉期、静脉期、延迟期及4期联合)图像进行降维,用筛选出的最佳特征构建基于各单期和4期联合的影像组学模型,计算影像组学评分,并在验证集中重复上述步骤进行验证。
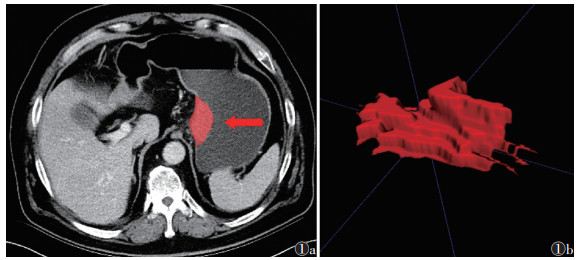 |
| 注:患者,男,72岁,图1a为CT静脉期图像,沿肿瘤边缘勾画ROI(红色区域);图1b为肿瘤所有层面的ROI融合后形成立体图像 图 1 胃癌病灶VOI的获取示意图 |
1.5 统计学方法
统计分析使用SPSS 26.0、R 4.2.2和MedCalc 20.0.0软件。计数资料以频数表示,组间比较行χ2检验。计量资料采用Kolmogorov-Smirnov检验正态性,正态分布的数据以x±s表示,组间比较行独立样本t检验;非正态分布以M(QL,QU)表示,组间比较行Mann-Whitney U检验。采用多因素logistic回归分析筛选出独立预测因子构建临床与影像组学的联合模型,绘制列线图和校正曲线,评价模型的预测效能和拟合优度;分别采用ROC曲线、决策曲线分析和Hosmer-Lemeshow检验评价模型预测效能、临床价值及校准曲线的一致性。采用DeLong检验比较多个模型间AUC的差异。以P < 0.05为差异有统计学意义。
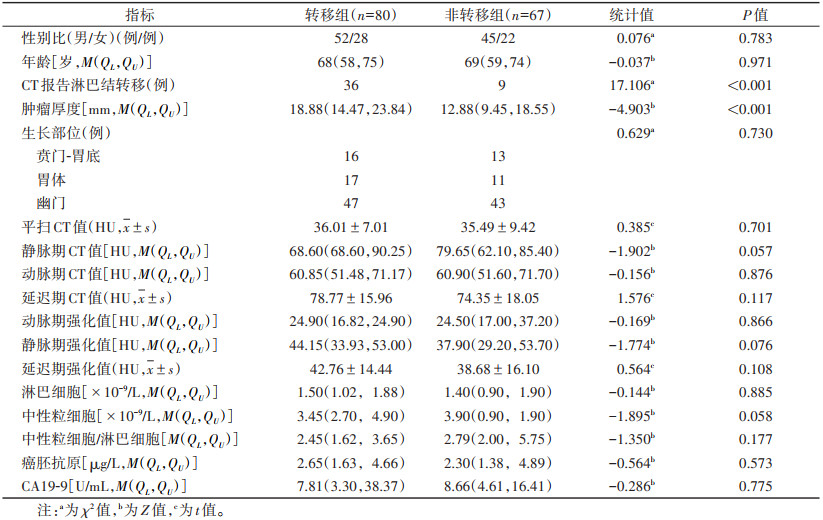
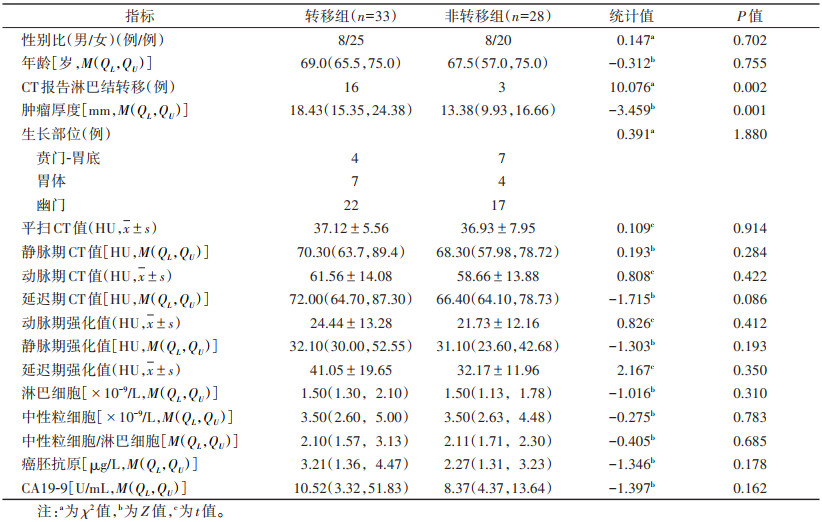
2 结果 2.1 训练集和验证集的临床及CT特征比较在训练集及验证集中,胃癌淋巴结转移组和非转移组的性别、年龄、肿瘤生长部位、平扫CT值、动脉期CT值、静脉期CT值、延迟期CT值、动脉期强化值、静脉期强化值、延迟期强化值、淋巴细胞、中性粒细胞、中性粒细胞/淋巴细胞、癌胚抗原及CA19-9差异均无统计学意义(均P > 0.05);肿瘤厚度、CT报告淋巴结转移差异均有统计学意义(均P < 0.05)(表 1,2)。
| 表 1 训练集中转移组和非转移组患者临床和CT特征的比较 |
 |
| 表 2 验证集中转移组和非转移组患者临床和CT特征比较 |
 |
训练集中差异有统计学意义的变量行多因素logistic回归分析,结果显示肿瘤厚度(OR=1.14,P=0.028),CT报告淋巴结转移(OR=4.70,P=0.009)为独立预测因子,用独立预测因子构建临床模型,并绘制ROC曲线,AUC在训练集和验证集中分别为0.79、0.81。
2.2 影像组学特征提取及影像组学模型建立应用FAE在208例患者CT扫描平扫+3期增强扫描图像中各提取1 316个纹理特征,采用mRNR去除冗余特征和LASSO算法降维后保留平扫、动脉期、静脉期(图 2)、延迟期及4期联合图像中最优纹理特征分别为12、15、13、15和12个,分别建立影像组学模型,静脉期模型在训练集和验证集中的AUC最高,均为0.81(表 3,4)。
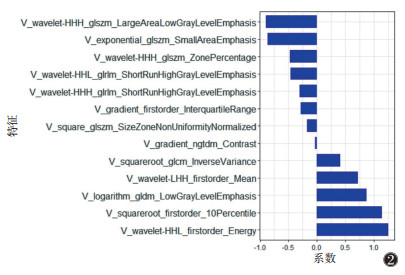 |
| 图 2 静脉期筛选出的最优特征 |
| 表 3 各模型在训练集的ROC曲线结果 |
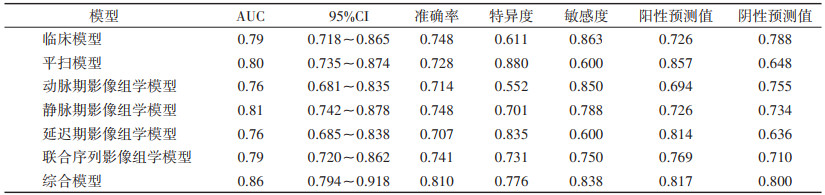 |
| 表 4 各模型在验证集的ROC曲线结果 |
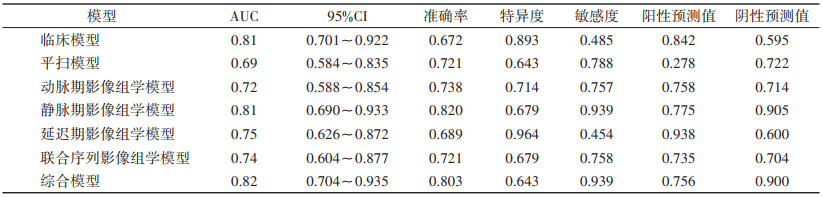 |
2.3 建立综合模型
将训练集中差异有统计学意义的临床变量和AUC最高的静脉期模型的影像组学评分纳入logistic回归分析,用筛选出的独立预测因子建立综合模型并绘制其列线图(图 3)。纳入的变量有肿瘤厚度、CT报告淋巴结及影像组学评分,logistic回归分析显示肿瘤厚度(OR=1.14,P < 0.05)、CT报告淋巴结(OR=4.70,P < 0.05)及静脉期影像组学评分(OR=2.45,P < 0.05)为独立预测因子,建立临床+静脉期影像组学综合模型。综合模型在训练集及验证集的AUC分别为0.86、0.82,优于临床模型、联合序列模型及各单一序列模型(图 4)。
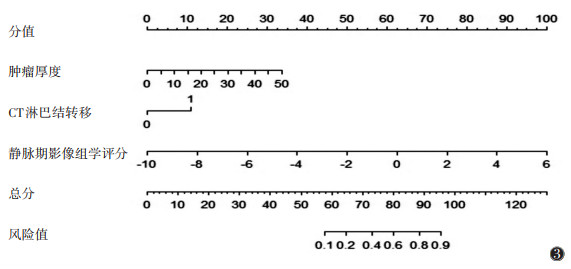 |
| 图 3 综合模型的列线图 |
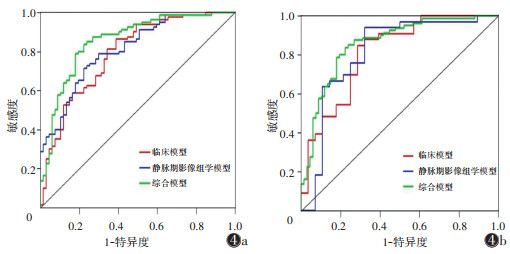 |
| 注:图4a代表训练集,图4b代表验证集,综合模型预测效能均高于临床模型和影像组学模型 图 4 临床模型、静脉期影像组学模型、综合模型的AUC |
DeLong检验显示,综合模型与静脉期模型之间AUC的差异有统计学意义(Z=2.082,P=0.037),与临床模型AUC差异有统计学意义(Z=2.612,P=0.009);静脉期模型与临床模型之间AUC差异无统计学意义(Z=0.453,P=0.650)。单序列之间且各单序列与联合序列影像组学模型之间差异均无统计学意义(平扫vs.动脉期:Z=1.117,P=0.264;平扫vs.静脉期:Z=0.159,P=0.873;平扫vs.延迟期:Z=1.028,P=0.304;静脉期vs.动脉期:Z=1.239,P=0.215;静脉期vs.延迟期:Z=1.232,P=0.218;动脉期vs.延迟期:Z=0.080,P=0.936;平扫vs.联合序列:Z=0.476,P=0.634;静脉期vs.联合序列:Z=0.577,P=0.564;动脉期vs.联合序列:Z=0.852,P=0.394;延迟期vs.联合序列:Z=0.685,P=0.494)。
综合模型行Hosmer-Lemeshow检验,在训练集和验证集中的χ2值分别为1.620、2.230,P值分别为0.445、0.328,具有较好的拟合效果。决策曲线分析显示,当风险阈值为23%~88%,综合诊断模型的临床价值均高于静脉期影像组学模型、临床模型(图 5)。
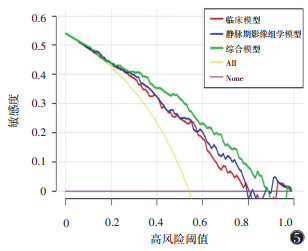 |
| 注:当风险阈值为23%~88%,综合模型的临床价值高于影像组学模型和临床模型。All代表所有胃癌患者均发生淋巴结转移,None代表所有胃癌患者均未发生淋巴结转移 图 5 训练集预测胃癌淋巴结转移的临床模型、静脉期影像组学模型及综合模型的决策曲线 |
3 讨论
本研究基于CT列线图预测胃癌术前淋巴结转移,结果显示基于静脉期影像组学模型能有效预测胃癌淋巴结转移状态,联合肿瘤厚度和CT报告淋巴结转移能进一步提高预测效能。为预测胃癌患者淋巴结转移的可能,纳入术前临床指标、CT特征及纹理特征等多变量,从不同层面建立预测模型进行研究,结果显示,CT报告淋巴结转移及肿瘤厚度在训练集及验证集转移和非转移患者中差异均有统计学意义,构建的临床模型具有一定的诊断价值(AUC=0.79、0.81)。静脉期注射和口服对比剂在胸部和腹部CT及FDG/CT可用于描述局部区域淋巴结。在临床实践中,如淋巴结呈圆形和/或短径 > 10 mm,则怀疑为肿瘤侵犯的区域淋巴结。本研究中,CT报告淋巴结转移是淋巴结转移的独立预测因素,这与Yin等[13]研究一致,但部分淋巴结肿大可能是炎性导致,仅依靠测量常导致假阳性。因此,虽然CT是术前评估淋巴结状态最常用的方式,但准确率仅约60%[14-15]。王睿等[16]的研究显示,胃癌肿瘤厚度与淋巴结转移密切相关,这与本研究一致。李靖等[17]研究发现,胃癌血管有无侵犯组间肿瘤厚度的差异有统计学意义,本研究显示肿瘤厚度在胃癌有无淋巴结转移中差异有统计学意义,说明肿瘤浸润越深,其生长时间越长,肿瘤周围组织侵犯能力越强。既往部分研究发现,CA19-9与胃癌淋巴结转移密切相关[18],但在本研究中差异无统计学意义,可能与样本量较小有关。Kosuga等[19]研究认为,癌症可能诱发全身的炎症反应,中性粒细胞/淋巴细胞比值越高,胃癌淋巴结转移的可能性越大,但本研究中单因素分析显示差异无统计学意义。
影像学对评估淋巴结有重要作用[20-21]。然而,在临床实践中,内镜、超声、CT、18FDG-PET/CT和腹腔镜检查等均具有一定局限性[22]。近年来出现的影像组学使以原发性肿瘤[23-24]的特征预测淋巴结状态成为可能。本研究基于CT平扫、动脉期、静脉期、延迟期及多期联合图像建立多个影像组学模型,结果显示静脉期影像组学模型预测效能相对较高。Wang等[25]的研究表明,动脉期影像组学模型对淋巴结转移有较高的预测价值,AUC在验证组中达0.837,联合CT报告淋巴结进一步提高了预测价值,AUC为0.886。然而本研究中动脉期模型在训练集中的AUC仅0.76,明显低于静脉期影像组学模型。但是Wang等[25]的研究未纳入平扫、静脉期及延迟期图像,无法证明动脉期影像组学模型的预测效能优于静脉期影像组学模型。Li等[26]研究认为,静脉期影像组学模型最优,与本研究结果一致。大多研究认为,多序列影像组学模型优于单一序列影像组学模型[27],但本研究显示,静脉期影像组学模型预测效能高于联合序列组学模型,推测可能与样本量大小及个体化因素有关,有待进一步探讨。
有研究建立了几个列线图,但其使用的一些因素仅能在术后获得,这可能限制了列线图在临床实践中的应用[28-29]。本研究采用基于术前的影像、组学特征构建的综合模型列线图来预测胃癌患者的淋巴结转移,具有较高的判别力。
本研究的局限性:①样本量较小,且为单中心研究,构建模型的稳定性和实用性有待进一步证实;②本研究的模型仅为内部测试,有待外部数据进一步测试;③病灶ROI是通过手动勾画,可能存在一定误差;④为回顾性研究,可能存在选择性偏倚。
总之,CT报告淋巴结、肿瘤厚度、静脉期影像组学评分是预测胃癌淋巴结转移的独立预测因子,三者联合诊断效能更高。基于静脉期CT影像组学特征建立的列线图对胃癌的淋巴结转移有较高的预测能力,有望为胃癌患者个性化治疗方案的制订和预后判断提供一种无创性的评估方法。
| [1] |
AJANI J A, D'AMICO T A, BENTREM D J, et al. Gastric cancer, version 2.2022, NCCN clinical practice guidelines in oncology[J]. J Natl Compr Canc Netw, 2022, 20(2): 167-192. DOI:10.6004/jnccn.2022.0008 |
| [2] |
KUTLU O C, WATCHELL M, DISSANAIKE S. Metastatic lymph node ratio successfully predicts prognosis in western gastric cancer patients[J]. Surg Oncol, 2015, 24(2): 84-88. DOI:10.1016/j.suronc.2015.03.001 |
| [3] |
SUMEET H, THOMAS C, KRISTOFER L R, et al. Combined CT radiomics of primary tumour and metastatic lymph nodes improves prediction of recurrence following radiotherapy for non-small cell lung cancer[J]. Lung Cancer, 2022, 165(S1): S59-S60. |
| [4] |
BAO D, ZHAO Y, LI L, et al. A MRI-based radiomics model predicting radiation-induced temporal lobe injury in nasopharyngeal carcinoma[J]. Eur Radiol, 2022, 32(10): 6910-6921. DOI:10.1007/s00330-022-08853-w |
| [5] |
JI G W, ZHU F P, XU Q, et al. Radiomic features at contrast-enhanced CT predict recurrence in early stage hepatocellular carcinoma: a multi-institutional study[J]. Radiology, 2020, 294(3): 568-579. DOI:10.1148/radiol.2020191470 |
| [6] |
HAN Y, MA Y, WU Z, et al. Histologic subtype classification of non-small cell lung cancer using PET/CT images[J]. Eur J Nucl Med Mol Imaging, 2021, 48(2): 350-360. DOI:10.1007/s00259-020-04771-5 |
| [7] |
SU C, JIANG J, ZHANG S, et al. Radiomics based on multicontrast MRI can precisely differentiate among glioma subtypes and predict tumour-proliferative behaviour[J]. Eur Radiol, 2019, 29(4): 1986-1996. DOI:10.1007/s00330-018-5704-8 |
| [8] |
CHU Y, LI J, ZENG Z, et al. A novel model based on CXCL8-Derived radiomics for prognosis prediction in colorectal cancer[J]. Front Oncol, 2020, 10: 575422. DOI:10.3389/fonc.2020.575422 |
| [9] |
BAI Y, WEI C, ZHONG Y, et al. Development and validation of a prognostic nomogram for gastric cancer based on DNA methylation-driven differentially expressed genes[J]. Int J Biol Sci, 2020, 16(7): 1153-1165. DOI:10.7150/ijbs.41587 |
| [10] |
章晓燕, 张光满. 术前NLR、MLR、PLR和SⅡ检测在判断胃癌淋巴结转移中的应用价值[J]. 临床输血与检验, 2021, 23(6): 783-787. DOI:10.3969/j.issn.1671-2587.2021.06.024 |
| [11] |
REN G, CAI R, ZHANG W J, et al. Prediction of risk factors for lymph node metastasis in early gastric cancer[J]. World J Gastroenterol, 2013, 19(20): 3096-3107. DOI:10.3748/wjg.v19.i20.3096 |
| [12] |
GAO X, MA T, CUI J, et al. A radiomics-based model for prediction of lymph node metastasis in gastric cancer[J]. Eur J Radiol, 2020, 129: 109069. DOI:10.1016/j.ejrad.2020.109069 |
| [13] |
YIN X Y, PANG T, LIU Y, et al. Development and validation of a nomogram for preoperative prediction of lymph node metastasis in early gastric cancer[J]. World J Surg Oncol, 2020, 18(1): 2. DOI:10.1186/s12957-019-1778-2 |
| [14] |
KIM A Y, KIM H J, HA H K. Gastric cancer by multidetector row CT: preoperative staging[J]. Abdom Imaging, 2005, 30(4): 465-472. DOI:10.1007/s00261-004-0273-5 |
| [15] |
KIM H J, KIM A Y, OH S T, et al. Gastric cancer staging at multi-detector row CT gastrography: comparison of transverse and volumetric CT scanning[J]. Radiology, 2005, 236(3): 879-885. DOI:10.1148/radiol.2363041101 |
| [16] |
王睿, 李靖, 梁盼, 等. 能谱CT术前预测胃腺癌淋巴结转移的价值[J]. 临床放射学杂志, 2019, 38(3): 469-474. |
| [17] |
李靖, 王艺, 魏莹莹, 等. 能谱CT碘基值术前预测胃癌脉管侵犯的价值[J]. 中华放射学杂志, 2023, 57(2): 181-186. |
| [18] |
CHEN S, NIE R C, OUYANG L Y, et al. Nomogram analysis and external validation to predict the risk of lymph node metastasis in gastric cancer[J]. Oncotarget, 2017, 8(7): 11380-11388. DOI:10.18632/oncotarget.14535 |
| [19] |
KOSUGA T, KONISHI T, KUBOTA T, et al. Clinical significance of neutrophil-to-lymphocyte ratio as a predictor of lymph node metastasis in gastric cancer[J]. BMC Cancer, 2019, 19(1): 1187. DOI:10.1186/s12885-019-6404-8 |
| [20] |
ZHANG Y, ZHU Z, SUN Z, et al. Preoperative predicting score of lymph node metastasis for gastric cancer[J]. Tumour Biol, 2014, 35(10): 10437-10442. DOI:10.1007/s13277-014-2363-5 |
| [21] |
GIGANTI F, TANG L, BABA H. Gastric cancer and imaging biomarkers: Part 1-a critical review of DW-MRI and CE-MDCT findings[J]. Eur Radiol, 2019, 29(4): 1743-1753. DOI:10.1007/s00330-018-5732-4 |
| [22] |
MA D, ZHANG Y, SHAO X, et al. PET/CT for predicting occult lymph node metastasis in gastric cancer[J]. Curr Oncol, 2022, 29(9): 6523-6539. DOI:10.3390/curroncol29090513 |
| [23] |
魏佳慧, 刘洋, 王明, 等. CT与MRI在宫颈癌术前评估淋巴结转移中的应用价值[J]. 中国妇产科临床杂志, 2022, 23(6): 583-586. |
| [24] |
李磊, 戴世鹏, 张田, 等. 乳腺浸润性导管癌的MRI特征与腋窝淋巴结转移的相关性[J]. 中国CT和MRI杂志, 2023, 21(2): 91-93. |
| [25] |
WANG Y, LIU W, YU Y, et al. CT radiomics nomogram for the preoperative prediction of lymph node metastasis in gastric cancer[J]. Eur Radiol, 2020, 30(2): 976-986. DOI:10.1007/s00330-019-06398-z |
| [26] |
LI J, DONG D, FANG M, et al. Dual-energy CT-based deep learning radiomics can improve lymph node metastasis risk prediction for gastric cancer[J]. Eur Radiol, 2020, 30(4): 2324-2333. DOI:10.1007/s00330-019-06621-x |
| [27] |
陈亮亮, 陈基明, 丁俊, 等. CT影像组学特征预测非小细胞肺癌同步脑转移的价值[J]. 放射学实践, 2022, 37(4): 419-425. |
| [28] |
戴立欢, 尹进学, 钟熹, 等. 基于CT征象联合血清肿瘤标志物的列线图对胃癌淋巴结转移风险的预测价值[J]. 中国中西医结合影像学杂志, 2023, 21(6): 620-624, 645. |
| [29] |
李波, 曹扬, 何风霞, 等. 胃癌淋巴结转移风险预测模型的构建及评价[J]. 医学研究杂志, 2022, 51(8): 43-46. |
 2024, Vol. 22
2024, Vol. 22


