| 分化型甲状腺癌的放射性131I治疗简述 |
甲状腺癌是内分泌系统和头颈部肿瘤中最常见的恶性肿瘤。甲状腺癌根据其病理特点分为乳头状癌、滤泡性癌、髓样癌、未分化癌等,其中乳头状癌和滤泡状癌又被称为分化型甲状腺癌(DTC),为甲状腺癌的主要类型。经过外科手术、放射性131I治疗及促甲状腺激素抑制治疗这一经典三阶梯治疗模式,多数DTC患者可取得良好的治疗效果。自1946年首次报道放射性131I用于治疗DTC以来,经过60多年的发展,该治疗方法已成为DTC术后处治的重要手段。
1 甲状腺癌的流行病学每年甲状腺癌新发病例占所有癌症新发病例的1%~5%[1]。近30年来,甲状腺癌发病率持续快速增长。美国流行病监测计划(Surveillance,Epidemiology,and End Results Program,SEER)数据库显示,美国甲状腺癌发病率由1975年4.9/10万增长至2009年的14.3/10万,发病率增长了近3倍,同时主要表现为甲状腺乳头状癌的增长,发病率从3.4/10万增长至12.5/10万[2]。2012年中国肿瘤登记年报[3]显示,全国肿瘤登记地区甲状腺癌发病率为6.6/10万,世界人口调整发病率(以下简称世标发病率)为4.8/10万,略高于全球平均发病水平(4.0/10万)。《北京市2012年度卫生与人群健康状况报告》[4]显示,北京户籍居民甲状腺癌发病率为11.0/10万,世标发病率为7.7/10万,高于我国肿瘤登记地区平均水平。
2 131I治疗DTC的原理DTC来源于甲状腺滤泡上皮细胞,可表达钠碘同向转运体,具有摄取和碘的能力,因此能够摄取进入体循环的放射性131I。131I是β衰变核素,发射β射线(99%)和γ射线(1%)。β射线可对细胞造成电离辐射损伤,导致残余甲状腺滤泡上皮细胞和DTC细胞的裂解和凋亡。β射线在组织内平均射程小于1 mm,所以能量几乎全部释放在残留中状腺组织或病灶内,对周围组织和器官影响较小,属于靶向内放射治疗。γ射线可用来显像,显示131I在体内的分布并探查可疑病灶。
3 放射性131I治疗DTC的意义放射性131I治疗DTC包括:去除术后残留甲状腺组织,即清甲治疗(图 1);治疗DTC转移灶,即清灶治疗(图 2)。
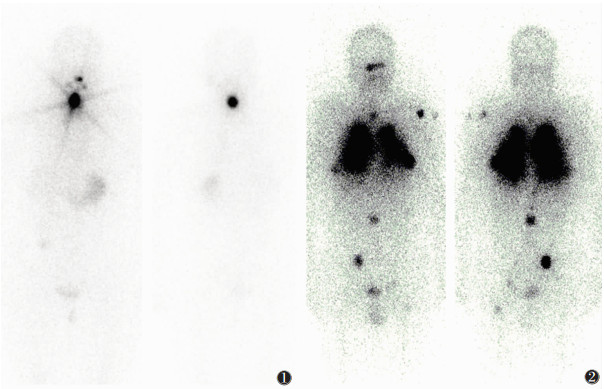 |
| 图 1 女,44岁。甲状腺乳头状癌术后清甲治疗。口服131I 200 mCi 3 d后行全身显像,颈部见大量131I摄取 图 2 男,48岁。甲状腺滤泡状癌术后双肺转移、多发骨转移,第2次清灶治疗。口服131I 200 mCi 3 d后行全身显像,双肺、纵隔内、左侧肱骨、腰椎、髂骨、左侧股骨上端见大量13II摄取 |
残留甲状腺组织能摄取放射性131I,放射性131I在清除残留甲状腺组织的同时,也清除了隐匿在残留甲状腺组织中的微小DTC病灶,同时具备摄碘能力的转移病灶也可摄取131I。残留甲状腺组织被完全清除后,体内无甲状腺球蛋白(Tg)的正常来源,有利于通过检测血清Tg水平的变化对DTC的复发或转移进行诊断;治疗后进行的全身显像,常可发现诊断性小剂量131I全身显像未能显示的DTC病灶,这对修正患者治疗和随访方案有重要意义。
4 放射性131I治疗DTC的适应证和禁忌证适应证:①高危患者,常规推荐放射性131I治疗,包括已知存在远处转移、肉眼可见的甲状腺外侵犯、肿瘤未完全切净、术后高水平血清Tg提示远处转移、滤泡性甲状腺癌广泛浸润血管。②中危患者,应结合患者复发危险因素,如淋巴结转移个数>5个或颈侧区淋巴结转移、高危病理类型及年龄综合评估放射性131I治疗的获益。③低危患者,通常不推荐行放射性131I治疗。原发肿瘤直径>4 cm或伴颈侧区淋巴结转移的年长患者也可考虑131I治疗。
禁忌证:妊娠、哺乳,计划6个月内妊娠者;肝肾功能异常;WBC < 3.0×109/L;手术切口未愈[5-7]。
5 放射性131I治疗前准备停服左旋甲状腺素片或2~3周使血清促甲状腺激素(TSH)升高到30 μU/mL,治疗前严格忌碘2~4周,并测定甲状腺激素水平、Tg、抗甲状腺球蛋白抗体(TgAb)、血常规、尿常规、大便常规、肝肾功能、电解质、心电图,选择性行胸部CT检查。治疗前1个月内勿行CT增强扫描。
6 放射性131I治疗剂量[5-7]治疗剂量:①推荐采用30~100 mCi剂量的放射性131I进行中、低危患者的清甲治疗。②伴可疑或已证实的镜下残存病灶或高侵袭性组织学亚型(高细胞型、柱状细胞型等)但无远处转移的中、高危患者,推荐辅助治疗剂量为150 mCi。③颈部残留手术未切除的DTC组织、伴颈部淋巴结或远处转移,但无法手术或拒绝手术、全甲状腺切除术后不明原因血清Tg尤其是刺激性Tg水平升高者,清甲治疗同时应兼顾清灶治疗,放射性131I剂量为100~200 mCi。④远处转移:肺转移的治疗,病灶仍摄取碘并评价为临床有效,应每隔6~12个月再次治疗,经验性治疗剂量推荐为100~200 mCi,70岁以上剂量为100~150 mCi;骨转移灶,剂量为100~200 mCi。⑤对于青少年、育龄妇女、高龄患者和肾脏功能轻、中度受损患者,可酌情减少放射性131I剂量。
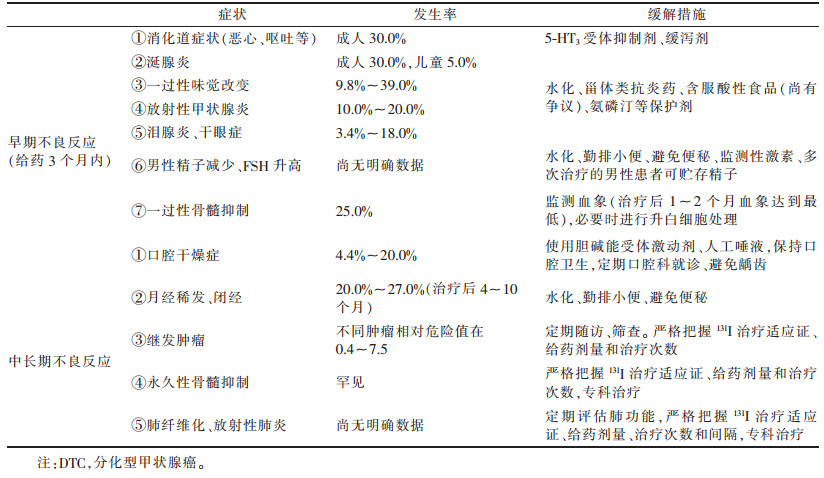
7 放射性131I治疗DTC不良反应及处理治疗不良反应及缓解措施见表 1[8]。短期损伤常见有颈部肿胀和咽部不适,上腹部不适,甚至恶心和呕吐,全身乏力,甚至唾液腺肿胀,外周血象一过性下降。少见有急性腹痛,呼吸困难,尿痛和血尿,严重肺转移者可出现咳痰增多、痰中带血甚至咯血,骨转移者可出现患处疼痛加剧等。中长期损伤常见有慢性唾液腺损伤,性功能和生殖能力下降,继发或并发其他恶性肿瘤的概率增加,肺纤维化,骨髓抑制等。
| 表 1 放射性131I治疗DTC相关不良反应及缓解措施 |
 |
8 放射性131I治疗DTC效果评价
① 清甲治疗效果评价:清甲治疗1~3个月应常规随诊。一般应在清甲治疗后6个月进行疗效评价。评价前应停用左旋甲状腺素2~3周。清甲成功的标准为诊断活度的131I显像甲状腺床无放射性摄取或颈部超声未发现异常,刺激状态下Tg < 1 ng/mL。如发现甲状腺清除不完全,应行第2次清甲治疗。如随访发现有转移灶,应行清灶治疗。
② 清灶治疗效果评价:1~3个月应常规随诊。在清灶治疗后6个月进行疗效评价。评价前应停用左旋甲状腺素2~3周。转移灶数目减少或直径减小,Tg和TgAb的水平降低或消失,为治疗有效;与治疗前相比转移灶数目增加,或旧的转移灶直径增大,则为进展。病灶仍摄取碘并评价为临床有效,应每隔6~12个月再次施行治疗。重复治疗使用剂量的原则与首次治疗相同,如首次治疗效差,可考虑适当增加剂量。应注意随着累积活度增高,发生不良反应和并发症的危险性也增高,所以对重复治疗的风险与效益应慎重评估。
| [1] |
Sipos JA, Mazzaferri EL. Thyroid cancer epidemiology and prognostic variables[J]. Clin Oncol, 2010, 22: 395-404. DOI:10.1016/j.clon.2010.05.004 |
| [2] |
Davies L, Welch HG. Current thyroid cancer trends in the United States[J]. JAMA Otolaryngol Head Neck Surg, 2014, 140: 317322. |
| [3] |
杨雷, 王宁. 甲状腺癌流行病学研究进展[J]. 中华预防医学杂志, 2014, 48(8): 744-748. DOI:10.3760/cma.j.issn.0253-9624.2014.08.021 |
| [4] |
北京市人民政府.北京市2012年度卫生与人群健康状况报告[R].北京: 人民卫生出版社, 2013: 45.
|
| [5] |
高明. 甲状腺结节和分化型甲状腺癌诊治指南[J]. 中国肿瘤临床, 2012, 39(17): 1249-1272. |
| [6] |
中华医学会核医学分会. 131I治疗分化型甲状腺癌指南(2014版)[J]. 中华核医学与分子影像杂志, 2014, 34(4): 264-278. DOI:10.3760/cma.j.issn.2095-2848.2014.04.002 |
| [7] |
Haugen BR, Alexander EK, Bible KC, et al. 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer:the American Thyroid Association guidelines task force on thyroid nodules and differentiated thyroid cancer[J]. Thyroid, 2016, 26: 124-133. |
| [8] |
Fard-Esfahani A, Emami-Ardekani A, Fallahi B, et al. Adverse effects of radioactive iodine-131 treatment for differentiated thyroid carcinoma[J]. Nucl Med Commun, 2014, 35: 808-817. |
 2019, Vol. 17
2019, Vol. 17


