| 早期帕金森病合并嗅觉功能障碍的静息态fMRI研究 |
1ⓑ. 山东中医药大学第二附属医院神经内科, 山东 济南 250001
帕金森病是一种中老年人常见的中枢神经系统的变性疾病,病情复杂,起病缓慢,呈进行性发展,严重影响患者生活质量,其中以嗅觉功能障碍最常见。该病病理改变导致的功能异常早于临床表现,因此如何应用现有的技术及方法早期诊断分析帕金森病一直是临床科研工作的重点。以往对于帕金森病的研究主要集中在以静止性震颤为典型症状的运动障碍的研究,但非运动症状常发生于帕金森病的整个病程,且常先于运动症状出现,其中嗅觉功能障碍多为最早出现且最常见的非运动症状,其在该病的发生率高达95%[1],Braak分期将嗅觉功能障碍作为首发症状进行评判。本文探讨帕金森病伴嗅觉功能障碍患者的静息态脑功能局部一致性(regional homogeneity,ReHo)值,以期早期诊断帕金森病。
1 资料与方法 1.1 一般资料选取2013年6月至2018年9月我院收治的30例帕金森病患者(患者组)(病程<3年),均符合英国帕金森病协会脑库临床诊断标准[2-3],Hoehn & Yahr分级(H-Y分级)介于1~2.5,伴嗅觉功能障碍,嗅觉症状与帕金森病病程呈正态相关性(图 1)。另招募30例基本信息相匹配的健康人作为对照组。
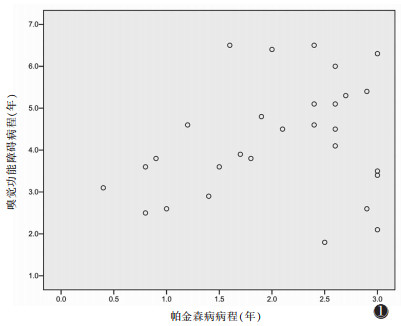 |
| 图 1 嗅觉障碍病程与帕金森病病程相关性散点图(r=0.246,P=0.01) |
1.2 排除标准
① 临床诊断阿尔茨海默病(Alzheimer’s disease,AD)、血管性痴呆;②影像学提示其他类型神经系统疾病;③严重心血管系统、呼吸系统、肝肾疾病及其他严重疾病;④由五官科医师检查后发现有鼻炎或鼻窦异常等;⑤因幽闭恐惧症或其他原因无法行MRI检查者。本研究经我院伦理委员会批准,所有受试者或家属知情同意并签署知情同意书。
1.3 嗅觉测试采用“异丙醇吸入试验测试法”,受试者均闭目、闭口,用70%异丙醇试纸置于鼻下约30 cm处,平静呼吸,每呼吸一次,将试纸向鼻腔靠近1 cm,直至嗅到异丙醇,测试鼻尖至试纸的距离,连测4次取平均值。<10 cm为失嗅,10~15 cm为嗅觉减退,> 15 cm为嗅觉正常[4-5]。
1.4 仪器与方法采用GE Signa HDX 1.5 T超导MRI扫描仪及8通道相控阵头颈神经血管联合线圈。受试者取仰卧位,在静息状态下检查,要求清醒、闭目、不进行任何主动思维活动,并佩戴耳塞及头垫固定。定位线平行于前连合与后连合之间的连线(AC-PC线),自颅底向额顶部方向扫描。首先常规采集T1WI、T2WI、T2FLAIR、DWI等序列图像,发现异常影像学表现者剔除本研究。连续采集BOLD静息态(GRE-EPI)序列图像TR/TE 3 000 ms/45 ms,翻转角90°,激励次数1,视野24 cm×24 cm,矩阵64×64,层厚3 mm,无间隔,扫描层数40。
1.5 数据预处理使用基于统计参数图软件(Statistical ParametricMapping,SPM 8)的DPARSF 2.0软件(data processing assistant for resting-state fMRI)对2组数据行预处理,去除前10个时间点(TR)采集的图像,已消除潜在的噪声干扰。对剩余时间点(TR)的数据依次行时间层校正、头动校正,将头动在X、Y、Z轴的平移最大设为1.5 mm,最大旋转角设为1.5°;采用一步配准法进行空间标准化,重采样体素大小为3 mm×3 mm×3 mm;采用线性回归方法去除线性漂移、带通滤波(0.01~0.08 Hz)提取其低频振荡信号部分,以减少生理噪音。最后对脑内体素行ReHo分析,并行半高全宽4 mm×4 mm×4 mm空间平滑。
1.6 统计学分析利用静息态fMRI数据分析工具包REST V 1.8软件(resting-state fMRI data analysis Toolkit)对ReHo图行双样本t检验,同时加入灰质模板,去除白质、脑脊液,并以年龄、性别、利手及嗅觉测试距离作为协变量,计算出每个像素与其邻近体素之间的时间一致性。取P<0.01作为阈值水平进行统计学分析,采用角连接的方式计算,数据经Alpha Sim校正,最后将差异有统计学意义的脑区融合配准到标准结构图像上,将2组差异表现出来,并将有变化的脑区叠加到加拿大蒙特利尔神经研究所(montrealneuro-logic institute,MNI)脑模板上表示出来,红色表示激活区域,蓝色代表抑制区域;再将MNI坐标脑模板转化为Talairach坐标脑模板,以精确查找激活区域对应的Brodman分区。
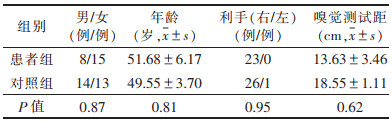
2 结果去除头动校正差、空间标准化配准效果差的数据,最后共50例纳入研究,其中患者组23例,对照组27例。2组性别、年龄和利手情况差异均无统计学意义(均P > 0.05,表 1)。
| 表 1 2组一般资料比较 |
 |
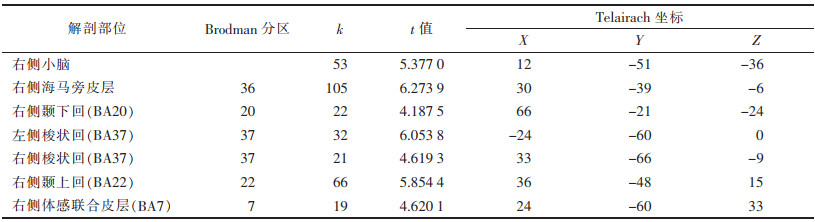
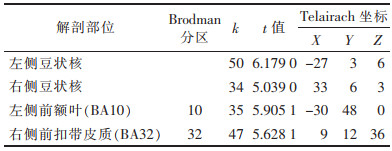
患者组较对照组差异均有统计学意义的激活区域:右侧小脑半球、右侧海马旁皮质(BA36)、右侧颞下回(BA20)、双侧梭状回(BA37)、右侧颞上回(BA22)、右侧体感联合皮质(BA7)。患者组较对照组差异有统计意义的抑制区域:双侧豆状核、左侧前额叶(BA10)、右侧前扣带皮质(BA32)(图 2,表 2、3)。
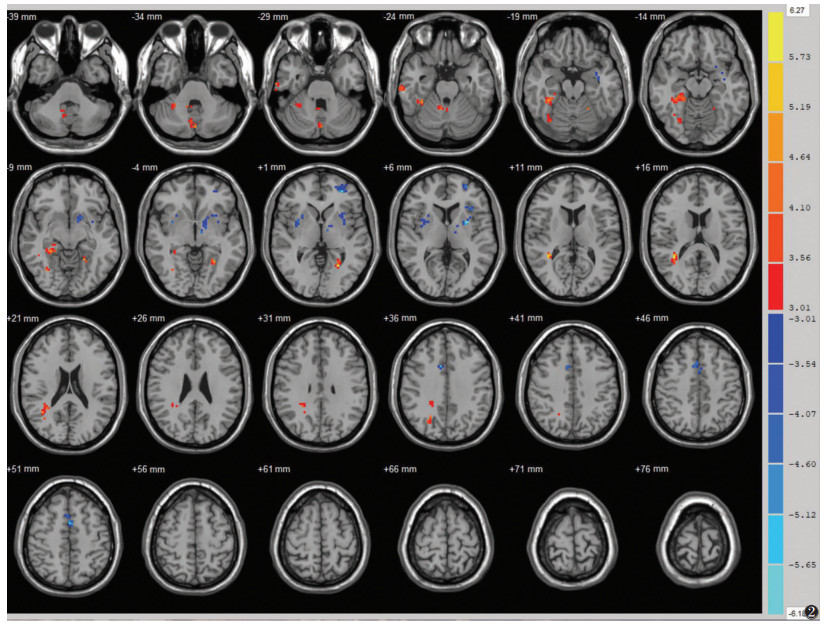 |
| 图 2 红色代表帕金森组激活区域,蓝色代表帕金森组抑制区域 |
| 表 2 静息态下患者组较对照组的激活脑区 |
 |
| 表 3 静息态下患者组较对照组的抑制脑区 |
 |
3 讨论
近年来,MRI技术迅速发展。相比于任务态fMRI,静息态fMRI无需复杂的实验设计,可避免由于实验设计或被试执行情况差异导致的实验结果的不可靠性,可无创、全面深入地研究大脑运行机制,具有较高的临床可行性和实用性,从而得到了快速发展。目前,静息态fMRI主要有以下几种研究方法:低频振幅(amplitude of low frequency fluctuation,ALFF)、比率低频振幅(fractional amplitude of low frequency fluctuation,fALFF)、ReHo、功能连接、有向连接等。ZANG等[6]首先提出了ReHo数据分析法,采用Kendall和谐系数度量多个相邻体素在同一时间序列中BOLD信号波动的相似性或同步性来探测脑功能,反映局部脑区神经元活动的一致性。局部脑区的ReHo值降低说明其神经元活动的一致性降低,提示此脑区存在功能异常,可能是神经元之间的相互联系发生紊乱;ReHo值升高即局部神经元活动的一致性增强,可能是帕金森病脑区损害出现后的一种代偿性反应[7],大量实验数据也证明ReHo在帕金森病脑功能研究中能够反映其功能变化。
本研究中帕金森病患者ReHo值显著降低的脑区主要位于双侧豆状核、左侧前额叶、右侧前扣带皮质。纹状体包括豆状核和尾状核,是椎体外系的重要通路,大脑皮质对锥体外系的调控是人类完成正常躯体运动的主要方式。锥体外系的主要通路包括皮质-纹状体环路、黑质-纹状体环路和皮质-丘脑-小脑环路。帕金森病患者由于黑质致密带多巴胺能神经元的大量退变,多巴胺分泌较少,从而导致纹状体功能下降,引起皮质-纹状体环路异常,可能导致锥体外系黑质-纹状体环路和/或皮质-丘脑-小脑环路脑活动减弱[8],本研究结果与该理论一致。HELMICH等[9]采用功能连接的方法发现帕金森病患者豆状核与本体感觉区及运动区皮质的功能连接明显减弱,证明了帕金森病患者皮质-纹状体环路功能出现下降。有学者[10]认为帕金森病患者脑功能存在对不同通路间不平衡的修饰作用,可表现为直接通路的活动减弱、间接通路活动增强,导致运动徐缓、僵硬和震颤等各种运动症状的出现。
前额叶负责情绪和注意网络自上而下的调节,在注意力、思维推理、行为计划、工作记忆等高级认知功能中起重要作用。越来越多的证据[11]显示,帕金森病导致的多巴胺能神经元变性对不同的额叶及额叶参与的纹状体回路产生不同的影响。刘虎等[12-13]发现帕金森病患者右侧前额叶ReHo值显著降低,与本实验结果一致。以ALFF和功能连接作为指标的研究[14-15]同样观察到帕金森病患者前额叶功能降低。LOU等[16]发现帕金森病左侧额上回和额中回的特征向量中心度异常,从而也能佐证帕金森病临床症状与额叶脑功能区的相关性。从结果上分析,前额叶还包含部分嗅觉中枢,其激活区域明显低于正常人,亦能反映帕金森病患者嗅觉中枢功能降低。前额叶功能异常能阻断多模态感觉信息的整合,导致情感缓冲机制障碍、认知调控功能失调,可能是帕金森病逐渐出现认知功能障碍的重要因素,可探索性预测帕金森病持续性痴呆的发生[17]。综合上述结果,推测前额叶神经环路功能缺陷可能是导致帕金森病嗅觉障碍、情感调节与认知功能异常,并进一步出现失嗅、抑郁症及痴呆的原因之一。
前扣带皮质参与情绪信息处理,与额叶、颞叶、顶叶均有广泛的纤维联系,且与海马有着密切联系。研究[18-19]认为帕金森病前扣带回ReHo信号降低,可反映情绪异常及认知损害,与抑郁症的发生、发展密切相关。谷何一等[20]用功能连接的方法也发现帕金森病前扣带回功能降低。同时,前扣带回及前额叶还共同参与构成大脑前注意网络,其功能异常可能是帕金森病患者注意功能缺陷的神经生理基础[21]。研究[22]证实,帕金森病合并认知功能障碍患者会出现前扣带回皮质、前额叶皮质明显的激活下降。本研究发现,早期帕金森病患者相比对照组,左侧额叶、右侧前扣带回同时ReHo信号降低,可能提示大脑注意网络环路的功能缺陷。
本研究中帕金森病患者ReHo值显著增高的脑区主要位于小脑半球、海马旁回、梭状回、右侧颞下回、右侧颞上回、右侧体感联合皮质。WU等[17]认为,帕金森病患者由于纹状体-丘脑-皮质通路损害,需更多的功能区脑组织活动代偿,以减轻自主活动障碍。
小脑是维持与调节姿势精确运动的中枢器官,调节全身的肌紧张以维持身体的姿势,能够反映帕金森病患者运动障碍的中枢机制。很多报道[12, 23]发现,帕金森病患者小脑半球的神经元活动比对照组代偿性增加。WU等[17]研究发现,帕金森病患者皮质-小脑功能连接也会发生代偿。由于黑质-纹状体环路中,黑质发出的投射纤维主要止于尾状核和豆状核,而皮质-丘脑-小脑环路中的主要节点是丘脑和小脑,小脑可能反映黑质纹状体环路损伤、基底节功能减退的代偿。且小脑与基底节相互联系也越来越多地得到证明[24]。本研究中小脑的激活及基底节区的抑制,也可解释为通路间不平衡的修饰作用。近年来,越来越多的证据[25-27]显示,小脑除了具有传统的整合运动的功能外,还参与非运动功能的调节,如语言、认知和情绪,表明小脑与神经系统的大部分区域有着更广泛的联系,通过协调作用参与较高级的认知行为,这些区域包括前额叶皮质、额叶言语区、后顶叶及颞上回皮质等皮质。因此,推测小脑不同区域的激活是帕金森病重要的神经网络机制,可能参与帕金森病的认知代偿。
海马旁回、梭状回属于边缘系统,边缘系统与嗅觉、内脏活动的调节及情绪反应密切相关,还参与高级情感的认知过程。有学者[28]认为,边缘系统的激活状态与情绪好坏有关,在情绪的调节中参与共情调节。推测本研究中帕金森病患者可能伴不同程度情绪问题。海马旁回及梭状回与边缘系统内的嗅觉中心相邻,海马旁回及梭状回的ReHo增强,也支持嗅觉障碍后邻近脑区代偿反应这种假设。
本研究中帕金森病患者右侧颞叶的ReHo值增大,提示帕金森病患者学习、记忆能力发生变化,与田琦等[24]采用fALFF方法的研究结果一致。研究[12]认为,帕金森病患者右侧颞下回ReHo值显著增大表明其皮质-纹状体环路功能减低,纹状体-额叶环路可能转向相对完整的颞叶一侧运动前区环路,以代偿性完成复杂运动。刘波等[29]通过默认网络也发现颞下回与扣带回功能连接增强,能够反映帕金森病患者运动环路会发生代偿性增高。
本研究中右侧体感联合皮质ReHo值显著增大,结果与YANG等[30]的研究一致,可能与帕金森病患者嗅觉、味觉等非运动症状有关。KURANI等[31]认为,感觉运动环路是从初级感觉运动皮质,如运动前区、额叶、中央后回、辅助运动区等相关皮质投射到壳核,后通过丘脑再次返回到上述区域,从而在神经网络环路角度解释了此种代偿现象,推测帕金森病患者出现神经通路功能缺陷或大脑网络之间相互抑制损失的补偿。
由于帕金森病的病程复杂、症状多样,且其他激活脑区或抑制脑区由于区域较小、强化程度较低,可理解为上述表现的协同改变。总之,静息态下帕金森病患者脑区与正常人ReHo改变存在差异,可能与其更复杂的临床症状有关。ReHo方法能够发现帕金森病患者脑神经活动早期改变,对帕金森病的早期诊断、评估,以及监测疾病进展起到一定作用,有助于对帕金森病发生发展机制进一步研究。
| [1] |
朱骏, 潘杨, 沈柏, 等. 帕金森病患者嗅觉减退的相关因素分析[J]. 卒中与神经疾病, 2016, 23(2): 102-106. |
| [2] |
HUGHES A J, DANIEL S E, Kilford L, et al. Accuracy of clinical diagnosis of idiopathic Parkinson's disease:a clinical-pathological study of 100 cases[J]. J Neurol Neurosurg Psychiatry, 1992, 55(3): 181-184. DOI:10.1136/jnnp.55.3.181 |
| [3] |
ROGERS G, DAVIES D, PINK J, et al. Parkinson's disease:summary of updated NICE guidance[J]. BMJ, 2017, 358: j1951. DOI:10.1136/bmj.j1951 |
| [4] |
DAVIDSON T M, MURPHY C. Rapid clinical evaluation of anosmia. The alcohol sniff test[J]. Arch Otolaryngol Head Neck Surg, 1997, 123(6): 591-594. DOI:10.1001/archotol.1997.01900060033005 |
| [5] |
ASHWIN C, CHAPMAN E, HOWELLS J, et al. Enhanced olfactory sensitivity in autism spectrum conditions[J]. Cular Autism, 2014, 5(1): 53. DOI:10.1186/2040-2392-5-53 |
| [6] |
ZANG Y, JIANG T, LU Y, et al. Regional homogeneity approach to fMRI data analysis[J]. Neuroimage, 2004, 22(1): 394-400. DOI:10.1016/j.neuroimage.2003.12.030 |
| [7] |
WU T, LONG X, ZANG Y, et al. Regional homogeneity changes in patients with Parkinson's disease[J]. Hum Brain Mapp, 2009, 30(5): 1502-1510. DOI:10.1002/hbm.20622 |
| [8] |
王维治, 罗祖明. 神经病学[M]. 4版. 北京: 人民卫生出版社, 2001: 206.
|
| [9] |
HELMICH R C, DERIKX L C, BAKKER M, et al. Spatial remapping of cortico-striatal connectivity in Parkinson's disease[J]. Cereb Cortex, 2010, 20(5): 1175-1186. DOI:10.1093/cercor/bhp178 |
| [10] |
HOLTBERND F, EIDELBERG D. Functional brain networks in movement disorders[J]. Curr Opin Neurol, 1998, 11(4): 319-326. DOI:10.1097/00019052-199808000-00007 |
| [11] |
ORTEGA G J, MENENDEZ D E, LA PRIDA L, et al. Synchro nization clusters of interictal activity in the lateral temporal cortex of epileptic patients:intraoperative electrocardiographic analysis[J]. Epilepsia, 2008, 49(2): 269-280. DOI:10.1111/j.1528-1167.2007.01266.x |
| [12] |
刘虎, 范国光, 徐克, 等. 帕金森病患者静息态下脑活动的局部一致性[J]. 中国医学影像技术, 2011, 27(10): 1967-1971. |
| [13] |
SHENG K S, FANG W, SU M S, et al. Altered Spontaneous brain activity in patients with Parkinson's disease accompanied by depressive symptoms, as revealed by regional homogeneity and functional connectivity in the prefrontal-limbic system[J]. PloS One, 2014, 9(1): e84705. DOI:10.1371/journal.pone.0084705 |
| [14] |
LUO C Y, CHEN Q, SONG W S, et al. Resting-state fMRI study on drug-naitve patients with Parkin's disease and with depres sion[J]. J Neurol Neurosurg Psychiatry, 2014, 85(6): 675-683. DOI:10.1136/jnnp-2013-306237 |
| [15] |
LUO C, SONG W, CHEN Q, et al. Reduced functional connecti vityin early-stage drug-naive Parkinson's disease:a resting-state fMRI study[J]. Neurobiol Aging, 2014, 35(2): 431-441. |
| [16] |
LOU Y, HUANG P, LI D, et al. Altered brain network centrality in depressed Parkinson's disease patients[J]. Mov Disord, 2016, 30(13): 1777-1784. DOI:10.1002/mds.26321 |
| [17] |
WU T, WANG L, HALLETT M, et al. Effective connectivity of brain networks during self-initiated movement in Parkinson's disease[J]. Neuroimage, 2011, 55(1): 204-215. DOI:10.1016/j.neuroimage.2010.11.074 |
| [18] |
YAO N, CHANG R S K, CHEUNG C, et al. The default mode network is disrupted in Parkinson's disease with visual halluc inations[J]. Hum Brain Mapp, 2014, 35(11): 5658-5666. DOI:10.1002/hbm.22577 |
| [19] |
FRODL T, JAGER M, BORN C, et al. Anterior cingulate cortex does not differ between patients with major depression and healthy controls, but relatively large anterior cingulate cortex predicts a good clinicalcourse[J]. Psychiatry Res, 2008, 163(1): 76-83. |
| [20] |
谷何一, 孙学进, 等. 静息态下早期帕金森病患者杏仁核功能连接的MRI研究[J]. 临床放射学杂志, 2017, 36(9): 1218-1221. |
| [21] |
YEO B T, KRIENEN F M, SEPULCRE J, et al. The organization of the human cerebral cortex estimated by intrinsic functional connectivity[J]. Neurophysiol, 2011, 106(3): 1125-1165. DOI:10.1152/jn.00338.2011 |
| [22] |
EKMAN U, ERIKASON J, FORSGREN L, et al. Functional brain activity and presynaptic dopamine uptake in patients with Parkinson's disease and mild cognitive impairment:acrosssecti onal study[J]. Lancet Neurol, 2012, 11(8): 679-687. DOI:10.1016/S1474-4422(12)70138-2 |
| [23] |
YU H, STERNAD D, CORCOS D M, et al. Role of hyperactive cere-bellum and motor cortex in Parkinson's disease[J]. Neur oimage, 2007, 35(1): 222-233. |
| [24] |
田琦, 黄丹青, 孙奕, 等. 帕金森病全脑比率低频振幅静息态功能磁共振研究[J]. 中国现代医学, 2017, 55(36): 30-33. |
| [25] |
GUILLEN D, CASTILLO A, ALONSO J, et al. Increased myo inositol in parietal white and gray matter as a biomarker of poor prognosis in neuropsychiatric lupus:a case report[J]. Lupus, 2014, 23(10): 1073-1078. DOI:10.1177/0961203314534303 |
| [26] |
ZIMNY A, SZMYRKA-KACZMAREK M, SZEWCZYK P, et al. In vivo evaluation of brain damage in the course of systemic lupus rythematosus using magnetic resonance spectroscopy, perfusion-weighted and diffusion-tensor imaging[J]. Lupus, 2014, 23(1): 10-19. DOI:10.1177/0961203313511556 |
| [27] |
SCHMAHMANN J D. From movement to thought anatomic substrates of the cerebellar contribution to cognitive processing[J]. Human Brain Mapping, 1996, 4(3): 174-198. DOI:10.1002/(SICI)1097-0193(1996)4:3<174::AID-HBM3>3.0.CO;2-0 |
| [28] |
申延蕊, 李中林, 武肖玲, 等. 静息态fMRI观察基于中国人脑模板的慢性失眠患者岛叶功能连接[J]. 中国医学影像技术, 2019, 35(1): 15-19. |
| [29] |
刘波, 陈俊, 刘岘, 等. 帕金森病静息态脑默认状态网络的观察[J]. 中国医学影像技术, 2009, 25(7): 1156-1159. |
| [30] |
YANG H, ZHOU X J, ZHANG M M, et al. Changes in spontaneous brain activity in early Parkinson's disease[J]. Neurosci Lett, 2013, 549: 24-28. DOI:10.1016/j.neulet.2013.05.080 |
| [31] |
KURANI A S, SEIDLER R D, BURCIU R G, et al. Subthalami cnucleussensorimotor cortex functional connectivity in de novo and moderate Parkinson's disease[J]. Neurobiol Aging, 2015, 36(1): 462-469. DOI:10.1016/j.neurobiolaging.2014.07.004 |
 2020, Vol. 18
2020, Vol. 18


