| 小肠克罗恩病炎症活动度的评估方法 |
2. 浙江中医药大学附属第一医院医学影像科,浙江 杭州 310006
克罗恩病(Crohn’s disease,CD)是一种原因不明的慢性、反复性肠道炎症性疾病,可累及胃肠道任何部位,其中小肠是最常见的部位,单独累及小肠者占30%~40%[1]。CD发生率近年来呈递增趋势[2],病程迁延,常反复发作,并伴纤维化和溃疡,甚至贯穿肠壁全层、侵犯肠系膜和局部淋巴结,且并发症多、致残率高。准确评价CD的炎症活动度对病情判定、后续治疗及并发症的处理十分重要。笔者总结现有评价小肠CD炎症活动度的方法,以期为临床诊断和治疗决策提供参考。
1 内镜检查内镜检查是诊断和评价小肠CD的常用且可靠的方法,目前常用的内镜检查有胶囊内镜(capsule endoscopy,CE)、小肠镜和结肠镜等。
1.1 CECE是一种重要的非侵入性检查方法,其临床应用显著改变了小肠的内镜检查范围,可对普通肠镜无法到达的肠道进行腔内可视化检查。在此之前,临床无法获得小肠全程的内镜图像,只能将短节段图像进行拼接。CE具有更高的图像分辨力、更快的帧速率和更强的实时分析能力,可进一步提高CD的检出率,但检查时需提醒患者实时观察粪便情况,及时检测胶囊是否排出体外。
相关组织专门为炎性肠病开发了CE评分系统——CE CD活动指数(CECDAI)。这是一种比路易斯评分(Lewis score,LS)更简单的评分系统,且2种评分之间存在很强的相关性,但CECDAI更能灵活反映炎症和临床活动度[3]。
另外,CE安全可靠,检查成功率高,胶囊滞留风险低,一旦发生滞留可使用类固醇减轻炎症促进胶囊排出[4-5],但其无法进行治疗操作和软组织活检,存在一定局限性。
1.2 小肠镜目前,临床常用双气囊小肠镜检查肠道[6]。双气囊小肠镜可抵达回肠中下段,部分可达回肠末端,经口和经肛进镜相结合的方式可实现对全小肠黏膜的观察,有助于尽早评价小肠CD活动度。Jeon等[7]研究发现,小肠镜诊断CD发病部位和活动度的准确率为90.7%,表明其在CD诊治中具有较高的临床应用价值。
双气囊小肠镜不仅可直接观察小肠黏膜,了解病变的形态和范围,还能对病变进行活检。但检查时患者常会感到不适,甚至在检查后出现恶心、腹胀和腹痛等不良反应。
1.3 结肠镜对于疑似CD患者,初步评估应包括结肠镜检查和回肠末端检查[8]。结肠镜检查不仅能直接观察回肠末端和结肠,还可进行活检。当怀疑炎性肠病时,建议活检标本取受累黏膜和正常黏膜2个部位[8]。内镜和组织学特征结合有助于炎性肠病的诊断、CD与溃疡性结肠炎的鉴别及排除具有相似表现的其他疾病[8]。
结肠镜检查是一种较为安全的方法,且不良事件发生率较低。其不足是:仅能观察至回肠末端,无法再向上探查,限制了对小肠上部疾病的观察;发生肠腔狭窄或肠粘连时,观察范围也会进一步受限;不适用于严重结肠炎和中毒性巨结肠患者。
2 实验室检查目前,临床上常用来评价CD活动度的实验室检查主要包括C反应蛋白(CRP)、红细胞沉降率(ESR)、粪钙卫蛋白(FC)等。
2.1 CRP血清CRP是机体受到炎性刺激时由肝脏合成的蛋白,是评估CD炎症活动度的参考指标。CRP检查成本低,操作便捷,通过简单的血液检查即可获得,其水平与炎症活动有一定的相关性。但有研究发现,CRP用于评估CD内镜下活动度的敏感度和特异度为49%及92%,低敏感度限制了其应用[9-10]。同时,CRP在预测内镜缓解方面并不可靠,CRP假阴性(<3 mg/L)的频率几乎是CD简化内镜评分(SES-CD)的2倍。
2.2 ESR炎症反应时ESR会加快,所以活动期CD患者的ESR较缓解期患者高[11]。但ESR的升高不仅受炎症反应影响,贫血、红细胞增多症等影响红细胞比容的疾病也会造成ESR升高,这降低了其评估CD炎症活动度的准确性及特异度[12]。另外,在生理状态下ESR也会出现波动,因此其不能有效评估CD炎症活动度。
2.3 FC人体发生炎症时,中性粒细胞会释放钙卫蛋白。因此,若CD患者粪便中检测到FC可直接提示炎症位于肠道,帮助临床评价。宋为娟等[13]选取128例CD确诊患者,用酶联免疫法检测FC,分析疾病炎症程度、活动度等指标。结果显示,重、中度炎症组FC水平均高于轻度炎症组;中、轻度活动期FC水平均高于缓解期,且中度活动期FC水平高于轻度活动期,差异均有统计学意义。上述结果从一定程度上说明FC可作为CD病情评估的无创标志物,为全民筛查潜在炎性肠病患者提供更大可能。
FC取材容易、检测方便,有望减少肠镜检查的次数,减轻检查带来的不适,且能较好地反映肠道炎症的活动度,但其缺乏特异性,无法单独作为疾病诊断的依据,且非甾体类抗炎药及质子泵抑制剂(PPI)等制剂对FC值有一定影响,因此在检测时应停药,减少干扰因素,尽量保证数值准确性。
3 影像学检查医学影像学检查是无创性评价CD炎症活动度的常用方法,包括小肠X线造影、CT小肠成像(CT enterography,CTE)、MRI小肠成像(MRI enterography,MRE)、PET-CT等。其中,CTE和MRE被美国胃肠病学会和北美放射学会列为主要的影像评价方法[14]。CTE和MRE可显示小肠CD的病变部位、炎症活动度等,结合临床表现,可更准确地评价小肠CD炎症活动度,从而指导治疗,提高治疗效果。值得注意的是,影像学上的活动性与非活动性疾病表现并非与组织学、内镜或临床表现等同,其存在一定关系,同时也存在差异[14]。
3.1 CTE研究表明,CD患者的影像表现与对应的组织学炎症密切相关[15],CT在横断面观察CD时,可发现小肠炎症和穿透性并发症,为CD诊断提供有利证据[14]。CD的影像学表现与炎症活动度有关:肠壁不对称增厚、异常强化和水肿是CD炎症的特征性表现[14],其中肠壁增厚在肠系膜侧表现较明显,在CTE图像上呈斑片状强化[16]。另外,可存在肠腔狭窄,并伴随近端肠腔扩张或活动性炎症的征象。因此,CTE诊断CD符合率较高,不仅能观察CD患者的肠道炎症分布、肠壁异常强化情况和小肠穿透性并发症,也可评估肠系膜静脉闭塞程度及是否存在小肠静脉曲张[14],为临床诊断和治疗方案的选择提供参考依据,具有较高的临床价值。但CTE需注射对比剂,对比剂过敏患者禁用;另外,有辐射损害的风险,应尽量避免频繁检查。虽然影像学上认为同时存在节段性肠壁强化和肠壁异常增厚是CD活动性炎症的反应[15],但许多其他因素,如感染性肠炎、移植性自体排异疾病、放射性肠炎、非甾体抗炎药所引起的肠病等也可出现上述征象[17],会对病因的判断造成干扰。
3.2 MRE高场强MRI设备和快速成像序列的开发应用和消化道口服对比剂的不断改进,使MRE图像具备了更高的SNR,且呼吸和运动伪影减少,图像更优质。另外,MRE对软组织有极佳的分辨力、能多平面成像,且无电离辐射,越来越多地应用于小肠疾病的诊断中。MRE成像技术有DWI、磁化传递成像(magnetization transfer,MT)及肠蠕动描记法成像等。DWI可在肠壁微环境水平进行水分子随机运动的定性和定量功能性分析,且无需注射对比剂。CD炎症会造成肠壁内水分子的运动降低,进而引起DWI信号升高、ADC值降低[18]。因此,ADC值随着CD活动度的增高而下降。另外,缓解期、轻度及中重度CD的ADC值差异有统计学意义[19],由此可知DWI能较好地评估CD炎症活动度。在MT方面,标准化磁化传递率随肠纤维化加重而升高,且在无纤维化、轻度、中度及重度肠壁纤维化间差异有统计学意义[19]。MRI活动指数(MaRIA)将肠壁增厚、增强、水肿和黏膜溃疡作为CD内镜严重程度指数评分的独立预测因子,随后在独立队列和临床试验环境中得到验证[20]。因此,MaRIA可用于评估CD的炎症活动度。但在切除节段小肠的患者中,整体评分并不准确,因此MaRIA更适合评价完整小肠的炎症活动度。有研究建立了简化的MaRIA评分,其敏感度90%,特异度81%(AUC 0.91),可更快捷地评估CD中的炎症和严重程度[20]。
MRI既能准确评估小肠黏膜情况,还能全面显示小肠和邻近结肠受累情况,提供更多有关病情分期、分型的评估信息。T1WI图像可用于评价肠壁的强化特征;增厚的肠壁在T2WI图像上表现为典型的靶征,且肠壁内还可见多发的等信号小结节,表现为典型的肉芽肿征。MRI横断面观察时发现的小肠肠壁T2WI高信号、弥散受限、肠周水肿、肠壁增厚和肠壁溃疡通常与内镜和组织学所提示的炎症严重程度密切相关[14]。郭淑栋等[21]筛选了22例完成MRE检查的活动性CD患者,其中轻度7例、中度9例、重度6例,Spearman相关分析显示,MRE诊断CD轻、中、重度与临床CD活动指数相关系数分别为r=0.873、0.826、0.899(均P<0.05)。由此得出:MRE与临床CD活动指数具有相关性,可准确评估活动性CD的活动度分级,为临床治疗提供参考。
在鉴别CD的炎性改变与肠壁纤维化方面,脂肪抑制T2WI也有独特的功能。炎症时,肠壁和肠间隙出现水肿,脂肪抑制T2WI呈明显高信号,而肠壁纤维化则呈低信号,有助于两者的鉴别[19, 22]。Hectors等[23]研究表明,定量参数ADC是具有诊断价值的区分正常和异常肠壁的独立参数,实验的AUC为0.800,若联合应用多个参数[容积转移常数(Ktrans)、血管外细胞外间隙容积分数(ve)、灌注分数、ADC],则会有更高的准确度(AUC=0.963)。另外,ADC图低信号对检测CD具有良好的敏感度:在一项对38例CD患者的回顾性研究中发现,ADC值阈值为2.1×10-3 mm2/s,敏感度88.8%,特异度95.0%[24]。DWI信号增高且伴ADC图信号减低时,才能被认为是有意义的DWI弥散受限,即有CD炎性病变的存在。
MRE成像清晰且无辐射损伤,能有效评价病变炎症活动度,为临床制订CD的治疗方案提供早期、精准的影像学依据。但MRI检查时间长、费用高;此外,MRI适用人群有局限性,无法检查体内有金属植入物的患者等。
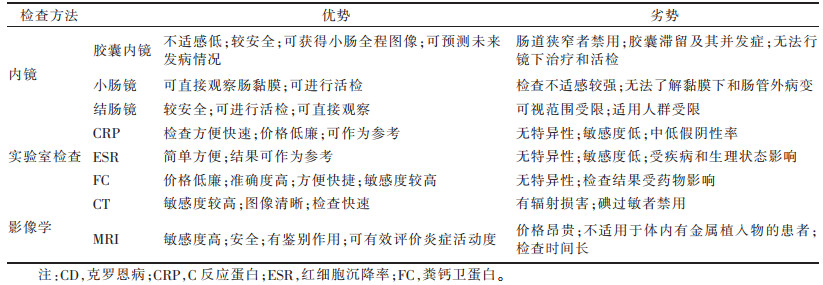
4 小结综上所述,小肠CD炎症活动度的各种评价方法各有优缺点(表 1),可相互补充,尚无法完全替代。小肠镜或结肠内镜检查是诊断CD的金标准,但检查过程较困难且常引起患者不适,加之CD经常复发需多次检查,故不适合频繁使用。胶囊内镜检查成功率高、效果好,胶囊滞留发生较少,临床应用有一定优势。CRP和ESR特异度低,且受其他生理因素影响,其结果仅供参考。FC对炎症评估的准确度高,费用较低,检查结果可为临床提供重要的参考价值,故可作为CD的一项常规检查项目。CTE检查过程快速、结果客观,但不适用于碘过敏者,全腹扫描辐射剂量大也不宜频繁检查。MRE无电离辐射且能有效评价病变,在CD的炎症活动度评估和疗效预测中有较大优势,但检查费时且价格较高。因此,临床工作中,应充分了解上述方法的优缺点,联合应用,为临床诊断和治疗提供更多有价值的信息。
| 表 1 小肠CD炎症活动度各种评估方法的优势与不足 |
 |
| [1] |
BAUMGART D C, SANDBORN W J. Crohn's disease[J]. Lancet, 2012, 380(9853): 1590-1605. DOI:10.1016/S0140-6736(12)60026-9 |
| [2] |
范一宏, 吕宾. 炎性肠疾病研究前沿[J]. 浙江大学学报(医学版), 2019, 48(3): 334-341. |
| [3] |
OMORI T, KAMBAYASHI H, MURASUGI S, et al. Comparison of Lewis score and capsule endoscopy Crohn's disease activity index in patients with Crohn's disease[J]. Dig Dis Sci, 2020, 65(4): 1180-1188. DOI:10.1007/s10620-019-05837-7 |
| [4] |
LEE H S, LIM Y J, KIM K O, et al. Outcomes and management strategies for capsule retention: a Korean Capsule Endoscopy Nationwide Database Registry study[J]. Dig Dis Sci, 2019, 64(11): 3240-3246. DOI:10.1007/s10620-019-05659-7 |
| [5] |
NEMETH A, WURM JOHANSSON G, NIELSEN J, et al. Capsule retention related to small bowel capsule endoscopy: a large Euro-pean single-center 10-year clinical experience[J]. United European Gastroenterol J, 2017, 5(5): 677-686. DOI:10.1177/2050640616675219 |
| [6] |
HUANG Z, LIU X, YANG F, et al. Diagnostic efficacy of double-balloon enteroscopy in patients with suspected isolated small bowel Crohn's disease[J]. BMC Gastroenterol, 2020, 20(1): 42. DOI:10.1186/s12876-020-01188-0 |
| [7] |
JEON S R, KIM J O, BYEON J S, et al. Enteroscopy in Crohn's disease: are there any changes in role or outcomes over time?A KASID Multicenter Study[J]. Gut Liver, 2021, 15(3): 375-382. DOI:10.5009/gnl20023 |
| [8] |
SPICELAND C M, LODHIA N. Endoscopy in inflammatory bowel disease: role in diagnosis, management, and treatment[J]. World J Gastroenterol, 2018, 24(35): 4014-4020. DOI:10.3748/wjg.v24.i35.4014 |
| [9] |
MOSLI M H, ZOU G, GARG S K, et al. C-Reactive protein, fecal calprotectin, and stool lactoferrin for detection of endoscopic activity in symptomatic inflammatory bowel disease patients: a systematic review and meta-analysis[J]. Am J Gastroenterol, 2015, 110(6): 802-819, 820. DOI:10.1038/ajg.2015.120 |
| [10] |
BOSCHETTI G, LAIDET M, MOUSSATA D, et al. Levels of fecal calprotectin are associated with the severity of postoperative endoscopic recurrence in asymptomatic patients with Crohn's disease[J]. Am J Gastroenterol, 2015, 110(6): 865-872. DOI:10.1038/ajg.2015.30 |
| [11] |
SAJJADI M, GHOLAMREZAEI A, DARYANI N E. No associa-tion between serum adenosine deaminase activity and disease activity in Crohn's disease[J]. Dig Dis Sci, 2015, 60(6): 1755-1760. DOI:10.1007/s10620-014-3510-y |
| [12] |
TANG J, GAO X, ZHI M, et al. Plateletcrit: a sensitive biomarker for evaluating disease activity in Crohn's disease with low hs-CRP[J]. J Dig Dis, 2015, 16(3): 118-124. DOI:10.1111/1751-2980.12225 |
| [13] |
宋为娟, 杨瑞霞. 粪钙卫蛋白在克罗恩病病情评估中的临床价值[J]. 临床检验杂志, 2021, 39(5): 373-375. |
| [14] |
骆逸凡, 范一宏, 许茂盛. RSNA/AGA/SAR克罗恩病CT/MR小肠成像评估、解释和应用专家共识(2018)解读[J]. 临床放射学杂志, 2020, 39(5): 927-930. |
| [15] |
SIDDIKI H, FLETCHER J G, HARA A K, et al. Validation of a lower radiation computed tomography enterography imaging protocol to detect Crohn's disease in the small bowel[J]. Inflamm Bowel Dis, 2011, 17(3): 778-786. DOI:10.1002/ibd.21364 |
| [16] |
BRUINING D H, ZIMMERMANN E M, LOFTUS E V JR, et al. Consensus recommendations for evaluation, interpretation, and utilization of computed tomography and magnetic resonance enterography in patients with small bowel Crohn's disease[J]. Radiology, 2018, 286(3): 776-799. DOI:10.1148/radiol.2018171737 |
| [17] |
PLUMB A A, PENDSE D A, MCCARTNEY S, et al. Lymphoid nodular hyperplasia of the terminal ileum can mimic active crohn disease on MR enterography[J]. AJR Am J Roentgenol, 2014, 203(4): 400-407. DOI:10.2214/AJR.13.12055 |
| [18] |
LI X H, SUN C H, MAO R, et al. Diffusion-weighted MRI enables to accurately grade inflammatory activity in patients of ileocolonic Crohn's disease: results from an observational study[J]. Inflamm Bowel Dis, 2017, 23(2): 244-253. DOI:10.1097/MIB.0000000000001001 |
| [19] |
LI X H, MAO R, HUANG S Y, et al. Characterization of degree of intestinal fibrosis in patients with Crohn's disease by using magnetization transfer MR imaging[J]. Radiology, 2018, 287(2): 494-503. DOI:10.1148/radiol.2017171221 |
| [20] |
ORDAS I, RIMOLA J, ALFARO I, et al. Development and vali-dation of a simplified magnetic resonance index of activity for Crohn's disease[J]. Gastroenterology, 2019, 157(2): 432-439. DOI:10.1053/j.gastro.2019.03.051 |
| [21] |
郭淑栋, 张贝贝, 丁孝民, 等. MRI小肠造影可评估克罗恩病活动度分级及临床活动指数[J]. 分子影像学杂志, 2021, 44(4): 618-623. |
| [22] |
POUS S, FRASSON M, JIMENEZ R, et al. Relevance of dyna-mic studies with magnetic resonance enterography in Crohn's disease[J]. Gastroenterol Hepatol, 2020, 43(4): 179-187. DOI:10.1016/j.gastrohep.2019.11.010 |
| [23] |
HECTORS S J, GORDIC S, SEMAAN S, et al. Diffusion and perfusion MRI quantification in ileal Crohn's disease[J]. Eur Radiol, 2019, 29(2): 993-1002. DOI:10.1007/s00330-018-5627-4 |
| [24] |
DURAYSKI E, WATTE G, PACINI G S, et al. Diffusion-weighted imaging and apparent diffusion coefficient values for evaluating terminal ileitis in patients with Crohn's disease[J]. Radiol Bras, 2019, 52(6): 361-367. DOI:10.1590/0100-3984.2019.0011 |
 2022, Vol. 20
2022, Vol. 20


