| 体素内不相干运动成像联合扩散峰度成像对乳腺癌不同分子分型的预测价值 |
乳腺癌是女性最常见的恶性肿瘤,且患病率逐年上升[1]。其治疗方案与基因分型密切相关,如Luminal A型激素受体高表达对内分泌治疗敏感,而对化疗反应较差;Luminal B型内分泌治疗效果较Luminal A型差,但化疗及分子靶向治疗效果更佳;曲妥珠单抗对HER-2阳性型治疗效果较好;三阴型乳腺癌仅对化疗敏感,预后较其他基因分型差[2]。单指数DWI模型的ADC值同时受组织内水分子扩散和微循环灌注2种成分的影响;而体素内不相干运动(intravoxel incoherent motion,IVIM)成像通过双指数曲线拟合方式可分离出微循环血流灌注引起的假扩散[3]。乳腺肿瘤的复杂性常使瘤内部水分子呈非高斯运动,扩散峰度成像(diffusion kurtosis imaging,DKI)基于水分子非高斯分布模型,能更真实反映乳腺肿瘤微环境的变化[4]。国内外学者多将IVIM成像及DKI单一序列应用于乳腺癌的基因分型判断[5-6],但两者联合的价值鲜有报道。因此,本研究拟联合运用IVIM成像及DKI的定量参数对乳腺癌分子分型进行判定。
1 资料与方法 1.1 一般资料收集2019年9月至2021年12月我院经病理证实的244例女性乳腺癌患者,年龄27~86岁,平均(51±10)岁。纳入标准:①临床拟诊为乳腺癌且行IVIM及DKI检查;②手术或穿刺活检后均行免疫组化或基因检测获取分子分型。排除标准:①存在MRI检查禁忌证或图像质量不佳;②MRI检查前已行穿刺活检、手术或放化疗。所有患者MRI检查前均签署知情同意书。
1.2 仪器与方法采用GE Discovery 750W 3.0 T超导型MRI扫描仪和乳腺8通道相控阵线圈。扫描序列与参数:①横断位IVIM成像,采用单次激发SE-EPI序列,TR 2 500 ms,TE 90 ms,层厚4 mm,层距0.4 mm,矩阵128×128,视野350 mm×350 mm,低b值7个,分别为0、30、50、80、100、150、200 s/mm2;高b值5个,分别为500、700、1 000、1 500、2 000 s/mm2,激励次数随b值的增加依次为1、1、1、1、1、1、1、2、2、4、5、6次,扫描时间6 min 40 s。②DKI,b值为0、1 000、2 500 s/mm2,激励次数2次,每个b值施加30个方向的扩散敏感梯度场,TR 5 000 ms,TE 89.9 ms,层厚4 mm,层距0.4 mm,矩阵128×128,视野350 mm×350 mm,扫描时间5 min 55 s。
1.3 图像处理及分析将采集数据传至GE AW 4.6后处理工作站,利用Funtools工作站中的MADC及DKI软件获取真实扩散系数(D)、灌注相关扩散系数(D*)、灌注分数(f)及平均扩散率(MD)、平均扩散峰度(MK)的伪彩图(图 1a~1e)。在IVIM灰度图(b=1 000 s/mm2)及DKI灰度图(b=1 000 s/mm2)上选取病灶实性成分最大的3个层面,避开出血、坏死、囊变等区域,勾画3个ROI(50~150 mm2),将ROI复制到D、D*、f、MD和MK伪彩图上。
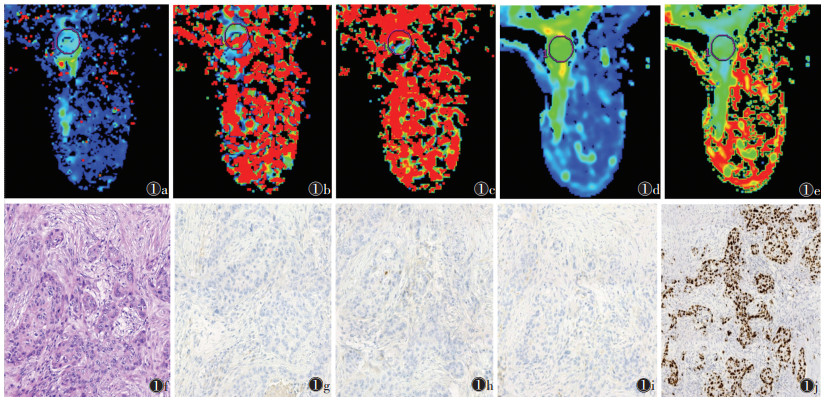 |
| 注:患者,女,46岁,右乳浸润性导管癌Ⅲ级,三阴型。图 1a~1e为真实扩散系数(D)、灌注相关扩散系数(D*)、灌注分数(f)、平均扩散峰度(MK)和平均扩散率(MD)值伪彩图,D=0.82×10-3 mm2/s,D*=59.4×10-3 mm2/s,f=60.7%,MD=2.03×10-3 mm2/s,MK=0.754;图 1f示病理诊断为浸润性导管癌(HE染色,高倍放大);图 1g~1i示ER、PR、HER-2阴性;图 1j示Ki-67为低表达 图 1 乳腺癌的扩散峰度成像(DKI)及体素内不相干运动(IVIM)参数图及病理图片 |
1.4 分子分型
根据雌激素受体(ER)、孕激素受体(PR)、人类表皮生长因子受体2(HER-2)及细胞核增殖指数(Ki-67)的表达情况,将乳腺癌分为4种亚型,分别为:①Luminal A型,ER(+)和/或PR(+),HER-2(-),Ki-67低表达(< 14%);②Luminal B型,ER(+)和/或PR(+),HER-2(+),Ki-67高表达(≥14%);③HER-2阳性型,ER和PR(-),HER-2(+),Ki-67任意表达;④三阴性型,ER、PR和HER-2(-),Ki-67任意表达[7](图 1f~1j)。
1.5 统计学方法采用SPSS 20.0和MedCalc 19.5.1软件对数据进行分析。计量资料的正态分布分析运用Kolmoforov-Smirnov Z检验,并运用Levene检验分析方差齐性,符合正态分布以x±s表示,不符合则以M(QL,QU)表示。IVIM成像及DKI参数在不同分子分型之间的比较采用单因素方差分析和Kruskal-Wallis H检验,两两比较采用LSD-t及Mann-Whitney U检验。通过绘制ROC曲线,计算AUC并获取敏感度、特异度及准确率,AUC的比较采用DeLong检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 不同分子分型乳腺癌的DKI及IVIM参数比较(表 1)| 表 1 不同分子分型乳腺癌IVIM成像及DKI定量参数的差异性分析 |
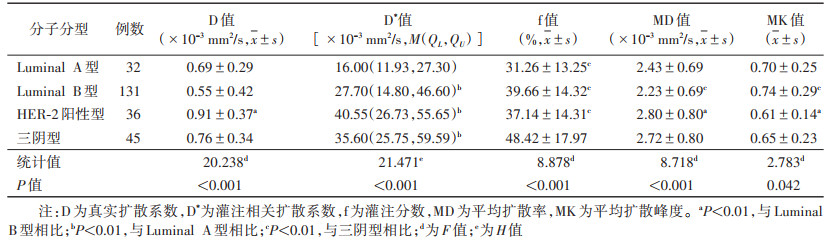 |
244例中,Luminal A型32例,Luminal B型131例,HER-2阳性型36例,三阴型45例(图 1)。将不同分子分型乳腺癌的DKI及IVIM参数行两两比较,Luminal A型的D*值均小于其他分子分型(均P < 0.01);三阴型的f值均高于其他分子分型(均P < 0.01);Luminal B型的D值小于HER-2阳性型(P=0.006);Luminal B型的MD值均小于HER-2阳性型及三阴型,而MK值均大于HER-2阳性型及三阴型(均P < 0.05)。
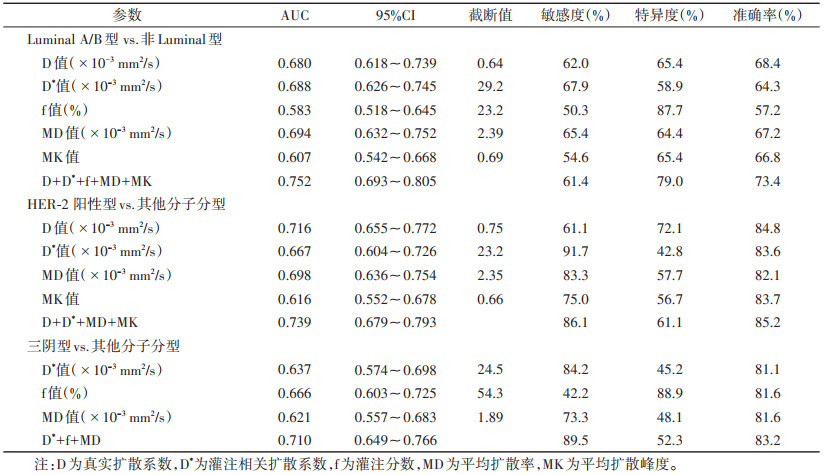
2.2 不同分子分型乳腺癌DKI及IVIM参数的诊断效能(表 2,图 2)| 表 2 IVIM成像及DKI定量参数对乳腺癌不同分子分型的鉴别诊断效能 |
 |
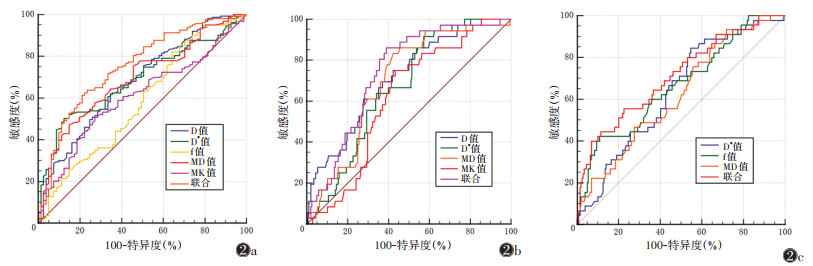 |
| 注:图 2a~2c分别为鉴别Luminal与非Luminal、HER-2阳性型与其他分子分型、三阴型与非三阴型乳腺癌的ROC曲线。D为真实扩散系数,D*为灌注相关扩散系数,f为灌注分数,MD为平均扩散率,MK为平均扩散峰度,IVIM为体素内不相干运动,DKI为扩散峰度成像 图 2 IVIM与DKI定量参数鉴别乳腺癌不同分型的ROC曲线 |
当D≤0.64×10-3 mm2/s、D*≤29.2×10-3 mm2/s、f≤23.2%、MD≤2.39×10-3 mm2/s、MK≥0.69时,对鉴别Luminal A/B型与非Luminal型有价值,其中IVIM成像的D*值及DKI成像的MD值AUC较大;联合D、D*、f、MD、MK值,AUC为0.752,诊断效能高于单一参数(Z=1.845~4.144,P=0.001~0.045)。当D≥0.75×10-3 mm2/s、D*≥23.2×10-3 mm2/s、MD≥2.35×10-3 mm2/s、MK≥0.66时,对鉴别HER-2阳性型与非HER-2型有价值,其中IVIM成像的D值及DKI成像的MD值的AUC较大;联合D、D*、MD、MK值,AUC为0.739,诊断效能高于MK值(Z=2.412,P=0.016),与其他参数差异均无统计学意义(均P > 0.05),但敏感度与准确率均高于单一参数。当D*≥24.5×10-3 mm2/s、f≥54.3%、MD≥1.89×10-3 mm2/s时,对鉴别三阴型与非三阴型有价值,联合后AUC为0.710,诊断效能高于MD值(Z=2.459,P=0.014),敏感度与准确率均高于单一参数,但与其他参数差异均无统计学意义(均P > 0.05)。
3 讨论不同分子分型乳腺癌的ER、PR、HER-2及Ki-67表达状态不同;ER/PR阳性表达可促进肿瘤细胞增殖,还可通过抑制血管内皮生长因子水平,减少肿瘤微血供,明显增加细胞外水分子受限程度[8]。HER-2可诱导生成血管内皮生长因子,促进肿瘤内新生大量微血管,同时还可促进细胞分裂,抑制细胞凋亡[9-10]。Ki-67是反映肿瘤细胞增殖程度的常用量化指标[11]。术前运用影像定量技术预测乳腺癌分子分型,可为临床治疗方案的制订提供参考。IVIM成像和DKI不仅能提供肿瘤的形态信息,还可通过定量参数提供肿瘤的功能信息。IVIM成像中D值反映的是组织内真实弥散系数,D*反映组织内微灌注,与平均血流速度和毛细血管段长度成正比,f值反映血管密度[12]。乳腺肿瘤内组织成分越复杂,非高斯运动的程度越显著,DKI的MK值越高,MD值越低[13]。IVIM成像与DKI均无需注射对比剂,在保证患者安全的前提下,为定量预测乳腺癌分子分型提供了新思路。
本研究发现,Luminal A型的D*值小于其他分子分型,病理基础为ER/PR阳性,HER-2阴性可明显减少肿瘤微血供,与Du等[14]的研究结果一致。Luminal A/B型乳腺癌D、D*、f及MD值小于非Luminal型,而MK值大于非Luminal型;Luminal阳性患者肿瘤细胞因ER/PR阳性而降低了肿瘤的微血供,同时促进肿瘤的增殖程度,使细胞排列紧密,细胞外水分子真实扩散受限明显;而非Luminal型(HER-2型及三阴型)肿瘤微灌注量及毛细血管容积较Luminal A/B型高,反而降低了细胞外水分子扩散受限程度,与Wang等[15-16]研究结果相似。此外,本研究IVIM成像的D*值及DKI的MD值鉴别Luminal A/B型与非Luminal型诊断效能最高;病理基础为肿瘤的高灌注使细胞外周围间隙扩大,在一定程度上降低了D及MK值的诊断效能。
本研究中,HER-2阳性乳腺癌的D、D*及MD值高于HER-2阴性组,而MK值小于HER-2阴性组;病理基础为HER-2阳性乳腺癌存在ER、PR的阴性表达及HER-2的阳性表达,使瘤内微灌注增高,肿瘤细胞致密性减低,从而扩大了细胞外周围间隙,使水分子扩散受限程度减低,与Yang等[17]的研究结果相似。此外,本研究IVIM成像的D值及DKI的MD值对鉴别HER-2与非HER-2型乳腺癌最有价值;原因可能是HER-2阴性组中包含了三阴型乳腺癌患者,而这部分患者因其微血供极为丰富,提高了水分子的高斯运动比重,非高斯运动相应减少,使MK值相对减小[18-20],上述2种病理基础导致HER-2阳性组与阴性组间总体微灌注及肿瘤内水分子非高斯运动效应相差不显著,诊断效能较D、MD值低。
本研究还发现,D*、f及MD值对三阴型与非三阴型乳腺癌有鉴别价值。三阴型乳腺癌的ER/PR阴性表达可降低肿瘤细胞异质性及密实性,同时增加肿瘤微血供,使细胞外周围间隙扩大;此外,瘤内较多的坏死成分亦可使水分子真实扩散受限程度减轻[21];由于非三阴性中HER-2乳腺癌的存在,使D及MK值对三阴性与非三阴性乳腺癌的诊断价值有限,后续可增加样本进一步探究。
本研究有一定局限性:①样本量较小,缺少验证集对2种序列诊断效能进行验证,后续将增加验证集;②ROI为手动勾画,具有主观性,对IVIM成像、DKI各定量参数ROI的选定与病理组织取材层面存在一定差异;③IVIM成像与DKI所选b值的数量及大小尚无统一标准。
综上所述,IVIM成像与DKI可定量评估乳腺癌分子分型的表达状态,两者联合可作为常规MRI的补充,有助于乳腺癌分子分型的术前判断及预后预测。
| [1] |
TORRE L A, SIEGEL R L, WARD E M, et al. Global cancer incidence and mortality rates and trends--an up-date[J]. Cancer Epidemiol Biomarkers Prev, 2016, 25(1): 16-27. DOI:10.1158/1055-9965.EPI-15-0578 |
| [2] |
赵毅, 邓鑫. 乳腺癌分子分型与治疗策略[J]. 中国实用外科杂志, 2015, 35(7): 704-708. |
| [3] |
安婷婷, 靳先文, 王大伟, 等. 磁共振体素内不相干运动成像在乳腺癌分级中的应用[J]. 医学影像学杂志, 2017, 27(3): 479-483. |
| [4] |
李昌帅, 梁园园, 张亚平, 等. DKI对动态增强时间-信号曲线呈平台型乳腺纤维腺瘤及乳腺癌的诊断价值[J]. 医学影像学杂志, 2021, 31(3): 439-444. |
| [5] |
YANG Z L, LI Y, ZHAN C A, et al. Evaluation of suspicious breast lesions with diffusion kurtosis MR imaging and connection with prognostic factors[J]. Eur J Radiol, 2021, 145(1): 110014. |
| [6] |
汪林, 陈向荣, 许淑惠, 等. IVIM定量分析在不同分子分型乳腺癌鉴别诊断中的效果分析[J]. 影像科学与光化学, 2020, 38(2): 368-375. |
| [7] |
李婷, 鲁伦博, 卓瑶瑶, 等. 扩散峰度成像与扩散加权成像对乳腺癌诊断价值的对比研究[J]. 中华放射学杂志, 2018, 52(3): 177-182. |
| [8] |
SUO S, ZHANG D, CHENG F, et al. Added value of mean and entropy of apparent diffusion coefficient values for evaluating histologic phenotypes of invasive ductal breast cancer with MR imaging[J]. Eur Radiol, 2019, 29(3): 1425-1434. DOI:10.1007/s00330-018-5667-9 |
| [9] |
SLAMON D, EIERMANN W, ROBERT N, et al. Adjuvant trastuzumab in HER2-positive breast cancer[J]. N Engl J Med, 2011, 365(14): 1273-1283. DOI:10.1056/NEJMoa0910383 |
| [10] |
马烨, 李锋, 张双, 等. 动态增强磁共振成像在乳腺癌诊断中的临床价值及联合Her-2和Ki-67检测对其预后评估的价值研究[J]. 中国医学装备, 2022, 19(3): 71-75. |
| [11] |
王铭, 田为中, 张继, 等. 基于TIRM序列的游程矩阵纹理特征联合ADC值预测乳腺癌Ki-67表达水平[J]. 放射学实践, 2021, 36(12): 1520-1525. |
| [12] |
ZHAO M, FU K, ZHANG L, et al. Intravoxel incoherent motion magnetic resonance imaging for breast cancer: a comparison with benign lesions and evaluation of hetero-geneity in different tumor regions with prognostic factors and molecular classification[J]. Oncol Lett, 2018, 16(4): 5100-5112. |
| [13] |
周洋, 徐鹏举. 扩散峰度成像(DKI)在体部应用的研究进展[J]. 复旦学报(医学版), 2018, 45(6): 911-915, 920. DOI:10.3969/j.issn.1672-8467.2018.06.027 |
| [14] |
DU S Y, GAO S, ZHANG L N, et al. Improved discrimination of molecular subtypes in invasive breast cancer: comparison of multiple quantitative parameters from breast MRI[J]. Magn Reson Imaging, 2021, 77(20): 148-158. |
| [15] |
WANG W, ZHANG X, ZHU L, et al. Prediction of prognostic factors and genotypes in patients with breast cancer using multiple mathematical models of MR diffusion imaging[J]. Front Oncol, 2022, 12(1): 825264. |
| [16] |
MENG N, WANG X, SUN J, et al. A comparative study of the value of amide proton transfer-weighted imaging and diffusion kurtosis imaging in the diagnosis and evaluation of breast cancer[J]. Eur Radiol, 2021, 31(3): 1707-1717. DOI:10.1007/s00330-020-07169-x |
| [17] |
YANG Z L, LI Y, ZHAN C A, et al. Evaluation of suspicious breast lesions with diffusion kurtosis MR imaging and connection with prognostic factors[J]. Eur J Radiol, 2021, 145(1): 110014. |
| [18] |
王婷, 李文武. 体素内不相干运动联合扩散峰度成像对乳腺癌HER-2表达的判断价值[J]. 医学影像学杂志, 2022, 32(1): 46-50. |
| [19] |
吴杰, 敬宗林, 黄小华, 等. MRI动态增强扫描联合扩散峰度成像对乳腺良恶性病变的鉴别诊断价值[J]. 中国中西医结合影像学杂志, 2020, 18(4): 378-382. |
| [20] |
黄海华, 何启强, 黄和平. 乳腺癌磁共振征象与肿瘤免疫组化表达的相关性分析[J]. 医学影像学杂志, 2023, 33(6): 1020-1023. |
| [21] |
WANG W, LV S, XUN J, et al. Comparison of diffusion kurtosis imaging and dynamic contrast enhanced MRI in prediction of prognostic factors and molecular subtypes in patients with breast cancer[J]. Eur J Radiol, 2022, 154(1): 110392. |
 2024, Vol. 22
2024, Vol. 22


