| 兔脑微出血的SWI、MRI常规序列表现及与病理的对照研究 |
脑微出血于1994年被Offenbacher等[1]首先发现,并定义为在T2WI图像上呈点状或圆形的均匀低信号区,直径2~5 mm,边缘无水肿。多发的脑微出血被认为是一种具有出血倾向的脑微血管病变标志。Lee等[2]针对自发性脑出血患者出血量与脑微出血的影像学研究发现,脑叶或壳核出血伴脑微出血患者与不伴微出血病灶的患者比较,出血量可增加2~3倍,提示脑微出血是大量脑出血的独立危险因素。
1 材料与方法 1.1 实验设备及药品① Siemens 1.5 T MRI仪及头部线圈;②精密颅骨钻(恒诺医疗器械公司TSDZ-2A);③100 μL锁紧式可换针头微量注射器(上海玻利鸽工贸有限公司);④医用骨蜡(上海强生公司);⑤兔头、针具固定装置(泰兴市三爱思实验仪器厂)。
1.2 实验动物及分组选用12个月龄成年新西兰大白兔40只,体质量2 500~3 100 g,雌雄不限,随机分成对照组(5只)、实验组(35只)。实验组分别于模型制作成功后1 h(超急性期)、48 h(急性期)、15 d(亚急性期)、35 d(慢性期)行MRI常规序列扫描,以及随机性病理取材。
1.3 脑微出血模型制作方法脑微出血模型制作采用自体血注射的方法[3],术前8 h实验动物禁食、禁水、头部备皮,使用10%水合氯醛溶液(剂量3~5 mL/kg体质量)腹腔注射诱导全麻。动物麻醉后腹卧位于手术台上,皮肤消毒正中矢状位切开兔额顶部皮肤1~2 cm,按预实验获得的基底节区穿刺点,取矢状缝向右旁开6 mm,冠状缝向后5~6 mm,与矢状面向外成10°~15°角,垂直冠状面,进针11 mm,注入肝素化的自体血40 μL,留针10~15 min,拔针,骨蜡封闭,消毒缝合。对照组只钻孔、进针,不注血。
1.4 MRI扫描及图像分析SWI参数:TE 40 ms,TR 49 ms,矩阵256×256,FOV 18 cm×18 cm,层厚2 mm,无间隔;T1WI(FSE)序列:TE 8 ms,TR 1 750 ms,矩阵320×224,FOV 16 cm×16 cm;T2采用propller序列:TE 98 ms,TR 6 300 ms,矩阵320×320,FOV 16 cm×16 cm。扫描后图像传入ADW4.4工作站观察记录各序列信号特点及测量各序列微出血灶体积值。血肿体积=各层血肿面积(层厚+层距)×1/2。
1.5 病理取材方法实验组按预定时间点完成MRI规定序列扫描后,随机选取1只,气体栓塞法处死实验动物;用甲醛溶液灌注取脑,固定72~96 h;固定好的兔脑先以2~3 mm层厚均匀冠状面切开,选取含出血灶的切片行脱水、石蜡包埋、切片、测量体积、HE染色及镜下观察。
1.6 统计学方法采用SPSS 13.0统计软件。血肿体积以x±s表示,各序列间比较行配对t检验,多组计量资料比较用方差分析,检出率采用四格表资料的χ2检验。以P<0.05为差异有统计学意义。
2 结果实验组35只,1只术中麻醉过量死亡,余均存活。术后未发现肢体活动障碍等较严重脑出血并发症。对照组5只MRI各序列术区未见异常信号灶,组织病理未见出血灶。
2.1 影像表现及组织病理表现脑微出血各期T2WI呈类圆形低信号灶(图 1a);T1WI呈等或略低信号(图 1b);SWI绝大多数表现为境界清楚的类圆形低信号(图 1c),少有中心呈等信号周围环绕低信号;相位图各期均呈密度均匀或不均匀高信号,周围环绕低信号环(图 1d)。
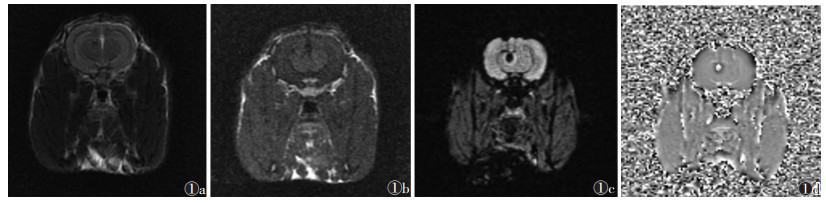 |
| 图 1 超急性期(1 h)兔脑微出血模型 图 1a T2WI示右侧基底节区类圆形低信号灶 图 1b T1WI未见异常信号 图 1c SWI呈均匀低信号,周围环绕高信号环,较 图 1a 显示病灶大 图 1d 相位图呈均匀高信号,周围环绕低信号环 |
组织病理:超急性期微出血灶边界清楚,红细胞形态饱满,核浆比例适当,周围脑组织形态正常;急性期出血灶红细胞变扁,胞浆减少,边缘可见少量巨噬细胞吞噬红细胞;亚急性期出血灶进一步缩小,红细胞失去正常形态并聚集成团,周围可见较多巨噬细胞聚集,出血灶周围可见含铁血黄素沉积,邻近脑组织内亦可见吞噬了红细胞的巨噬细胞及小胶质细胞;慢性期出血灶区仅剩少量条形及斑片状含铁血黄素沉积,周围脑组织可见多发小胶质细胞聚集。
2.2 SWI与T1WI+T2WI对出血灶检出率比较实验组34只存活兔,SWI序列检出34处微出血灶,检出率100%,T1WI+T2WI序列检出微出血灶24处,检出率70.59%,两者检出率差异有统计学意义(P<0.05)。
2.3 实验组不同时期各序列及石蜡切片测量体积对比(表 1)| 表 1 实验组不同时期各序列及石蜡切片测量平均体积对比(V/mm3,x±s) |
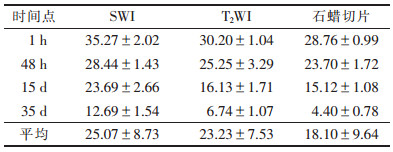 |
造模成功后1 h、48 h、15 d、35 d,SWI、T2WI序列及石蜡切片测量的各出血灶直径均<5 mm,在T2序列未见水肿信号。
各序列间比较采用配对t检验,SWI所示体积与大体病理所测体积及T2WI所示体积间比较差异均有统计学意义(均P<0.05),T2WI所示体积与大体病理所测体积间差异无统计学意义(P>0.05)。
2.4 实验组不同序列影像放大率对比(表 2)| 表 2 实验组不同序列影像放大率对比(x±s) |
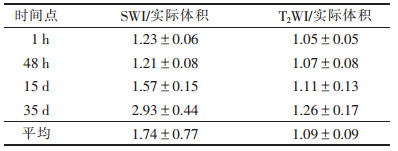 |
T2WI与实际体积比值接近1,不同时间点放大率无差别。SWI序列与实际体积比值随时间延长呈增大趋势,1 h与48 h比较差异无统计学意义,其余时间点组间差异均有统计学意义(均P>0.05)。
3 讨论 3.1 SWI原理及特点SWI是近年来应用于临床的一种新开发的MRI技术,它利用不同组织间磁敏感性的差异产生信号对比,是在T2*加权梯度回波序列(T2*GRE)的基础上发展而来,具有三维、高分辨力、对微小的顺磁性物质敏感等诸多优点[4]。GE公司也在继承T2*GRE序列的基础上发展了一种新的SWI序列,命名为SWAN(T2 star weighted angiography)。
以往将SWI与T2*GRE进行对比的文章较多[5],且结论相似。本实验以病理为金标准,一方面验证SWI对微出血检出的敏感性,另一方面探讨磁敏感放大效应是否存在。
3.2 脑微出血SWI显示体积与实际体积对比对微出血血肿体积的研究少有文献报道,Belayev等[6]在鼠的右侧纹状体注入45 μL自体动脉血制作微出血模型,在4.7 T MRI观察脑微出血随时间变化(0~1 h、6 h、24 h、72 h、7 d)不同序列的体积变化情况,结果显示血肿在不同时间点体积变化较大,24 h时血肿体积最小,与本实验存在差别。本实验显示,血肿体积随时间延长逐渐变小,在35 d时即慢性期体积最小;分析其原因可能为2组实验观察的时间不同,Belayev等的观察时间点主要集中在出血的亚急性早期,此期组织病理显示仅少量巨噬细胞聚集,即这段时间内血肿的自身清除机制尚未发挥主要作用,体积变化以血肿本身的固缩、脱水等占主导作用,而本实验观察时间较长,亚急性后期脑组织的自身血肿清除机制占主导,血肿慢性期组织病理显示可辨认的红细胞已不存在,仅剩巨噬细胞清除红细胞后的少量含铁血黄素沉积,故体积最小。
Belayev等[6]证明,SWI对实际出血灶的显示可放大5倍左右,24 h时放大作用最明显,T2WI测量的出血灶大小与实际大小接近。而本实验结果显示,SWI对实际出血灶存在放大作用,在慢性期放大作用最明显,平均放大2倍以上,而在急性期放大作用不显著;分析其原因,一方面与场强不同有关,场强的增加会使磁敏感性及磁敏感放大作用相应增加,使具有微弱顺磁性物质及更小的出血灶显示出来,与Bian等[7]报道的7 T MRI的SWI序列比3 T的SWI序列敏感,能够发现更多出血灶的结果相一致。另一方面,出血的慢性期病理结果显示,出血灶内仅少量含铁血黄素沉积,含铁血黄素与去氧血红蛋白相比具有更强的顺磁性,会在出血灶周围较大范围内影响磁场的均匀性,所以磁敏感放大作用最显著。
3.3 脑微出血研究的临床意义及研究进展微出血与无症状的脑白质病变、腔隙性脑梗死、微血管腔隙的扩大,均被认为是微血管病变的标志,是亚临床损害。它们均与认知功能障碍、高血压、脑出血、缺血性脑卒中、糖尿病、家族性血管畸形等小血管疾病密切相关[8-11],而这些疾病进展到一定程度均可导致认知功能障碍。
研究[12]证明,溶栓治疗过程中脑叶的微出血使发生出血性转化的概率明显增加,提示淀粉样脑血管病可能是溶栓治疗发生脑出血转归的独立危险因素。Sun等[13]对85例烟雾病患者脑微出血进行前瞻性研究随访2年后发现,与其他区域相比,深部及室周白质的脑微出血与脑室出血具有更高的相关性,推测烟雾病患者深部及室周白质微出血的出现可能预示未来的脑室内出血。
综上所述,SWI对各期微出血灶检出率均较高,是微出血相关疾病的首选检查方法,其对超急性期及急性期的脑微出血磁敏感放大作用较弱,对亚急性期及慢性期的脑微出血存在较强的磁敏感放大作用,结合病理组织学表现考虑与强顺磁性物质含铁血黄素的沉积有关。微出血灶各期的SWI表现相似,均呈低信号,相位图均呈高信号,仅依靠SWI无法对微出血灶进行分期诊断。
| [1] |
Offenbacher H, Fazekas F, Schmidt R, et al. MR of cerebral abnormalities concomitant with primary intracerebral hematomas[J]. AJNR Am J Neuroradiol, 1996, 17: 573-578. |
| [2] |
Lee SH, Kim BJ, Roh JK. Silent microbleeds are associated with volume of primary intracerebral hemorrhage[J]. Neurology, 2006, 66: 430-432. DOI:10.1212/01.wnl.0000196471.04165.2b |
| [3] |
Barth A, Guzman R, Andres RH, et al. Experimental intracerebral hematoma in the rat[J]. Restor Neurol Neurosci, 2007, 25: 1-7. |
| [4] |
Haacke EM, Mittal S, Wu Z, et al. Susceptibility-weighted imaging:technical aspects and clinical applications, part 1[J]. AJNR Am J Neuroradiol, 2009, 30: 19-30. |
| [5] |
Cheng AL, Batool S, McCreary CR, et al. Susceptibility-weighted imaging is more reliable than T2*-weighted gradient-recalled echo MRI for detecting microbleeds[J]. Stroke, 2013, 44: 2782-2786. DOI:10.1161/STROKEAHA.113.002267 |
| [6] |
Belayev L, Obenaus A, Zhao W, et al. Experimental intracerebral hematoma in the rat:characterization by sequential magnetic resonance imaging, behavior, and histopathology. Effect of albumin therapy[J]. Brain Res, 2007, 1157: 146-155. DOI:10.1016/j.brainres.2007.04.077 |
| [7] |
Bian W, Hess CP, Chang SM, et al. Susceptibility-weighted MR imaging of radiation therapy-induced cerebral microbleeds in patients with glioma:a comparison between 3 T and 7 T[J]. Neuroradiology, 2014, 56: 91-96. |
| [8] |
Huijts M, Duits A, van Oostenbrugge RJ, et al. Accumulation of MRI markers of cerebral small vessel disease is associated with decreased cognitive function. A study in first-ever lacunar stroke and hypertensive patients[J]. Front Aging Neurosci, 2013, 5: 72. |
| [9] |
Gasecki D, Kwarciany M, Nyka W, et al. Hypertension, brain damage and cognitive decline[J]. Curr Hypertens Rep, 2013, 15: 547-558. DOI:10.1007/s11906-013-0398-4 |
| [10] |
Potigumjon A, Watcharakorn A, Dharmasaroja PA. Prevalence of cerebral microbleeds in Thai patients with ischemic stroke[J]. J Neurosci Rural Pract, 2017, 8: 216-220. DOI:10.4103/0976-3147.203836 |
| [11] |
Zou X, Hart BL, Mabray M, et al. Automated algorithm for counting microbleeds in patients with familial cerebral cavernous alformations[J]. Neuroradiology, 2017, 59: 685-690. DOI:10.1007/s00234-017-1845-8 |
| [12] |
Kakar P, Charidimou A, Werring DJ. Cerebral microbleeds:a new dilemma in stroke medicine[J]. JRSM Cardiovasc Dis, 2012, 1: 1-13. |
| [13] |
Sun W, Yuan C, Liu W, et al. Asymptomatic cerebral microbleeds in adult patients with moyamoya disease:a prospective cohort study with 2 years of follow-up[J]. Cerebrovasc Dis, 2013, 35: 469-475. DOI:10.1159/000350203 |
 2018, Vol. 16
2018, Vol. 16


