2. 青岛水务环境公司,山东 青岛 266021;
3. 山东省海洋环境地质工程重点实验室,山东 青岛 266100
人工湿地(CW)作为一种投资和运行费用低、管理简便的污水处理工艺,已广泛应用于多种污水的处理[1]。其中,传统垂直流人工湿地(VFCW)占地面积较小,运行过程中整个湿地床体处于水不饱和状态,供氧能力较强,因而具有较好的有机物和氨氮去除能力[2-4];但由于缺少适宜的缺氧条件,反硝化能力较差,对TN的去除能力受到限制[5]。针对这一问题,改善湿地内溶解氧的分布状况,实现在同一湿地内形成硝化和反硝化过程所需的环境,成为提高垂直流人工湿地脱氮效率的有效途径[6]。
研究表明,在垂直流人工湿地底部设置部分水饱和区,能够在湿地上部非饱和区形成好氧环境,而下部饱和区处于厌氧或缺氧状态,为完成连续的硝化-反硝化过程提供适宜的条件,提高了TN的去除效率[7-8]。因此,通过调节垂直流人工湿地的饱和水位,可以控制湿地内好氧区和厌氧区的分布,进而提高脱氮效果。目前,针对垂直流人工湿地中水位对净化效果影响的研究还较少。垂直流人工湿地主要通过基质、微生物和湿地植物的协同作用,实现对污水中污染物的去除[4],各类氮转化微生物在湿地脱氮过程中起着至关重要的作用,微生物特征是评价人工湿地功能的重要指标[9]。湿地植物作为人工湿地的重要组成部分,能够通过对氮磷的直接吸收和改善微生物环境等作用,提高污染物的净化效果[10],所以,研究湿地内植物和微生物的特征和功能对深入理解人工湿地的净化机理具有重要意义。本研究采用4个不同水位的垂直流人工湿地,在连续进水的运行模式下,对比分析了水位对氮、磷和有机物去除效果的影响,研究了湿地中植物的生长特征和植物对氮磷的去除贡献,阐析了表层基质中脱氮功能菌的演变规律。
1 材料与方法 1.1 试验装置本研究在室外构建了4套结构和尺寸相同的垂直流人工湿地系统(见图 1)。湿地主体为内径30 cm、总高度100 cm的聚氯乙烯圆筒,中心设直径50 mm、长105 cm的穿孔通风管直达底部,基质层总高度为84 cm,填料组成由下至上依次为:底部为厚15 cm、粒径50~100 mm的砾石排水层;中层依次为厚33 cm的砾石层(粒径5~20 mm)和32 cm的炉渣层(粒径2~10 mm);表层为厚4 cm的土壤。进水通过蠕动泵和布水装置均匀的自上而下流经床体,出水由与底部出水口相连的软管排出,根据虹吸原理,通过调节出水软管高度来控制湿地内的饱和水位。3个湿地(CW1,CW2和CW3)栽种黄花鸢尾,水位分别控制在19、51和84 cm,另一个湿地(CW4)作为对照,不栽种植物,运行水位为51 cm。
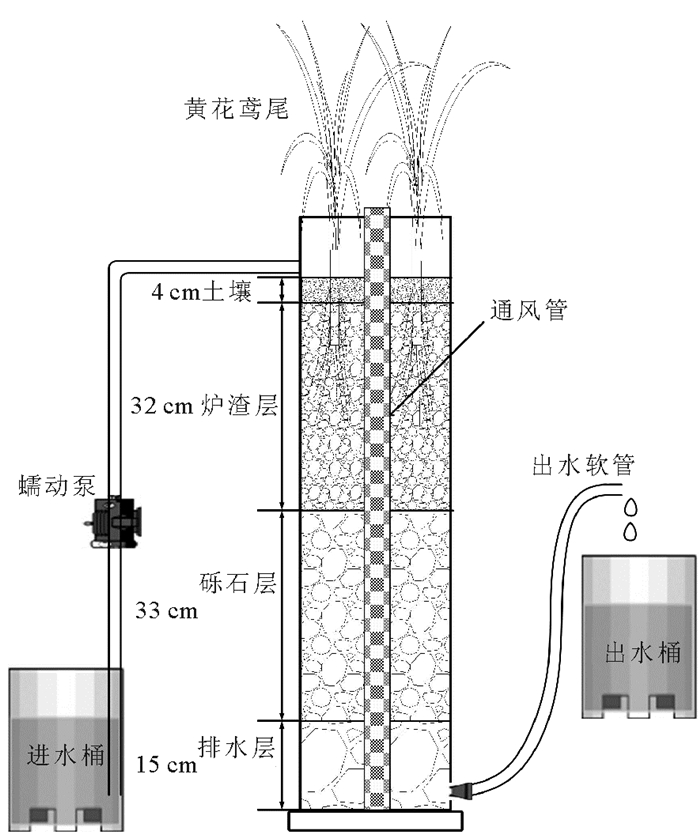
|
图 1 垂直流人工湿地试验装置示意图 Fig. 1 Schematic diagram of a VFCW system |
4个人工湿地系统于2015年4月启动,采用连续进水的运行方式,共运行103 d。试验进水为人工配制的模拟污水,通过将C12H22O11、NH4Cl、NaNO3和K2HPO4溶解到自来水中配制而成。试验期间水力负荷保持不变,为0.35 m/d;进水温度随季节变化范围为16.5~26.1 ℃,进水溶解氧维持在0.8~1.1 mg/L。试验分为P1和P2两个阶段,两阶段进水COD、TP和TN浓度相同,平均为230、3.2和31.7 mg/L;但两阶段进水氨氮(NH4+-N)和硝酸盐氮(NO3--N)浓度不同,P1阶段(0~68 d)进水NH4+-N和NO3--N平均浓度为20.1和11.5 mg/L,P2阶段(69~103 d)为10.7和21.0 mg/L。
1.3 样品采集与分析 1.3.1 水质测定和分析试验期间每隔3 d采集进水和出水样品,现场测定溶解氧(DO)、氧化还原电位(ORP)、温度和pH,并测定COD、NH4+-N、NO3--N、NO2--N和TP的浓度,方法参照《水和废水监测分析方法》[11],TN浓度由NH4+-N、NO3--N和NO2--N浓度相加求得。采用SPSS 20.0统计软件进行单因素方差(one-way ANOVA)分析,当p<0.05时视为存在显著性差异。
1.3.2 表层基质样品采集及功能菌数量测定湿地运行前,取原始土壤样品,湿地运行33、66和103 d时取4个湿地的表层土壤(表面以下0~4 cm)样品,测定功能菌的数量,包括亚硝化细菌、硝化细菌和反硝化细菌。功能菌数量的测定采用最大可能数法(MPN)[12],结果以n(MPN)/g(以干土计)表示,测定方法参照《土壤微生物分析方法手册》[13]。
1.3.3 植物样品采集与测定湿地CW1,CW2和CW3中各栽种2株生物量和长势基本一致的黄花鸢尾,移栽前植物的培养条件与湿地中一致,移栽时剪除所有叶片,并测定初始生物量和氮磷含量。试验期间,定期记录植物株高、叶宽和分支数等生长特征,在各阶段试验结束时取出所有植物组织(包括叶片和根茎),并移栽新的植物。将收获的植物洗净,吸干水分后分为叶片(地上)和根茎(地下)两部分,分别测定鲜重;然后将所有植物样品在75℃下烘干至恒重,测定生物量,计算含水率。烘干后的样品经研钵粉碎并过60目(0.25 mm)筛后,准确称取0.15 g测定TN和TP含量,方法参考《现代植物生理学实验指南》[14]。
2 结果与讨论 2.1 不同条件下湿地系统的净化效果由图 2可以看出,不同水位湿地对有机物和氮的去除效果存在显著差异(p<0.05);在P2阶段气温较高,有利于微生物保持较高的活性,污染物净化效果优于P1阶段。整个试验期间,4个湿地的TP去除率均高于60.1%,且不存在明显差异(p>0.05),主要是因为试验采用的炉渣填料对磷具有良好的吸附能力,有研究表明填料对磷的吸附是影响湿地磷去除效率的主要因素[15]。
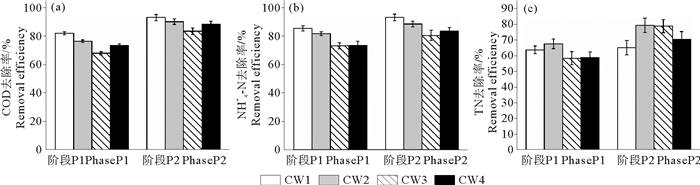
|
图 2 人工湿地系统污染物去除效果 Fig. 2 Pollutant removal efficiencies of the VFCW systems |
NH4+-N先通过微生物硝化作用转化为NO3--N,后经反硝化过程从湿地内彻底去除,这是垂直流人工湿地实现脱氮的主要途径。湿地系统运行期间,出水温度(P1阶段16.9~25.5 ℃,P2阶段23.2~26.9 ℃)和pH(7.20~7.24)范围均适合微生物的硝化和反硝化作用[16-17]。方差分析显示,不同水位湿地对NH4+-N和NO3--N的去除效果存在显著性差异(p<0.05),如图 2(b)所示,低水位(19 cm)运行的湿地CW1具有较高的NH4+-N去除效果,在P2阶段的NH4+-N去除率能达到93.0%,主要是因为较大的非饱和区有利于促进大气复氧作用,能够提供有利于硝化作用的好氧条件(出水DO浓度1.6~3.4 mg/L);但由图 2(c)可知,TN去除率最高的不是CW1,这是由于CW1内较高的DO限制了反硝化效果,造成硝酸盐氮的积累,NO3--N去除率较低(24.0%~50.6%)。51 cm水位运行的湿地(CW2),出水DO(1.0~1.8 mg/L)和ORP(-100.8~33.6 mV)较低,表明随着水位升高能够在下层饱和区形成缺氧环境[18],床体内沿水流方向出现好氧-缺氧交替的现象,为硝化-反硝化过程提供了良好的条件,使CW2不仅具有较高的NH4+-N转化效率(81.6%~88.4%),其NO3--N去除率也能达到42.0%~74.6%,从而具有最好的TN去除效果(67.4%~79.2%),高于Pelissari等人研究中部分饱和垂直流人工湿地的TN去除率(58%±12%)[7]。完全饱和湿地(CW3)在P2阶段具有较高的TN去除率,主要是因为在高进水NO3--N浓度(21.0 mg/L)条件下,适宜的厌氧条件有利于反硝化过程的充分进行。综上所述,通过调节饱和水位,能够有效控制基质中好氧区和厌氧区的分布,促进微生物的硝化和反硝化作用,提高垂直流人工湿地的脱氮效果。
2.1.2 湿地中有机物的去除效果人工湿地中有机物的去除主要依靠好氧异养微生物的降解作用来完成[18]。方差分析显示,COD去除率随着水位的升高显著降低(p<0.05)。由图 2(a)可知,部分饱和湿地系统(CW1、CW2和CW4)COD去除率能达到73.1%~92.9%,明显高于完全饱和系统(CW3)的67.8%~83.3%,这是由于基质中DO含量的降低会抑制好氧微生物的活性,不利于有机物的去除。本研究中的部分饱和湿地系统具有较好的有机物净化效果,与其他研究的单级部分饱和垂直流人工湿地[6, 19]的去除效果相当甚至更高。
2.2 植物的生长特征及对氮磷去除的贡献 2.2.1 湿地植物生长特征黄花鸢尾在移栽前去除所有叶片,移栽后3~6 d萌发新芽,整个试验过程中长势良好,无病变枯萎现象,各阶段最大叶宽和株高增长率如表 1所示。不同湿地中植物的生长特征没有显著差异(p>0.05),说明水位对黄花鸢尾的生长没有明显影响,植物均能正常发挥作用。P1阶段的最大株高和叶宽增长率明显低于P2阶段,地上部分的生物量增长率在P2阶段有明显升高(见表 1),这是因为P2阶段气温较高(21~31 ℃),能促进植物的快速生长。植物地下部分的生物量在P1阶段略有增加或减少,在P2阶段明显减少,这可以归因于黄花鸢尾的生长习性,移栽后新萌发叶片的快速生长会消耗球根中的养分,不利于地下组织的生长发育,P2阶段地上部分生长更快,会加速消耗球根中储存的养分。综上所述,黄花鸢尾在3种水位湿地中均生长良好,具有较高的生长率,能正常发挥湿地植物的功能。
|
|
表 1 湿地中植物最大株高、叶宽及净生物量的增长率 Table 1 The growth rate of the maximum plant height and leaf width and the net biomass production of plants in VFCWs |
各阶段试验结束时测定植物地上和地下组织中TN和TP含量(见图 3)。植物地上和地下组织中TN和TP含量在不同水位湿地间无显著差异(p>0.05),地上组织TN和TP含量(19.8~22.8和1.5~1.8 mg/g)均明显高于地下组织(6.0~6.8和0.5~0.7 mg/g),说明植物吸收的N、P向地上部分迁移的较多,可能是因为植物被移栽到湿地前所有叶片被剪除,移栽到湿地后为了供应新叶片快速生长所需的营养,更多的N、P被输送到叶片中,相关研究也表明植物新生叶片具有较高的TN和TP含量[20]。P1阶段植物的TN含量略高于P2阶段,可能是因为P1阶段植物生长周期较长(68 d),会吸收较多的营养盐来实现组织细胞的分裂[21]。由于植物生长对磷的需求小于氮,所以植物组织中TP含量要远小于TN。TP含量在两阶段中无明显差异。
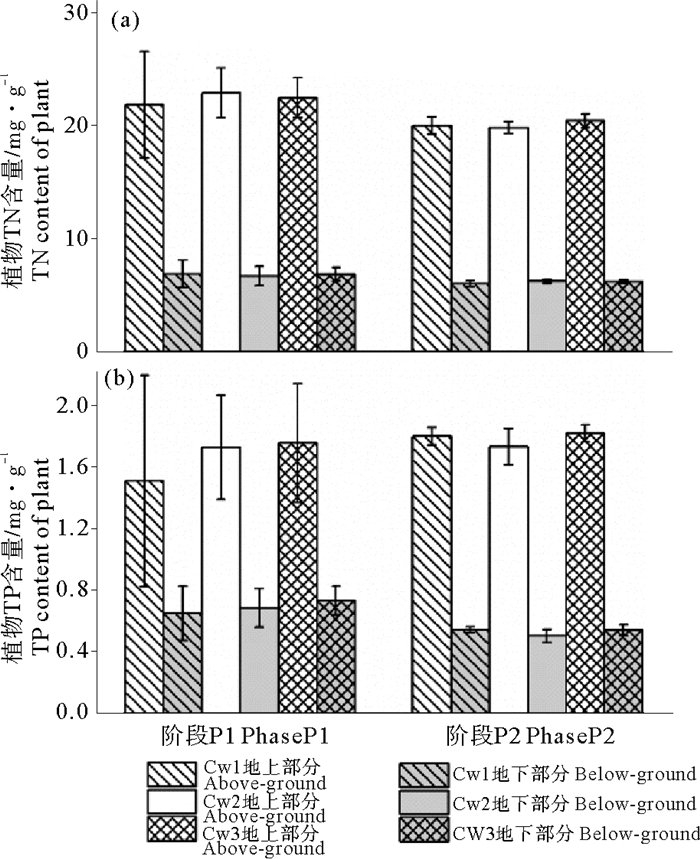
|
图 3 湿地植物组织TN和TP含量 Fig. 3 TN and TP content of plant in the VFCWs |
相同水位条件下,栽种植物的湿地(CW2)对TN和TP的去除效果显著优于无植物的湿地(CW4)。如图 2(b)和(c)所示,湿地CW2对NH4+-N、NO3--N和TN的去除效果较CW4分别高出5.9%、10.0%和8.9%,主要可以归因于以下四个方面:(1)植物能直接吸收基质中的氮,提高脱氮效果;(2)植物通过根系泌氧能够改善根际好氧微环境,有利于微生物对NH4+-N的转化;(3)植物根系能够分泌有机物和微量生长素,提高了湿地内的微生物活性,同时分泌物还可以作为碳源促进反硝化作用[22];(4)植物根系具有为微生物生长提供附着界面,改善基质水力传导性能等作用[23]。栽种植物单元(CW2)的TP去除率为62.5%~65.1%,略高于无植物单元(CW4)的61.6%~63.8%,主要是因为植物对磷的直接吸收。
植物作为人工湿地的重要组成部分,对提高湿地脱氮除磷能力具有重要作用[21],其主要作用方式为对氮磷的直接吸收。通常采用植物TN和TP吸收量来衡量植物的吸收作用,植物吸收量等于生物量和组织中N、P含量的乘积,各阶段植物的TN和TP吸收量如图 4所示。
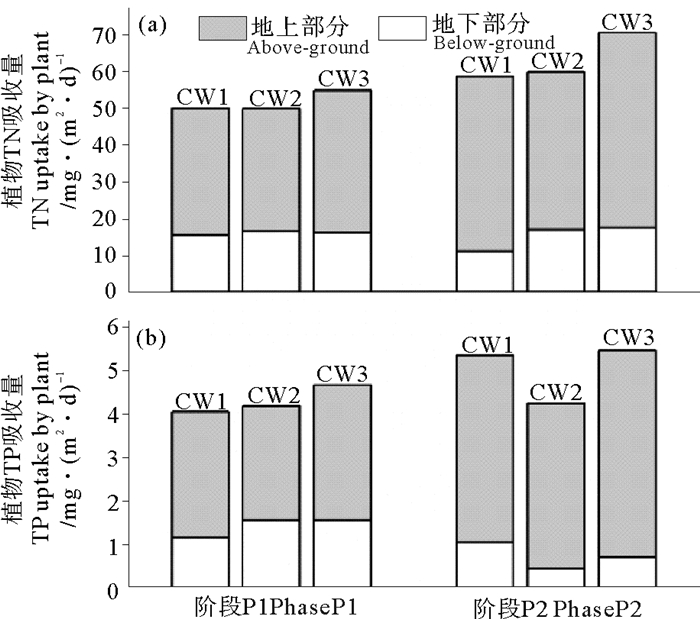
|
图 4 湿地植物TN和TP吸收量 Fig. 4 TN and TP uptake by plant in the VFCWs |
不同水位湿地中植物的TN和TP吸收量不存在显著差异(p>0.05),P2阶段的吸收能力略强于P1阶段,这主要与P2阶段植物的生长量较高有关。由图 4可知,植物地上部分对TN和TP的吸收量分别为33.2~52.9和2.6~4.7 mg/m2·d,远高于地下部分,说明地上部分在植物吸收过程中发挥更重要的作用,这与Zhang等[20]得出的水葱在N、P供应充足情况下,超过60%的TN和TP吸收由地上组织完成的研究结论一致。主要是因为植物组织的吸收能力受生长阶段影响,叶片在生长早期对N、P具有更强的吸收能力[21]本试验中黄花鸢尾在移栽前被剪除所有叶片,栽种后萌发的新叶快速生长,具有更高的生物量和N、P含量,因而吸收能力更强。
植物直接吸收对N、P去除的贡献率一般以植物吸收的TN和TP量占湿地TN和TP去除总量的百分比来表示,各阶段黄花鸢尾吸收对TN和TP去除的贡献率如图 5所示。植物吸收对TN和TP的去除贡献分别为19.2%~27.3%和14.7%~19.2%,这与Liu等[24]和Gao等[10]的研究结果相似。Liu等[24]采用人工曝气垂直流人工湿地研究不同进水COD/N条件下的脱氮效果,得出黄花鸢尾吸收作用对TN去除的贡献率为10.12%~21.93%。Gao等[10]的研究发现,鸢尾对TN和TP的吸收量分别占垂直流人工湿地TN和TP去除总量的19.86%~50.19%和13.19%~22.32%。综上所述,黄花鸢尾具有较好的N、P吸收能力,有利于提高人工湿地的脱氮除磷效果。
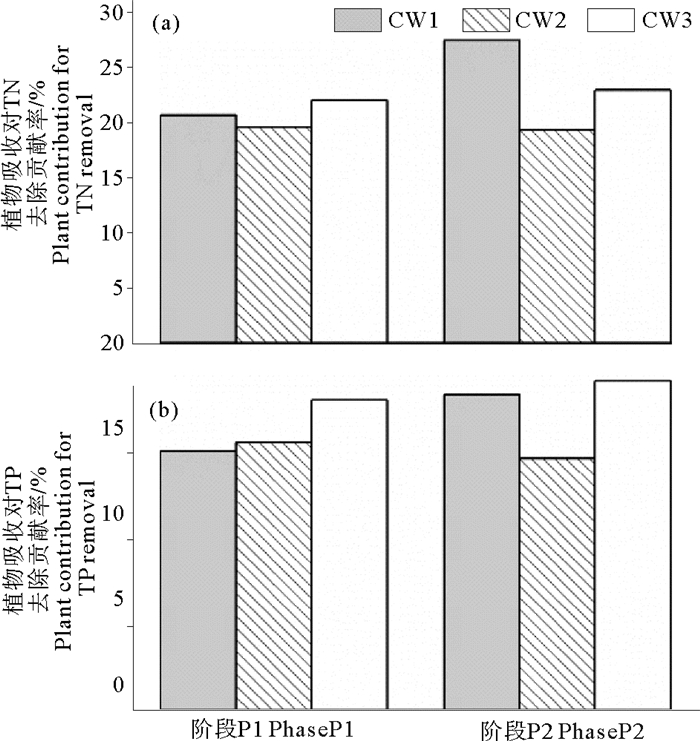
|
图 5 植物吸收对TN和TP去除的贡献率 Fig. 5 Plant contribution ratio for TN and removal in VFCWs |
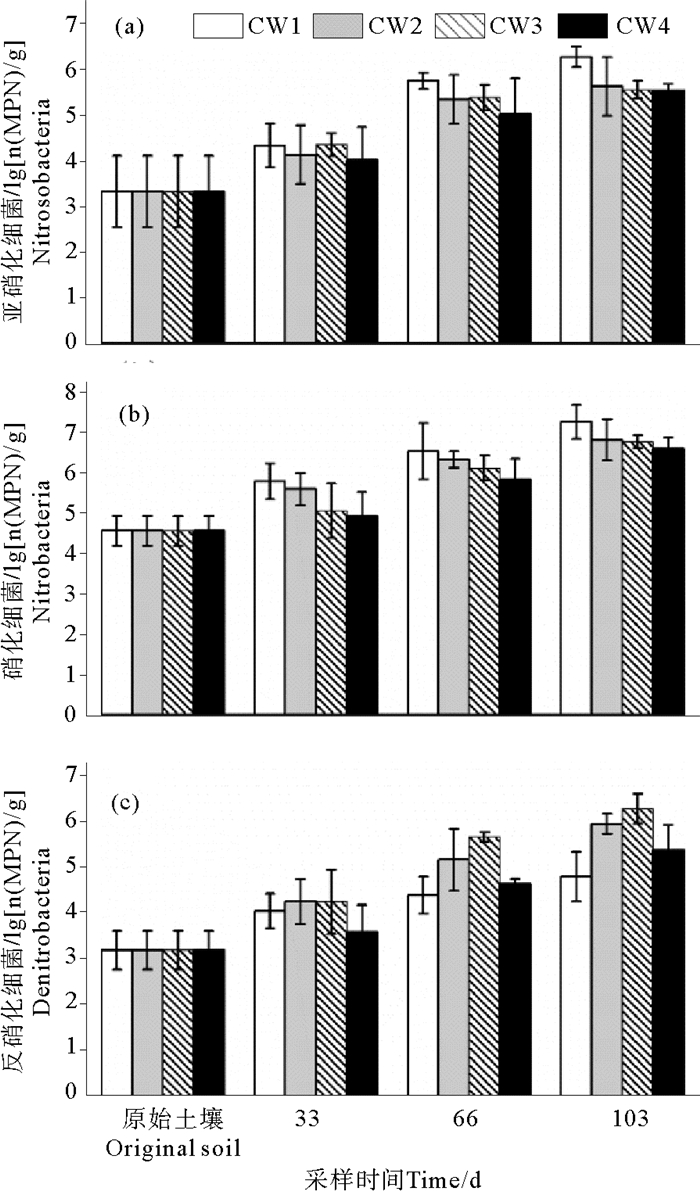
“硝化-反硝化”过程是垂直流人工湿地系统实现脱氮的有效途径,其中硝化过程主要由亚硝化细菌和硝化细菌来完成氨氮到硝酸盐氮的转化,而反硝化过程主要依靠反硝化细菌来实现硝酸盐氮的去除。试验中分别在湿地未运行前取原始土壤样品,湿地运行33、66和103 d时采集4个湿地的表层基质样品,测定亚硝化细菌、硝化细菌和反硝化细菌的数量(MPN/g),其对数变化如图 6所示。
|
图 6 湿地表层基质中脱氮功能菌数量对数图 Fig. 6 Logarithm of the nitrogen transformation microbial densities in the surface layer of VFCWs |
由图 6(a)和(b)可知,试验期间亚硝化细菌和硝化细菌数量分别在104~106和105~107 MPN/g范围内,均比原始土壤高1~3个数量级,且随运行时间整体呈逐渐增长的趋势。主要是因为进水中营养盐充足,促进亚硝化细菌和硝化细菌的生长繁殖,经过驯化培养后其数量显著增长;其次,亚硝化细菌和硝化细菌对温度变化敏感,随着试验的进行,环境温度逐渐升高,有利于其生长繁殖,促进微生物数量的增长。氨氮浓度是影响亚硝化细菌和硝化细菌的主要因素之一[25],P1阶段进水NH4+-N浓度(20.1 mg/L)高于P2阶段(10.7 mg/L),充足的底物有利于亚硝化细菌和硝化细菌的生长繁殖,因而P1阶段微生物数量增长较快。
随水位升高,亚硝化细菌和硝化细菌数量基本呈上升趋势,即CW1>CW2>CW3,这与NH4+-N转化效果随水位变化的趋势相一致(图 2(b))。这是由于水位的升高会影响基质内整体的氧环境,形成的缺氧条件降低了亚硝化细菌和硝化细菌的活性,从而抑制其对NH4+-N的硝化作用。栽种植物的湿地(CW2)内亚硝化细菌和硝化细菌数量明显高于无植物的湿地(CW4),这是因为植物根系是微生物生长的重要载体,为微生物生长提供了附着界面,同时植物根系泌氧作用会在根表面形成根系氧化带,该富氧环境能促进亚硝化细菌和硝化细菌的生长繁殖。
2.3.2 表层基质反硝化细菌数量如图 6(c)所示,反硝化细菌数量随运行时间的变化趋势与亚硝化细菌和硝化细菌类似,均高于原始土壤中微生物数量,且随时间逐渐增长,但其数量(103~106 MPN/g)略低于亚硝化细菌和硝化细菌。值得注意的是在P2阶段,反硝化细菌数量仍保持较大的增长幅度,这是因为P2阶段进水硝酸盐氮浓度较高(21.0 mg/L),有利于反硝化细菌的生长繁殖。不同水位湿地中,反硝化细菌数量的变化趋势与亚硝化细菌和硝化细菌恰好相反,其数量随水位的升高而增加,特别是在完全饱和湿地(CW3)中,厌氧还原条件较好,在湿地运行后期,其反硝化细菌数量明显高于部分饱和湿地系统(CW1, CW2和CW4),与之对应CW3的NO3--N去除率明显高于其他3个湿地,能达到46.3%~78.0%。这证明了水位的变化可以调节基质内整体的氧环境,从而影响脱氮功能菌的生长繁殖,影响湿地系统的脱氮效果。虽然植物根系泌氧会增加根区的溶解氧浓度,但试验中栽种植物的单元(CW2)反硝化细菌数量高于无植物的单元(CW4)。这可能是因为在根系氧化带之外的区域,由于土壤致密,溶解氧分布不均,以及植物的覆盖影响,仍能实现局部缺氧环境,适合反硝化细菌的生存[26],同时植物根系能提供较大的附着界面,分泌的有机物可以提供更充足的碳源,能促进反硝化细菌的生长繁殖。
3 结语研究结果表明,将垂直流人工湿地的饱和水位控制在适当高度,能有效提高脱氮效果,栽种植物的51 cm水位湿地具有较高的TN去除效率,达到67.4%~79.2%;试验中各湿地TP去除率均高于60.1%,不存在显著差异;19和51 cm水位湿地均能达到较好的COD去除效果(73.1%~92.9%)。
黄花鸢尾在3个不同水位湿地中均生长良好,植物吸收对TN和TP的去除贡献分别为19.2%~27.3%和14.7%~19.2%。植物地上部分对氮磷的吸收能力更强,TN和TP含量为19.8~22.8和1.5~1.8 mg/g,TN和TP吸收量为33.2~52.9和2.6~4.7 mg/m2·d,均明显高于地下部分。
本试验期间,湿地表层基质中亚硝化细菌、硝化细菌和反硝化细菌快速生长繁殖,微生物数量随时间的增加显著提高,保证了湿地系统的脱氮效果。亚硝化细菌和硝化细菌数量分别为104~106 和105~107 MPN/g,随湿地内饱和水位的升高而减少;反硝化细菌数量为103~106 MPN/g,随水位升高而增加。
| [1] |
Kumar M, Singh R. Performance evaluation of semi continuous vertical flow constructed wetlands (SC-VF-CWs) for municipal wastewater treatment[J]. Bioresource Technology, 2017, 232: 321-330. DOI:10.1016/j.biortech.2017.02.026
(  0) 0) |
| [2] |
Zhou X, Wang X, Zhang H, et al. Enhanced nitrogen removal of low C/N domestic wastewater using a biochar-amended aerated vertical flow constructed wetland[J]. Bioresource Technology, 2017, 241: 269-275. DOI:10.1016/j.biortech.2017.05.072
(  0) 0) |
| [3] |
Zhang D, Gersberg R M, Keat T S. Constructed wetlands in China[J]. Ecological Engineering, 2009, 35(10): 1367-1378. DOI:10.1016/j.ecoleng.2009.07.007
(  0) 0) |
| [4] |
刘曦, 陈芳清, 杨丹, 等. 垂直流人工湿地系统中氮去除影响因素的研究[J]. 安徽农业科学, 2015(15): 226-228. Liu X, Chen F Q, Yang D. Study on the factor influence nitrogen removal in vertical flow constructed wetlands system[J]. Journal of Anhui Agricultural Sciences, 2015(15): 226-228. DOI:10.3969/j.issn.0517-6611.2015.15.081 (  0) 0) |
| [5] |
Vymazal J. Removal of nutrients in various types of constructed wetlands[J]. Science of Total Environment, 2007, 380: 48-65. DOI:10.1016/j.scitotenv.2006.09.014
(  0) 0) |
| [6] |
Dong Z, Sun T. A potential new process for improving nitrogen removal in constructed wetlands-promoting coexistence of partial-nitrification and ANAMMOX[J]. Ecological Engineering, 2007, 31(2): 69-78. DOI:10.1016/j.ecoleng.2007.04.009
(  0) 0) |
| [7] |
Pelissari C, Ávila C, Trein C M, et al. Nitrogen transforming bacteria within a full-scale partially saturated vertical subsurface flow constructed wetland treating urban wastewater[J]. Science of the Total Environment, 2017, 574: 390-399. DOI:10.1016/j.scitotenv.2016.08.207
(  0) 0) |
| [8] |
Silveira D D, Belli Filho P, Philippi L S, et al. Influence of partial saturation on total nitrogen removal in a single-stage French constructed wetland treating raw domestic wastewater[J]. Ecological Engineering, 2015, 77: 257-264. DOI:10.1016/j.ecoleng.2015.01.040
(  0) 0) |
| [9] |
常军军, 吴苏青, 梁康, 等. 复合垂直流人工湿地微生物特征对典型污水的响应差异[J]. 环境科学研究, 2016, 29(8): 1200-1206. Chang J J, Wu S Q, Liang K, et al. Responses of microbia1 features in integrated vertical-flow constructed wetlands (IVCWs) for treatment of two types of representative wastewater[J]. Research of Environmental Sciences, 2016, 29(8): 1200-1206. (  0) 0) |
| [10] |
Gao J, Wang W, Guo X, et al. Nutrient removal capability and growth characteristics of Iris sibirica in subsurface vertical flow constructed wetlands in winter[J]. Ecological Engineering, 2014, 70: 351-361. DOI:10.1016/j.ecoleng.2014.06.006
(  0) 0) |
| [11] |
国家环境保护总局. 水和废水监测分析方法(第4版)[M]. 北京: 中国环境科学出版社, 2002. NEPA Chinese. Water and Wastewater Monitoring Methods[M]. Beijing: Chinese Environmental Science Publilshing House, 2002. (  0) 0) |
| [12] |
李阜棣, 喻子牛, 何绍江. 农业微生物学实验技术[M]. 北京: 中国农业出版社, 1996: 69-89. Li F D, Yu Z N, He S J. Experimental Technique of Agricultural Microbiology[M]. Beijing: China Agriculture Press, 1996: 69-89. (  0) 0) |
| [13] |
许光辉, 郑洪元. 土壤微生物分析方法手册[M]. 北京: 中国农业出版社, 1986: 17-18. Xu G H, Zheng H Y. Soil Microbiological Analysis Method Manual[M]. Beijing: China Agriculture Press, 1986: 17-18. (  0) 0) |
| [14] |
中国科学院上海植物生理研究所, 上海市植物生理学会. 现代植物生理学实验指南[M]. 北京: 科学出版社, 1999: 53-58. Science of Plant Physiology and Ecology of CAS SIBS, Shanghai Society for Plant Biology. Modern Plant Physiology Experiment Guide[M]. Beijing: Science Press, 1999: 53-58. (  0) 0) |
| [15] |
Vymazal J. The use of hybrid constructed wetlands for wastewater treatment with special attention to nitrogen removal: A review of a recent development[J]. Water Research, 2013, 47(14): 4795-4811. DOI:10.1016/j.watres.2013.05.029
(  0) 0) |
| [16] |
Chang J, Wu S, Dai Y, et al. Nitrogen removal from nitrate-laden wastewater by integrated vertical-flow constructed wetland systems[J]. Ecological Engineering, 2013, 58: 192-201. DOI:10.1016/j.ecoleng.2013.06.039
(  0) 0) |
| [17] |
Saeed T, Sun G. A review on nitrogen and organics removal mechanisms in subsurface flow constructed wetlands: Dependency on environmental parameters, operating conditions and supporting media[J]. Journal of Environmental Management, 2012, 112: 429-448. DOI:10.1016/j.jenvman.2012.08.011
(  0) 0) |
| [18] |
Ong S, Uchiyama K, Inadama D, et al. Performance evaluation of laboratory scale up-flow constructed wetlands with different designs and emergent plants[J]. Bioresource Technology, 2010, 101(19): 7239-7244. DOI:10.1016/j.biortech.2010.04.032
(  0) 0) |
| [19] |
Kim B, Gautier M, Prost-Boucle S, et al. Performance evaluation of partially saturated vertical-flow constructed wetland with trickling filter and chemical precipitation for domestic and winery wastewaters treatment[J]. Ecological Engineering, 2014, 71: 41-47. DOI:10.1016/j.ecoleng.2014.07.045
(  0) 0) |
| [20] |
Zhang Z, Rengel Z, Meney K. Ⅱnteractive effects of nitrogen and phosphorus loadings on nutrient removal from simulated wastewater using Schoenoplectus validus in wetland microcosms[J]. Chemosphere, 2008, 72(11): 1823-1828. DOI:10.1016/j.chemosphere.2008.05.014
(  0) 0) |
| [21] |
Liu X, Huang S, Tang T, et al. Growth characteristics and nutrient removal capability of plants in subsurface vertical flow constructed wetlands[J]. Ecological Engineering, 2012, 44: 189-198. DOI:10.1016/j.ecoleng.2012.03.011
(  0) 0) |
| [22] |
Wang Y, Wang J, Zhao X, et al. The inhibition and adaptability of four wetland plant species to high concentration of ammonia wastewater and nitrogen removal efficiency in constructed wetlands[J]. Bioresource Technology, 2016, 202: 198-205. DOI:10.1016/j.biortech.2015.11.049
(  0) 0) |
| [23] |
Abou-Elela S I, Golinielli G, Abou-Taleb E M, et al. Municipal wastewater treatment in horizontal and vertical flows constructed wetlands[J]. Ecological Engineering, 2013, 61: 460-468. DOI:10.1016/j.ecoleng.2013.10.010
(  0) 0) |
| [24] |
Liu L, Zhao X, Zhao N, et al. Effect of aeration modes and influent COD/N ratios on the nitrogen removal performance of vertical flow constructed wetland[J]. Ecological Engineering, 2013, 57: 10-16. DOI:10.1016/j.ecoleng.2013.04.019
(  0) 0) |
| [25] |
张列宇, 饶本强, 熊瑛, 等. 人工湿地黑臭水体处理系统微生物脱氮机理研究[J]. 水生生物学报, 2010, 34(2): 256-261. Zhang L Y, Rao B Q, Xiong Y, et al. The microbial mechanism of horizonal constructed wetland used to treated black-odor river[J]. Acta Hydrobiologica Sinica, 2010, 34(2): 256-261. (  0) 0) |
| [26] |
王国祥, 濮培民, 黄宜凯, 等. 太湖反硝化、硝化、亚硝化及氨化细菌分布及其作用[J]. 应用与环境生物学报, 1999, 5(2): 190-194. Wang G X, Pu P M, Huang Y K, et al. Distribution and role of denitrifying, nitrifying, nitrosation and ammonifying bacteria in the Taihu Lake[J]. Chinese Journal of Applied & Environmental Biology, 1999, 5(2): 190-194. DOI:10.3321/j.issn:1006-687X.1999.02.015 (  0) 0) |
2. Qingdao Water Environmental Company, Qingdao 266021, China;
3. The Key Laboratory of Ocean Environmental Geology Engineering, Shandong Province, Ocean University of China, Qingdao 266100, China
 2019, Vol. 49
2019, Vol. 49


