在纳米技术领域,纳米粒是指粒径在1~100 nm之间的颗粒;而药剂学中的纳米粒(纳米药物或纳米给药系统)一般是指粒径在10~1 000 nm之间用于递送药物或生物分子的纳米载体,主要包括纳米球、纳米囊、纳米胶束、纳米脂质体、固体脂质纳米粒等。与传统的药物剂型相比,纳米给药系统具有以下优势:(1)能穿透毛细血管避免了吞噬细胞的快速清除作用,延长了其在血液中的存留时间;(2)可以透过细胞和组织间隙到达肝、脾、肺、脊髓和淋巴等靶器官;(3)由材料本身的生物降解性、pH、离子和/或温度敏感性决定了所负载药物的控释特性等。目前,纳米给药系统已被广泛应用于小分子药物、多肽、蛋白质(疫苗)、核酸等领域,在生物、医学和制药等领域显示出巨大的应用潜力[1-3]。研究主要内容包括:(1)选择适当种类的载体材料和配比,以获得适当的药物释放速度;(2)筛选特异性配基修饰纳米粒的表面,以提高其药物递送的靶向性;(3)研究纳米粒与血液、靶向组织器官等相互作用的体内动力学过程;(4)优化纳米粒的制备方法,提高其载药能力及工业化生产的可能性;(5)进行相关的临床的实验。制备纳米给药系统的原料必须具有生物相容性,还应可生物降解,常用的材料包括聚乳酸、聚乙醇酸、聚己内酯、多糖(如壳聚糖)、聚丙烯酸系列、蛋白质或多肽(如明胶)等,其中多糖是制备纳米给药系统最常用的材料[4]。
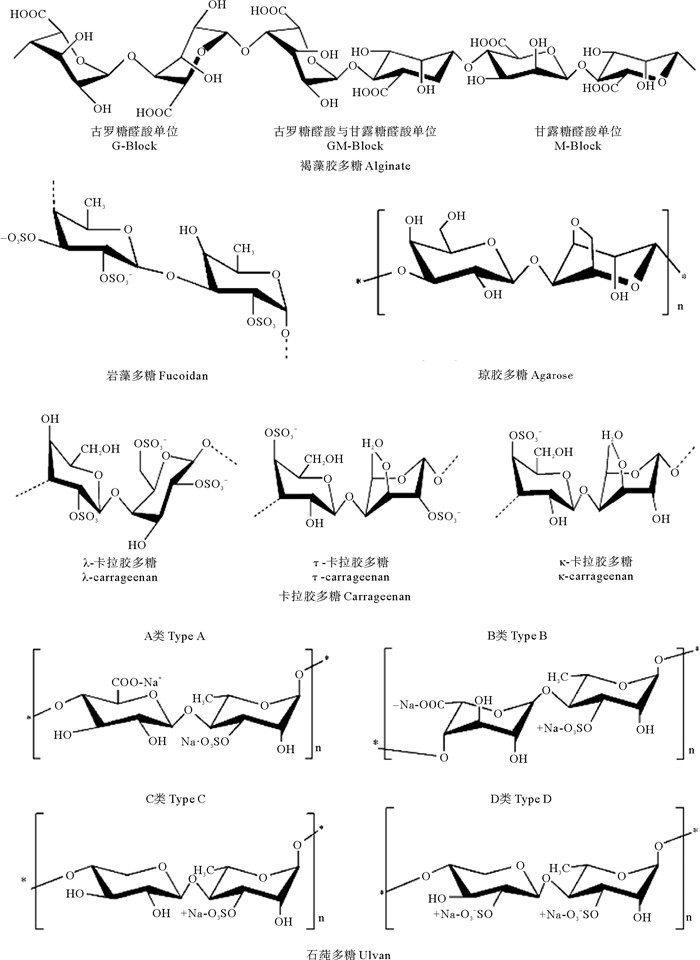
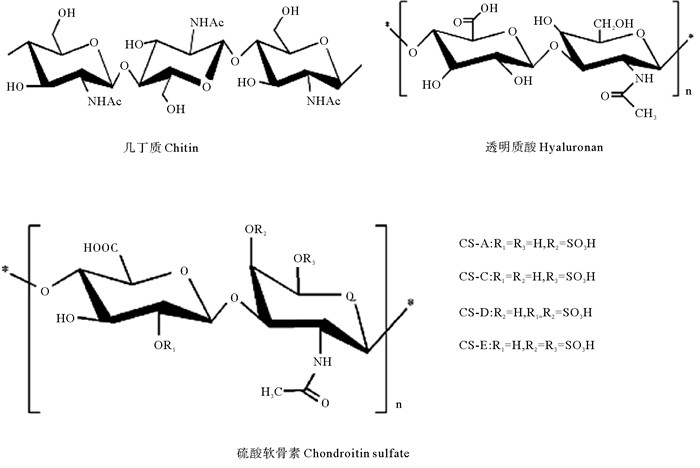
多糖(如纤维素、几丁质等)是地球上含量最丰富的天然聚合物。在过去的几十年里来源于海洋生物的多糖类物质(以下简称“海洋多糖”)不仅成为学术研究的热点,也吸引了医学和制药工业领域的广泛关注。主要是因为海洋多糖具有多样的生物活性,在生物、医药和健康领域展现出了巨大的应用潜力。海洋多糖主要来源于海洋植物、海洋动物和海洋微生物。大型海藻(主要包括褐藻、红藻和绿藻三类)是海洋多糖的主要来源。其中,褐藻中富含褐藻胶多糖(Alginate)、岩藻多糖(Fucoidan)等;红藻中以卡拉胶多糖(Carrageenan)、琼胶多糖(Agarose)等为主;绿藻则主要含石莼多糖(Ulvan)。海藻多糖一般为水溶性,大都含有硫酸基团,具有很强的凝胶性和增稠性。组成海藻多糖的单糖单位主要包括葡萄糖、甘露糖、鼠李糖、阿拉伯糖、半乳糖、半乳糖醛酸、岩藻糖(见图 1)等[5]。海洋多糖的另一个重要来源是海洋动物,其结构更复杂多样,如甲壳动物含有大量的几丁质(Chitin);海参中含有大量的岩藻糖基化硫酸软骨素(Fucosylated chondroitin sulfate)和高硫酸化岩藻聚糖(Highly sulfated fucoidan);鲨鱼皮肤中含有透明质酸(Hyaluronan)、鲨鱼软骨中有大量的硫酸软骨素(Chondroitin sulfate)(见图 2);另外,软体动物扇贝、文蛤、鲍鱼、海兔等富含糖蛋白或糖胺聚糖等。部分海洋细菌和真菌可以产生种类多样的胞外多糖,由于可以通过发酵进行规模化生产,是海洋多糖一个潜在的重要来源。
|
图 1 植物来源多糖化学结构 Fig. 1 Chemical structure of plant-derived polysaccharide |
|
图 2 动物来源多糖化学结构图 Fig. 2 Chemical structure of animal-derived polysaccharides |
海洋多糖具有来源丰富、低毒性、易生物降解、生物相容性好、亲水性好等特点;同时,其多糖链上大量游离羟基和羧基的存在,使化学改性变的非常容易。另一方面,海洋多糖的一些独特理化性质,还为制备主动靶向纳米材料提供了可能。例如利用海藻酸钠和壳聚糖的生物粘附性可制备定位于粘膜的纳米粒;利用石莼多糖含有的大量鼠李糖残基可制备巨噬细胞靶向的纳米粒;而透明质酸纳米粒可用于靶向CD44和CD168过度表达的癌细胞和炎症细胞等[6]。因此,海洋多糖是制备药物(或生物活性物质)递送纳米材料的理想原料。本文将基于我们实验室近十几年关于纳米给药系统的研究成果,综述纳米粒的制备方法、应用研究的最新进展、指出了目前研究中存在的问题,同时对该领域未来的发展趋势进行了展望。
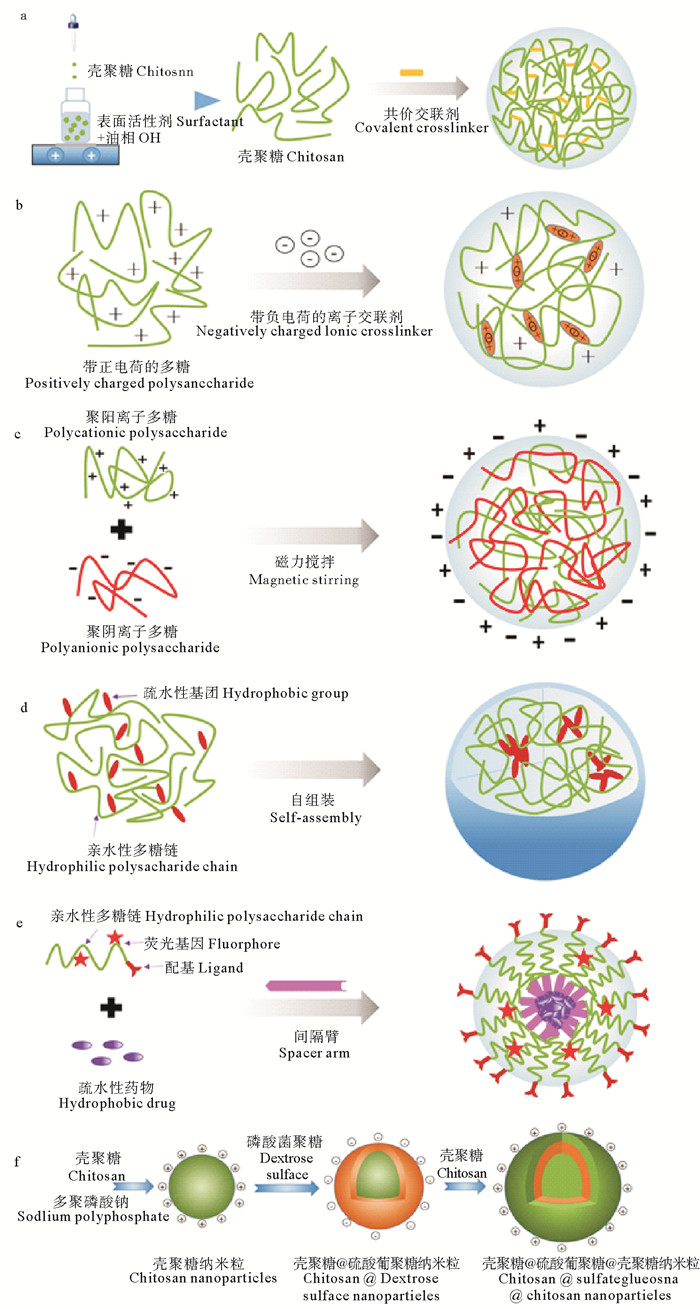
1 多糖纳米给药系统的制备方法依据原材料的性质和载体功能的不同需求,纳米材料的制备方法主要有两类:(1)自上而下法(Top-down methods):即由大变小法,是用机械的方法将宏观尺度较大的材料转化为小单元的方法,常用的方法有胶体磨碾磨法、高压均质法、纳米喷雾干燥法等;(2)自下而上法(Bottom-up methods):即由小变大法,是在原子和分子水平上,通过分子或胶体颗粒间的结合来构筑纳米载体。由于该方法可在原子、分子水平上设计载体的结构和性能,因此可装备出高质量的纳米材料,是制备纳米材料的主流技术。主要方法包括交联法、自组装法和缀合物合成法等[7]。基于海洋多糖的纳米材料的制备主要是采用这一技术。
1.1 交联法 1.1.1 共价交联法共价交联法是利用多糖分子链上的羟基、氨基或羧基等能与交联剂(戊二醛、甲醛、甘油醛、环氧氯丙烷等)上的活泼基团发生共价交联反应制备纳米粒的方法。例如,将壳聚糖溶液分散于油相(石蜡油、矿物油、植物油等)制备油包水型(W/O)乳液,同时加入适当的交联剂(如戊二醛等)对纳米粒进行固化(见图 3a)。该方法制备的纳米粒可形成稳定的刚性三维网状结构,能吸附水分和生物活性成分。但这种方法使用的交联剂,往往具有细胞毒性,对所负载药物的活性也有影响。因此,近来已被一些新型的低毒性交联剂,如京尼平(Genipin)、1—乙基—3—(3—二甲氨基丙基)碳化二亚胺(EDC)、天然二元和三元羧酸所替代。
|
图 3 海洋糖纳米药物制备原理示意图 Fig. 3 Schematic diagram of the preparation of marine glyconanomedicine nanomedicine |
离子交联法主要通过正、负电荷间的静电作用来制备纳米粒。在带电荷的小分子存在的条件下,带相反电荷的多糖分子被结合在一起形成纳米粒子(见图 3b)。例如,带正电荷的壳聚糖分子通过与带负电荷三聚磷酸钠分子的静电作用而形成纳米粒;离子交联法制备纳米粒的条件温和、对所负载的药物,特别是生物大分子药物(如多肽和蛋白质)的活性影响较小,是一种制备生物降解和生物相容性的多糖纳米粒子的有效方法。
1.2 聚电解质复合法该方法是指在溶液中两种带相反电荷的聚电解质通过静电相互作用凝聚形成纳米结构的聚集体(PEC)。例如将聚阴离子多糖(透明质酸、海藻酸钠、硫酸软骨素、羧甲基纤维素等)溶液与聚阳离子多糖(如壳聚糖)溶液按一定比例混合,室温下搅拌即可形成的纳米复合物(见图 3c)。该方法对于水溶性小分子或生物大分子物质的递送均适合,而且制备过程简单,也不需要添加其他的化学试剂,因此得到了广泛的应用,是一种理想的制备纳米载体的方法。与离子交联法不同,在PEC中由于静电相互作用是发生在大分子之间,溶液的pH值、离子强度、温度以及混合的持续时间和顺序等对其稳定性影响较大;其次,其稳定性还会受到聚电解质的分子量及分子的柔韧性等因素的影响。研究显示,加入小分子离子交联可以增强大分子之间的相互作用,得到更稳定的纳米复合物。
1.3 自组装法如前所述,海洋多糖分子链上存在多种可被修饰的基团如羧基、硫酸基、羟基等,易于进行化学改性。将疏水性基团例如烷基、芳香、脱氧胆酸基等接枝到亲水性糖骨架上,可制成两亲性多糖分子。在水相环境中,两亲性多糖为了使界面自由能最小化,其上的疏水基可通过分子内和/或分子间自组装形成自聚集体(见图 3d)。例如,疏水化修饰的壳聚糖(如烷基化或脱氧胆酸化等)通过超声或乳化的处理两亲性分子可以自组装形成纳米粒,能用作抗癌药物(如紫杉醇、阿霉素等)的载体。通过自组装法制备的纳米粒在应用上有以下特点,如:(1)可通过原料的选择和制备工艺的优化控制纳米粒的粒径和分散度;(2)与传统的小分子表面活性剂相比,聚合物的临界胶束浓度较低,使纳米粒的结构在各种生理条件下具有较好的稳定性,保证药物的高的运送效率和生物利用度。(3)纳米粒具有一种独特的核-壳结构,其中核是由多糖分子链上的疏水基团聚集而成,而外壳是由多糖的亲水骨架构成。内核主要通过疏水作用结合小分子药物或生物大分子(如蛋白质、DNA等),而外壳的表面性质决定了纳米粒的生物利用度。
1.4 制备糖链-药物缀合物1975年,Ringsdorf首次提出了可以制备聚合物-药物缀合物用于小分子疏水性药物的递送。同游离的药物相比,与聚合物的结合改变了小分子药物在体内的生物分布和循环时间,并且借助滞留渗透(EPR)效应,聚合物-药物缀合物能选择性地在肿瘤处聚集和积累。目前,这种给药策略已被用于制备糖链-药物缀合物,特别适用于水难溶性抗癌药物的输送。糖链-药物缀合物主要由三部分组成:多糖分子、药物和连接两者的可生物降解间隔臂,同时还可共价偶联上示踪剂和靶向病灶的配基(见图 3e)。在进行缀合物设计时,间隔臂的选择是成功的关键因素。理想的多糖-药物缀合物具备以下特点:第一,间隔臂在血流中稳定不被降解,以增加循环时间,但进入细胞后能迅速分解;第二,间隔臂能在不改变药物分子化学结构的前提下将其完整的释放;第三,糖链的结构在血液中不发生改变。糖链-药物缀合物的大小和形状最终由其组分的特性决定。例如,糖链-疏水性药物缀合物可自组装成球形纳米粒,糖链位于表面,而药位于其核心。
1.5 逐层组装法逐层组装法(LBL)是一种多用途的纳米制造技术,聚电解质LBL是制备纳米复合材料最有效的方法之一。基于静电相互作用,用带相反电荷的聚电解质的交替吸附来制备纳米粒的技术是近年来出现的一个新的策略。例如,以聚阳离子壳聚糖和聚阴离子硫酸葡聚糖为原料,采用LBL可制备多层纳米颗粒(见图 3f)。这个方法制备纳米粒的优势表现在:(1)在生理条件下,治疗药物和生物材料通过非共价的形式掺入到LBL膜中,其生物活性不受到影响;(2)可通过控制表面化学、LBL膜的厚度等因素将多种组分组合在一起,制备可自由调节药物释放持续时间的多功能纳米给药系统。
2 多糖纳米给药系统的应用 2.1 褐藻胶多糖(Alginate)褐藻胶多糖是从褐藻中提取由β—D—甘露糖醛酸(M)和α—L—古罗糖醛酸(G)通过α或β—(1→4)糖苷键连接而成的天然多糖。褐藻胶多糖由于其优异的生物相容性、低成本、低生物毒性和环境响应性等优点而被广泛研究并应用于药物递送领域[8]。制备褐藻胶多糖纳米粒的常用的方法是离子交联法,其中交联速率是控制褐藻胶多糖纳米粒形成的关键因素。然而,该方法只适用于水溶性活性成分的包封。
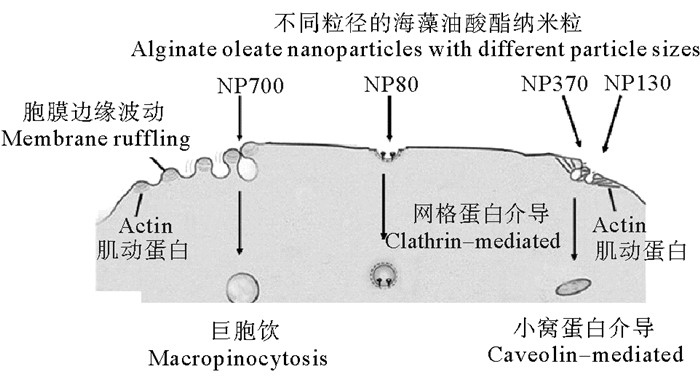
为了拓展海藻酸纳米粒的应用范围,李倩等[9]应用活性酯法首先制备得到了油酰海藻酸(OAE),进而分别用自组装法和乳化法构建了油酰海藻酸纳米粒。以维生素D3和维生素E为模型药物对其包埋效率和缓释效果进行了测定。OAE纳米粒在模拟胃液中保持完整球形结构、粒径变小、药物释放率低;在模拟肠液中形状变得不规则、粒径变大、药物释放率迅速提高,表明OAE纳米粒具有肠道靶向缓释作用。为了进一步阐明纳米粒的转运和吸收机制(见图 4),李倩等[10-11]通过差速离心法制备了不同粒径的负载VE的海藻酸钠单分散颗粒(50、120、420和730 nm)。体外Transwell的跨膜转运模型实验表明,负载VE的OAE纳米粒的透过率显著提高,但随着粒径的增加(70 nm升到700 nm),VE表观渗透系数降低((2.72 ± 0.66)×10-4 cm/s降到(0.94 ± 0.43)×10-4 cm/s)。Wistar大鼠肠外翻实验结果表明:OAE纳米粒主要通过主动运输吸收;不同粒径的OAE纳米粒胞吞机制不同,其中网格蛋白介导了NP 80和NP 130的内吞作用,小凹蛋白介导了NP 370的内吞作用,而NP 700主要通过巨胞饮作用进入细胞。
|
图 4 不同粒径纳米粒进入细胞的不同机制 Fig. 4 Different mechanisms of cellular uptake of nanoparticles with different particle sizes |
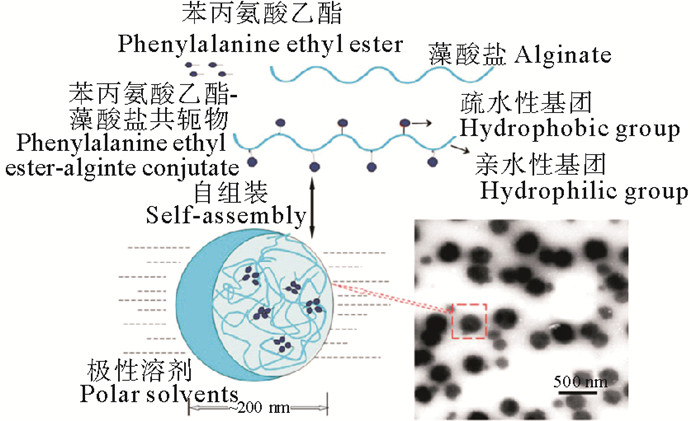
在以上研究的基础上,为了进一步提高药物的跨膜通透率及口服生物利用度,张沛等[12-13]利用肠上皮细胞表面存在苯丙氨酸酯类受体这一原理,合成了苯丙氨酸乙酯-海藻酸钠耦合物(PE-SA, SP),研究了两亲性褐藻胶多糖在水溶液中的自组装行为;制备了负载维生素B2(VB2)的褐藻胶多糖纳米粒(VB2-SP)(见图 5)。结果显示:纳米粒的最大载药量为(12.76 ± 1.22)%;VB2从PEA-NPs的体外释放行为显示出双相释放曲线,在最初的10 h内爆发性释放约占VB2的40%~50%,随后在pH 7.4的PBS中50 h稳定持续释放;同时,相对于pH 7.4,VB2-SP在pH 2.0条件下释放率较低;SP纳米粒可作为VB2的肠道靶向载体。激光共聚焦扫描显微镜结果显示苯丙氨酸乙酯对于Caco-2细胞对SP纳米粒摄取具有一定的促进作用。SP能有效提高所负载营养物的生物利用度,可解决低生物利用度营养物质吸收问题。
|
图 5 基于苯丙氨酸乙酯的共轭物的自聚集体的示意图和透射电子显微照片 Fig. 5 Schematic and transmission electron micrographs of self-aggregates of phenylalanine ethyl ester-based conjugates |
随着褐藻种类的不同,岩藻多糖的结构和组成有差别,海带来源的岩藻多糖由硫酸岩藻糖通过α(1→3)糖苷键连接而成,而墨角藻和泡叶藻来源的岩藻多糖通过α(1→3)和α(1→4)糖苷键连接而成。岩藻多糖具有多种生物学活性,如抗凝[14]、抗病毒[15]、抗血管生成、抗肿瘤、抗炎[16]、抗氧化剂[17]以及抗增殖和免疫调节特性[15],是用于制备药物递送载体的优质材料。
Leung等[18]的研究使用了羧甲基化的瓜儿豆胶多糖及岩藻多糖作为还原剂和稳定剂来生物合成银纳米粒。从褐藻中分离出岩藻多糖,使用脂质体作为纳米载体将其包裹在纳米粒中。这些纳米粒对骨肉瘤显示出有效的体外抗癌活性,为了制备载有化疗药物的纳米粒,研究人员又通过岩藻多糖的乙酰化合成了疏水改性的岩藻多糖。阿霉素被用作治疗模型中的化疗药物,将该药物装载于乙酰化岩藻多糖纳米粒子中研究其载药性能。
2.3 卡拉胶多糖(Carrageenan)卡拉胶来源于海洋红藻,生产卡拉胶的原藻主要为卡帕藻和麒麟菜两个属,其中以麒麟菜属海藻资源最为丰富。卡拉胶多糖链由两种单糖即α—(1→4)—D—吡喃型半乳糖—β—(1→3)—D—半乳吡喃糖(或3, 6内醚—D—半乳吡喃糖)组成二糖单元交替连接而成。卡拉胶多糖根据不同硫酸根基团的取代度分为k, l, λ-卡拉胶多糖三种类型。在药物制剂中常用作乳化剂、助悬剂、胶凝剂、缓控释材料、包衣材料等。
Daniel-da-Silva等[19]利用卡拉胶多糖研究了磁性纳米粒的生物合成,并对k, l, λ-卡拉胶多糖纳米复合材料的颗粒形态和化学稳定性进行了研究。De Souza等[20]报道了从海洋褐藻和红藻中提取的6种硫酸多糖混合物的的抗氧化活性; λ-卡拉胶多糖表现出很强的抗氧化活性,对猫疱疹病毒(FHV)-1在体外具有良好的抑制作用。Grenha等[21]开发了一种新型的卡拉胶多糖制备的纳米粒,作为一类优秀的药物传递系统。这类纳米粒被证明是具备缓释及可控性的药物输送载体,对成纤维细胞的生物毒性低,具有良好的生物相容性,是药物递送载体及组织工程应用的优良材料。
2.4 琼胶多糖(Agarose)琼胶多糖,主要是从红藻(如石花菜、江蓠和紫菜属等)中提取出的多糖,琼胶多糖是由β-1, 3-连接的D-半乳糖和α-1, 4-连接的3, 6-內醚-α-L-半乳糖残基的交替连接形成的共聚物。琼胶多糖在药物制剂领域有广泛的应用,可作胶凝剂、增稠剂、助悬剂、乳化或乳化稳定剂等,可用于凝胶剂、冻胶剂、乳剂、合剂的制备。琼胶多糖还常用于生物化学,分子生物学等生物技术领域,通过琼脂糖电泳分离DNA等生物分子。琼胶多糖由于其凝胶化的特性还常用于制造半导体和金属纳米粒,这些纳米粒对大肠杆菌表现出很强的抗菌活性。
有趣的是,琼胶多糖复合膜在氮气中碳化后可以迅速转化为碳-金属复合材料[22]。Kattumuri等[23]报道了使用琼胶多糖固定金纳米粒,利用表面增强拉曼光谱检测DNA核苷的微摩尔浓度,通过结果表明,琼胶多糖固定金纳米粒子产生更高的表面增强拉曼光谱检测DNA核苷,将其应用于芯片上的生物传感用途。
2.5 绿藻多糖浒苔和石莼同属于石莼属,是引发海洋“绿藻潮”的主要藻种。近十年来,中国黄海南部及东海北部海域频繁爆发“绿潮”,严重威胁了沿海地区的渔业和旅游业的发展,探索绿藻有效的利用途径,对解决它带来的环境问题及经济损失有重大意义。海洋绿藻多糖来源丰富、同时还具有良好的生物相容、生物可降解性。近30年的研究结果表明:这类多糖具有广泛的生物学功能如抗氧化、抗凝血、抗肿瘤、抗高血压、抗菌、抗病毒、免疫调节作用等。因此,在医药、食品、化妆品等领域显示出广阔的应用前景。以下就两种主要的水溶性绿藻多糖:石莼多糖和浒苔多糖来讨论相关研究及应用情况。
2.5.1 石莼多糖(Ulvan)石莼多糖是从海洋绿藻的细胞壁中分离出来的一种复杂的阴离子硫酸化多糖。石莼中提取的石莼聚糖为酸性多糖,主要单糖组成为鼠李糖、木糖、葡萄糖、艾杜糖醛酸、葡萄糖醛酸等,其糖残基绝大多数以α-(1→4)-和β-(1→4)-连接构成主链。鼠李糖的O-2位置存在分支,鼠李糖的C-3位置被硫酸化[24]。其中,艾杜糖醛酸、木糖、葡萄糖通过β-(1→4)-连接, 鼠李糖通过α-(1→4)-连接[25]。石莼多糖在抗氧化剂,抗肿瘤剂,抗凝剂和免疫调节剂方面具有较大的应用研究潜能[26]。目前,从海洋绿藻中分离出的石莼多糖已被用于制备纳米纤维,纳米纤维在药物输送,伤口敷料和组织工程中有较大应用潜力。
Toskas等[27]报道了来自绿藻的富含石莼多糖的分离多糖的可纺织特性,该多糖可用于制造纳米纤维。Kikionis等[28]使用电纺技术制备了新型的石莼多糖纤维生物复合材料,富含石莼多糖的提取物的可制备成纳米纤维的能力及其有趣的物理化学和生物学特性可以应用于生物医学领域,例如药物输送,伤口敷料和组织工程。
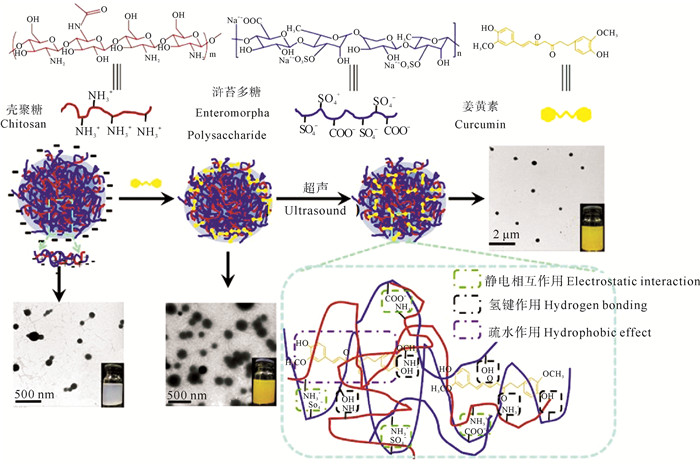
2.5.2 浒苔多糖浒苔多糖的单糖组成比较复杂,随季节、种类和地域的不同有一定差异,主要由鼠李糖、葡萄糖、木糖和葡萄糖醛酸等组成。木糖通过α-(1→2, 4)连接; 鼠李糖、葡萄糖醛酸和葡萄糖通过α-(1→4)连接; 半乳糖通过α-(1→3, 6)连接;其中硫酸化基团位于木糖的O-2位置。然而,浒苔多糖在生物医药领域的应用研究较少,我们李嘉欣等[29]在浒苔多糖的生物功能和纳米材料的制备方面进行了以下研究:首先,探究了浒苔多糖、浒苔低聚糖及其硫酸衍生物的抗氧化和吸湿/保湿活性。浒苔多糖(PEP)和浒苔低聚糖(LEP)通过氯磺酸/吡啶法制备其硫酸衍生物(SPEP和SLEP)。获得的SPEP和SLEP的硫酸取代度分别为0.57和0.81。理化性质研究和红外光谱结果表明浒苔多糖的酶降解和硫酸化修饰成功。13C NMR结果表明硫酸基团连接到鼠李糖C-6位置。此外,研究结果表明天然多糖经酶降解和硫酸化修饰后显著增强了超氧自由基、羟基自由基、DPPH自由基的体外清除活性,同时也提高了多糖的吸湿/保湿能力。这表明分子量和硫酸基团含量显著影响浒苔多糖的抗氧化性和吸湿/保湿活性。同时,李嘉欣等[30]还就负载姜黄素的浒苔多糖聚电解质纳米粒的制备及体外抗癌开展了研究。浒苔多糖(EP)和壳聚糖(CS)通过静电作用制备了聚电解质复合纳米粒(EP/CS NPs)(见图 6)。在pH 4.0、EP:CS质量比为3.0:1.0的条件下成功制备单分散、带负电荷的EP/CS NPs。负载姜黄素纳米粒(CUR-NPs)显示球形,粒径为230~330 nm,带-(16.27 ± 0.97) mV电荷。CUR-NPs改善了姜黄素的储存稳定性、热稳定性和光稳定性。在体外释放实验中能持续释放姜黄素。此外,CUR-NPs显示出比游离CUR更高的细胞摄入,MTT结果表明CUR-NPs对B16F10细胞具有良好的细胞毒性。因此,对于疏水性抗肿瘤药物递送,浒苔多糖纳米粒是一种有前景的载体。
|
图 6 聚电解质复合纳米粒(EP/CS NPs)和负载姜黄素纳米粒(CUR-NPs)的原理图 Fig. 6 Schematic diagram of polyelectrolyte composite nanoparticles (EP / CS NPs) and curcumin-loaded nanoparticles (CUR-NPs) |
壳聚糖是甲壳动物外骨骼的主要成分甲壳素的脱乙酰化后的产物,由β-(1→4)连接N-乙酰-D-葡萄糖胺(GlcNAc)和D-葡萄糖胺(GlcN)以β-(1→4)糖苷键相连接。壳聚糖糖链骨架上游离的氨基存在为制备基于壳聚糖的纳米粒提供便利。因此,可以通过自组装法、交联法和聚电解质复合法等方法制备壳聚糖纳米粒[31-33]。壳聚糖纳米药物递送载体可采用口服给药,注射给药,局部给药等不同给药方式,用于小分子药物、蛋白质药物或核酸药物的递送[34]。
其中自组装法是制备壳聚糖纳米粒最受关注的方法。Lee等[32]最早使用脱氧胆酸修饰壳聚糖,制备了自组装壳聚糖纳米粒用于阿霉素的递送。载药量达16.5 wt%,在pH 7.2的磷酸缓冲液中阿霉素缓慢的释放。后来,Kim首先合成了5β-胆酸修饰的乙二醇壳聚糖(HGC),随后制备自组装纳米粒作为紫杉醇(PTX)的载体,其最大载药量可达10 wt%。PTX-HGC的抗癌效果与紫杉醇的Cremophor EL剂型接近,但毒性大大降低[33]。
刘晨光等[35-39]也较早开展了这方面的工作,制备了基于亚油酸修饰的羧甲基壳聚糖(LCC)[35-37]、丙烯腈(AN)和精氨酸(Arg)修饰的壳聚糖(CS)(AN-CS-Arg)[38]、N-乙酰组氨酸(NAcHis)和精氨酸(Arg)修饰的壳聚糖(NAcHis-CS-Arg)[39]等的纳米粒分别用作小分子抗癌药物(如阿霉素、姜黄素和柔比多星)的载体。同时,为进一步提高药物的递送效率,还开发了肿瘤靶向的叶酸修饰壳聚糖纳米粒(FCC)。与正常细胞相比,叶酸受体(ER)在癌细胞中过表达,结果显示:癌细胞(Hela)表面过表达的叶酸受体介导了细胞主动摄入FCC-DOX过程,这样大量的FCC-DOX进入细胞释放药物,从而提高药物的作用效果[40]。
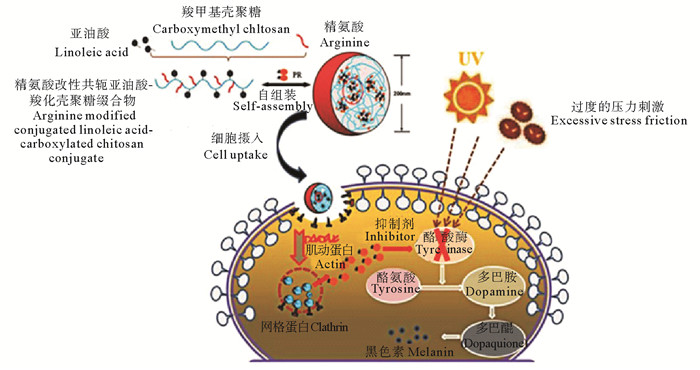
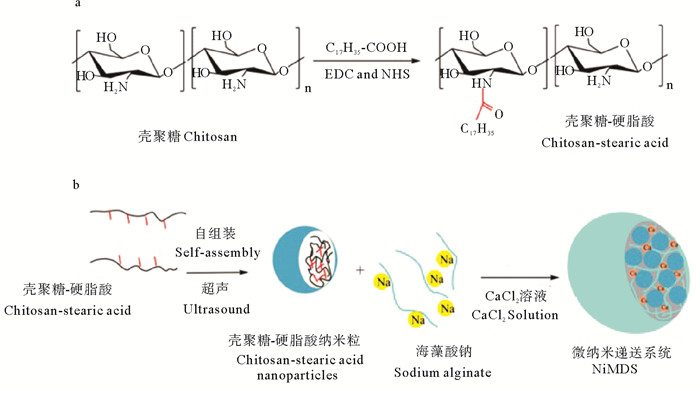
张沛等[41]制备的碱性氨基酸(精氨酸,Arg)性共轭亚油酸-羧化壳聚糖(CLA-CMCS)缀合物,可以自组装形成超分子胶束,有效包封酪氨酸酶抑制剂——苯乙基间苯二酚(见图 7),用于靶向传递抑制黑色素沉着。李倩等[42]将硬脂酸改性的壳聚糖采用自聚合法制备了壳聚糖纳米粒,并通过共轴气流法将壳聚糖纳米粒子包埋在海藻酸盐微球中(见图 8),在温和的条件下制备了一种纳米微传递系统(NiMDS),结果表明NiMDS可作为一种理想的、在胃肠道环境中缓释共轭亚油酸(CLA)的口服载体。
|
图 7 精氨酸改性共轭亚油酸-羧化壳聚糖-NPs在蒸馏水中的自组装与苯乙基间苯二酚在B16细胞中的高效传递 Fig. 7 Self-assembly of arginine modified conjugated linoleic acid-carboxylated chitosan-NPs in distilled water and efficient delivery of ethylresorcinol in B16 Cells |
|
图 8 (a)硬脂酸改性壳聚糖的原理图;(b)纳米微传递系统(NiMDS)的形成 Fig. 8 (a)Schematic diagram of stearic acid modified chitosan; (b) Preparation of the nano-micro delivery system (NiMDS) |
基于两亲性多糖自组装纳米粒还可通过氢键和疏水作用结合蛋白质,并自发的形成蛋白质-纳米粒复合物。这种复合结构可提高蛋白质抵抗变性的能力和热稳定性,其作用类似于“分子伴侣”可预防蛋白质不可逆的变性聚集沉淀。刘晨光等[43-44]曾用基于亚油酸接枝的壳聚糖自组装纳米粒负载胰蛋白酶,结果显示纳米粒可显著提高胰蛋白酶的稳定性。环境因素(如pH值、尿素或NaCl浓度)可影响TR在纳米粒子上的负载,提示酶蛋白与纳米粒的结合可能受到氢键、疏水作用和离子相互作用等因素的影响。随后的研究发现自组装壳聚糖纳米粒还可以作为菠萝蛋白酶的载体[45]。分别通过物理吸附和化学共价连接使酶负载于纳米粒上。研究结果显示:固定化菠萝蛋白酶的热稳定性及储存稳定性显著提高。原因是酶和纳米粒之间的离子相互作用、氢键以及疏水作用力等因素增强了酶分子的刚性。有趣的是与游离酶相比,固定化酶的Km值变小,提示纳米粒通过静电作用提高了酶与底物的亲和力。
聚电解质复合法是另一种制备壳聚糖纳米粒的有效方法。最近,Arif等[46]通过缀合半胱氨酸的壳聚糖(Cys-CS)和聚苹果酸(PMLA),制备用于包封阿莫西林的Cys-CS / PMLA纳米颗粒。结果表明,Cys-CS / PMLA纳米颗粒具有良好的pH敏感性,并有粘膜黏附和穿透功能可延缓阿莫西林在胃酸中的释放,使药物能够有效传递并靶向幽门螺杆菌。同时,丛莹等[47]还制备了硬脂酸接枝的羧甲基壳聚糖共聚物(CMCS-g-SA),并进一步接枝尿素,得到脲基-羧甲基壳聚糖-硬脂酸(U-CMCS-g-SA)共聚物,以U-CMCS-g-SA共聚物制备的纳米胶束负载疏水性抗生素克拉霉素(见图 9),羧甲基壳聚糖基赋予了纳米胶束在胃中优异的保存时间,而接枝的尿素基团赋予了胶束对幽门螺杆菌的有效靶向能力。
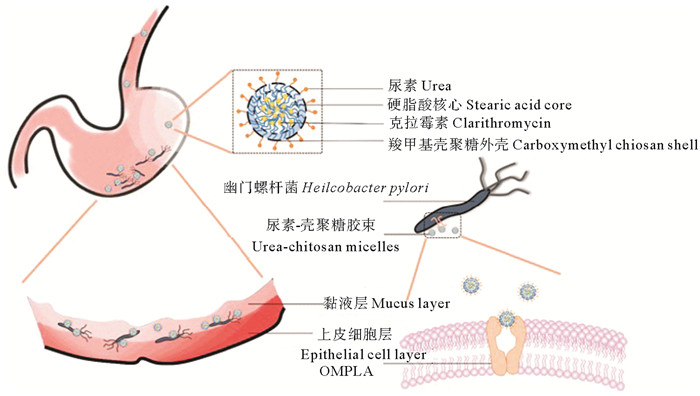
|
图 9 脲基-羧甲基壳聚糖-硬脂酸共聚物制备的纳米胶束用于靶向抑制幽门螺旋杆菌 Fig. 9 Nanomicelles prepared by urea-carboxymethyl chitosan-stearic acid copolymer for targeted inhibition of Helicobacter pylori |
随着糖化学的发展以及各种新型壳聚糖衍生物的研发,壳聚糖纳米药物递送载体将在不久的将来被充分开发用于更多的生物医学领域。
2.7 透明质酸(Hyaluronan)透明质酸由D-葡萄糖醛酸和N-乙酰-D-葡萄糖胺双糖单元重复连接而成,在一些海洋动物组织(如鱿鱼眼、鲨鱼皮和鲸鱼软骨)中存在含量丰富的透明质酸。透明质酸在溶液中分子间相互作用交织成网,对药物分子起到生物粘附作用,使其扩散速率大大减小,从而延长药效。透明质酸的这种缓释药物的功能使之非常适于用作药物载体材料。肿瘤细胞过表达的细胞表面分化簇44(D44)透明质酸高亲和性的受体,因此,基于透明质酸的纳米粒被广泛应用于抗肿瘤药物递送研究。
我们(董学猛[48]等)曾制备了透明质酸-脱氧胆酸耦合物(HD),并制备了基于HD的透明质酸纳米粒;以阿霉素为模型药物制备了载药的透明质酸纳米粒,研究结果显示:可以通过选择脱氧胆酸的取代度来控制纳米粒的粒径、载药量、药物释放速率和细胞的摄入量。随后又(武敬亮[49]等)合成了组氨酸修饰的透明质酸耦合物,以阿霉素(DOX)为模型药物,应用超声分散法制备包载阿霉素的纳米粒。体外细胞实验结果显示:载药纳米粒可通过受体介导的胞吞被细胞摄入,组氨酸基团使纳米粒具有显著的pH值响应性,显示出广阔的应用前景。以H22荷瘤小鼠为动物模型,考察DOX、DOX/His-HA纳米粒的抑瘤效果,证明DOX/His-HA纳米粒可有效抑制肿瘤,并降低了药物的毒副作用。
3 总结与展望同其它的基于化学合成材料(如聚乳酸、聚己内酯等)的纳米粒、基于脂质的纳米粒(如脂质体等),基于海洋多糖的纳米粒在小分子药物、生物大分子药物的递送中显示出独特的优势,如由于其亲水性和低免疫原性的特点避免了对血浆蛋白的非特异性识别和吸附,提高了药物的生物利用度,增强了药物的治疗效果;其凝胶性质(如对刺激的响应性、柔软性和膨胀性等)和易化学或酶学改性的特点为制备靶向和缓控释纳米药物提供了可能。研究者采用不同的方法(如聚电解质复合法(PEC)、自组装法、共价交联法和离子交联法等)成功制备了不同的海洋多糖纳米给药系统,在生物和医药领域显示出良好的应用前景。然而,目前这类研究大多仍处于实验室阶段,成功的商业应用较少。主要原因是:一方面,在应用基础研究中以下问题还需进一步阐明:(1)纳米药物在人体内的转运途径及细胞摄入机制;(2)纳米药物与免疫系统各组分的相互作用及其机制。另一方面,在实际应用中也面临一些挑战:(1)在进行体外实验、体内实验研究和临床应用时,目前尚缺乏统一的质量标准和检测方法;(2)产业化成本较高,或难以进行规模化生产。但是,随着研究的不断深入,这些问题的会得到逐步的解决,有理由相信基于海洋多糖的纳米给药系统将会在多种生物医学(如药物递送、组织工程和伤口敷料等)领域具有广泛的应用。
| [1] |
Jung T, Kamm W, Breitenbach A, et al. Biodegradable nanoparticles for oral delivery of peptides: Is there a role for polymers to affect mucosal uptake?[J]. European Journal of Pharmaceutics and Biopharmaceutics, 2000, 50: 147-160. DOI:10.1016/S0939-6411(00)00084-9
(  0) 0) |
| [2] |
Reis C P, Neufeld R J, Ribeiro A J, et al. Nanoencapsulation I. Methods for preparation of drug-loaded polymeric nanoparticles[J]. Nanomedicine Nanotechnology Biology & Medicine, 2006, 2(1): 8-21.
(  0) 0) |
| [3] |
Liu Z, Jiao Y, Wang Y, et al. Polysaccharides-based nanoparticles as drug delivery systems[J]. Advanced Drug Delivery Reviews, 2008, 60(15): 1650-1662. DOI:10.1016/j.addr.2008.09.001
(  0) 0) |
| [4] |
Vincent M, Chenglong W, Hongjing D. Saccharide-based nanocarriers for targeted therapeutic and diagnostic applications[J]. Polymer International, 2018, 68: 306-319.
(  0) 0) |
| [5] |
Sudha P N, Soundararajan A, Nithya R, et al. Industrial applications of marine carbohydrates[J]. Advances in Food and Nutrition Research, 2014, 73: 146-171.
(  0) 0) |
| [6] |
Bhatia S. Marine Polysaccharides Based Nano-Materials and Its Applications[M]. Switzerland: Springer International Publishing, 2016: 185-225.
(  0) 0) |
| [7] |
Mizrahy S, Landesman-Milo D, Peer D. Sweet fairytale: Carbohydrates as backbones for glyconanomedicine[J]. Israel Journal of Chemistry, 2013, 53: 616-629.
(  0) 0) |
| [8] |
Rajaonarivony M, Vauthier C, Couarraze G, et al. Development of a new drug carrier made from alginate[J]. Journal of Pharmaceutical Sciences, 1993, 82(9): 912-917. DOI:10.1002/jps.2600820909
(  0) 0) |
| [9] |
Ali Raja M, Liu C, Huang Z. Nanoparticles based on oleate alginate ester as curcumin delivery system[J]. Current Drug Delivery, 2015, 12(5): 613-627. DOI:10.2174/1567201812666150511095029
(  0) 0) |
| [10] |
Li Q, Liu C G, Yu Y. Separation of monodisperse alginate nanoparticles and effect of particle size on transport of vitamin E[J]. Carbohydrate Polymers, 2015, 124: 274-279. DOI:10.1016/j.carbpol.2015.02.007
(  0) 0) |
| [11] |
Li Q, Yu Y, Liu C. Preparation and evaluation of nanoparticles with narrow size distribution for oral delivery[J]. Journal of Controlled Release, 2013, 172(1): e21-e22.
(  0) 0) |
| [12] |
Ji S Q, Zhao R, Yin Q, et al. Gel microbead cultivation with a subenrichment procedure can yield better bacterial cultivability from a seawater sample than standard plating method[J]. Journal of Ocean University of China, 2012, 11(1): 45-51. DOI:10.1007/s11802-012-1869-y
(  0) 0) |
| [13] |
Zhang P, Zhao S R, Li J X, et al. Nanoparticles based on phenylalanine ethyl ester-alginate conjugate as vitamin B2 delivery system[J]. Journal of Biomaterials Applications, 2016, 31(1): 13-22. DOI:10.1177/0885328216630497
(  0) 0) |
| [14] |
Becker C F, Guimarães J A, Mourão P A S, et al. Conformation of sulfated galactan and sulfated fucan in aqueous solutions: Implications to their anticoagulant activities[J]. Journal of Molecular Graphics and Modelling, 2007, 26(1): 391-399. DOI:10.1016/j.jmgm.2007.01.008
(  0) 0) |
| [15] |
Hayashi K, Nakano T, Hashimoto M, et al. Defensive effects of a fucoidan from brown alga Undaria pinnatifida against herpes simplex virus infection[J]. International Immunopharmacology, 2008, 8(1): 109-116. DOI:10.1016/j.intimp.2007.10.017
(  0) 0) |
| [16] |
Cumashi A, Ushakova N A, Preobrazhenskaya M E, et al. A comparative study of the anti-inflammatory, anticoagulant, antiangiogenic, and antiadhesive activities of nine different fucoidans from brown seaweeds[J]. Glycobiology, 2007, 17(5): 541-552. DOI:10.1093/glycob/cwm014
(  0) 0) |
| [17] |
Wang J, Zhang Q, Zhang Z, et al. Antioxidant activity of sulfated polysaccharide fractions extracted from Laminaria japonica[J]. International Journal of Biological Macromolecules, 2008, 42(2): 127-132. DOI:10.1016/j.ijbiomac.2007.10.003
(  0) 0) |
| [18] |
Leung T C Y, Wong C K, Xie Y. Green synthesis of silver nanoparticles using biopolymers, carboxymethylated-curdlan and fucoidan[J]. Materials Chemistry and Physics, 2010, 121(3): 402-405. DOI:10.1016/j.matchemphys.2010.02.026
(  0) 0) |
| [19] |
Daniel-Da-Silva A L, Trindade T, Goodfellow B J, et al. In situ synthesis of magnetite nanoparticles in carrageenan gels[J]. Biomacromolecules, 2007, 8(8): 2350-2357. DOI:10.1021/bm070096q
(  0) 0) |
| [20] |
Souza L F, Barreto F, Silva E G, et al. Regulation of LPS stimulated ROS production in peritoneal macrophages from alloxan-induced diabetic rats: Involvement of high glucose and PPARγ[J]. Life Sciences, 2007, 81(2): 153-159. DOI:10.1016/j.lfs.2007.04.035
(  0) 0) |
| [21] |
Grenha A, Gomes M E, Rodrigues M, et al. Development of new chitosan/carrageenan nanoparticles for drug delivery applications[J]. Journal of Biomedical Materials Research Part A, 2010, 92(4): 1265-1272.
(  0) 0) |
| [22] |
Datta K K R, Srinivasan B, Balaram H, et al. Synthesis of agarose-metal/semiconductor nanoparticles having superior bacteriocidal activity and their simple conversion to metal-carbon composites[J]. Journal of Chemical Sciences, 2008, 120(6): 579-586. DOI:10.1007/s12039-008-0088-y
(  0) 0) |
| [23] |
Kattumuri V, Chandrasekhar M, Guha S, et al. Agarose-stabilized gold nanoparticles for surface-enhanced Raman spectroscopic detection of DNA nucleosides[J]. Applied Physics Letters, 2006, 88(15): 153114. DOI:10.1063/1.2192573
(  0) 0) |
| [24] |
Vandamme T F, Lenourry A, Charrueau C, et al. The use of polysaccharides to target drugs to the colon[J]. Carbohydrate Polymers, 2002, 48(3): 219-231. DOI:10.1016/S0144-8617(01)00263-6
(  0) 0) |
| [25] |
Caroline L, Ruxandra G, Patrick C. Polysaccharide-decorated nanoparticles[J]. European Journal of Pharmaceutics & Biopharmaceutics, 58(2): 327-341.
(  0) 0) |
| [26] |
Lahaye M, Robic A. Structure and functional properties of ulvan, a polysaccharide from green seaweeds[J]. Biomacromolecules, 2007, 8(6): 1765-1774. DOI:10.1021/bm061185q
(  0) 0) |
| [27] |
Toskas G, Hund R D, Laourine E, et al. Nanofibers based on polysaccharides from the green seaweed Ulva rigida[J]. Carbohydrate Polymers, 2011, 84(3): 1093-1102. DOI:10.1016/j.carbpol.2010.12.075
(  0) 0) |
| [28] |
Kikionis S, Ioannou E, Toskas G, et al. Electrospun biocomposite nanofibers of ulvan/PCL and ulvan/PEO[J]. Journal of Applied Polymer Science, 2015, 132(26): 42153.
(  0) 0) |
| [29] |
Li J X, Chi Z, Yu L, et al. Sulfated modification, characterization, and antioxidant and moisture absorption/retention activities of a soluble neutral polysaccharide from Enteromorpha prolifera[J]. International Journal of Biological Macromolecules, 2017, 105: 1544-1553. DOI:10.1016/j.ijbiomac.2017.03.157
(  0) 0) |
| [30] |
Li J X, Jiang F, Chi Z, et al. Development of Enteromorpha prolifera polysaccharide-based nanoparticles for delivery of curcumin to cancer cells[J]. International Journal of Biological Macromolecules, 2018, 112: 413-421. DOI:10.1016/j.ijbiomac.2018.02.002
(  0) 0) |
| [31] |
Wang Z H, Sun J H, Qiu Y Q, et al. Specific photothermal therapy to the tumors with high EphB4 receptor expression[J]. Biomaterials, 2015, 68: 32-41. DOI:10.1016/j.biomaterials.2015.07.058
(  0) 0) |
| [32] |
Lee K Y, Kim Y H, Kwon I C, et al. Self-aggregates of deoxycholic acid-modified chitosan as a novel carrier of adriamycin[J]. Colloid and Polymer Science, 2000, 278: 1216-1219. DOI:10.1007/s003960000389
(  0) 0) |
| [33] |
Kim J-H, Kim Y-S, Kim S, et al. Hydrophobically modified glycol chitosan nanoparticles as carriers for paclitaxel[J]. Journal of Controlled Release, 2006, 111: 228-234. DOI:10.1016/j.jconrel.2005.12.013
(  0) 0) |
| [34] |
Kean T, Thanou M. Biodegradation, biodistribution and toxicity of chitosan[J]. Advanced Drug Delivery Reviews, 2010, 62(1): 3-11.
(  0) 0) |
| [35] |
Liu C, Fan W, Chen X, et al. Self-assembled nanoparticles based on linoleic-acid modified carboxymethyl-chitosan as carrier of adriamycin (ADR)[J]. Current Applied Physics, 2007, 7S1: c125-c129.
(  0) 0) |
| [36] |
Tan Y L, Liu C G. Self-aggregated nanoparticles from linoleic acid modified carboxymethyl chitosan: Synthesis, characterization and application in vitro[J]. Colloids and Surfaces B: Biointerfaces, 2009, 69(2): 178-182. DOI:10.1016/j.colsurfb.2008.11.026
(  0) 0) |
| [37] |
Liu C G, Desai K G H, Chen X G, et al. Linolenic acid-modified chitosan for formation of self-assembled nanoparticles[J]. Journal of Agricultural and Food Chemistry, 2005, 53(2): 437-441. DOI:10.1021/jf040188w
(  0) 0) |
| [38] |
Ali R M, Zeenat S, Muhammad A, et al. Self-assembled nanoparticles based on amphiphilic chitosan derivative and arginine for oral curcumin delivery[J]. International Journal of Nanomedicine, 2016, 11: 4397-4412. DOI:10.2147/IJN.S106116
(  0) 0) |
| [39] |
Raja M A, Arif M, Feng C, et al. Synthesis and evaluation of pH-sensitive, self-assembled chitosan-based nanoparticles as efficient doxorubicin carriers[J]. Journal of Biomaterials Applications, 2017, 31(8): 1182-1195. DOI:10.1177/0885328216681184
(  0) 0) |
| [40] |
Tan Y L, Liu C G. Preparation and characterization of self-assembled nanoparticles based on folic acid modified carboxymethyl chitosan[J]. Journal of Materials Science: Materials in Medicine, 2011, 22(5): 1213-1220. DOI:10.1007/s10856-011-4302-y
(  0) 0) |
| [41] |
Zhang P, Guo H, Liu C G. Fabrication of carboxylmethyl chitosan nanocarrier via self-assembly for efficient delivery of phenylethyl resorcinol in B16 cells[J]. Polymers, 2020, 12(408): 1-15.
(  0) 0) |
| [42] |
Li Q, Xue F, Qu J, et al. Nano-in-micro delivery system prepared by co-axial air flow for oral delivery of conjugated linoleic acid[J]. Marine Drugs, 2019, 17(15): 1-10.
(  0) 0) |
| [43] |
Liu C G, Desai K G H, Chen X G, et al. Preparation and characterization of nanoparticles containing trypsin based on hydrophobically modified chitosan[J]. Journal of Agricultural and Food Chemistry, 2005, 53(5): 1728-1733. DOI:10.1021/jf040304v
(  0) 0) |
| [44] |
Liu C G, Chen X G, Park H J. Self-assembled nanoparticles based on linoleic-acid modified chitosan: Stability and adsorption of trypsin[J]. Carbohydrate Polymers, 2005, 62(3): 293-298. DOI:10.1016/j.carbpol.2005.08.010
(  0) 0) |
| [45] |
Tan Y L, Liu C G, Chen X G, et al. Effect of linoleic-acid modified carboxymethyl chitosan on bromelain immobilization onto self-assembled nanoparticles[J]. Frontiers of Materials Science in China, 2008, 2(2): 209-213. DOI:10.1007/s11706-008-0035-3
(  0) 0) |
| [46] |
Arif M, Dong Q J, Raja M A, et al. Development of novel pH-sensitive thiolated chitosan/PMLA nanoparticles for amoxicillin delivery to treat Helicobacter pylori[J]. Materials Science and Engineering: C, 2018, 83: 17-24. DOI:10.1016/j.msec.2017.08.038
(  0) 0) |
| [47] |
Cong Y, Geng J Y, Wang H Y, et al. Ureido-modified carboxymethyl chitosan-graft-stearic acid polymeric nano-micelles as a targeted delivering carrier of clarithromycin for Helicobacter pylori: Preparation and in vitro evaluation[J]. International Journal of Biological Macromolecules, 2019, 129: 686-692. DOI:10.1016/j.ijbiomac.2019.01.227
(  0) 0) |
| [48] |
Wei W H, Dong X M, Liu C G. In vitro investigation of self-assembled nanoparticles based on hyaluronic acid-deoxycholic acid conjugates for controlled release doxorubicin: Effect of degree of substitution of deoxycholic acid[J]. International Journal of Molecular Sciences, 2015, 16(4): 7195-7209.
(  0) 0) |
| [49] |
Wu J, Liu C, Wang X, et al. Preparation and characterization of nanoparticles based on histidine-hyaluronic acid conjugates as doxorubicin carriers[J]. Journal of Materials Science: Materials in Medicine, 2012, 23(8): 1921-1929. DOI:10.1007/s10856-012-4665-8
(  0) 0) |
 2020, Vol. 50
2020, Vol. 50

