中国东海是重要的碳汇区域,浮游植物对碳的吸收量为222(65.15~821 Tg·a-1),远远高于海气间CO2的吸收量(7~23 Tg·a-1)和河流输入量(17 Tg· a-1)[1]。长江口及其临近海域是赤潮多发区,也是浮游植物的生产力高值区,对于调控东海海域的碳汇规模有重要影响[2]。
海区的净群落生产力(NCP)能衡量营养状态,当浮游植物的总生产力(GPP)大于群落呼吸(Community respiration, CR),即NCP>0,海区呈自养状态,海洋对CO2吸收并形成碳汇;反之呈异养状态,形成向大气释放CO2的碳源[3]。NCP与GPP的比值为周转效率,反映浮游植物从总生产力向固碳量的转化效率,它也是衡量浮游植物传输碳效率的重要指标。
18O示踪法是目前同步测定浮游植物GPP和NCP中最直接有效的方法[4],具有灵敏、精确、无放射性等优点,但它难以像14C法一样广泛使用于海洋、水生环境中。这主要受限于样品处理和分析中存在的技术困难。过去主要通过稳定同位素质谱仪(IRMS,Isotopic-ratio mass spectrometer)测定。虽然仪器精度高,但存在前处理繁琐、培养水体量大、气体从水中向气态置换时易受到大气污染、IRMS造价昂贵,需要配备特制18O16O (m/z=34)的法拉第杯等问题[5]。
四极杆质谱广泛应用于残余气体分析(Residual gas analysis)。该方法将溶于水中的气体和挥发性有机物分离,广泛使用在气体生成机理的研究、水污染检测等领域[6]。结合同位素18O标记,国外陆续有基于四极杆质谱研究光合作用机制的报道。Ferrón等[4]首次利用18O示踪法,结合选择性薄膜分离和四极杆质谱,在寡营养盐水体测定GPP和NCP,取得了与IRMS近似的计算结果(误差低于±0.4‰)。该方法能避免IRMS前处理的繁琐流程,降低误差。
本文探索性地利用配备四级杆质谱的膜进样质谱(Membrane inlet mass spectrometry, MIMS)测定同位素及氧氩比(O2/Ar),通过优化质谱的稳定性和标记物添加量,使得H218O示踪法在近海更为实用。首次将该技术用于东海长江口海域,研究了春季藻华的种类和光合作用,建立GPP和NCP的光响应曲线,对比了浮游植物种类和生理生化过程在最大浑浊带、锋面地带和舟山海域的区域性差异。
1 实验方法 1.1 仪器设置通过前置分离装置,从流动的水样中连续进行溶解性气体18O16O、16O16O以及40Ar的同步监测,用于计算GPP和NCP。水样在蠕动泵(MiniPuls 3, Gilson)带动下,以恒定流速流经盘卷于恒温水浴槽内的毛细管。当水样流经气体选择性交换的半透膜(直径0.8 mm,Silastic®) 时,溶解性气体从水中向高真空的质谱端扩散。气体经过液氮冷阱时,水蒸气和CO2被去除,避免质子化过程中杂质气体对18O16O与16O16O的影响。用四极杆质谱接收放大的质荷比信号m/z 32、m/z 34和m/z 40。定时测定平衡水对O2/Ar和18O/Ar的漂移进行校正。
1.2 模拟实验 1.2.1 培养时间长时间培养可能造成营养盐耗尽影响浮游植物的光合作用,浮游动物的摄食效应也对生产力监测产生负面影响。为了缩短培养时间,通过模拟实验Ⅰ,确定现场培养的时长。将重氧水(H218O, 97%)稀释80倍,制得H218O储备液(δ18O =5 618‰)。按储备液与藻液1∶7的体积比,加入5×106cells·L-1的塔玛亚历山大藻(Alexandrium tamarense)中。混合均匀后,迅速分装入一组培养管(Exetainer®)中,水中无气泡,且装满后溢流5 mL,密封。在光强350 μmol· m-2·s-1、温度20 ℃下培养,分别在0、2、4、8 h,向培养管中加入10 μL饱和HgCl2溶液(SCR®,CN),以终止微生物的生理活动。通过δ18O (O2)与Δ(O2/Ar) 单位时间的变化计算GPP和NCP(具体计算过程见1.4.2生产力计算)。
1.2.2 示踪剂用量在模拟实验Ⅰ结束三天后,进行模拟实验Ⅱ。改变H218O浓度,以确保光合产物18O16O含量高于四极杆质谱的检出限。即:在相同培养条件下,将不同体积的储备液加入A. tamarense的培养瓶中,混匀。由于培养时间在0~8 h内该藻种的光合速率保持恒定(详细结果见2.3),选取培养时长为3 h。3 h后加入饱和HgCl2溶液固定,中止光合与呼吸作用,研究H218O初始浓度对光合反应速率GPP和NCP的影响。
1.3 现场实验 1.3.1 采样站位本次研究区域为受冲淡水、季风、沿岸流以及台湾暖流等多重影响长江口邻近海域(122.0°E—123.5°E,29.0°N—32.0°N)[7]。在2020年5月,借助“浙渔科2号”科考船,在长江入海口附近选取了三个代表性站位:河口附近的最大浑浊带(A,122.19°E,31.36°N)、北部咸淡水混合的锋面地带(B,122.35°E,31.61°N) 和南部舟山群岛附近(C,123.01°E,30.13°N)(见图 1)。用装配温度、盐度、浊度、光强、叶绿素荧光等传感器的Seabird-45 CTD和8L采样瓶采水。根据叶绿素荧光的垂向变化,将叶绿素荧光最大层的海水在不同光照条件下培养,测定生产力。固定浮游植物样品,过滤并冷冻保存了叶绿素和营养盐水样。
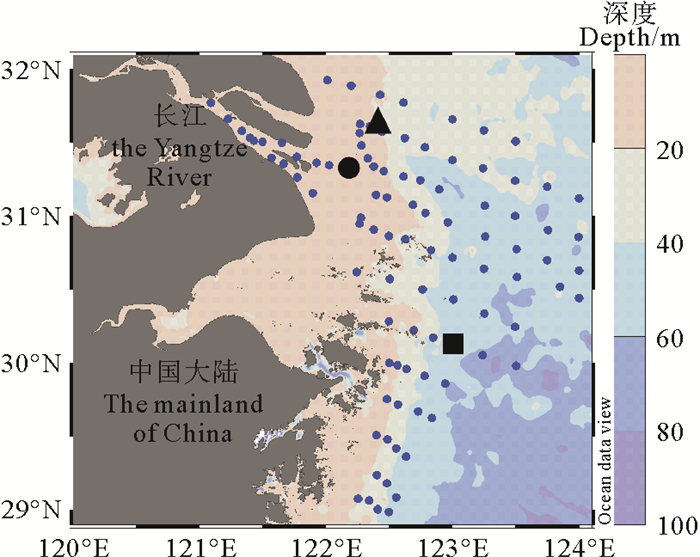
|
图 1 航次大面站位(蓝色小圆点)与代表性站位A(黑色圆点)、B(黑色三角形)和C(黑色方块)示意图 Fig. 1 The schematic map of basic stations (small blue dots) and representative stations A (the black dot), B (the black triangle) and C (the black square) |
取水样350 mL,使浮游植物适应半小时后,加入17.5 mL H218O储备液,使得δ18Owater达到约600‰。充分摇匀后,迅速分装入18支培养管中并密封。实验包括黑暗和4个光照梯度组,每组3个平行样;在培养初始以HgCl2固定3支培养管,作为反应的初始值。培养实验在甲板循环水水浴槽内进行,定时取样固定。使用MIMS测量16O16O、18O16O和Ar信号,计算GPP和NCP。
1.3.3 生物量和环境因子在100 mL棕色瓶中,以1mL 5% Lugo碘液(Phygene®,Fuzhou,CN)固定海水样品,一式三份避光保存。在倒置显微镜(Zeiss®,×400倍)下进行浮游植物鉴定和计数。以GF/F滤膜(孔径0.7 μm, WhatmanTM)过滤,水样和膜分别冷冻保存。滤膜经90%丙酮(AR,SCR®,CN) 在-20 ℃下,避光萃取14 h,在荧光仪(Turner Designs,San Jose,CA)上以酸性荧光法测叶绿素a (Chl a)[8]。水样经靛酚蓝法、硅钼蓝法和磷钼蓝法,以紫外-可见分光光度仪(Cary Series, Agilent Technologies®) 测氨氮(NH4+-N)、硅酸盐(SiO32--Si)和溶解性活性磷(Soluble reactive phosphorus, SRP)的浓度[9]。基于咪唑-铬圈法,以营养盐分析仪(AQ400, Seal Analytical®)测硝酸盐(NO3--N)和亚硝酸盐(NO2--N)的含量。
1.4 数据处理 1.4.1 水采鉴定结果处理藻种优势度指数(Y=ni/N×fi),并取Y>0.02的藻种作为优势种[10]。N表示所有藻种密度之和,ni表示第i种藻的密度,fi为该藻种的出现频率。
1.4.2 生产力计算水中18O16O的相对丰度(18R)、相对于参比样品(Rreference)的δ18O(O2)(‰)和氧氩比过饱和度(Δ(O2/Ar)(%))分别由以下公式计算(式(1)~(3)[5]),其中样品培养结束和零时刻分别用sample和t0标注。
| $ { }^{18} R=\frac{{ }^{18} O}{{ }^{16} O}=\frac{(m / z 34)}{2 \times(m / z 32)+(m / z 34)} 。$ | (1) |
| $ \delta^{18} O\left(O_2\right)=\left(\frac{R_{\text {sample }}}{R_{\text {reference }}}-1\right) \times 1000 。$ | (2) |
| $ \Delta\left(O_2 / A r\right)=\left[\frac{\left(O_2 / A r\right)_{\text {sample }}}{\left(O_2 / A r\right)_{t 0}}-1\right] \times 100 。$ | (3) |
由式4计算NCP(mmol ·m-3·h-1)[5]。
| $ N C P=\left[\frac{\left(O_2 / A r\right)_{t_2}}{\left(O_2 / A r\right)_{\text {reference }}}-\frac{\left(O_2 / A r\right)_{t 1}}{\left(O_2 / A r\right)_{\text {referennee }}}\right] \times \frac{\left[O_2\right]_{t_1}}{\left(t_2-t_1\right)} \text {. } $ | (4) |
其中t1和t2分别代表培养的始末时间点,参比样品的O2/Ar用reference标注。
根据式(5),计算GPP(mmol ·m-3·h-1)[5]。
| $ G P P=\left[\frac{\delta^{18} O\left(O_2\right)_{t_2}-\delta^{18} O\left(O_2\right)_{t_1}}{\delta^{18} O_{\text {water }}-\delta^{18} O\left(O_2\right)_{t_1}}\right] \times \frac{\left[O_2\right]_{t_1}}{\left(t_2-t_1\right)} $ | (5) |
培养实验前后,溶解氧浓度([O2]: mmol· m-3)和同位素比例(δ18O) 的变化分别用t1和t2标注。δ18Owater代表加入H218O后培养水样中的H218O所占比例的增量,溶氧饱和浓度按水温和盐度计算[11]。此外,使用平衡水的18O16O、16O16O以及40Ar信号做误差矫正。
利用NASA数据(https://oceancolor.gsfc.nasa.gov/l3/)得出现场培养的日均光强,并根据式6拟合GPP和NCP的光响应曲线[12]。
| $ P=P_{\max } \cdot\left(1-e^{-\frac{\alpha \cdot E}{P_{\max }}}\right) \cdot e^{-\frac{\beta \cdot E}{P_{\max }}} 。$ | (6) |
式中:P分别代表GPP和NCP(mmol ·m-3·h-1);E为光强(μmol·m-2·s-1);Pmax、α和β为拟合系数。现场培养没有出现明显光抑制情形时,β等于0。
根据叶绿素荧光f与Chl a实测值的线性关系(Chl a=1.119 2 f + 0.206,R2=0.947 8),拟合Chl a随深度的变化。结合光响应曲线拟合系数,计算水柱积分GPP(mmol· m-2·h-1, 式(7))与水柱积分NCP(mmol·m-2·h-1, 式(8))。
| $ \begin{gathered} G P P=\int\limits_{Z=0}^Z \operatorname{Chl} a(z) \cdot P_{\max } \cdot\left[1-e^{-\frac{\alpha \cdot E(z)}{P_{\max }}}\right] \cdot \\ {\left[e^{-\frac{\beta \cdot E(z)}{P_{max }}}\right] \mathrm{d} z \cdot { Daytime }} \end{gathered} $ | (7) |
| $ \begin{aligned} & N C P=\int\limits_{Z=0}^Z \operatorname{Chl} a(z) \cdot P_{\max }^{\prime} \cdot\left[1-e^{-\frac{\alpha^{\prime} \cdot E(z)}{P_{\max }}}\right] \cdot \\ & {\left[e^{-\frac{\beta^{\prime} \cdot E(z)}{P_{ {max }}}}\right] \mathrm{d} z \cdot { Daytime }-R \cdot { Nighttime }} \end{aligned} $ | (8) |
式中:Pmax、α和β均为GPP-E曲线拟合系数;P'max、α'和β'均为NCP-E曲线拟合系数;z代表深度(m);Daytime与Nighttime分别为长江口白天与夜晚的时长(https://orchidculture.com/COD/daylength.html);R表示夜晚群落呼吸耗氧,由培养实验的黑暗实验组O2消耗量推算得出。
1.4.4 数据汇总统计对于模拟实验Ⅱ算出的GPP和NCP,利用统计软件SPSS 24做单因素方差分析(One-way ANOVA);将四极杆质谱得出的16O16O、18O16O和Ar信号以及δ18O(O2)、Δ (O2/Ar)、GPP、NCP等参数用绘图软件sigmaplot12.5呈现;使用Ocean Data View 5.1.7制作盐度、浊度和Chl a平面图。
2 结果 2.1 质谱性能测试分离后的气体总压力保持在10-6mbar以下,在四极杆质谱的检测量程内。通过扫描分析显示,O2(m/z 32)、18O16O (m/z 34)和Ar (m/z 40) 峰型对称,无杂质峰干扰(见图 2)。
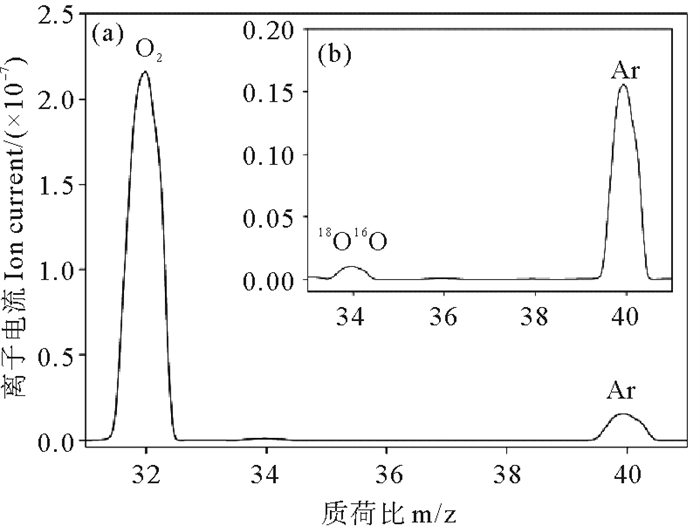
|
图 2 氧气(a)、重氧和氩气(b) 扫描示意图 Fig. 2 The schematic diagram of the scan of O2 (a), 18O16O and Ar (b) |
温盐垂向剖面(见图 3)显示,最大浑浊带表层温度略高于21 ℃、锋面地带和舟山海域海表温度都在20~21 ℃,该温度已达到浮游植物生长条件。其中,锋面地带5~7 m出存在明显温盐跃层;舟山海域温盐跃层在深度15 m处。
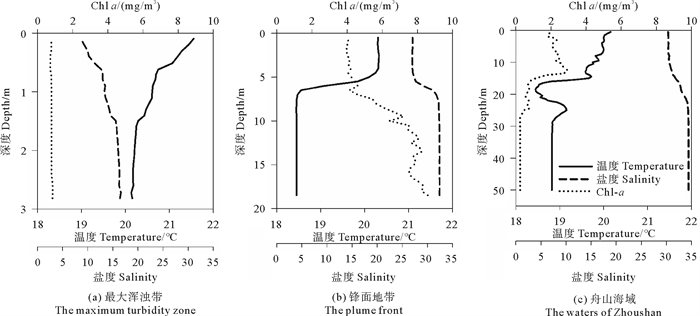
|
图 3 站位温度、盐度和叶绿素a的垂向剖面 Fig. 3 Vertical profiles of temperature, salinity and Chlorophyll a |
SRP、Si、NO3--N、NO2--N和Kd均由最大浑浊带到外海依次递减,其中最大浑浊带受长江输入影响,各营养盐充足,但光衰减系数Kd高达1.89,浊度极高,表明浮游植物处于严重光限制(见表 1)。
|
|
表 1 采样水层的部分物理参数、叶绿素a (mg/m3)和各项营养盐(μmol/L)含量 Table 1 Part of physical variables, Chl a(mg/m3) and several nutrient contents (μmol/L) in the sampling water layer |
在温度、光照与营养盐共同影响下,调查区表层叶绿素分布呈现近岸低,122.5°E—123.0°E处高的特征,变化范围为0~10 mg/m3(见图 4(c)),锋面地带表层Chl a明显高于舟山海域和最大浑浊带。Chl a垂向剖面(见图 3)显示,最大浑浊带Chl a普遍较低,不足1 mg/m3;锋面地带在温盐跃层以下,Chl a逐渐上升,并在底层达到极高值,Chl a平均含量高于5 mg/m3;舟山海域Chl a在温盐跃层开始迅速下降,在30 m以深降至0.5 mg/m3以下。
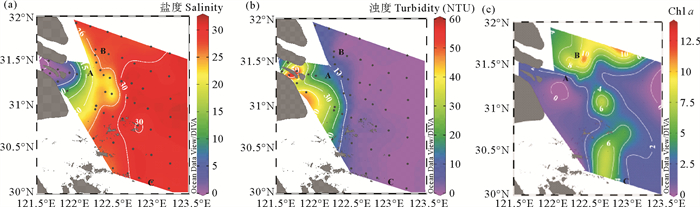
|
图 4 长江口表层盐度分布(a), 长江口表层浊度(NTU)分布(b)及长江口表层叶绿素a (mg/m3)分布(c) Fig. 4 The distribution of salinity(a), turbidity (NTU)(b) and Chl a contents (mg/m3)(c) in the surface layer off the Changjiang River Estuary |
浮游植物种群结构呈现明显空间变化。硅藻是最大浑浊带和锋面地带的优势种,甲藻成为舟山群岛附近的优势种。其中,最大浑浊带的藻密度最低;咸淡水混合的锋面地带藻密度最高,绝大多数为骨条藻,种群结构较单一;舟山海域以东海原甲藻为主,并伴随其它甲藻(见表 2)。
|
|
表 2 各区域采样水层浮游植物优势种 Table 2 Dominant species of phytoplankton in the sampling water layer at each region |
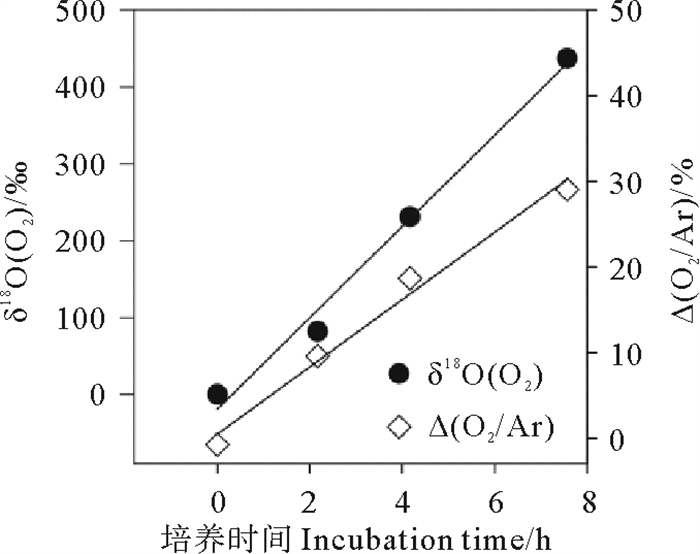
藻液中δ18O(O2)与Δ(O2/Ar)随时间线性增长(见图 5)(δ18O(O2)=59.36t-18.93,R2=0.989 2;Δ(O2/Ar)=38.44t + 9.509,R2=0.986 6)。光合速率稳定,GPP和NCP分别为(19.84±1.38)和(10.33±0.67) mmol·m-3·h-1。
|
图 5 δ18O (O2)与Δ(O2/Ar) 随培养时间的变化 Fig. 5 Changes of δ18O(O2)and Δ(O2/Ar) with incubation |
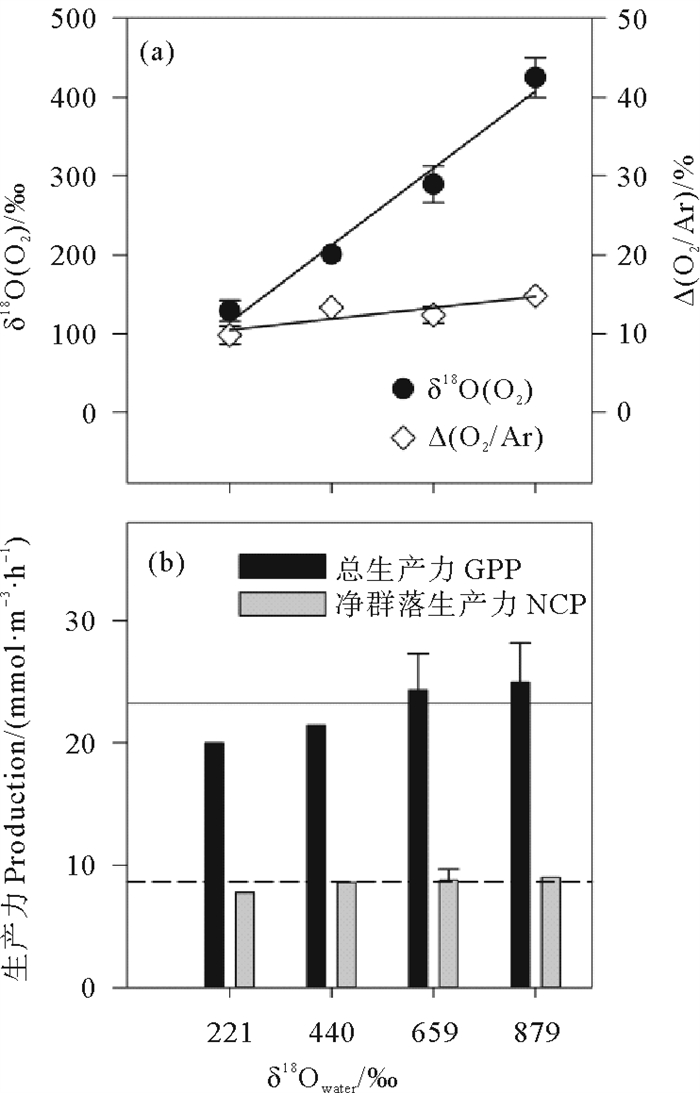
添加微量H218O做标记(δ18Owater约221‰),MIMS也能灵敏地检出δ18O(O2)的增加(见图 6(a))。MIMS测得δ18O(O2)与δ18Owater呈线性相关(δ18O(O2)=0.458 δ18Owater+ 2.306,R2=0.958 0)。而δ18Owater对Δ(O2/Ar)几乎没有影响(见图 6(b)) (Δ(O2/Ar)=0.006 414 δ18Owater+ 9.034,R2=0.749 2)。GPP、NCP分别为(23.24±1.89) 和(8.64±0.30) mmol· m-3·h-1,实验浓度下18O的添加对GPP和NCP无显著影响(One-way ANOVA,p>0.05)。
|
图 6 (a)δ18O (O2)与Δ (O2/Ar)随δ18Owater的变化和(b) 各实验组GPP与NCP Fig. 6 Changes of δ18O (O2) and Δ(O2/Ar) with δ18Owater(a), GPP and NCP (b) in each group |
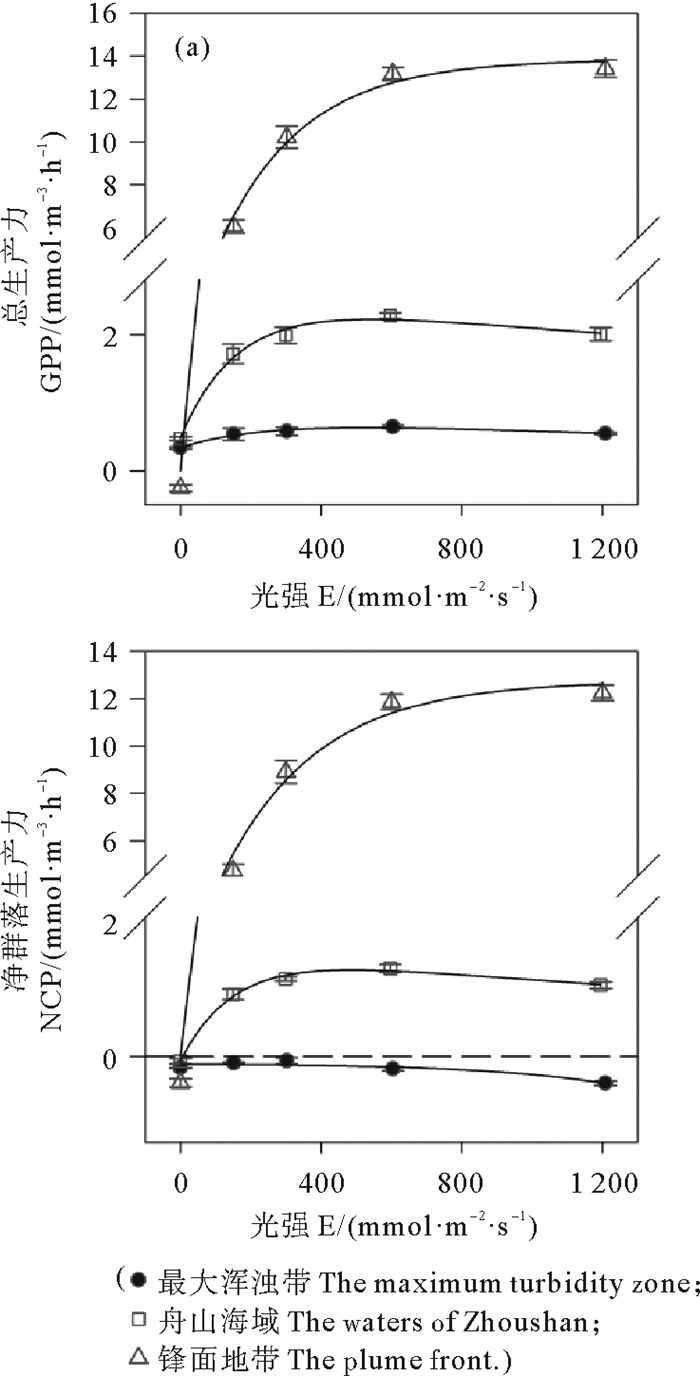
在最大浑浊带,随培养光强增加,GPP略微增加(见图 7(a)),NCP并未随光强的增大而增加(见图 7(b))。生物量高的锋面地带随培养光强增加,GPP和NCP大幅度增加,强光下进入平台期(见图 7)。在舟山海域,强光下GPP和NCP出现下降趋势(见图 7)。
|
图 7 GPP(a) NCP(b)对光强变化的响应 Fig. 7 The responses of GPP(a) and NCP(b) to irradiance variations |
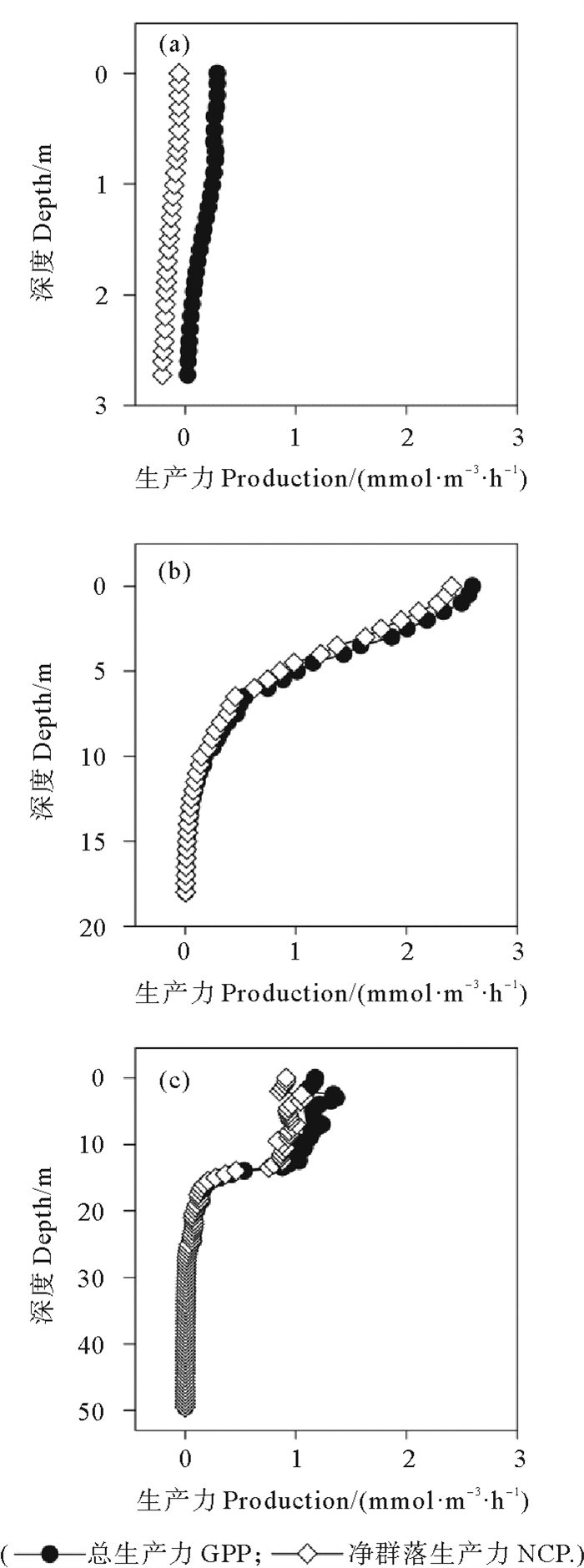
垂向剖面显示,在真光层浅且生物量低的最大浑浊带,GPP和NCP在各深度均很小(见图 8(a))。在锋面地带,GPP与NCP的垂向分布高度一致,从深度约2 m处迅速递减,到10 m以下稳定在较低水平(见图 8(b))。在舟山海域,GPP与NCP在混合层0~15 m随深度变化均较小,深度15 m以下才开始降低(见图 8(c))。
|
((a) 最大浑浊带The maximum turbidity zone;(b) 锋面地带The plume front;(c) 舟山海域The waters of Zhoushan。) 图 8 各区域拟合GPP与NCP垂向剖面 Fig. 8 Depth profiles of fitted GPP and NCP |
在异养状态的最大浑浊带, 水柱积分GPP最小,水柱积分NCP为负; 在水体深且透明度大的舟山海域,水柱积分GPP与NCP均远高于锋面地带,周转效率略低于锋面地带(见表 3)。
|
|
表 3 水柱积分GPP、NCP (mmol·m-2·d-1)及周转效率 Table 3 Column integrated GPP, NCP (mmol·m-2·d-1)and the turnover rate in each region |
本研究使用MIMS检测18O16O、16O16O等信号,约4min达到平衡,精度可达0.3‰,国外相关报道的精度相近[5]。本研究的模拟实验表明,培养时间与18O的添加均未对GPP和NCP造成显著影响。在此基础上设计的现场培养实验中,培养站位的GPP和NCP均出现对光照的响应,且重现性良好(见图 7)。另一方面,根据碳和氧Redfield比值,得出长江口春季以碳为单位的水柱积分GPP。鉴于短时间14C培养得到的PP与GPP相近[13],将该GPP结果与往年东海海区PP范围进行比较(见表 4),其中往年PP的高值往往出现在锋面或沿岸上升流区,在河口混浊区域出现低值,这些区域GPP与本研究采样区域吻合。综上所述,MIMS与18O培养法联用可精确地研究长江口海域春季浮游植物的光合生产。
|
|
表 4 历年东海陆架地区积分生产力范围[14-19] Table 4 Recorded integrated carbon production rate range in the East China Sea |
本研究水柱积分GPP和NCP结果差异显著(见表 3),该差异源于长江口海域的物理环境。长江径流冲淡水在5月往往由东南转向东北[7],并在122.6°E附近与底部高盐度的台湾暖流相作用,形成表层盐度梯度极大的羽状锋[20]。此处为咸淡水混合锋面地带,光限制减弱,是浮游植物光合生长的理想场所。而在长江口东南部的舟山群岛附近海域,传统观点认为上升流和地形促进了浮游植物的高生产力,形成支持舟山渔场的环境条件[7],近年来的研究指出,尽管冲淡水主体在春末转向北部,南部浙闽沿岸水域仍受一部分冲淡水影响,并形成底层锋面,位于底层和表层锋面之间的等深线30~50 m狭长区域,由于底部锋面的层化能限制沿岸高浊度的水体混合,该区域的光照条件得以改善,是藻华的热点地区[21]。
从种群结构上分析,不难推测锋面水柱积分GPP和NCP主要由表层水体的硅藻贡献,而舟山海域水柱积分GPP和NCP主要由0~15 m水体的甲藻贡献。早先的研究将长江口海域分为淡水、沿岸低盐、外海高盐等不同浮游生物群落[7]。对2009年春季长江口海域浮游植物种群聚类分析显示,长江口海域可分为以河口硅藻为主的混浊区带,122.5°E以西的中肋骨条藻聚集区以及甲藻占比高的外海,孔凡洲等指出,在浑浊带,藻类多样性高,骨条藻、帕拉藻、圆筛藻等并存,但生物量极低;122.5°E以西混合区域多样性最低,骨条藻密度高达3.2×106cells/L,占比高达94%;外海地区东海原甲藻密度可达52.7×104cells/L[22]。除了舟山海域站位的东海原甲藻测得密度偏低以外,本次浮游植物种群调查结果与2009年春季高度吻合(见表 2)。综上所述,在长江口物理环境的背景下,不同群落表现出不同的生理活性,从而形成了显著的光合生产空间变化。
4 结语本研究将18O示踪、MIMS测定的快捷监测方法应用于长江口海域GPP和NCP的评估,发现锋面地带和舟山海域水柱积分GPP和NCP远远大于异养状态的最大混浊带,且周转效率均很高;锋面地带和舟山海域不同的物理环境,使得两区域的浮游植物种群结构不一,锋面地带的光合生产主要来自表层(0~5 m)的硅藻,而舟山海域0~15 m水层的甲藻贡献高生产力。该方法对于研究海洋生态具有重要意义,值得进一步完善。
致谢: 该航次(航次编号:NORC2020-03-01)由“浙渔科”2号科考船实施,在此一并致谢。
| [1] |
焦念志, 梁彦韬, 张永雨, 等. 中国海及邻近区域碳库与通量综合分析[J]. 中国科学: 地球科学, 2018, 61(11): 1393-1421. Jiao N, Liang Y, Zhang Y, et al. Carbon pools and fluxes in the China Seas and adjacent oceans[J]. Science China Earth Sciences, 2018, 61: 1393-1421. (  0) 0) |
| [2] |
戴民汉, 翟惟东, 鲁中明, 等. 中国区域碳循环研究进展与展望[J]. 地球科学进展, 2004, 19(1): 120-130. Dai M, Zhai W, Lu Z, et al. Regional studies of carbon cycles in China: Progress and perspectives[J]. Advance in Earth Sciences, 2004, 19(1): 120-130. (  0) 0) |
| [3] |
Kemp W M, Smith E M, Marvin-DiPasquale M, et al. Organic carbon balance and net ecosystem metabolism in Chesapeake Bay[J]. Marine Ecology Progress Series, 1997, 150(1): 229-248. (  0) 0) |
| [4] |
Regaudie-de-Gioux A, Lastermas S, Agusti S, et al. Comparing marine primary production estimates through different methods and development of conversion equations[J]. Frontiers in Marine Science, 2014, 1(19): 1-14. (  0) 0) |
| [5] |
Ferrón S, Valle D, Björkman K, et al. Application of membrane inlet mass spectrometry to measure aquatic gross primary production by the 18O in vitro method[J]. Limnology and Oceanography: Methods, 2016, 14(9): 610-622. DOI:10.1002/lom3.10116 (  0) 0) |
| [6] |
Gross M, Caprioli R. Membrane inlet mass spectrometry (MIMS) in historical perspective[J]. The Encyclopedia of Mass Spectrometry, 2016, 9: 143-148. (  0) 0) |
| [7] |
周名江, 颜天, 邹景忠. 长江口邻近海域赤潮发生区基本特征初探[J]. 应用生态学报, 2003, 14(7): 1031-1038. Zhou M, Yan T, Zou J. Preliminary analysis of the characteristics of red tide areas in Changjiang River estuary and its adjacent sea[J]. Chinese Journal of Applied Ecology, 2003, 14(7): 1031-1038. (  0) 0) |
| [8] |
中华人民共和国国家质量监督检验检疫总局. 海洋调查规范第6部分: 海洋生物调查[M]. 北京: 中国标准出版社, 2007: 1-157. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China. Marine Survey Specifications Part 6: Marine Biological Survey[M]. Beijing: China Standard Press, 2007: 1-157. (  0) 0) |
| [9] |
祝陈坚. 海水分析化学实验[M]. 青岛: 中国海洋大学出版社, 2006: 40-69. Zhu C. Analytical Chemistry Experiment of Seawater[M]. Qingdao: China Ocean University Press, 2006: 40-69. (  0) 0) |
| [10] |
何青. 长江口及东海陆架区浮游植物群集生态学研究[D]. 北京: 中国科学院大学, 2008. He Q. Ecological Study of Phytoplankton Assemblage in the Changjiang Estuary and the East China Sea Shelf[D]. Beijing: University of Chinese Academy of Sciences, 2008. (  0) 0) |
| [11] |
Millero F J. Chemical Oceanography[M]. New York, USA: CRC Press, 2013: 229-232.
(  0) 0) |
| [12] |
Prado C, Moraes J. Photosynthetic capacity and specific leaf mass in twenty woody species of Cerado vegetation under field conditions[J]. Photosynthetica, 1997, 33(1): 103-112. DOI:10.1023/A:1022183423630 (  0) 0) |
| [13] |
Marra J, Approaches to the measurement of plankton production, Williams P, Thomas D, Reynolds C, et al. Phytoplankton Productivity: Carbon Assimilation in Marine and Freshwater Ecosystems[M]. Oxford, UK: Blackwell Science Ltd, 2002: 222-264.
(  0) 0) |
| [14] |
Ning X, Daniel V, Liu Z, et al. Standing stock and production of phytoplankton in the estuary of the Changjiang (Yangtse River) and the adjacent East China Sea[J]. Marine Ecology-Progress Series, 1988, 49: 141-150. DOI:10.3354/meps049141 (  0) 0) |
| [15] |
焦念志, 王荣, 李超伦. 东海春季初级生产力与新生产力的研究[J]. 海洋与湖沼, 1998, 29(2): 135-140. Jiao N, Wang R, Li C. Primary production and new production in spring in the East China Sea[J]. Oceanologia et Limnologia Sinica, 1998, 29(2): 135-140. (  0) 0) |
| [16] |
Gong G, Wen Y, Wang B, et al. Seasonal variation of chlorophyll a concentration, primary production and environmental conditions in the subtropical East China Sea[J]. Deep Sea Research Part Ⅱ: Topical Studies in Oceanography, 2003, 50(6): 1219-1236. (  0) 0) |
| [17] |
Chen Y, Chen Y, Gong G, et al. Phytoplankton production during a summer coastal upwelling in the East China Sea[J]. Continental Shelf Research, 2004, 24(12): 1321-1338. (  0) 0) |
| [18] |
Liu X, Laws E, Xie Y, et al. Uncoupling of seasonal variations between phytoplankton chlorophyll a and production in the East China Sea[J]. Journal of Geophysical Research: Biogeosciences, 2019, 124(7): 2400-2415. (  0) 0) |
| [19] |
Wang K, Chen J, Jin H, et al. Summer nutrient dynamics and biological carbon uptake rate in the Changjiang River plume inferred using a three end-member mixing model[J]. Continental Shelf Research, 2014, 91: 192-200. (  0) 0) |
| [20] |
朱建荣, 丁平兴, 胡敦欣. 2000年8月长江口外海区冲淡水和羽状锋的观测[J]. 海洋与湖沼, 2003, 34(3): 249-255. Zhu J, Ding P, Hu D. Observation of the diluted water and plume front off the Changjiang River estuary during August 2000[J]. Oceanologia et Limnologia Sinica, 2003, 34(3): 249-255. (  0) 0) |
| [21] |
Wang Y, Wu H, Gao L, et al. Spatial distribution and physical controls of the spring algal blooming off the Changjiang River Estuary[J]. Estuaries and Coasts, 2019, 42: 1066-1083. (  0) 0) |
| [22] |
Kong F, Xu Z, Yu R, et al. Distribution patterns of phytoplankton in the Changjiang River estuary and adjacent waters in spring 2009[J]. Chinese Journal of Oceanology and Limnology, 2016, 34(5): 902-914. (  0) 0) |
 2023, Vol. 53
2023, Vol. 53


