2. 天津渤海水产研究所, 天津 300457
美人鱼发光杆菌(Photobacterium damselae)又称为美人鱼弧菌(Vibrio damsela),包括2个亚种美人鱼发光杆菌美人鱼亚种( Photobacterium damselae subsp. damselae)和美人鱼发光杆菌杀鱼亚种(Photobacterium damselae subsp. piscicida),都是革兰氏阴性细菌性鱼类病原体,呈杆状或者球杆状,在海洋中广泛存在。美人鱼发光杆菌杀鱼亚种是巴斯德菌病的致病因子[7]。美人鱼发光杆菌美人鱼亚种不仅是野生和养殖鱼类的病原体,也是海洋动物和人类的病原体,没有明显的宿主特异性,最初于1981年被分离为雀鲷(Chromis punctipinnis)皮肤溃疡的致病因子[6]。它是导致各种海洋物种溃疡和出血性败血症的主要病原体,如五条鰤(Seriola quinqueradiata)[11]、卵形鲳鲹(Trachinotus ovatus)[3]、军曹鱼(Rachycentron cana-dum)[2]、条石鲷(Oplegnathus fasciatus)[1]等多种海洋经济鱼类。该菌使患病鱼临床表现为体表溃疡,败血症,鳍部出血,断尾。据报道,美人鱼发光杆菌美人鱼亚种引起人类伤口感染和致命性坏死性筋膜炎[8-9],并且还从患有菌血症或脑膜炎的患者中分离出来并可能导致致命的结果[5]。
2018年6月,天津市滨海新区某海水工厂化养殖场半滑舌鳎(Cynoglossus semilaevis Gunther)一周内死亡率达到20%,对患病濒死的半滑舌鳎进行病原分离,得到3株优势菌,通过回归感染实验确定菌株PSC0601对该鱼致病,通过细菌形态,生理生化和16S rDNA基因序列对致病菌进行鉴定,通过药敏实验和病理组织切片,以期为半滑舌鳎的健康养殖和病害的防治提供理论依据。
1 材料与方法 1.1 实验材料濒死患病半滑舌鳎选自天津市滨海新区某海水养殖场,体长(21±2) cm, 体质量(40±2) g,健康半滑舌鳎选自天津市滨海新区乾盛源半滑舌鳎养殖公司,体长(19±2) cm, 体质量(36±3) g,暂养7 d后用于感染实验。
细菌分离所用的2216E和TCBS培养基购自青岛海博生物技术有限公司;脑心浸液培养基购自青岛海博生物技术有限公司;法国API 20E细菌鉴定系统试剂条购自生物梅里埃中国有限公司;16S rDNA所用的引物购自生工生物工程(上海)股份有限公司合成;TAE缓冲液购自上海百赛生物科技有限公司;药敏实验所用的药敏纸片购自温州市康泰生物科技有限公司。
1.2 病原菌的分离培养在无菌条件下解剖具有典型症状的濒死病鱼,取病鱼的心、肾脏、肝脏、脾脏、肠道等部位,加入灭菌的磷酸盐缓冲液(PBS)研磨,取研磨液划线接种于2216E平板上,置于25 ℃培养箱中培养24 h,在平板上挑取形态一致的优势菌落进行多次纯化培养,直到获得纯培养菌株后,放入-80 ℃冰箱保存备用。
1.3 致病菌的鉴定 1.3.1 致病菌的形态学观察挑取纯培养菌株中的单菌落,分别在2216E琼脂平板和血琼脂平板上进行菌落形态和溶血性的观察,并且对分离后的菌株进行革兰氏染色,通过镜检观察其形态和大小。
1.3.2 致病菌16S rDNA基因序列测定与系统发育学分析制备模板DNA:挑取PSC0601菌株的单菌落置于已装好100 μL超纯水的离心管中,煮沸10 min,12 000 g离心10 min,取上清液为模板DNA。PCR扩增所用的引物由生工生物工程(上海)股份有限公司合成,上下游引物序列分别为27F(5′-AGAGTTTGATCCTGGCTCAG -3′)和1492R (5′-CTACGGTTACCTTGTTAGGAC-3′)。50 μL PCR反应体系:Taq DNA聚合酶25 μL、上下游引物各1.5 μL、灭菌双蒸水20 μL、DNA模板2 μL。PCR反应条件:95 ℃预变性3 min;98 ℃变性10 s;55 ℃复性15 s;72 ℃延伸10 s,30个循环;最后72 ℃温育5 min。产物经琼脂糖凝胶电泳。
对该菌株的测序结果经过拼接后,通过NCBI的blast检索系统进行同源性分析,下载同源性高的菌株序列和其他相关菌种的菌株序列。然后采用MEGA7.0软件构建系统发育树。
1.3.3 致病菌的生理生化鉴定按照所购买的产品说明书所述以法国API 20E细菌鉴定系统的生化实验测定细菌的生理生化指标。
1.4 人工回归感染实验将PSC0601菌株接种于BHI(含2.0% NaCl)液体培养基,30 ℃恒温摇菌24 h,麦氏比浊法调整细菌浓度为1.0×108 CFU/mL, 无菌生理盐水稀释为1.0×106、1.0×105、1.0×104、1.0×103和1.0×102 CFU/mL,共5个稀释度。
选择规格均一、活力好的半滑舌鳎进行回归感染实验。实验在60 L定制水族缸中进行,随机分成6组,5组实验组,1组对照组,每组10条鱼,采用腹腔注射的方式,实验组每尾鱼腹腔注射菌液0.2 mL,对照组鱼腹腔注射无菌生理盐水0.2 mL。注射后,7 d观察试验鱼的发病症状及死亡情况,死鱼立即解剖取样,并从死鱼的病灶进行细菌的分离鉴定。采用Bliss法测定7 d的LD50。
1.5 致病菌的药敏试验药敏实验采用纸片扩散法(K-B法),挑取单菌落制成浓度约为1.0× 108 CFU/mL菌悬液,无菌棉签蘸取纯化的菌液(0.5个麦氏浊度),在培养基表面涂布均匀,培养基底下垫一张适用于药敏试验纸片粘贴标准的六方形白纸,将药敏纸片按照六方形白纸安放位置分别贴放到培养基表面,25 ℃培养24 h,测定药敏纸片抑菌圈直径,重复2次,取平均值,按照所购抗菌药物药敏纸片的产品使用说明,对结果进行判定。
1.6 主要器官组织病理观察用解剖工具分别取患病半滑舌鳎和正常半滑舌鳎的肝脏和肠。用Bouin氏液固定24 h,直接用70%乙醇洗数次,再用70%~100%乙醇逐级脱水45~60 min,然后二甲苯透明,石蜡包埋,用石蜡切片机切片,HE染色,中性树胶封片,在显微镜下观察并拍照保存。
2 结果 2.1 患病鱼临床症状检查结果患病半滑舌鳎拒食,行动迟缓,受惊吓后,过度反应,体表鳍条、尾鳍无明显症状,腹部肿胀明显,解剖腹腔内有积水,内脏组织器官出血严重。通过水浸片显微镜下观察鳃、体表粘液及病变组织,未发现真菌及寄生虫。
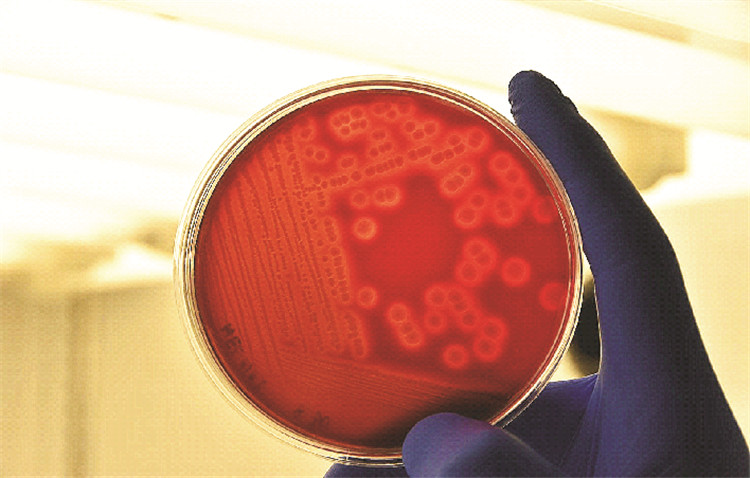
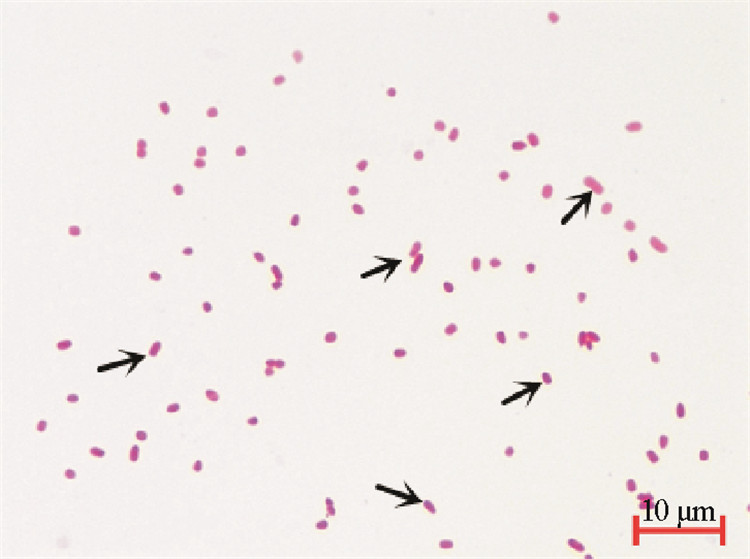
2.2 病原菌的分离及形态学观察分别从患病半滑舌鳎肝脏和肠道分离得到3株优势菌, 经过人工感染预试验证实其中优势菌PSC0601为致病菌,其他2株菌PSC0602、PSC0603均不致病。在2216E琼脂平板上25 ℃培养24 h后, PSC0601菌株的菌落为圆形, 乳白色, 表面光滑湿润, 边缘光滑, 菌落直径1~2 mm。病原菌在绵羊血平板上呈现典型的β型溶血(见图 1),病原菌进行革兰氏染色,在镜下观察,呈球杆状革兰氏阴性菌(见图 2箭头所示)。
|
图 1 PSC0601菌株血琼脂培养 Fig. 1 PSC0601 strain blood agar culture |
|
图 2 PSC0601菌株革兰氏染色 Fig. 2 PSC0601 strain Gram stain |
采用通用引物扩增所分离菌株的16S rDNA基因,测序结果经过去除载体序列和拼接后,PSC0601菌株16S rDNA基因的片段为1 454 bp,在NCBI数据库中进行Blast比对,结果显示PSC0601菌株与美人鱼发光杆菌的同源性最高,均都达到99%,所以不能以此直接区分PSC0601菌株为美人鱼亚种或杀鱼亚种,还要通过生理生化特性进行分析才能确定其为美人鱼亚种或杀鱼亚种。
在GenBank数据库中选取同源性较高的美人鱼杆菌菌株和不同亲缘关系的菌株的16S rDNA序列,利用MEGA 7.0软件构建系统发育树(见图 3),进行系统进化分析,结果发现PSC0601菌株与美人鱼发光杆菌的2个亚种处为同一分支,进一步证明PSC0601菌株为美人鱼发光杆菌。

|
图 3 基于菌株PSC0601的16S rDNA序列所构建的系统发育树 Fig. 3 Phylogenetic tree constructed based on the 16S rDNA sequence of strain PSC0601 |
生理生化结果表明(见表 1),该PSC0601菌株在25和37 ℃均生长;在革兰氏染色、β-半乳糖苷酶、赖氨酸脱羧酶、色氨酸脱氨酶、H2S产生、鸟氨酸脱酸酶、吲哚产生等生化项目结果显示为阴性;在氧化酶、精氨酸双水解酶、脲酶、V-P实验、葡萄糖、硝酸盐还原等生化项目结果显示为阳性;在O-F实验结果显示能发酵;该PSC0601菌株在API 20E细菌鉴定系统编号为201500457,与美人鱼发光杆菌美人鱼亚种生理生化特征一致。
|
|
表 1 菌株PSC0601的主要生理生化指标检测结果 Table 1 Test results of main physiological and biochemical indexes of strain PSC0601 |
感染实验结果显示,注射菌株PSC0601的实验组半滑舌鳎在感染1 d拒食、受惊吓后,过度反应、腹腔肿大。在感染的2 d注射浓度为1×106组最先开始死亡,感染至7 d该组实验鱼全部死亡,人工感染实验发病鱼与自然发病鱼的症状相同,体表腹腔肿大,腹部两侧肌肉出血,体内组织器官出血严重。而对照组及另一实验组(1×102)不表现出任何症状,无一死亡(见表 2)。从人工感染后发病的濒死半滑舌鳎肝脏及肠道处分离细菌,均可分离到大量菌落形态高度一致的细菌,其菌落形态、大小以及生理生化特征均与原感染菌PSC0601相同,再次感染半滑舌鳎,也导致其死亡,说明所分离的菌株PSC0601对半滑舌鳎具有致病性。根据表 2的实验结果, 按照Bliss法, 计算得到半数致死量LD50为1.5×104 CFU/g,菌株PSC0601有强的致病性。
|
|
表 2 半滑舌鳎人工回归感染实验结果 Table 2 Half-smooth tongue sole artificial regression infection experiment results |
通过对48种抗菌药物药敏实验结果显示(见表 3),PSC0601菌株对氟苯尼考、氯霉素、阿莫西林、阿奇霉素、壮观霉素、头孢哌酮等20种药物高度敏感;对利福平、克拉霉素、罗红霉素、诺氟沙星、多黏菌素B、新霉素、呋喃唑酮7种药物中度敏感;对土霉素、四环素、红霉素、环丙沙星、庆大霉素、链霉素等21种药物不敏感。
|
|
表 3 菌株PSC0601药敏实验结果 Table 3 Results of antibiotic sensitivity test of strain PSC0601 |
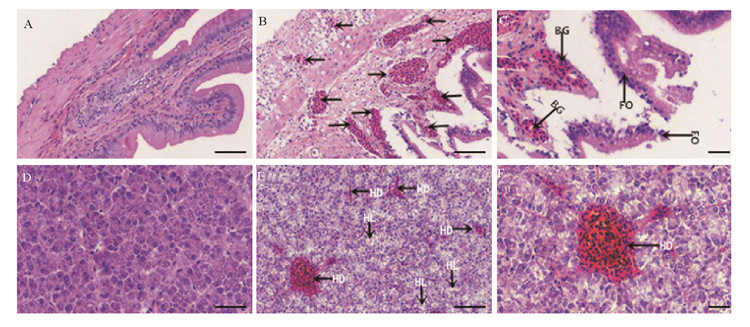
采用HE染色法对患病鱼肝脏及肠道进行组织病理观察(见图 4),肝脏病理切片显示,肝细胞肿胀,肝细胞索结构紊乱,肝血窦充血明显,肝细胞溶解性坏死。图中肝血窦扩张、充血明显,且这种类型的肝血窦在肝小叶中普遍存在。肠道病理切片显示,肠道中粘膜、粘膜下层、粘膜肌层均出现出血,肠道横纹边缘粘膜上皮结构紊乱、脱落、粘膜固有层出血且局灶性坏死。
|
( A肠道,对照组。B肠道,粘膜、粘膜下层、粘膜肌层出血(向左和向右箭头)。C肠道,粘膜上皮结构紊乱,脱落(箭头FO);粘膜固有层出血(箭头BG)。D肝脏,对照组。E肝脏,肝血窦充血(箭头HD);肝细胞溶解性坏死(箭头HL)。F肝脏,肝血窦扩张充血(箭头HD)。图片A、B、D和E的比例尺=50 μm,图片C和F的比例尺=20 μm。A intestinal, control group. B intestinal, mucosal, submucosal, mucosal muscle layer bleeding (left and right arrows). C intestinal, mucosal epithelial structure disorder, shedding (arrow FO); mucosal lamina propria bleeding (arrow BG). D liver, control group. E liver, hepatic sinus congestion (arrow HD); hepatocyte lytic necrosis (arrow HL). F liver, hepatic sinusoidal dilatation and hyperemia (arrow HD).Scale bar of A、B、D and E=50 μm, Scale bar of C and F=20 μm. ) 图 4 美人鱼发光杆菌感染半滑舌鳎的肠和肝组织病理学变化 Fig. 4 Photobacterium damselae infects the intestinal and liver histopathological changes of half-smooth tongue sole |
美人鱼发光杆菌是公认的鱼类病原体,研究表明该菌对多种海洋经济鱼类致病,目前已陆续从养殖大菱鲆(Psetta maxima)[4]、军曹鱼(Rachycentron canadum)[2]、五条鰤(Seriola quinqueradiata)[11]、条石鲷(Oplegnathus fasciatus)[1]体内分离到该菌并通过人工回归试验证美人鱼发光对以上宿主的致病性。本次研究从患病的半滑舌鳎肝脏、肠道中分离到大量形态均一的菌落, 经形态学、生理生化分析及分子生物学鉴定所得的优势致病菌株为美人鱼杆菌美人鱼亚种。美人鱼发光杆菌美人鱼亚种(Photobacterium damselae subsp.damselae)是美人鱼发光杆菌的一个亚种。据报道,美人鱼亚种已被公认为海洋动物和人类的新兴病原体[10]。患病半滑舌鳎体表腹腔肿胀,腹部两侧肌肉出血。体内肝脏肠道等组织器官出血严重,其中肝脏表现最为严重,鳃轻微出血,脑部解剖出血也非常严重,说明该菌的致病性是很强的。组织病理分析可见肠和肝脏出血严重,进行该菌人工回归感染实验后,与病鱼症状基本一致,从回归感染实验中的患病半滑舌鳎再次进行细菌的分离鉴定,也证实该PSC0601菌株为此次患病半滑舌鳎主要的致病菌。目前国内外关于半滑舌鳎感染美人鱼发光杆菌美人鱼亚种的报道较少,本次研究中,患病半滑舌鳎为典型的出血性败血症与Nan等[12]感染的半滑舌鳎相似,但体表却无明显的溃疡症状。该菌对半滑舌鳎的半数致死量(LD50)为1.5×104 CFU/g,与Nan等[12]从半滑舌鳎所分离菌的半数致死量(LD50)3.1×104 CFU/g相比较低,可能是其不同菌株的毒力不同而导致的。
在细菌分类学研究中, 16S rDNA基因序列是最常用的遗传标记, 通常将16S rDNA基因同源性大于97.5%的菌株为同种菌株[13]。该研究中菌株PSC0601与美人鱼亚种和杀鱼亚种的16S rDNA的基因序列的同源性均达到99%以上。构建系统发育树,显示PSC0601菌株与美人鱼发光杆菌聚为一支,亲缘关系最近,但却不能直接鉴定其种。一些有关美人鱼杆菌的报道表明,API 20E是鉴定美人鱼发光杆菌的一种有效手段,其鉴定该菌株准确率为100%[18]。本次研究中,PSC0601菌株在API 20E细菌鉴定系统编号为201500457,与美人鱼发光杆菌美人鱼亚种生理生化特征一致,并且我们通过对该美人鱼发光杆菌不同种的耐受温度进行补充鉴定,杀鱼亚种在37 ℃下不生长而美人鱼亚种在37 ℃下生长良好,并且API 20E细菌鉴定手册表明美人鱼亚种在25 ℃下生长良好。本研究结果显示,该菌在25和37 ℃下生长良好,进一步证实了PSC0601菌株为美人鱼发光杆菌美人鱼亚种。
目前对于鱼类细菌病的治疗,生产上通常采用抗生素治疗。因为巴斯德菌病是水产养殖中经济损失巨大的主要原因,因此美人鱼发光杆菌杀鱼亚种的抗生素敏感性比美人鱼发光杆菌美人鱼亚种更受关注。从不同国家分离的美人鱼发光杆菌杀鱼亚种菌株被发现对一些抗生素有抗性,如氨苄青霉素,羧苄青霉素,头孢噻吩,头孢唑啉,红霉素,卡那霉素和四环素[14-17],但对于美人鱼发光杆菌美人鱼亚种对多种抗生素抗性的相关报道也陆续增多,包括对四环素,环丙沙星,氟苯尼考,氨苄青霉素,磺胺甲恶唑/甲氧苄啶,氧嗪酸,土霉素,红霉素和青霉素G的抗性[7],对此本研究也对该PSC0601菌株进行了48种抗生素药物的药敏实验分析,该菌株对氟苯尼考、氯霉素、阿莫西林、阿奇霉素、壮观霉素、头孢哌酮等20种药物高度敏感,由于氯霉素等为水产禁用药物,故本结果可为同类药物使用提供参考依据。本研究结果发现该菌对大多数抗生素耐药,我国抗生素仍是水产养殖病害的主要防治措施,水产抗生素滥用不仅会污染水体环境,而且还会加速细菌对抗生素的耐药,因此,还应研究疾病发生的流行病学和病原菌的耐药机制,如开发疫苗、中草药防治[19]、益生菌调控等其他合理有效的方法预防疾病的发生,是实现健康养殖势在必行的重要手段。
4 结语研究显示引起天津市滨海新区某海水工厂化养殖场半滑舌鳎患病的病原菌为美人鱼发光杆菌美人鱼亚种。该菌能使半滑舌鳎的肝脏,肠道等器官发生明显的病理性变化并导致其死亡。该菌对氟本尼考、氯霉素等高度敏感,可以使用这些药物对患病的半滑舌鳎进行治疗。但由于美人鱼发光杆菌对抗生素会产生耐药性,所以为防止再次出现感染该菌导致养殖鱼大量死亡的情况,应加深对该病原体致病机理以及免疫原性的研究,以期达到用该菌的疫苗对其进行有效防治的目的。
| [1] |
王庚申, 许文军, 谢建军, 等. 条石鲷(Oplegnathus fasciatus)源美人鱼发光杆菌杀鱼亚种(Photobacterium damselae subsp. piscicida)的分离鉴定[J]. 渔业科学进展, 2017, 38(2): 151-157. Wang G S, Xu W J, Xie J J, et al. Isolation and identification of Photobacterium damselae subsp. piscicida from diseased rock bream (Oplegnathus fasciatus)[J]. Progress in Fishery Sciences, 2017, 38(2): 151-157. (  0) 0) |
| [2] |
Tran H B, Lee Y H, Guo J J, et al. De novo transcriptome analysis of immune response on cobia (Rachycentron canadum) infected with, Photobacterium damselae subsp. piscicida, revealed inhibition of complement components and involvement of MyD88-independent pathway[J]. Fish&Shellfish Immunology, 2017, 77: 120-130.
(  0) 0) |
| [3] |
宋沙沙, 马红玲, 冯娟, 等. 卵形鲳鲹Tf、TNFα和C-Lys的组织分布及对美人鱼发光杆菌感染的响应[J]. 南方水产科学, 2017, 13(2): 77-84. Song S S, Ma H L, Feng J, et al. Tissue distribution and response to infection of Photobacterium damselae subsp. piscicida of Tf, TNFα and C-Lys in Trachinotus ovatus[J]. South China Fisheries Science, 2017, 13(2): 77-84. DOI:10.3969/j.issn.2095-0780.2017.02.010 (  0) 0) |
| [4] |
吴同垒, 张志强, 李巧玲, 等. 大菱鲆源美人鱼发光杆菌杀鱼亚种的分离鉴定[J]. 中国兽医学报, 2018(2): 301-306. Wu T L, Zhang Z Q, Li Q L, et al. Isolation and identification of Photobacterium damselae subsp. piscicida from turbot[J]. Chinese Journal of Veterinary Science, 2018(2): 301-306. (  0) 0) |
| [5] |
Rivas A J, Lemos M L, Osorio C R. Photobacterium damselae subsp. damselae, a bacterium pathogenic for marine animals and humans[J]. Frontiers in Microbiology, 2013, 4: 283.
(  0) 0) |
| [6] |
Rivas A J, Balado M, Lemos M L, et al. The Photobacterium damselae subsp. damselae hemolysins damselysin and HlyA are encoded within a new virulence plasmid[J]. Infection and Immunity, 2011, 79(11): 4617-4627. DOI:10.1128/IAI.05436-11
(  0) 0) |
| [7] |
Chiu T H, Kao L Y, Chen M L. Antibiotic resistance and molecular typing of Photobacterium damselae subsp. damselae, isolated from seafood[J]. Journal of Applied Microbiology, 2013, 114(4): 1184-1192. DOI:10.1111/jam.12104
(  0) 0) |
| [8] |
Clarridge J E, Zighelboim-Daum S. Isolation and characterization of two hemolytic phenotypes of Vibrio damsela associated with a fatal wound infection[J]. Journal of Clinical Microbiology, 1985, 21(3): 302. DOI:10.1128/JCM.21.3.302-306.1985
(  0) 0) |
| [9] |
Yamane K, Asato J, Kawade N, et al. Two cases of fatal necrotizing fasciitis caused by Photobacterium damsela in Japan[J]. Journal of Clinical Microbiology, 2004, 42(3): 1370-2. DOI:10.1128/JCM.42.3.1370-1372.2004
(  0) 0) |
| [10] |
Labella A, Sanchezmontes N, Berbel C, et al. Toxicity of Photobacterium damselae subsp. damselae strains isolated from new cultured marine fish[J]. Diseases of Aquatic Organisms, 2010, 92(1): 31-40. DOI:10.3354/dao02275
(  0) 0) |
| [11] |
Aoki T, Teru Y, Morimoto N, et al. Complete genome sequence of Photobacterium damselae subsp. piscicida strain ot-51443 isolated from yellowtail (Seriola quinqueradiata) in Japan[J]. Genome Announc, 2017, 5(21): 1-2.
(  0) 0) |
| [12] |
Nan Y, Zhiqiang Z, Tonglei W, et al. isolation and identification of Photobacterium damselae subsp. damselae(PDD) from tongue sole[J]. Animal Husbandry&Feed Science, 2018, 10(2): 99-102.
(  0) 0) |
| [13] |
鲁辛辛, 黄艳飞, 田晓波. 细菌rDNA分类鉴定的方法学研究[J]. 中华检验医学杂志, 2006, 29(5): 435-437. Lu X X, Huang Y F, Tian X B. Methodological study on bacterial rDNA classification and identification[J]. Chinese Journal of Laboratory Medicine, 2006, 29(5): 435-437. DOI:10.3760/j:issn:1009-9158.2006.05.016 (  0) 0) |
| [14] |
Thyssen A, Ollevier F. In vitro antimicrobial susceptibility of Photobacterium damselae subsp. piscicida to 15 different antimicrobial agents[J]. Aquaculture, 2001, 200(3): 259-269.
(  0) 0) |
| [15] |
Kawanishi M, Kijima M, Kojima A, et al. Drug resistance and random amplified polymorphic DNA analysis of Photobacterium damselae ssp. piscicida isolates from cultured Seriola(yellowtail, amberjack and kingfish) in Japan[J]. Letters in Applied Microbiology, 2010, 42(6): 648-653.
(  0) 0) |
| [16] |
Martínez-Manzanares E, Tapia-Paniagua S T, Díaz-Rosales P, et al. Susceptibility of Photobacterium damselae subsp. piscicida strains isolated from Senegalese sole, Solea senegalensis Kaup, and gilthead seabream, Sparus aurata L. to several antibacterial agents[J]. Journal of Fish Diseases, 2008, 31(1): 73-76.
(  0) 0) |
| [17] |
Laganà P, Caruso G, Minutoli E, et al. Susceptibility to antibiotics of Vibrio spp. and Photobacterium damsela ssp. piscicida strains isolated from Italian aquaculture farms[J]. New Microbiologica, 2011, 34(1): 53.
(  0) 0) |
| [18] |
O'Hara C M, Sowers E G, Bopp C A, et al. Accuracy of six commercially available systems for identification of members of the family vibrionaceae[J]. Journal of Clinical Microbiology, 2003, 41(12): 5654-9. DOI:10.1128/JCM.41.12.5654-5659.2003
(  0) 0) |
| [19] |
王洪彬, 李永慧, 吴同垒, 等. 中草药对美人鱼发光杆菌的体外抑菌试验[J]. 黑龙江畜牧兽医, 2018(6): 155-157. Wang H B, Li Y H, Wu T L, et al. In vitro antibacterial test of chinese herbal medicine to Photobacterium damselae[J]. Heilongjiang Animal Science and Veterinary Medicine, 2018(6): 155-157. (  0) 0) |
2. Tianjin Bohai Sea Fisheries Research Institute, Tianjin 300457, China
 2020, Vol. 50
2020, Vol. 50

