2. 中国海洋大学 农业农村部水产动物营养与饲料重点实验室,山东 青岛 266003;
3. 青岛海洋科学与技术试点国家实验室,山东 青岛 266237
蛋氨酸和半胱氨酸是存在于天然蛋白质中的两种含硫氨基酸[1]。据报道,蛋氨酸是鱼类[2]和虾类[3]的必需氨基酸,生物体不能自身合成,而需要从饮食中摄取。一般来说,蛋氨酸是生物体内转甲基作用和胆碱、胸腺嘧啶、肾上腺素等生物合成作用的重要甲基供体[4];同时,蛋氨酸及其中间代谢产物在转录翻译、表观遗传、细胞增殖、各种信号级联和代谢稳态中发挥重要作用[5-6]。蛋氨酸还具有促进抗氧化功能的作用。蛋氨酸和半胱氨酸对几乎所有形式的活性氧都极其敏感,蛋氨酸及其代谢产物容易与活性氧结合从而使其失去活性,由此保护组织免受氧化应激损伤[7]。蛋氨酸很容易与诸多氧化剂发生反应,生成蛋氨酸亚砜,从而有效地除去氧化剂,蛋氨酸亚砜可以通过蛋氨酸亚砜还原酶又转化成蛋氨酸,因此每个蛋氨酸残基都具有更大的抗氧化潜力[8]。
和其他动物一样,水产动物对饲料中必需氨基酸和非必需氨基酸的均衡性有要求[9]。而蛋氨酸和赖氨酸是植物性饲料原料中主要限制性氨基酸[10-11],尤其是在豆类植物蛋白中[12]。因此,在植物蛋白源大规模替代饲料中鱼粉的背景下,添加蛋氨酸和赖氨酸成为了提高水产动物饲料利用率的重要方式。饲料中适宜的蛋氨酸和赖氨酸添加水平还可以改善生物体其他必需氨基酸的利用率,因为它们能够降低其他氨基酸的氧化速率[10]。但是在实际生产中,饲料中的蛋氨酸添加容易缺乏或过量,这两种情况都会对水产动物的生长性能和饲料利用产生不良影响。例如,饲料蛋氨酸缺乏会显著降低大菱鲆的生长性能和饲料利用率[13]。育苗期银鲳(Trachinotus blochii)[14]和海参(Apostichopus japonicus)[15]中,蛋氨酸缺乏或过量都会抑制其生长。
有许多因素会影响水产动物对蛋氨酸的需要量,包括虾的种类、大小、饲料成分、适口性、饲料和环境条件等[16]。研究表明,发育阶段[17]、养殖密度[18]、水流速度[19]、氨基酸的平衡性[20]、离子浓度与pH值[21]和饲料投喂量[22]等诸多因素都会影响鱼虾类的蛋氨酸需求量。文献[23]指出,大部分鱼虾对蛋氨酸的需求量为干物质的0.5%~2%(占饲料粗蛋白的1.5%~5%),且凡纳滨对虾(Litopenaeus vannamei)对蛋氨酸的需要量为饲料干物质的0.66%~0.91%(占蛋白质的1.83%~2.52%)[18, 24-25]。以往关于凡纳滨对虾饲料蛋氨酸需求量的研究条件和方法不同,且结果存在争议,例如,陈义方的研究中设置的蛋氨酸梯度均高于凡纳滨对虾的需求量[26]。霍雅文等[27]和Lin等[25]通过在饲料中添加晶体蛋氨酸研究凡纳滨对虾的蛋氨酸需求量,但晶体蛋氨酸在水中容易溶失。本研究设置的蛋氨酸梯度为饲料干物质的0.54%~1.33%,能够覆盖凡纳滨对虾蛋氨酸缺乏和过量的范围;并且,本研究的实验饲料中以包膜蛋氨酸的形式添加蛋氨酸,旨在探究其对凡纳滨对虾幼虾生长性能、饲料利用和代谢的影响,以确定凡纳滨对虾幼虾的最适蛋氨酸需求量。
1 材料与方法 1.1 实验饲料配方设计与制作基础饲料(G1)的主要蛋白质来源为鱼粉、豆粕、花生粕和谷朊粉;主要脂类来源为鱼油、大豆油和大豆卵磷脂;主要碳源为小麦粉;每组实验饲料添加等量虾壳粉作为诱食剂。饲料中添加0.1%的三氧化二钇作为指示剂,用于表观消化率测定。设计了5组等氮(42%)等脂(7.3%)的饲料。实验饲料的配方及近似组成见表 1,实验饲料的氨基酸近似组成见表 2。
|
|
表 1 实验饲料的组成及成分分析(饲料干物质) Table 1 Composition and composition analysis of experimental feed (dry matter in feed) |
|
|
表 2 实验饲料的氨基酸组成(饲料干物质) Table 2 Amino acid composition of experimental feed (in dry matter of feed) |
包膜蛋氨酸缺乏组的蛋氨酸含量为0.54%(G1)。在缺乏组的基础上添加不同水平的包膜蛋氨酸,使不同处理中的蛋氨酸含量为0.72%(G2)、0.93%(G3)、1.07%(G4)和1.33%(G5)。添加晶体赖氨酸,使日粮中赖氨酸含量达到2%以满足凡纳滨对虾需求[18]。
将所有原料都磨成细粉,然后通过60目网筛。采用逐级放大的方法混合均匀,将粉末与鱼油、大豆油、胆固醇、大豆卵磷脂充分混合。加入冷蒸馏水,直到面团变硬。用制粒机将坚硬的面团压成直径为1.5 mm的下沉料。将饲料颗粒在55 ℃的烘箱中烘24 h,然后用双层塑料袋密封后保存在-20 ℃中,直到后续使用。
1.2 饲养试验和样品采集凡纳滨对虾虾苗购自福建省漳州市某养殖场,并在福建省漳州市诏安县大北农海康基地进行实验。正式试验前,暂养14 d使对虾适应养殖场环境,驯化期间用商品料(饲料干物质粗蛋白为42.5%,粗脂肪为8.2%)进行投喂。开始实验时,选取健康的幼虾(初始体质量(0.75±0.01)g)随机分配到15个养殖桶中(1 000 L,每个处理组3个养殖桶,每个养殖桶70尾虾)。每个桶上都盖有塑料网,以避免对虾跳出。在正式试验前,取足量对虾全虾,用双层塑料袋密封后置于-20 ℃保存,以供进一步分析。
每天7:00、12:00、18:00在喂料盘(圆形筛网,直径30 cm,高度10 cm)上人工喂料。前2周投喂初始总质量的4%,从第3周开始至试验结束,根据投喂后1 h的饲料剩余情况来调整下一餐的投喂量。每天换水并用虹吸法吸出粪便,使水质保持清澈。实验过程中,每天测量水温、盐度和溶解氧。每周测定pH、总氨氮和亚硝酸盐氮,水体温度保持在(28±1)℃;盐度为27±0.5;pH为8.0±0.5;总氨氮小于0.02 mg/L;亚硝酸盐小于0.1 mg/L;溶解氧大于6 mg /L。
在实验过程中,收集对虾粪便,并保存在-20 ℃中,用于后续分析。在6周实验结束时,统计每桶对虾的数量以计算存活率,称量各桶对虾总质量和饲料剩余量以计算摄食量、增重率、特定生长率和饲料系数。采集每组饲料各25 g,在4 ℃下密封干燥保存,以供进一步分析。实验结束后,禁食24 h后取样,每桶取10尾虾。用1 mL注射器预装0.5 mL抗凝血剂,从每尾虾中收集大约0.5 mL的血淋巴。抗凝剂溶液配方为:柠檬酸钠为7.49 g/L,NaCl为19.6 g/L,EDTA-Na2为3.3 g/L,体系pH为7.5。收集的血淋巴用1 150 g在4 ℃下离心10 min,收集上清样本放入2 mL冻存管中,在液氮中速冻,然后保存在-80 ℃中,以待进一步分析。然后,取对虾肝胰腺、肌肉和肠道放入2 mL冻存管中,在液氮中速冻,然后保存在-80 ℃中,以待进一步分析。
1.3 化学分析将饲料和全虾在105 ℃烘箱里干燥24 h,使之恒重,记录完全烘干后的重量损失,从而计算得出水分含量。将干燥后的饲料和全虾用马弗炉在550 ℃下燃烧16 h,使之恒重,记录完全燃烧后的质量损失,从而计算得出灰分含量。将粪便冷冻干燥。用凯式定氮仪(Kjeltec TM 8400,FOSS,Sweden)检测饲料、全虾和粪便的粗蛋白含量,用索式抽提仪(Buchi 36680,Switzerlan)检测饲料、全虾和粪便的粗脂肪含量。在浓硝酸的催化下用密闭式智能微波消解仪(MWD-650)消化饲料和粪便,然后用ICP仪(ICP-OES, Vista-mpx, Varian, America)检测实验饲料和对虾粪便中的钇(Y)含量,以计算营养物质的消化率。
1.4 酶活分析使用南京建成试剂盒检测凡纳滨对虾的消化酶(蛋白酶、脂肪酶、淀粉酶)、谷丙转氨酶、谷草转氨酶和抗氧化及免疫相关酶的活性,具体实验步骤依据说明书的指示。
1.5 计算公式与统计分析在SPSS 23.0软件中,用单因素方差分析进行分析,使用Tukey’s多重检验。如果P < 0.05,则认为平均值有显著差异。所有实验数据都以平均值±标准误差(M±SE)的形式进行表示。
| $存活率=终末虾数量/初始虾数量 \times 100\%;$ | (1) |
| $增重率=(终末虾质量-初始虾质量)/初始虾质量\times 100\%;$ | (2) |
| $特定生长率=(\ln 终末虾质量-\ln 初始虾质量)/养殖天数\times 100\%;$ | (3) |
| $饲料系数=总摄食量/(终末虾质量-初始虾质量)\times 100\%;$ | (4) |
| $干物质表观消化率=(1-饲料中氧化钇含量/粪便中氧化钇含量)\times 100\%;$ | (5) |
| $蛋白质表观消化率=(1-(饲料中氧化钇含量\times粪便中蛋白质含量)/(粪便中氧化钇含量\times饲料中蛋白质含量))\times 100\%;$ | (6) |
| $蛋白质效率=(终末虾质量-初始虾质量)/(摄食量\times饲料中蛋白质含量)\times 100\%;$ | (7) |
| $营养物质沉积率=(终末虾质量×终末虾营养物质含量-初始虾质量×初始虾营养物质含量)/(摄食量×饲料营养物质含量)\times 100\%。$ | (8) |
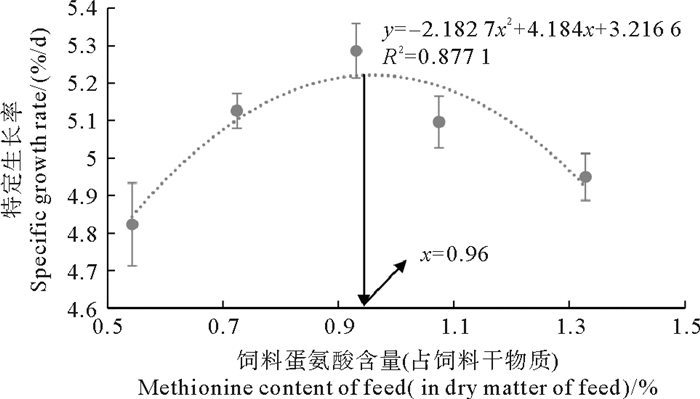
凡纳滨对虾生长性能的数据如表 3所示。随着饲料蛋氨酸含量的升高,凡纳滨对虾的存活率无显著变化(P>0.05),但是末均质量、增重率和特定生长率都出现了显著变化(P < 0.05),呈先增加再降低的趋势。G3组的末均质量和增重率最高,显著高于G1和G5组(P < 0.05)。G3组的特定生长率最高,且显著高于G1组(P < 0.05)。饲料蛋氨酸含量与凡纳滨对虾特定生长率的关系如图 1所示。以特定生长率为评价指标,凡纳滨对虾的最适饲料蛋氨酸含量为饲料干物质的0.96%(饲料粗蛋白的2.23%)。
|
|
表 3 包膜蛋氨酸添加量对凡纳滨对虾生长性能的影响 Table 3 Effects of dietary coated methionine amount on growth performance of L. vannamei |
|
图 1 饲料蛋氨酸含量与凡纳滨对虾特定生长率的关系 Fig. 1 Relationship between dietary methionine content and specific growth rate of L. vannamei |
凡纳滨对虾体组成的数据如表 4所示。随着饲料蛋氨酸含量的升高,凡纳滨对虾全虾的水分、灰分和粗蛋白含量无显著变化(P>0.05),粗脂肪含量出现显著变化(P < 0.05),呈先增加后降低的趋势。G3组的粗脂肪含量最高,显著高于G1和G5组(P < 0.05)。
|
|
表 4 包膜蛋氨酸添加量对凡纳滨对虾体组成的影响(干物质) Table 4 Effects of dietary coated methionine amount on body composition of L. vannamei (in dry matter) |
凡纳滨对虾饲料利用的数据如表 5所示。随着饲料蛋氨酸含量的增加,凡纳滨对虾的摄食量没有显著变化(P>0.05),但是饲料系数先降低再升高(P < 0.05),G3组显著低于G1组(P < 0.05);蛋白质效率、蛋白质沉积率和脂肪沉积率呈先升高再降低的趋势(P < 0.05)。G3组的蛋白质效率最高,显著高于G1和G5组(P < 0.05)。G2、G3和G4组的蛋白质沉积率显著高于G1和G5组(P < 0.05)。G3组的脂肪沉积率最高,显著高于G1和G5组(P < 0.05)。
|
|
表 5 包膜蛋氨酸添加量对凡纳滨对虾饲料利用的影响 Table 5 Effects of dietary coated methionine amount on feed utilization of L. vannamei |
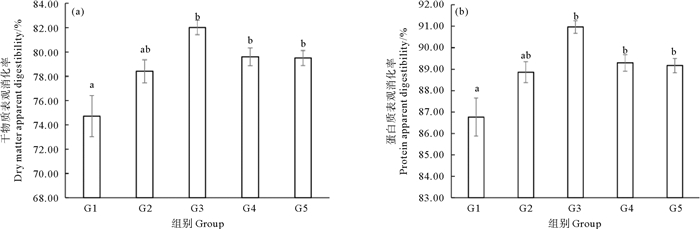
凡纳滨对虾营养物质表观消化率的数据如图 2所示。随着饲料蛋氨酸含量的升高,凡纳滨对虾的蛋白质和干物质表观消化率出现显著变化(P < 0.05),呈先升高后基本稳定的趋势,G1组最低,G3、G4和G5组显著高于G1和G2组(P < 0.05)。
|
(同一图中不同的字母表示差异显著(P < 0.05)。Different letters in the same graph indicate significant differences (P < 0.05).) 图 2 包膜蛋氨酸添加量对凡纳滨对虾营养物质表观消化率的影响 Fig. 2 Effects of dietary methionine content on nutrient apparent digestibility of L. vannamei |
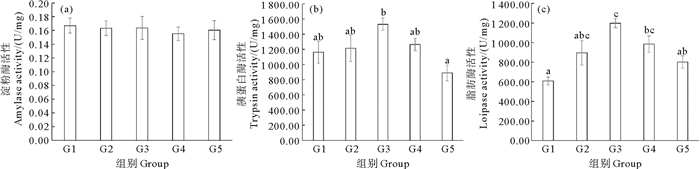
凡纳滨对虾肠道消化酶的数据如图 3所示。随着饲料蛋氨酸含量的升高,凡纳滨对虾的淀粉酶(AMS)活性未出现显著变化(P>0.05),但是脂肪酶和胰蛋白酶活性出现了显著变化(P < 0.05)。G3组的胰蛋白酶活性最高,显著高于G5组(P < 0.05)。G3组的脂肪酶活性最高,显著高于G1和G5组(P < 0.05)。
|
(同一图中不同的字母表示差异显著(P < 0.05)。Different letters in the same graph indicate significant differences (P < 0.05).) 图 3 包膜蛋氨酸添加量对凡纳滨对虾肠道消化酶活性的影响 Fig. 3 Effects of dietary coated methionine amount on intestinal digestive enzyme activities of L. vannamei |
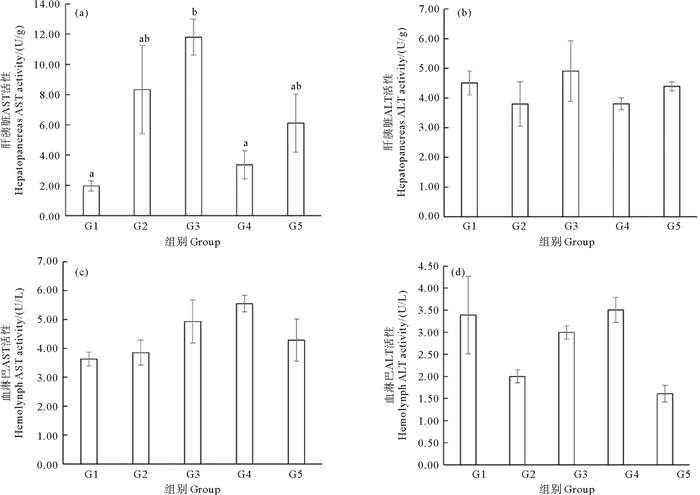
凡纳滨对虾谷草转氨酶(AST)和谷丙转氨酶(ALT)的活性数据如图 4所示。随着饲料蛋氨酸含量的升高,凡纳滨对虾肝胰脏的AST活性出现了显著变化(P < 0.05)。G3组最高且显著高于G1和G4组(P < 0.05),但是肝胰脏的ALT和血淋巴的AST和ALT活性无显著变化(P>0.05)。饲料蛋氨酸含量增加会提高肝胰脏的AST活性。
|
(同一图中不同的字母表示差异显著(P < 0.05)。Different letters in the same graph indicate significant differences (P < 0.05).) 图 4 包膜蛋氨酸添加量对凡纳滨对虾谷草转氨酶(AST)和谷丙转氨酶(ALT)活性的影响 Fig. 4 Effects of dietary coated methionine amount on aspartate aminotransferase (AST) and alanine aminotransferase (ALT) activities of L. vannamei |
凡纳滨对虾抗氧化和免疫相关酶活性的数据如图 5和6所示。随着饲料蛋氨酸含量的升高,凡纳滨对虾肝胰脏和血淋巴的AKP和LZM活性未发生显著性变化(P>0.05),但血淋巴还原性GSH含量、GSH-ST活性和肝胰脏GSH-ST、SOD、CAT、T-AOC活性和MDA含量出现了显著变化(P < 0.05)。G2和G3组的血淋巴还原性GSH含量显著高于G1组(P < 0.05);G3组肝胰脏GSH-PX活性显著高于G1组(P < 0.05);G3组肝胰脏GSH-ST活性显著高于G1、G2和G5组(P < 0.05);G3组肝胰脏CAT活性显著高于G1组(P < 0.05);G3组肝胰脏MDA含量显著低于G1和G5组(P < 0.05);G3组肝胰脏T-AOC活性显著高于G1和G4组(P < 0.05)。
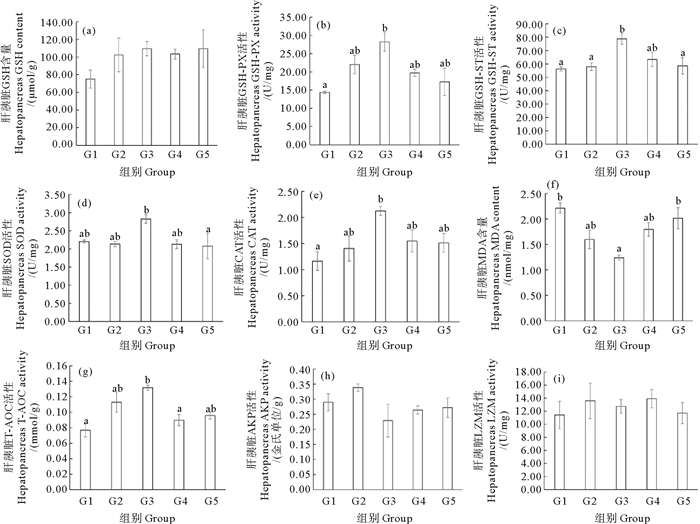
|
(同一图中不同的字母表示差异显著(P < 0.05)。GSH: 谷胱甘肽;GSH-PX: 谷胱甘肽过氧化物酶;GSH-ST: 谷胱甘肽-S转移酶;SOD: 超氧化物歧化酶;CAT: 过氧化氢酶;MDA: 丙二醛;T-AOC: 总抗氧化能力;AKP: 碱性磷酸酶;LZM: 溶菌酶。Different letters in the same graph indicate significant differences (P < 0.05). GSH: Glutathione; GSH-PX: Glutathione peroxidase; GSH-ST: Glutathione-S transferase; SOD: Superoxide dismutase; CAT: Catalase; MDA: Malondialdehyde; T-AOC: Total antioxidant capacity; AKP: Alkaline phosphatase; LZM: Lysozyme.) 图 5 包膜蛋氨酸添加量对凡纳滨对虾肝胰脏抗氧化和免疫酶活性的影响 Fig. 5 Effects of dietary coated methionine amount on hepatopancreas antioxidant and immune enzyme activities of L. vannamei |
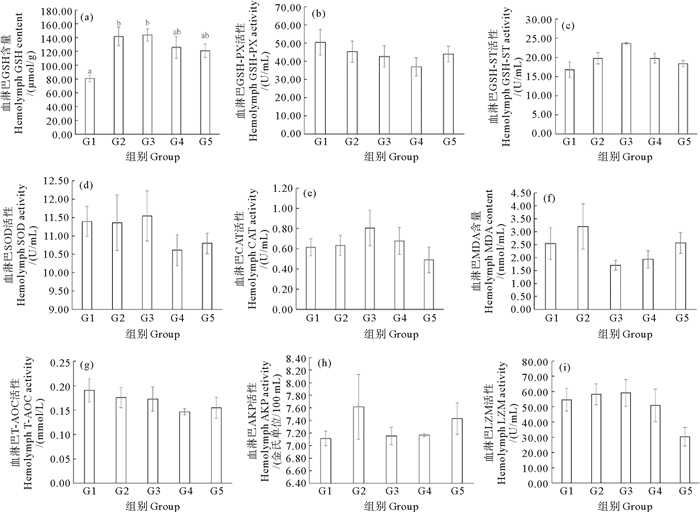
|
(同一图中不同的字母表示差异显著(P < 0.05)。GSH: 谷胱甘肽;GSH-PX: 谷胱甘肽过氧化物酶;GSH-ST: 谷胱甘肽-S转移酶;SOD: 超氧化物歧化酶;CAT: 过氧化氢酶;MDA: 丙二醛;T-AOC: 总抗氧化能力;AKP: 碱性磷酸酶;LZM: 溶菌酶。Different letters in the same graph indicate significant differences (P < 0.05). GSH: Glutathione; GSH-PX: Glutathione peroxidase; GSH-ST: Glutathione-S transferase; SOD: Superoxide dismutase; CAT: Catalase; MDA: Malondialdehyde; T-AOC: Total antioxidant capacity; AKP: Alkaline phosphatase; LZM: Lysozyme.) 图 6 包膜蛋氨酸添加量对凡纳滨对虾血淋巴抗氧化和免疫酶活性的影响 Fig. 6 Effects of dietary coated methionine amount on hemolymphe antioxidant and immune enzyme activities of L. vannamei |
本实验用5种不同包膜蛋氨酸添加量的饲料喂养凡纳滨对虾,进行了42天的养殖实验。实验结果表明,蛋氨酸缺乏或过量都会显著降低凡纳滨对虾的末均质量、增重率和特定生长率,添加适宜含量的蛋氨酸则能显著提高凡纳滨对虾的生长性能。已有研究证明,饲料中蛋氨酸的含量会影响生物体的生长性能。在大西洋鲑中,蛋氨酸缺乏或过量都会抑制其生长,适宜含量下大西洋鲑的特定生长率显著高于其他处理组[28]。在对草鱼(Ctenopharyngodon idella)的研究中也得到了相同的结果[29]。本研究得出的凡纳滨对虾(初始体质量0.75 g)蛋氨酸需求量为饲料干物质的0.96%(饲料粗蛋白的2.23%)。另有研究表明,初始体质量为0.34 g的凡纳滨对虾的蛋氨酸需求量为饲料干物质的0.89%(即饲料粗蛋白的2.16%)[27]。初始体质量为0.55 g的凡纳滨对虾的最适蛋氨酸添加量为饲料干物质的0.91%(即饲料粗蛋白的2.28%),初始体质量为9.77 g的凡纳滨对虾的最适蛋氨酸添加量为饲料干物质的0.66%(即饲料粗蛋白的1.94%)[25]。这些结果和本研究略有不同,这可能与对虾的初始体质量、实验条件有关,不同研究的总结见表 6。
|
|
表 6 凡纳滨对虾蛋氨酸需求量比较分析 Table 6 Comparative analysis of methionine requirement of L. vannamei |
蛋氨酸含量会影响凡纳滨对虾体组成。本研究中,蛋氨酸含量适宜组的全虾粗脂肪含量显著高于蛋氨酸含量过低或过高组,这一结果可能是由于蛋氨酸含量影响了凡纳滨对虾对饲料的利用。实验结果表明,适宜的蛋氨酸含量会增加蛋白质和干物质的表观消化率,并增强凡纳滨对虾肠道消化酶的活性,相关研究证明了这一结果[13, 16]。在草鱼中,饲料蛋氨酸缺乏或过量同样会显著抑制肠道胰蛋白酶和脂肪酶,且显著提高饲料系数,而添加饲料蛋氨酸能显著提高蛋白质效率[29]。文献[30]对此做出了解释,认为增加饲料蛋氨酸的摄入量可促进肝脏转硫产生牛磺酸,牛磺酸与胆汁酸结合,促进胆汁分泌,从而促进了脂肪的乳化和肝脏对饲料营养素的利用,这与本研究中适宜蛋氨酸水平下脂肪保留率最高的结果相一致。对军曹鱼(Rachycentron canadum)的研究表明,饲料中适宜水平的蛋氨酸可提升肝脏脂肪合成的相关基因表达。因此,蛋氨酸可以促进生物体对营养物质的消化利用,但是摄入过量蛋氨酸却作用有限,甚至会产生危害。这是由于当饲料中游离氨基酸的添加量过高时,高达40%的游离氨基酸会通过鳃和肾脏排出,无法被利用[31]。饲料中游离氨基酸含量较高时会被机体快速吸收,当游离氨基酸含量超过机体代谢需求时,组织中游离氨基酸分解代谢加快,导致生物体内氨基酸失衡,抑制生长[20, 32]。
3.3 包膜蛋氨酸添加量对凡纳滨对虾转氨酶活性的影响肝胰脏是氨基酸代谢的场所,而谷草转氨酶(ALT)和谷丙转氨酶(AST)的活性可以反映对虾肝胰脏的功能[33]。血清中转氨酶活性上升可反映肝脏损伤[34]。本研究中,随着饲料蛋氨酸含量的增加,凡纳滨对虾血淋巴转氨酶活性无显著差异,肝胰脏AST活性先增加后降低,这表明适宜的蛋氨酸含量能提高凡纳滨对虾的肝胰脏功能,促进氨基酸的分解代谢。文献[35]指出,AST和ALT在非洲大鲶(Clarias gariepinus)的氨基酸分解代谢、仔稚鱼发育中发挥着重要作用。在草鱼中,饲料蛋氨酸缺乏或过量都会抑制肝胰脏AST活性和肌肉ALT活性,在适宜饲料蛋氨酸含量下其活性则显著高于其他处理组[29]。在建鲤(Cyprinus carpio)幼鱼中,随着饲料蛋氨酸羟基类似物含量的增加,肌肉和肝胰脏的AST和ALT的活性先增加后降低,表明摄入适量蛋氨酸可降低氨基酸分解代谢率[36]。这些研究结果证明,适宜的蛋氨酸含量可提高动物体转氨酶的活性,从而促进氨基酸的利用。究其原因,可能是饲料中补充蛋氨酸后,鱼体游离氨基酸池中氨基酸变得更均衡,从而促进鱼体蛋白合成[36]。
3.4 包膜蛋氨酸添加量对凡纳滨对虾抗氧化能力的影响肝胰脏也是凡纳滨对虾重要的消化和免疫器官,在营养物质的消化吸收、代谢利用和免疫反应等生理过程中具有重大的作用[37]。此外,血淋巴和鳃也是凡纳滨对虾重要的免疫器官[38]。由于凡纳滨对虾缺乏适应性免疫系统,主要依赖先天性免疫进行防御[39],因此,肝胰脏和血淋巴中的抗氧化酶和免疫酶都是重要的免疫指标。在本研究中,蛋氨酸摄入量的提高会通过增强凡纳滨对虾肝胰脏和血淋巴抗氧化酶的活性来提高抗氧化能力,而蛋氨酸缺乏或摄入过量会降低抗氧化能力。同样的,文献[40-41]得出了与本研究相同的结论。随着蛋氨酸羟基类似物摄入量的增加,建鲤肠道和肝胰脏SOD、GST、GPX活性与GSH含量呈先增加后降低的趋势,肝胰脏MDA含量则呈先降低后增加的趋势,这表明适宜的蛋氨酸摄入量能提高建鲤的抗氧化能力,蛋氨酸缺乏或过量摄入则会产生负面作用[42]。在草鱼[29]、印度鲤鱼(Labeo rohita)[43]和大黄鱼(Larimichthys crocea)[44]的研究中也得到了相似的结果。由此证明,增加蛋氨酸摄入量可提高鱼体肝脏的抗氧化能力。
4 结语本研究首次在凡纳滨对虾的饲料中添加包膜蛋氨酸,并设置了多个饲料蛋氨酸梯度组,以特定生长率为评价指标,通过二次曲线回归拟合分析发现添加包膜蛋氨酸时,初始体质量为(0.75±0.01)g的凡纳滨对虾的最适饲料蛋氨酸含量为饲料干物质的0.96%(占饲料粗蛋白的2.23%)。饲料中添加适宜水平的蛋氨酸可提高凡纳滨对虾的表观消化率、消化酶活力及转氨酶活力。本研究为凡纳滨对虾饲料中包膜蛋氨酸的添加和利用做出了新的尝试,在饲料鱼粉替代的背景下能够为饲料产业发展提供借鉴。
| [1] |
Mcisaac R S, Kaitlyn N L, Patrick A G, et al. From yeast to human: Exploring the comparative biology of methionine restriction in extending eukaryotic life span[J]. Annals of the New York Academy of Sciences, 2016, 1363(1): 155-170. DOI:10.1111/nyas.13032 (  0) 0) |
| [2] |
Oliveira T S, Khan K U, Boaratti A Z, et al. Evaluation of the optimum dietary essential amino acid pattern for adult pacu (Piaractus mesopotamicus)[J]. Aquaculture, 2021, 540: 736686. DOI:10.1016/j.aquaculture.2021.736686 (  0) 0) |
| [3] |
Cedric J S, Ha T, Natalie H, et al. Feeding behaviour and bioavailability of essential amino acids in shrimp Penaeus monodon fed fresh and leached fishmeal and fishmeal-free diets[J]. Animals, 2021, 11(3): 847. DOI:10.3390/ani11030847 (  0) 0) |
| [4] |
Walton M J, Cowey C B, Adron J W. Methionine metabolism in rainbow trout fed diets of differing methionine and cystine content[J]. The Journal of Nutrition, 1982, 112(8): 1525-1535. DOI:10.1093/jn/112.8.1525 (  0) 0) |
| [5] |
Aksnes A, Njaa L R. Absorption of methionine and methionine sulphoxide in rat intestine and the effect of glutathione[J]. British Journal of Nutrition, 1983, 50(3): 583-588. DOI:10.1079/BJN19830129 (  0) 0) |
| [6] |
Laxman S, Sutter Benjamin M, Wu X, et al. Sulfur amino acids regulate translational capacity and metabolic homeostasis through modulation of tRNA thiolation[J]. Cell, 2013, 154(2): 416-429. DOI:10.1016/j.cell.2013.06.043 (  0) 0) |
| [7] |
Bin P, Huang R L, Zhou X H. Oxidation resistance of the sulfur amino acids: Methionine and cysteine[J]. Biomed Research International, 2017, 2017: 9584932. (  0) 0) |
| [8] |
Levine R L, Berlett B S, Moskovitz J, et al. Methionine residues may protect proteins from critical oxidative damage[J]. Mechanisms of Ageing and Development, 1999, 107(3): 323-332. DOI:10.1016/S0047-6374(98)00152-3 (  0) 0) |
| [9] |
Wilson R P. Amino acids and proteins[M]// Fish Nutrition. Mississippi: Elsevier, 2003: 143-179.
(  0) 0) |
| [10] |
Nunes A J P, Sá M V C, Browdy C L, et al. Practical supplementation of shrimp and fish feeds with crystalline amino acids[J]. Aquaculture, 2014, 431: 20-27. DOI:10.1016/j.aquaculture.2014.04.003 (  0) 0) |
| [11] |
Qiu X, Buentello A, Shannon R, et al. Evaluation of three non-genetically modified soybean cultivars as ingredients and a yeast-based additive as a supplement in practical diets for Pacific white shrimp Litopenaeus vannamei[J]. Aquaculture Nutrition, 2018, 24(1): 173-183. DOI:10.1111/anu.12545 (  0) 0) |
| [12] |
Chen J N, Li X Q, Huan D Y, et al. Comparative study on the utilization of crystalline methionine and methionine hydroxy analogue calcium by Pacific white shrimp (Litopenaeus vannamei Boone)[J]. Aquaculture Research, 2018, 49(9): 3088-3096. DOI:10.1111/are.13771 (  0) 0) |
| [13] |
Gao Z Y, Wang X, Tan C, et al. Effect of dietary methionine levels on growth performance, amino acid metabolism and intestinal homeostasis in turbot (Scophthalmus maximus L.)[J]. Aquaculture, 2019, 498: 335-342. DOI:10.1016/j.aquaculture.2018.08.053 (  0) 0) |
| [14] |
Sanal E, Vijayagopal P, Srivastava P P, et al. Optimum dietary methionine requirement of juvenile silver pompano, Trachinotus blochii (Lacepede, 1801)[J]. Animal Feed Science and Technology, 2020, 268: 114592. DOI:10.1016/j.anifeedsci.2020.114592 (  0) 0) |
| [15] |
Li B S, Han X J, Wang J Y, et al. Optimal dietary methionine requirement for juvenile sea cucumber Apostichopus japonicus selenka[J]. Aquaculture Research, 2021, 52(4): 1348-1358. DOI:10.1111/are.14989 (  0) 0) |
| [16] |
Daniel Antonio R, Suzete R, Isadora Liberalesso De F, et al. Determination of methionine requirement of juvenile silver catfish (Rhamdia quelen) and its effects on growth performance, plasma and hepatic metabolites at a constant cystine level[J]. Aquaculture Research, 2018, 49(2): 858-866. DOI:10.1111/are.13530 (  0) 0) |
| [17] |
Rønnestad I, Tonheim S K, Fyhn H J, et al. The supply of amino acids during early feeding stages of marine fish larvae: A review of recent findings[J]. Aquaculture, 2003, 227(1): 147-164. (  0) 0) |
| [18] |
Felipe N F, Adhemar R O N, Claudia F S, et al. Effect of shrimp stocking density and graded levels of dietary methionine over the growth performance of Litopenaeus vannamei reared in a green-water system[J]. Aquaculture, 2016, 463: 16-21. DOI:10.1016/j.aquaculture.2016.05.024 (  0) 0) |
| [19] |
Felipe N F, Hassan S N, Claudia F S, et al. Minimum water exchange spares the requirement for dietary methionine for juvenile Litopenaeus vannamei reared under intensive outdoor conditions[J]. Aquaculture Research, 2018, 49(4): 1682-1689. DOI:10.1111/are.13624 (  0) 0) |
| [20] |
Amogh A A, Robert C R, Millie B W. Absorption of amino acids from intact dietary proteins and purified amino acid supplements follows different time-courses in channel catfish (Ictalurus punctatus)[J]. Aquaculture, 2009, 291(3-4): 179-187. DOI:10.1016/j.aquaculture.2009.02.044 (  0) 0) |
| [21] |
Takeshi M Y H, Toshio A, Takeshi N. Effects of dietary pH and electrolyte concentration on utilization of crystalline amino acids by fingerling carp[J]. Bulletin of the Japanese Society of Scientific Fisheries, 1983, 49(9): 1377-1380. DOI:10.2331/suisan.49.1377 (  0) 0) |
| [22] |
Felipe N F, Hassan S N, Adhemar R O N, et al. Increasing feed allowance in low-fish meal diets allows for a reduction in dietary methionine for juvenile Litopenaeus vannamei raised in green-water tanks[J]. Revista Brasileira de Zootecnia, 2019, 48: e20180198. DOI:10.1590/rbz4820180198 (  0) 0) |
| [23] |
Sadasivam J K, Iban S. Protein and amino acid nutrition and metabolism in fish: Current knowledge and future needs[J]. Aquaculture Research, 2010, 41(3): 322-332. DOI:10.1111/j.1365-2109.2009.02174.x (  0) 0) |
| [24] |
Fox J M, Lawrence A L, Patnaik S, et al. Estimation of Feed Level of Methionine by Litopenaeus vannamei (Boone) Using Covalently-attached and Crystalline Sources in Low-protein Semi-purified Diets[C]. Monterrey: Universidad Autónoma de Nuevo León, 2010: 232-249.
(  0) 0) |
| [25] |
Lin H Z, Chen Y F, Niu J, et al. Dietary methionine requirements of pacific white shrimp Litopenaeus vannamei, of three different sizes[J]. Israeli Journal of Aquaculture-Bamidgeh, 2015, 67: 1-10. (  0) 0) |
| [26] |
陈义方. 不同规格凡纳滨对虾对蛋白质和蛋氨酸需要量研究[D]. 上海: 上海海洋大学, 2012. Chen Y F. Study on Protein and Methionine Requirements of Litopenaeus vannamei with Different Specifications[D]. Shanghai: Shanghai Ocean University, 2012. (  0) 0) |
| [27] |
Huo Y W, Zeng W, Jin M, et al. Methionine requirement of juvenile Pacific white shrimp (Litopenaeus vannamei)[J]. Chinese Journal of Animal Nutrition, 2014, 26(12): 3707-3716. DOI:10.3969/j.issn.1006-267x.2014.12.021 (  0) 0) |
| [28] |
Marit E, Vibeke V, Ta。rn Helgøy T, et al. Atlantic salmon fed a nutrient package of surplus methionine, vitamin B12, folic acid and vitamin B6 improved growth and reduced the relative liver size, but when in excess growth reduced[J]. Aquaculture Nutrition, 2020, 26(2): 477-489. DOI:10.1111/anu.13010 (  0) 0) |
| [29] |
Wu P, Tang L, Jiang W D, et al. The relationship between dietary methionine and growth, digestion, absorption, and antioxidant status in intestinal and hepatopancreatic tissues of sub-adult grass carp (Ctenopharyngodon idella)[J]. Journal of Animal Science and Biotechnology, 2017, 8(1): 1-14. DOI:10.1186/s40104-016-0130-8 (  0) 0) |
| [30] |
Marit E, Bjørn L, Ernst Morten H, et al. DL-methionine enrichment in diets fed to Atlantic salmon increases apparent digestibility[J]. Aquaculture Research, 2011, 42(8): 1123-1130. DOI:10.1111/j.1365-2109.2010.02700.x (  0) 0) |
| [31] |
Murai T. Biological Assessment of Nutrient Requirements and Availability of Fish[C]. USA: Special workshop at the International Congress on Nutrition, 1985: 19-25.
(  0) 0) |
| [32] |
Tesser M, Terjesen B, Zhang Y, et al. Free-and peptide-based dietary arginine supplementation for the South American fish pacu (Piaractus mesopotamicus)[J]. Aquaculture Nutrition, 2005, 11(6): 443-453. DOI:10.1111/j.1365-2095.2005.00373.x (  0) 0) |
| [33] |
Wang L, Ye L, Hua Y, et al. Effects of dietary DL-methionyl-DL-methionine (Met-Met) on growth performance, body composition and haematological parameters of white shrimp (Litopenaeus vannamei) fed with plant protein-based diets[J]. Aquaculture Research, 2019, 50(6): 1718-1730. DOI:10.1111/are.14064 (  0) 0) |
| [34] |
甘华, 陈劲霜, 聂志红, 等. 血清转氨酶在腹部闭合伤后肝损伤诊断及分级中的临床应用[J]. 中国当代医药, 2019, 26(21): 49-51. Gan H, Chen J S, Nie Z H, et al. Clinical application of serum transaminase in diagnosis and grading of liver injury after abdominal closure injury[J]. Chinese Journal of Contemporary Medicine, 2019, 26(21): 49-51. DOI:10.3969/j.issn.1674-4721.2019.21.015 (  0) 0) |
| [35] |
Segner H, Verreth J. Metabolic enzyme activities in larvae of the African catfish, Clarias gariepinus: Changes in relation to age and nutrition[J]. Fish Physiology and Biochemistry, 1995, 14(5): 385-398. DOI:10.1007/BF00003376 (  0) 0) |
| [36] |
Xiao W W, Feng L, Liu Y, et al. Effects of dietary methionine hydroxy analogue supplement on growth, protein deposition and intestinal enzymes activities of juvenile Jian carp (Cyprinus carpio)[J]. Aquaculture Nutrition, 2011, 17(4): 408-417. DOI:10.1111/j.1365-2095.2010.00818.x (  0) 0) |
| [37] |
罗展, 张继泉, 李富花, 等. 凡纳滨对虾C-型凝集素LvLec2对不同刺激的免疫应答[J]. 海洋科学, 2010, 34(11): 103-110. Luo Z, Zhang J Q, Li F H, et al. Immune response of C-type lectin LvLec2 in Litopenaeus vannamei to different stimuli[J]. Marine Sciences, 2010, 34(11): 103-110. (  0) 0) |
| [38] |
宋巧珍, 邹枘峰, 张亦陈, 等. 凡纳滨对虾丝氨酸蛋白酶基因(Lv-SP)的克隆及表达分析[J]. 安徽农业科学, 2018, 46(12): 102-106. Song Q Z, Zou T F, Zhang Y C, et al. Cloning and expression analysis of serine protease gene (Lv-SP) in Litopenaeus vannamei[J]. Journal of Anhui Agricultural Sciences, 2018, 46(12): 102-106. (  0) 0) |
| [39] |
Duan Y F, Liu P, Li J T, et al. Molecular responses of calreticulin gene to Vibrio anguillarum and WSSV challenge in the ridgetail white prawn Exopalaemon carinicauda[J]. Fish & Shellfish Immunology, 2014, 36(1): 164-171. (  0) 0) |
| [40] |
Noor Z, Noor M, Khan S A, et al. Dietary supplementations of methionine improve growth performances, innate immunity, digestive enzymes, and antioxidant activities of rohu (Labeo rohita)[J]. Fish Physiology and Biochemistry, 2021, 47(2): 451-464. DOI:10.1007/s10695-021-00924-x (  0) 0) |
| [41] |
Elmada C Z, Huang W, Jin M, et al. The effect of dietary methionine on growth, antioxidant capacity, innate immune response and disease resistance ofjuvenile yellow catfish (Pelteobagrus fulvidraco)[J]. Aquaculture Nutrition, 2016, 22(6): 1163-1173. DOI:10.1111/anu.12363 (  0) 0) |
| [42] |
Feng L, Xiao W W, Liu Y, et al. Methionine hydroxy analogue prevents oxidative damage and improves antioxidant status of intestine and hepatopancreas for juvenile Jian carp (Cyprinus carpio)[J]. Aquaculture Nutrition, 2011, 17(6): 595-604. DOI:10.1111/j.1365-2095.2011.00853.x (  0) 0) |
| [43] |
Zohaib N, Mannal N, Syed Allauddin K, et al. Dietary supplementations of methionine improve growth performances, innate immunity, digestive enzymes, and antioxidant activities of rohu (Labeo rohita)[J]. Fish Physiology and Biochemistry, 2021, 47(2): 451-464. DOI:10.1007/s10695-021-00924-x (  0) 0) |
| [44] |
于海瑞, 艾庆辉, 麦康森, 等. 大黄鱼稚鱼L-蛋氨酸需要量的研究[J]. 水生生物学报, 2013, 37(6): 1094-1102. Yu R H, Ai Q H, Mai K S, et al. L-methionine requirement of large yellow croaker(Pseudosciaena crocea R.) larvae[J]. Acta Hydrobiologica Sinica, 2013, 37(6): 1094-1102. (  0) 0) |
2. Key Laboratory of Aquatic Animal Nutrition and Feed of Ministry of Agriculture and Rural Affairs, Ocean University of China, Qingdao 266003, China;
3. Pilot National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266237, China
 2023, Vol. 53
2023, Vol. 53


