2. 中国海洋大学海洋生命学院, 山东 青岛 266003;
3. 青岛海洋科学与技术国家实验室, 海洋渔业科学与食物产出过程功能实验室, 山东 青岛 266237
中国经济快速发展, 能源消耗增加, 二氧化碳排放量大幅提高。国家“十三五”规划纲要明确指出坚持减缓与适应并重, 主动控制碳排放, 落实减排承诺[1]。目前CO2减排技术分3类:物理法固定、化学法固定和生物法固定CO2[2-3]。而生物固碳符合自然循环和节能需求, 被认为是地球上最重要且有效的固碳方式[4]。与绿色植物、光合细菌等相比, 微藻固定CO2具有较多的优势:生长周期短, 繁殖快, 不占用耕地, 固碳效率是陆生植物的10~50倍; 高附加值产物丰富, 可实现环境友好与经济效益双赢[5-7]。
钝顶螺旋藻(Arthrospira platensis)属于蓝藻门(Cyanophyta)蓝藻纲(Cyanobacteria)颤藻目(Oscillatoriales)螺旋藻属(Spirulina)或节旋藻属(Arthrospira), 呈多细胞丝状螺旋形, 藻丝宽4~5 μm, 长400~600 μm[8]。其蛋白质含量可达50%~70%, 含有人体必需的8种氨基酸和非必需的9种氨基酸以及不饱和脂肪酸、维生素、矿物质、藻蓝蛋白等, 被联合国粮农组织(FDA)誉为“人类二十一世纪最理想的保健食品”[9-10]。
硒(Selenium, Se)是人体必需的微量元素, 是谷胱甘肽过氧化酶(GPX)的活性成份, 参与构成硫氧还蛋白还原酶(TR)、脱碘酶(ID)等酶的活性中心[11-12]。螺旋藻是硒有机化的理想载体, 可有效实现对硒的富集和有机化。关于硒对螺旋藻的影响, 目前研究主要集中在最适硒浓度以及富硒螺旋藻坏境因子优化, 如温度、光照、pH等, 以获得高产生物量和含硒藻蓝蛋白、螺旋藻多糖等生物活性物质[13-16], 关于硒与螺旋藻固碳效率的相互关系, 未见研究报道。螺旋藻对硒的富集具有双重效应, 低浓度硒促进生长, 高浓度硒抑制其生长[17], 而不同品系的螺旋藻以及培养方式不同, 最适硒浓度随之不同[18-20]。高海洋[18]报道, 当硒浓度为7 mg/L时, 螺旋藻生长最好, 生物量达到1.719 g/L, 比对照组提高了11.62%。Wang等[19]报道, 低浓度硒(0.1~1 mg/L)对螺旋藻无毒, 且生物量最大, 生长速率最快, 促进其生长, 而高浓度硒(10 mg/L)几乎抑制了藻的生长。Zhong等[20]研究了不同硒浓度对石莼光合作用以及抗氧化酶活性的影响, 表明低浓度硒(≤750 mg/L)可提高谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)、过氧化物酶(POD)和超氧化物歧化酶(SOD)的活性, 增加光合色素含量, 提高抗脂质过氧化(LPO)能力, 降低细胞内活性氧(ROS)水平。
本实验研究硒对钝顶螺旋藻生长及固碳速率的影响, 通过添加不同浓度的无机硒(Na2SeO3), 测定其生物量、叶绿素荧光参数以及含碳率, 筛选出促进其生长并提高固碳速率的最佳硒浓度, 为大规模培养螺旋藻提供一定的参考。
1 材料与方法 1.1 藻种培养钝顶螺旋藻(Arthrospira platensis)来自中国科学院水生生物研究所淡水藻种库, 编号为FACHB-834。在改良的Zarrouk培养基中添加无机硒(Na2SeO3·5H2O)进行培养[21]。首先, 用微吸管与96孔板逐级稀释相结合的方法纯化藻种[22], 将纯化的藻种培养至指数生长期, 转接至500 mL的锥形瓶, 每瓶中加入350 mL培养基, 初始接种密度OD750为0.1, 共6组, 每组3个平行, 分别添加不同质量的Na2SeO3·5H2O, 调节Na2SeO3·5H2O终浓度为0 mg/L(对照组)、1、10、20、50和100 mg/L。培养温度(30±1)℃, LED光照强度(70~80) μmol·m-2·s-1, 光周期L:D =12 h:12 h, 培养周期10 d, pH稳定在9.0±0.5。
1.2 实验方法 1.2.1 生长曲线及比生长速率测定用紫外分光光度计(Hitachi U-3310)隔天定时测定各组OD750值, 并绘制生长曲线。比生长速率通过公式(1)进行计算[23]。式中:μ为比生长速率(d-1); x1, x2分别为培养开始和结束时细胞干重; t1, t2为培养开始和结束时间。
| $ \mu = \frac{{\ln {x_2} - \ln {x_1}}}{{{t_2} - {t_1}}}。$ | (1) |
用水样叶绿素荧光仪(Water-PAM)隔天定时测定各组钝顶螺旋藻的诱导光曲线和快速光曲线。藻细胞暗适应15 min, 吸取2 mL藻液上样测定各参数。可直接读出PSII最大光转换效率Fv/Fm, 最大光合电子传递速率rERTmax, 光能的利用效率α等参数。其中F0(基础荧光)用弱测量光(0.01 μmoL·m-2·s-1)测量可得, Fm(最大荧光)用饱和脉冲(4 000 μmoL·m-2·s-1, 持续时间为0.8 s)激发可得[24]。
1.2.3 生物量测定分别取初始和培养11 d的藻液50 mL, 用GF/CTM(WhatmanTM公司)玻璃纤维素滤膜进行抽滤, 将滤膜转移至干燥的培养皿中, 放入恒温烘箱, 60 ℃干燥, 反复称量至恒重[25]。培养11 d, 剩余藻液采收用1 250目筛绢抽滤, 用蒸馏水洗涤3次, 将藻泥连同筛捐转入离心管中真空冷冻干燥备用。
1.2.4 细胞含碳率及固碳速率测定称取2 mg左右经真空冷冻干燥的藻粉, 用锡箔纸将藻粉包裹好, 使用CHN元素分析仪(Vario EL Ⅲ, 德国)测定藻细胞含碳率Cc。
CO2固定速率[26]通过公式(2)计算。式中RC:CO2固定速率; Px为螺旋藻的生长速率, 通过公式(3)计算, x2:终生物量, x1:初始生物量, t2-t1:两次测量的间隔时间; Cc:藻干细胞含碳率; MCO2:CO2分子量; Mc为C原子量。
| $ {R_{\rm{c}}} = {P_x} \cdot {C_{\rm{c}}} \cdot \frac{{{M_{{\rm{C}}{{\rm{O}}_2}}}}}{{{M_{\rm{c}}}}}; $ | (2) |
| $ {P_x} = \frac{{{x_2} - {x_1}}}{{{t_2} - {t_1}}}。$ | (3) |
数据采用软件SPSS18.0进行单因素方差分析(LSD, Duncan), 并进行多重比较, 显著性水平为P<0.05;采用Origin8.0绘图。
2 结果与分析 2.1 硒对钝顶螺旋藻生长的影响图 1显示, 不同硒浓度下, 钝顶螺旋藻在指数生长前期OD750值差异不显著(P>0.05), 培养7~11 d, 硒浓度>10 mg/L处理组藻细胞密度显著低于对照组(0 mg/L)(P<0.05), 说明较高的硒浓度抑制钝顶螺旋藻的生长, 且培养后期显微观察部分藻丝断裂死亡, 藻液泛黄; 硒浓度≤10 mg/L处理组差异不显著(P>0.05), 生长状态良好。
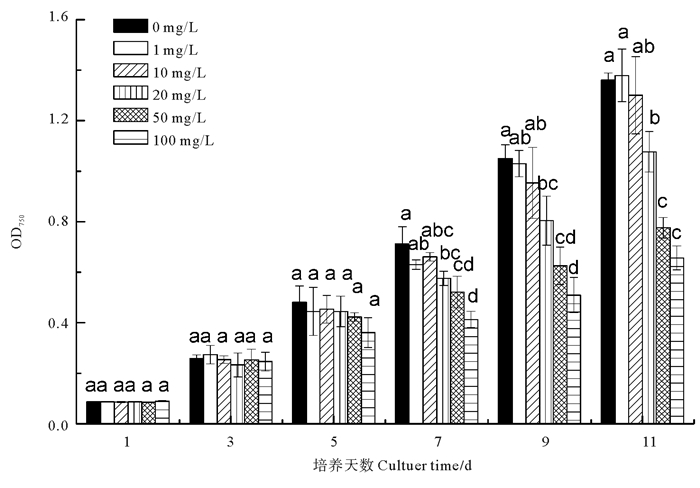
|
(数据均表示为平均数±标准差, 图中不同字母表示存在显著性差异(P<0.05, Duncan多重比较)。Values are expressed as mean ± standard deviation. Different letters indicate significant difference (P < 0.05, one-way ANOVA, followed by Duncan, s).) 图 1 不同硒浓度下钝顶螺旋藻的生长情况 Fig. 1 The growth of Arthrospira platensisexposed to different Se concentrations |
由图 2可以看出, 钝顶螺旋藻的比生长速率在不同硒浓度处理下差异显著, 低浓度处理组(1、10 mg/L)显著高于高浓度处理组(50、100 mg/L), 1 mg/L时比生长速率最高, 达0.27 d-1。
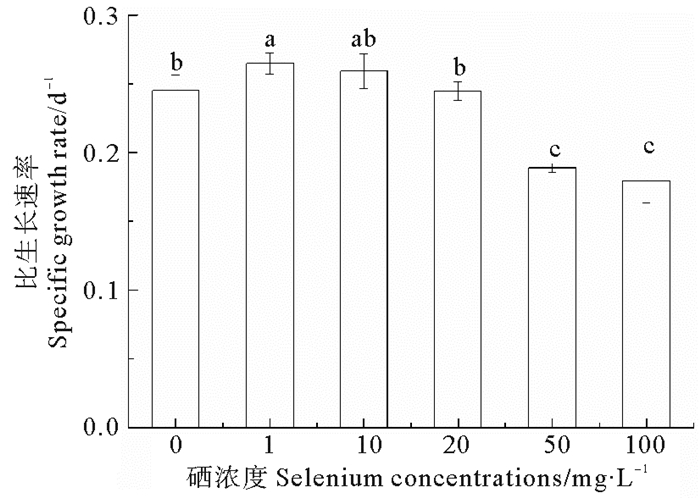
|
(数据均表示为平均数±标准差, 图中不同字母表示存在显著性差异(P<0.05, Duncan多重比较)。Values are expressed as mean±standard deviation. Different letters indicate significant difference (P < 0.05, one-way ANOVA, followed by Duncan, s).) 图 2 不同硒浓度下钝顶螺旋藻比生长速率 Fig. 2 The specific growth rate of Arthrospira platensis exposed to different Se concentrations |
不同硒浓度处理下钝顶螺旋藻收获时的生物量与比生长速率趋势一致(见图 3), 低浓度处理组(1、10 mg/L)显著高于高浓度处理组(50、100 mg/L), 与对照组相比, 1 mg/L处理组生物量提高了21%, 100 mg/L的处理组则降低了48%, 说明硒对钝顶螺旋藻生长具有两重性, 较低的硒浓度(≤10 mg/L)促进其生长; 较高的硒浓度(>20 mg/L)则对其生长产生不同程度的抑制甚至导致部分藻体断裂死亡。
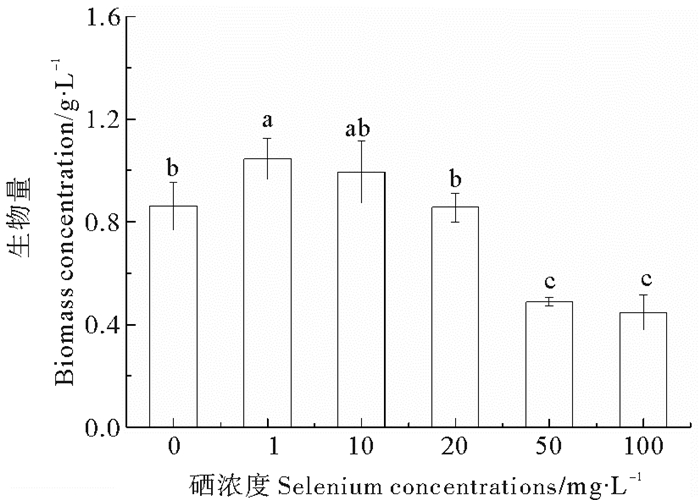
|
(数据均表示为平均数±标准差, 图中不同字母表示存在显著性差异(P<0.05, Duncan多重比较)。Values are expressed as mean ± standard deviation. Different letters indicate significant difference. (P < 0.05, one-way ANOVA, followed by Duncan, s).) 图 3 不同硒浓度下钝顶螺旋藻生物量 Fig. 3 The biomass density of Arthrospira platensis exposed to different Se concentrations |
最大光能转换效率Fv/Fm反映了PSII反应中心均处于开放时的最大量子产量, 即能量捕获效率[27]。快速光响应曲线(Rapid response light curve, RLC)中, 快速光曲线的初始斜率α, 用于表征光能的利用效率; 最大电子传递速率rETRmax, 用于表征潜在的最大光合作用速率[28]。由图 4(A、B、C)可以看出, 最大光能转换效率(Fv/Fm), 最大电子传递速率(rETRmax)和光能利用率(α)与对照组相比均有所提高, 但差异不显著, 低浓度处理组(1、10 mg/L)显著高于高浓度处理组(50、100 mg/L)说明高浓度硒胁迫使PSII反应中心受损, 抑制了光合作用的原初反应, 阻碍了光合电子传递的过程。
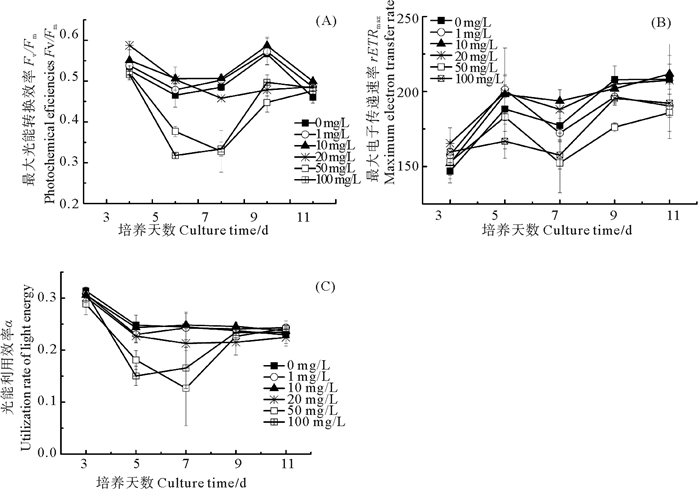
|
图 4 不同硒浓度下钝顶螺旋藻Fv/Fm、rETRmax、α Fig. 4 The Maximum photochemical efficiencies Fv/Fm, rETRmax、α of Arthrospira platensis exposed to different Se concentrations |
钝顶螺旋藻的含碳率与固碳效率变化趋势一致(见图 5), 均为低浓度处理组(1、10 mg/L)显著高于高浓度处理组(50、100 mg/L)(P<0.05), 与对照组相比, 1 mg/L处理组固碳速率显著提高了26.86%, 达153.32 mg/(L·d), 100 mg/L处理组固碳速率最低, 为47.23 mg/(L·d), 说明硒浓度在一定范围内(1~10 mg/L)有利于钝顶螺旋藻固定二氧化碳。
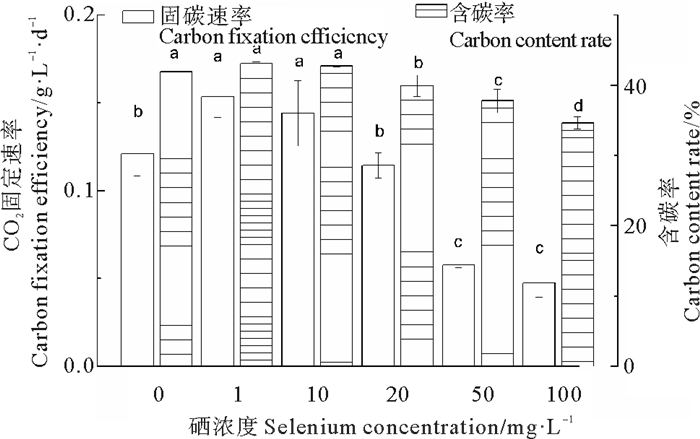
|
(数据均表示为平均数±标准差, 图中不同字母表示存在显著性差异(P<0.05, Duncan多重比较)。Values are expressed as mean ± standard deviation. Different letters indicate significant difference (P < 0.05, one-way ANOVA, followed by Duncan, s).) 图 5 不同硒浓度下钝顶螺旋藻CO2固碳速率以及含碳率 Fig. 5 Carbon dioxide fixation rate and carbon content of Arthrospira platensis exposed to different Se concentrations |
硒(Se)是人体必需的微量元素, 螺旋藻培养过程中适当添加无机硒, 不仅可以促进其生长, 还能提高螺旋藻的品质, 但培养螺旋藻适宜的硒浓度, 不同研究者报道差别很大[13-16]。何晓艳等[29]报道, 当培养基中的硒离子(Se4+)浓度为0.1 mg/L时, 能够促进螺旋藻的生长, 提高生物量和藻胆蛋白的含量。Li等[30]培养螺旋藻时添加亚硒酸钠, 在0.5~40 mg/L硒浓度下显著促进螺旋藻的生长, 低于400 mg/L均利于藻细胞的生长, 超过500 mg/L时, 对藻细胞有制毒作用。Cepoi等[31]研究表明:添加硒浓度为50~70 mg/L, 螺旋藻的生物量较不添加硒提高22%~25%, 在硒浓度超过200 mg/L时, 其生长受到抑制。周志刚等[32]研究了硒对极大螺旋藻藻细胞、藻胆体及藻蓝蛋白的光谱特性, 发现硒(Ⅳ)浓度低于40 mg/L促进藻细胞生长, 超过60 mg/L则抑制细胞生长, 而李志勇等[21]报道, 在0.02~411 mg/L浓度范围内, 硒促进钝顶螺旋藻生长, 提高其生物量。在本研究中, 较低的硒浓度(1、10 mg/L)促进钝顶螺旋藻的生长, 1 mg/L硒浓度下, 其生物量最大(1.04 g/L), 比生长速率最快(0.265 d-1), 固碳速率最高(153.32 mg/(L·d); 硒浓度为20 mg/L时, 生物量和比生长速率与对照组相比没有显著差异, 但OD750在指数生长末期却显著低于对照组(见图 1), 可能原因是该浓度的硒有利于细胞内容物的积累与合成(比如藻蓝蛋白和叶绿素a等)[20], 导致细胞密度不变的情况下生物量增加, 比生长速率也增加, 这方面还需要进一步实验验证。显示与对照组在培养指数后期差异显著, 因添加硒影响其生物量, 从而影响比生长速率, 同时也会对细胞的内容物和胞外物产生影响, 影响OD750值。而较高的硒浓度(50、100 mg/L)则抑制藻细胞的生长, 与对照组相比生物量分别显著降低了43%和47.7%。以上研究结果表明, 不同螺旋藻藻株适宜添加的硒浓度, 不同的研究者得出了不同的结论, 因此, 针对不同的螺旋藻品系, 应适时调整最适硒浓度, 为规模化生产提供可靠的理论依据。
叶绿素荧光动力学参数, 比如Fv/Fm、rETRmax等可以直观反映藻细胞的光合作用能力及生理状态。已有的研究表明, 硒可以提高植物的光合作用能力。Feng等[33]在梨、葡萄和桃子叶面喷洒17 mg/L的硒, 提高了叶子的净光合作用效率, PSⅡ的最大光能转换效率(Fv/Fm)和光化学淬灭等。在一定范围内(≤50 mg/L), 随着硒浓度的增加, 水稻PSII的Fv/Fm显著增加, 硒浓度超过50 mg/L, Fv/Fm则逐渐降低[34]。用10 mg/L硒处理苦荞, PSII的潜在光合作用效率显著高于对照组[35]。本研究中, 低浓度硒提高了藻细胞的最大光能转换效率(Fv/Fm), 最大电子传递速率(rETRmax)和光能利用率(α), 且低浓度处理组(1、10 mg/L)显著高于高浓度处理组(50、100 mg/L)(见图 4 A、B、C), 说明硒有助于提高螺旋藻的光合作用能力。单雪凤等[36]报道, 硒对螺旋藻的捕光色素蛋白如藻蓝蛋白、别藻蓝蛋白和Rubisco大亚基及超氧化物歧化酶(SOD)等蛋白质具有明显上调作用。由于藻胆蛋白是螺旋藻的重要捕光色素蛋白, 能将吸收的光能高效快速传递给光合反应中心[37], Rubisco大亚基直接参与光合作用固定CO2, 同时, 硒可参与辅酶A和辅酶Q的合成, 影响非特异性磷酸化酶的活性和ATP形成的速率[38]。因此, 这些蛋白质及酶含量增加有助于提高藻细胞的光合作用能力。
硒不但提高螺旋藻的光合作用能力, 还可以提高藻细胞的含碳率和固碳速率。本研究中, 螺旋藻的含碳率和固碳速率均为低浓度处理组(1、10 mg/L)显著高于高浓度处理组(50、100 mg/L), 与对照组相比, 1 mg/L处理组固碳速率显著提高了26.86%, 达153.32 mg/(L·d)(见图 5)。硒是谷胱甘肽过氧化物酶(GSH-Px)的活性成分, 具有抗氧化作用。Othman等[39]研究发现, 硒能显著提高SOD、GSH-Px的活性, 使GSH含量增加, 增强细胞的抗氧化能力, 清除活性氧自由基, 还能提高捕光色素蛋白如藻蓝蛋白、别藻蓝蛋白及叶绿素a的含量, 增强细胞的光合固碳能力[40-42]。Zhong等[20]的研究结果表明, 较低的硒浓度(≤750 mg/L)提高石莼细胞内过氧化物酶(GPX、CAT、POD)和超氧化物歧化酶(SOD)活性及光合色素含量, 有助于降低活性氧(ROS)水平, 维持藻细胞较好的生理状态, 提高藻细胞的光合作用能力和固碳效率, 但高浓度硒(≥1 000 mg/L)对石莼细胞产生毒性, 导致抗氧化系统活力下降, 细胞凋亡。本研究中, 高浓度硒(50、100 mg/L)抑制藻细胞生长, 与对照组相比, 固碳速率分别显著下降了52.9%和61.2%。有研究表明, 硒浓度较低时作为抗氧化剂, 而在较高浓度时, 硒则作为氧化剂导致细胞的抗氧化能力降低, 活性氧(ROS)水平升高, 引起蛋白质、核酸和脂质的氧化损伤, 最终细胞死亡[19, 43-44]。另外, 藻细胞硒代谢过程中产生的硒化氢对细胞色素氧化酶有强烈的抑制作用[43], 硒能与氨基酸的巯基反应, 抑制巯基酶活性[45], 高浓度亚硒酸钠能使藻细胞叶绿素含量降低, 从而影响光合作用[46]。
4 结语本实验使用改良的Zarrouk培养基, 设置不同的硒浓度, 在光照为70~80 μmoL·m-2·s-1 (LED光源), 温度为(30±1) ℃条件下培养钝顶螺旋藻, 结果表明, 较低的硒浓度(1和10 mg/L)促进藻细胞生长, 硒浓度为1 mg/L时, 培养10 d后, 其最终生物量达1.04 g/L, 比生长速率为0.27 d-1, 固碳速率最高为153.32 mg/(L·d), 综合考虑生长及固碳率速, 培养钝顶螺旋藻的最佳硒浓度为1 mg/L。本实验可为大规模培养富硒钝顶螺旋藻提供一定的参考。
| [1] |
师应来, 胡晟明. 技术进步、经济增长对二氧化碳排放的动态分析[J]. 统计与决策, 2017(16): 149-150. Ying S L, Hu C M. Dynamic analysis of carbon dioxide emissions by technological progress and economic growth[J]. Statistics and Decision, 2017(16): 149-150. (  0) 0) |
| [2] |
谢爽.利用污水污泥和高浓度二氧化碳培养海洋微藻技术研究[D].青岛: 中国海洋大学, 2010. Xie S. Study on the Cultivation Techniques of Marine Microalgae Using Sewage Sludge from Municipal Wastewater Treatment Plants Under High CO2 Concentrations[D]. Qingdao: Ocean University of China, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10423-1011030491.htm (  0) 0) |
| [3] |
杨玉娟.顿顶螺旋藻生长及固碳过程的影响因子研究[D].无锡: 江南大学, 2013. Yang Y J. The Study of Impact Factors Affecting the Growth and Carbon Fixation of Spirulina platensis[D]. Wuxi: Jiang Nan University, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10295-1013242218.htm (  0) 0) |
| [4] |
Abanades J C, Alvarez D. Conversion limits in the reaction of CO2 with lime[J]. Energy & Fuels, 2003, 17(2): 308-315.
(  0) 0) |
| [5] |
Kumar K, Dasgupta C N, Nayak B, et al. Development of suitable photobioreactors for CO2 sequestration addressing global warming using green algae and cyanobacteria[J]. Bioresource Technology, 2011, 102(8): 4945-4953. DOI:10.1016/j.biortech.2011.01.054
(  0) 0) |
| [6] |
Ho S H, Chen C Y, Lee D J, et al. Perspectives on microalgal CO2-emission mitigation systems-A review[J]. Biotechnology Advances, 2011, 29(2): 189-198. DOI:10.1016/j.biotechadv.2010.11.001
(  0) 0) |
| [7] |
Wang B, Li Y, Wu N, et al. CO2 bio-mitigation using microalgae[J]. Applied Microbiology and Biotechnology, 2008, 79(5): 707-718. DOI:10.1007/s00253-008-1518-y
(  0) 0) |
| [8] |
福迪, 罗迪安. 藻类学[M]. 上海: 上海科学技术出版社, 1980. Fott B, Luo A D. Algal Science[M]. Shanghai: Shanghai Science and Technology Press, 1980. (  0) 0) |
| [9] |
Santillan C. Mass production of Spirulina[J]. Cell Mol Life Sci, 1982, 38(1): 40-43. DOI:10.1007/BF01944524
(  0) 0) |
| [10] |
Becher E W. Production and utilization of the blue-green alga Spirulina in India[J]. Biomas, 1994, 4: 105-125.
(  0) 0) |
| [11] |
Rotruck J T, Pope A L, Gantherhe, et al. Selenium: Biochemical role as a component of glutathione per-oxidase[J]. Science, 1973, 179: 588-590. DOI:10.1126/science.179.4073.588
(  0) 0) |
| [12] |
Rotruck J T, Banu L, Larsen P R. Type I iodothyronine deiodinase is a selenocysteine-containing enzyme[J]. Nature, 1991, 349: 438-440. DOI:10.1038/349438a0
(  0) 0) |
| [13] |
徐晶, 朱茂祥, 陈婉华, 等. 螺旋藻富集同化无机硒研究[J]. 植物营养与肥料学报, 1997, 3(2): 169-175. Xu J, Zhu M X, Chen W H, et al. Study on assimilation of Spirulina to inorganic Selenium[J]. Plant Nutrition and Fertilizer Science, 1997, 3(2): 169-175. DOI:10.3321/j.issn:1008-505X.1997.02.012 (  0) 0) |
| [14] |
Julien C, Irena A W, Bertrand C, et al. Assessment of selenium bioavailability from high-selenium Spirulina subfraction in selenium-deficient rats[J]. Journal of Agricultural and Food Chemistry, 2002, 50(13): 3867-3873. DOI:10.1021/jf011646t
(  0) 0) |
| [15] |
杨芳, 郑文杰, 唐全民, 等. Se(Ⅳ)对钝顶和极大螺旋藻生长的影响[J]. 暨南大学学报(自然科学版), 2005, 26(5): 678-683. Yang F, Zheng W J, Tang Q M, et al. The effects of selenium(Ⅳ) on the growth of S. platensis and S. maxima[J]. Journal of Jinan University(Natural Science), 2005, 26(5): 678-683. (  0) 0) |
| [16] |
Chen T F, Zheng W J, Wong Y S, et al. Accumulation of selenium in mixotrophic culture of Spirulina platensis on glucose[J]. Bioresource Technology, 2007, 97: 2260-2265.
(  0) 0) |
| [17] |
Huang Z, Zheng W J, Guo B J. Optimization of cultivation conditions in se-enriched Spirulina platensis[J]. Chinese Journal of Biotechnology, 2002, 18(3): 373-376.
(  0) 0) |
| [18] |
高海洋. LED光照对富锌和富硒螺旋藻生长的影响[D].湛江: 广东海洋大学, 2016. Gao H Y. Effect of LED on growth Zinc enrichment of Spirulina[J]. Zhanjiang: Guangdong Ocean University, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10566-1016253685.htm (  0) 0) |
| [19] |
Wang D Z, Cheng Z D, Li S J, et al. Toxicity and accumulation of selenite in four microalgae[J]. Chinese Journal of Oceanology and Limnology, 2003, 21(3): 280-285. DOI:10.1007/BF02842844
(  0) 0) |
| [20] |
Zhong Y, Chen T F, Zheng W J, et al. Selenium enhances antioxidant activity and photosynthesis in Ulva fasciata[J]. Journal of Applied Phycology, 2015, 27(1): 555-562. DOI:10.1007/s10811-014-0350-2
(  0) 0) |
| [21] |
李志勇, 郭祀远, 李琳. 富硒螺旋藻培养技术研究[J]. 水生生物学报, 2001, 25(4): 386-391. Li Z Y, Guo S Y, Li L. A study of the se-rich cultivation technology of Spirulina platensis[J]. Acta Hydrobiologica Sinica, 2001, 25(4): 386-391. DOI:10.3321/j.issn:1000-3207.2001.04.014 (  0) 0) |
| [22] |
韩吉昌.产油微藻降耗、增效生产原理与技术研究[D].青岛: 中国海洋大学, 2017. Han J C. Biodiesel Production from Microalgae-Technical Research of Improving Efficiency and Reducing Cost[D]. Qingdao: Ocean University of China, 2017. (  0) 0) |
| [23] |
Zhu B, Sun F, Yang M, et al. Large-scale biodiesel production using flue gas from coal-fired power plants with Nannochloropsis microalgal biomass in open raceway ponds[J]. Bioresource Technology, 2014, 174: 53-59. DOI:10.1016/j.biortech.2014.09.116
(  0) 0) |
| [24] |
朱葆华, 常雅青, 何文栋, 等. RNA干扰UGP基因表达对三角褐指藻碳流分配的影响[J]. 中国海洋大学学报(自然科学版), 2017, 47(5): 42-49. Zhu b H, Chang Y Q, He W D, et al. Effect of RNA interference of UGP-Glucose pyrophosphorylase gene expression on carbon allocation in Phaeodactylum tricornutum[J]. Periodical of Ocean University of China, 2017, 47(5): 42-49. (  0) 0) |
| [25] |
陈新美, 梅兴国, 房伟, 等. 培养条件对螺旋藻生长和藻胆蛋白含量的影响[J]. 氨基酸和生物资源, 2003, 25(1): 21-25. Chen X M, Mei X G, Fang W, et al. Effect of culture condition on growth of S. platensis and phycobiliprotein content[J]. Amino Acids & Biotic Resources, 2003, 25(1): 21-25. DOI:10.3969/j.issn.1006-8376.2003.01.008 (  0) 0) |
| [26] |
田辉, 谯顺彬, 彭晓东, 等. 无机与有机碳源混合营养培养对钝顶螺旋藻生长的影响[J]. 贵州农业科学, 2011, 39(10): 122-124. Tian H, Qiao S B, Peng S D, et al. The influence of inorganic and organic carbon sources on mixtrophic growth of Spirulina platensis[J]. Guizhou Agricultural Sciences, 2011, 39(10): 122-124. DOI:10.3969/j.issn.1001-3601.2011.10.033 (  0) 0) |
| [27] |
段静波, 刘文清, 张玉钧, 等. 叶绿素荧光技术对受Cu2+胁迫藻类暗适应时间的研究[J]. 光子学报, 2014, 43(2): 217002. Duan J B, Liu W Q, Zhang Y J, et al. Study on the dark adaptation time of algaes stressed by Cu2+ using chlorophyll fluorescence measurements[J]. Acta Photonica Sinica, 2014, 43(2): 217002. (  0) 0) |
| [28] |
Krall J P, Edwards G E. Environmental effects on the relationship between the quantum yields of carbon assimilation and in vivo PSⅡ electron transport in maize[J]. Australian Journal of Plant Physiology, 1991, 18(3): 267-278.
(  0) 0) |
| [29] |
何晓艳, 向文洲, 何慧, 等. 海水钝顶螺旋藻富硒及其含硒藻蓝蛋白的研究[J]. 热带海洋学报, 2005, 24(4): 30-34. He X Y, Xiang W Z, He H, et al. A study on Se accumulation and Se enriched phycocyanin in Spirulina platensis cultured in seawater-based medium[J]. Journal of Tropical Oceanography, 2005, 24(4): 30-34. DOI:10.3969/j.issn.1009-5470.2005.04.005 (  0) 0) |
| [30] |
Li Z Y, Guo S Y, Li L. Bioeffects of selenite on the growth of Spirulina platensis and its biotransformation[J]. Bioresour Technol, 2003, 89(2): 171-176. DOI:10.1016/S0960-8524(03)00041-5
(  0) 0) |
| [31] |
Cepoi L, Zinicovscaia I, Zosim L, et al. Metals Removal by Cyanobacteria and Accumulation in Biomass[M]. Switzerland: Springer International Publishing, 2016.
(  0) 0) |
| [32] |
周志刚, 尹长松. 富硒极大螺旋藻整细胞、藻胆体及藻蓝蛋白的光谱特性[J]. 上海水产大学学报, 2002, 11(3): 205-214. Zhou Z G, Yin C S. Spectrum properties of intact cells, phycobilisomes and phycoyanin from se-rich Spirulina maxima[J]. Journal of Shanghai Fisheries University, 2002, 11(3): 205-214. (  0) 0) |
| [33] |
Feng T, Chen S S, Gao D Q, et al. Selenium improves photosynthesis and protects photosystem Ⅱ in pear (Pyrus bretschneideri), grape (Vitis vinifera), and peach (Prunus persica)[J]. Photosynthetica, 2015, 53(4): 609-612. DOI:10.1007/s11099-015-0118-1
(  0) 0) |
| [34] |
Zhang M, Tang S, Huang X, et al. Selenium uptake, dynamic changes in selenium content and its influence on photosynthesis and chlorophyll fluorescence in rice (Oryza sativa L.)[J]. Environ and Experimental Botany, 2014, 107: 39-45. DOI:10.1016/j.envexpbot.2014.05.005
(  0) 0) |
| [35] |
Kreft I, Mechora Š, Germ M, et al. Impact of selenium on mitochondrial activity in young tartary buckwheat plants[J]. Plant Physiology & Biochemistry Ppb, 2013, 63(4): 196-199.
(  0) 0) |
| [36] |
单雪凤, 张水妹, 蔡智辉, 等. 富硒螺旋藻光谱特性及其含硒蛋白质组分析[J]. 分析化学, 2016, 44(12): 1814-1819. Shan X F, Zhang S M, Cai Z H. Infrared spectrum, UV-visible absorption spectral characteristics and proteomic analysis of selenium enriched Spirulina platensis[J]. Chinese Journal of Analytical Chemistry, 2016, 44(12): 1814-1819. (  0) 0) |
| [37] |
Glazer A N, Yeh S N, Webb S P. Disk-to-disk transfer as the rate-limiting step for energy flow in phycobilisomes[J]. Science, 1985, 227: 419-423. DOI:10.1126/science.227.4685.419
(  0) 0) |
| [38] |
马文彦.硒(Ⅳ)、碲(Ⅳ)双组分胁迫对螺旋藻的生理生化影响[D].广州: 暨南大学, 2006. Ma W Y. Effects of Se(Ⅳ)、Te(Ⅳ) Stress on the Growth of Spiurlina[D]. Guangzhou: Jinan University, 2006. http://cdmd.cnki.com.cn/Article/CDMD-10559-2007044404.htm (  0) 0) |
| [39] |
Othman A I, El Missiry M A. Role of selenium against lead toxicity in male rats[J]. Journal of Biochemical & Molecular Toxicology, 2015, 12(6): 345-349.
(  0) 0) |
| [40] |
尹希.硒对钝顶螺旋藻和人血红细胞氧化损伤的保护作用及其机制[D].广州: 暨南大学, 2010. Yin X. Protection and Mechanisms of Selenium on Spirulina platensis and Human Red Blood Cells Against Oxidative Stress[D]. Guangzhou: Jinan University, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10559-2010124578.htm (  0) 0) |
| [41] |
乔玉辉, 商树田. 施硒对钝顶螺旋藻(S. platensis)品质的影响[J]. 中国农业大学学报, 2000, 5(1): 31-34. Qiao Y H, Shang S T. Effects of selenium (Se) on quality of Spirulina platensis(Sp.-D)[J]. Journal of China Agricultural University, 2000, 5(1): 31-34. DOI:10.3321/j.issn:1007-4333.2000.01.006 (  0) 0) |
| [42] |
Bhat V B, Madyastha K M. C-Phycocyanin: A potent peroxyl radical scavenger in vivo, and in vitro[J]. Biochemical & Biophysical Research Communications, 2000, 275(1): 20-25.
(  0) 0) |
| [43] |
尹长松.硒对极大螺旋藻整细胞、藻胆体及藻蓝蛋白光谱特性的影响[D].上海: 上海水产大学, 2002. Yin C S. Effects of selenium on spectra of intact cells、phycobilisomes and phycocyanin from Spirulina maxima[D]. Shanghai: Shanghai Ocean University, 2002. (  0) 0) |
| [44] |
Imlay J A, Linn S. DNA damage and oxygen radical toxicity[J]. Science, 1998, 240: 1302-1309.
(  0) 0) |
| [45] |
Ray N R, Ray A K. Liver succinoxidase and kidney succinic dehydrogenase activities on selenium toxicity[J]. Indian Veterinary Journal, 1975, 52: 267-270.
(  0) 0) |
| [46] |
Padmaja K, Somasekharaiah B V, Prasad A R K. Inhibition of chlorophyll synthesis by selenium: Involvement of lipoxygenase mediated lipid peroxidation and antioxidant enzymes[J]. Photosynthetica, 1995, 31: 1-7.
(  0) 0) |
2. College of Marine Life Sciences, Ocean University of China, Qingdao 266003, China;
3. Laboratory for Marine Fisheries and Aquaculture, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266237, China
 2019, Vol. 49
2019, Vol. 49


