2. 中国海洋大学三亚海洋研究院海南省热带水产种质重点实验室,海南 三亚 572000
分节是节肢动物、环节动物和一些脊索动物的共同特征。然而,不同物种的体节形成模式及其维持时间不同,体现了特定分类阶元动物体节形成的特征[1-6]。根据环节动物和节肢动物体节形成方式的组织学特点,将体节形成模式分为4种:后生长区模式、合胞体模式、端细胞模式和侧增殖带模式。在后生长区模式中,体节在后生长区通过细胞增殖逐个形成[1-2, 7];合胞体模式主要是一些长胚带昆虫体节形成模式,这些昆虫的部分或全部体节在其合胞体胚层中同时形成[3];端细胞模式仅在环节动物环带纲、寡毛类和水蛭(Helobdella triserialis)中发现,这类动物的体节是由4对外胚层干细胞(N、O、P和Q端细胞)增殖形成[4, 8-9];侧增殖带模式的体节起源于身体侧面对称形成的增殖细胞带,它们首先在侧面分节,然后向背侧或腹侧扩展形成体节[1]。
螠虫是一类海洋底栖无脊椎动物,最初被归类为环节动物。然而,尽管它们同为螺旋卵裂并具有典型的担轮幼虫和分节现象,但是螠虫动物的分节仅在幼虫中短暂维持,变态后便消失。这与典型环节动物终生维持分节的特征存在差异,由此螠虫动物曾被单独列为一个动物门类。之后,螠虫动物与环节动物的亲缘关系一直存在争议[10]。当前,学者们依据体壁结构、神经系统特征以及一些进化保守基因的系统分析数据提出螠虫动物应该隶属于环节动物[11-14],属于多毛纲的退化类型。Hou等[15]以栖息于中国沿海底质U形洞穴内的螠虫动物单环刺螠(Urechis unicinctus)为研究对象,基于转录组筛选了其幼虫体节形成的相关基因和通路。然而,由于缺失单环刺螠幼虫体节形成的组织发生过程,一定程度上限制了相关分子功能的深入研究进程。为此,本研究采用组织学和免疫组织化学技术揭示了其体壁发生和体节形成的特点,提出了螠虫动物体节形成模式,为探究在螠虫动物发育和进化中体节的分子机制提供基础数据。
1 材料与方法 1.1 实验动物与取样单环刺螠成体购自青岛市四方路,产地为烟台莱州海区。选择生殖期的雌、雄个体(体质量为(28.7±8.6) g),解剖肾管获得成熟的卵子和精子,体外人工授精(精卵数量比为10∶1)后,将受精卵于室温(17 ℃)下孵化,孵出的幼虫在充气海水(17~20 ℃,pH=7.8±0.2,盐度29±1)中饲养,投喂海洋单细胞藻类(球等鞭金藻(Isochrysis galbana)、小球藻(Chlorella vulgaris)和牟氏角毛藻(Chaetoceros muelleri)。定期观察和收集早期担轮幼虫、中期担轮幼虫、晚期担轮幼虫、早期体节幼虫、体节幼虫、蠕虫状幼虫和幼螠,用4%多聚甲醛固定16 h(4 ℃),在系列甲醇(25%、50%、75%和100%)中脱水,于-20 ℃冰箱中保存。所有样本需先滴加饱和氯化镁以使幼虫麻醉,待呈现完全伸展状态后进行固定。
1.2 组织学制样和观察采用琼脂石蜡双包埋法进行幼虫制样。取在甲醇中保存的各发育时期的幼虫,用梯度甲醇(95%、75%、50%、25%)复水后,预包埋于1.5%的琼脂中,定位后切成小块,再经梯度乙醇(75%、85%、95%、100%)脱水和二甲苯透明后,石蜡包埋。最后,使用旋转切片机进行石蜡连续切片,切片厚度为4 μm。使用Masson三色染色试剂盒(索莱宝,北京)并按照实验操作指南对切片进行染色,中性树胶封片后,在尼康E80i显微镜(尼康,日本)下观察和拍照。
1.3 免疫荧光组织化学制样和观察采用免疫荧光组织化学技术并使用增殖细胞核抗原抗体PCNA[16](Sigma,美国)检测了单环刺螠幼虫中细胞增殖情况。取冰箱中保存的样本,在梯度甲醇中复水后,经抗原修复和封闭处理,转移到一抗溶液(PCNA∶BSA=1∶500)中孵育过夜(4 ℃)。样本经0.1 mol/L PBT(pH=7.4)洗涤后,置于含有二抗荧光偶联抗体(驴抗兔Alexa Fluor 488,Invitgen,美国)的稀释液(二抗∶PBT=1∶300)中孵育2 h。最后,使用PBT洗涤幼虫,并在含有2.5% DAPI(索莱宝,北京)的PBT中室温避光孵育2 h,以标记细胞核。不加一抗孵育的样品作为阴性对照,以检验抗体的特异性。
使用细胞凋亡检测试剂盒(Roche,瑞士) 并按照操作指南执行TUNEL(末端脱氧核苷酸转移酶介导的dUTP缺口末端标记)检测。所有样本在尼康A1RSi共聚焦激光扫描显微镜(尼康,日本东京)下观察和拍照。
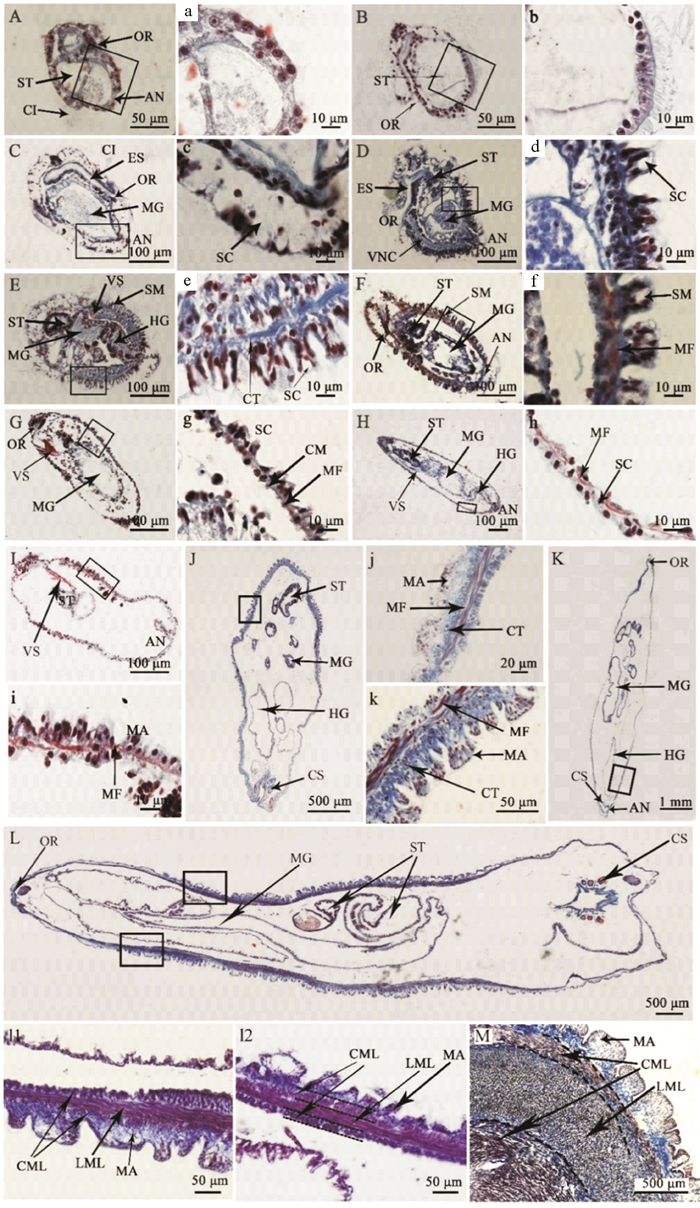
2 结果 2.1 单环刺螠体壁的组织发生组织学观察发现单环刺螠体壁经历了仅由单层上皮构成的体壁到由表皮、结缔组织和肌肉组织组成的多层结构体壁的发育过程(见图 1)。单环刺螠胚胎孵化后的第一个阶段为担轮幼虫(体长130~400 μm),其体壁是由单层上皮细胞构成(见图 1 A—C);该单层上皮细胞在早期担轮幼虫中呈近方形(见图 1 A),细胞核较大充满整个细胞(见图 1 a);中期担轮幼虫体壁上皮细胞转变为柱状,单层上皮中出现少量分泌细胞(见图 1 B,1b);晚期担轮幼虫的体壁柱状上皮中可见大量分泌细胞(见图 1 C,1c)。体节幼虫(体长380~500 μm)的体壁为单层柱状上皮、薄的结缔组织和少量纵肌纤维构成的多层结构(见图 1 D—F);其肌纤维直至晚期体节幼虫的体壁中才明显可见(见图 1 f);此外,体节幼虫体壁表面可见大小相同的体节。蠕虫状幼虫(体长480 μm~4 mm)的体壁组织类型与体节幼虫的基本一致,但体节在这个阶段消失,且各层组织结构更发达(见图 1 G—H);此外,当蠕虫状幼虫体长达到0.6 mm时,体壁表面可见一些大小一致的乳突结构(见图 1 I)。当蠕虫状幼虫前端产生吻,后端产生尾部刚毛时,它们将发育成幼螠(体长4 mm以上);幼螠的体壁上皮呈明显的复层上皮特征,乳突结构增多,结缔组织和肌肉组织增厚(见图 1 J—L);当幼螠体长达12 mm时,体壁上的肌纤维由外向内呈环肌-纵肌-环肌三个方向排列(见图 1 l1和l2),此时,体壁的组成和结构与成体基本一致,仅厚度与成体存在差异(见图 1 M)。
|
( A:早期担轮幼虫;B:中期担轮幼虫;C:晚期担轮幼虫;D:早期体节幼虫;E-F:体节幼虫;G-H:体节正在消失的幼虫;I:蠕虫状幼虫(0.6 mm);J:幼螠(4 mm);K:幼螠(1 cm);L:幼螠(1.2 cm);M:成体体壁;a—l:对应图黑框中的放大图;成体体壁(M)为横切,其他样本均为纵切。AN:肛门;CI:纤毛环;CML:环肌层;CS:尾刚毛;ES:食管;HG:后肠;LML:纵肌层;MA:乳突;MF:肌纤维;MG:中肠;OR:口部;SC:分泌细胞;ST:胃;SM:体节;VNC:腹神经索;VS:腹棘。A: early-trochophore; B: mid-trochophore; C: late-trochophore; D: early-segmentation larva; E and F: segmentation larvae; G and H: larvae with the disappearing segments; I: worm-like larva (0.6 mm); J: juvenile (4 mm); K: juvenile (1 cm); L: juvenile (1.2 cm); M: body wall of adult; a—l: magnifications of the box in the corresponding figure; the body wall of adult (M) is transversely cut, and other samples are longitudinally cut. AN: anus; CI: ciliary band; CML: circular muscle layer; CS: caudal setae; ES: esophagus; HG: hindgut; LML: longitudinal muscle layer; MA: mastoid; MF: muscle fiber; MG: mid-gut; OR: oral area; SC: secretory cell; ST: stomach; SM: segment; VNC: ventral nerve cord; VS: ventral seta. ) 图 1 单环刺螠体壁发生的组织学观察 Fig. 1 Histological observation of the body wall in U. unicinctus during ontogenesis |
组织学结果显示,单环刺螠体节仅在体节幼虫中明显可见,它们同时发生,共11个体节;每个体节由柱状上皮和结缔组织组成(见图 1 D—F)。至蠕虫状幼虫,这些体节消失(见图 1 e—h)。
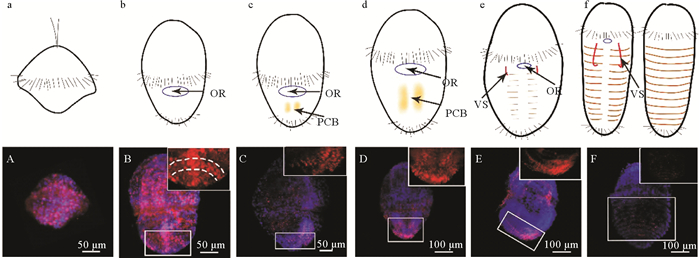
为了更好地了解单环刺螠幼虫的体节形成模式,本研究使用细胞分裂标记物(PCNA)和TUNEL试剂盒检测了幼虫体节形成过程中细胞增殖和凋亡。PCNA免疫组化结果显示,在早期担轮幼虫(见图 2 a)中可见大量的PCNA阳性细胞遍布幼虫虫体(见图 2 A);至中期担轮幼虫(见图 2b ),在其后部腹面中线两侧隐约可见一些PCNA阳性增殖信号,推测它们是体节的前体细胞(见图 2 B—D);至晚期担轮幼虫(见图 2 c, d),阳性增殖信号在其侧腹部呈隐约的条带状分布(见图 2 E);至早期体节幼虫(见图 2 e),阳性增殖信号在其背侧可见较弱的呈现(见图 2 F);至体节幼虫,在体节区域未检测到PCNA阳性信号(见图 2 f)。
|
( 红色PCNA信号代表增殖细胞,蓝色DAPI信号代表细胞核。A:早期担轮幼虫;B:中期担轮幼虫(受精后5 d,腹面观);C:中期担轮幼虫(受精后10 d,腹面观,腹面朝右);D:中期担轮幼虫(受精后10 d,腹面观);E:晚期担轮幼虫(腹面观,腹面朝左);F:早期体节幼虫(背面观);插图是方框区的放大。a—f:A—F幼虫示意图,表示增殖细胞带和体节形成模式;OR:口部;PCB:增殖细胞带;VS:腹棘。The red PCNA signals represent the proliferation cells and the blue DAPI signals represent the cell nuclei. A: early-trochophore; B: mid-trochophore (5 dph, ventral view); C: mid-trochophore (10 dph, right ventral view); D: mid-trochophores (10 dph, ventral view); E: late-trochophore (left ventral view); F: early-segmentation larva (dorsal view). The inserts are the magnifications of the boxes in the corresponding figures. a-f: Schematic exhibition of larva in A-F pictures, showing the proliferative cell bands and the segmentation formation pattern; OR: oral area; PCB: proliferating cell band; VS: ventral seta. ) 图 2 PCNA单抗检测单环刺螠幼虫中的细胞增殖 Fig. 2 The cell proliferation in U. unicinctus larvae detected using the PCNA monoclonal antibody |
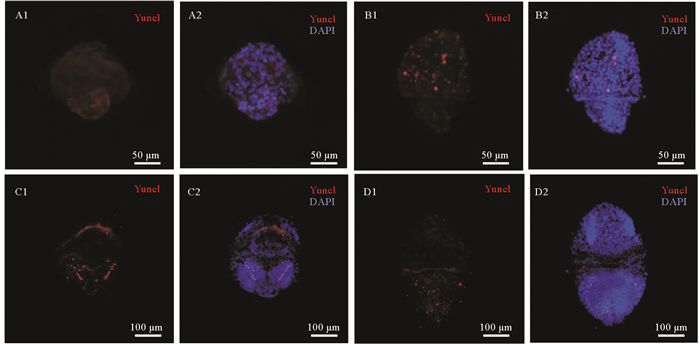
TUNEL检测结果显示,早期担轮幼虫中未发生明显的细胞凋亡(见图 3 A),随着幼虫的发育,从中期担轮幼虫到体节幼虫仅观察到少量的凋亡阳性信号,且除了晚期担轮幼虫外,在幼虫后腹部区域的体节发生部位未观察到明显的凋亡信号(见图 3)。
|
( 红色Tunel信号代表凋亡细胞;蓝色DAPI信号代表细胞核。A:早期担轮幼虫;B:中期担轮幼虫;C:晚期担轮幼虫;D:早期体节幼虫;1:Tunel检测;2:Tunel与DAPI检测的叠加图。Red Tunel signal represents the apoptotic cell; Blue DAPI signal represents the nucleus. A: early-trochophore; B: mid-trochophore; C: late-trochophore; D: early-segmentation larva. 1: Tunel assay; 2: merged pictures of Tunel and DAPI signals. ) 图 3 Tunel检测单环刺螠幼虫中的细胞凋亡 Fig. 3 The cell apoptosis in U. unicinctus larvae detected by Tunel |
体壁位于动物的最外层,是构成生物体的第一道防线,对机体内部器官具有保护作用,体壁的结构特征通常与其生长环境和生态习性有密切的相关性。单环刺螠的体壁既是一道保护屏障,还具有辅助摄食和代谢硫化物的作用[17-18]。本研究表明,单环刺螠体壁在最初担轮幼虫中仅由单层上皮组织构成,发育至幼螠时形成完整的体壁结构,由复层上皮、发达的结缔组织和肌肉组织(环肌-纵肌-环肌)构成。在此过程中,体节幼虫体壁中肌纤维显著增多,单层柱状上皮组织中的分泌细胞也大量增多,这种体壁结构特点更适应于体节幼虫的生活方式由浮游转变至底栖爬行。至蠕虫状幼虫,肌肉层进一步增厚,并在发育至1.2 cm幼螠时肌肉层中纤维分布达到成体肌肉层的组成形式,由外向内依次为环肌-纵肌-环肌,这种肌肉组织的迅速发育以及特定排列方式,使幼虫的运动能力大大增强,确保蠕虫状幼虫可以钻入底质洞穴内,并通过在洞穴内不断蠕动引起海水交换,利于呼吸和摄食。此外,在单环刺螠体壁发生过程中,其上皮组织中分泌细胞在中期担轮幼虫时呈零星状分布,随着发育该细胞数量逐渐增多,并在体节幼虫的体节处和蠕虫状幼虫以及幼螠体表的乳突处大量分布,这些分泌细胞所分泌的黏液增加了幼虫或幼螠的表面光滑度,推测可能具有减少其在底质中蠕动阻力的作用。自单环刺螠蠕虫状幼虫开始,体壁表面产生乳突,且数量和发达程度随着发育过程不断增加,推测这种结构特点可能有助于增大其体表面积,提高呼吸能力,以便其更好地适应穴居生活。
单环刺螠体壁发生过程中伴有体节形成,且体节仅在体节幼虫中维持,在蠕虫状幼虫中消失。组织学观察发现体节幼虫中的所有体节是同时产生的,它们仅在体壁表面(上皮组织和结缔组织)产生分节,而体壁内部的肌肉层和肠道内部结构中均未见分节特征(见图 1),这与环节动物典型的分节特征不同,后者分节不仅在外部形态可见,其内部器官也呈分节状排列,且环节动物的分节终生存在[12-13]。
TUNEL检测,单环刺螠从中期担轮幼虫到早期体节幼虫仅见少量阳性凋亡信号,未观察到凋亡信号的分节排列现象(见图 3),这表明单环刺螠此阶段幼虫的细胞基本处于正常生活状态,且幼虫体节的产生与细胞凋亡无关。
PCNA检测发现单环刺螠幼虫体节发生区域呈现明显的细胞增殖(见图 2)。在中期担轮幼虫中,其后部区域出现的细胞增殖区(PCNA阳性区)中增殖细胞逐渐增多、聚集、延伸并在幼虫的腹侧形成两个增厚的细胞带;晚期担轮幼虫至早期体节幼虫的发育过程中,这些PCNA阳性的增殖细胞开始呈分节状分布,这种分布特征从腹侧向背侧延伸,直至形成可见的条纹状体节。根据PCNA阳性信号在各期幼虫腹部的分布特点,我们提出这些PCNA阳性的增殖细胞参与了幼虫体节形成,它们首先聚集在中期担轮幼虫的后部腹侧,之后在幼虫腹中线两侧形成两个纵向增厚的细胞带,体节将在该区域产生并从腹侧向背侧扩展,直到形成完整的体节。将单环刺螠幼虫体节形成模式与已报道的4类模式[1-4, 7-9]进行比较,发现它与多毛类小头虫体节早期发生的侧增殖带模式类似[7]。综上,尽管螠虫动物体节仅在幼虫中短暂出现,不同于其他环节动物的体节终生维持,但本文发现单环刺螠幼虫体节形成模式与多毛类小头虫体节早期发生模式相似,这与近期的一些条形码基因(16S rRNA、18S rRNA、28S rRNA、Histone H3、Elongation Factor-1α、Cytochrome c oxidase subunit Ⅰ等)系统分析研究结论一致[11-14, 19-20],这表明单环刺螠与小头虫间亲缘关系更近。
| [1] |
Seaver E C, Thamm K, Hill S D. Growth patterns during segmentation in the two polychaete annelids, Capitella sp. Ⅰ and Hydroides elegans: Comparisons at distinct life history stages[J]. Evolution & Development, 2005, 7(4): 312-326. (  0) 0) |
| [2] |
Paul Z, Liu T C K. Short and long germ segmentation: Unanswered questions in the evolution of a developmental mode[J]. Evolution & Development, 2005, 7(6): 629-646. (  0) 0) |
| [3] |
Gregory K, Davis N H P. Short, long, and beyond: Molecular and embryological approaches to insect segmentation[J]. Annual Review of Entomology, 2002, 47: 669-699. DOI:10.1146/annurev.ento.47.091201.145251 (  0) 0) |
| [4] |
Weisblat D A, Shankland M. Cell Lineage and Segmentation in the Leech[J]. Philosophical Transactions of the Royal Society B: Biological Sciences, 1985, 312(1153): 39-56. (  0) 0) |
| [5] |
Scholtz G. The Articulata hypothesis—or what is a segment?[J]. Organisms Diversity & Evolution, 2002, 2(3): 197-215. (  0) 0) |
| [6] |
Olivier P. The segmentation clock: Converting embryonic time into spatial pattern[J]. Science, 2003, 301(5631): 328-330. DOI:10.1126/science.1085887 (  0) 0) |
| [7] |
Seaver E C, Kaneshige L M. Expression of 'segmentation' genes during larval and juvenile development in the polychaetes Capitella sp. Ⅰ and Hydroieds elegans[J]. Developmental Biology, 2006, 289(1): 179-194. DOI:10.1016/j.ydbio.2005.10.025 (  0) 0) |
| [8] |
Steven M, Irvine M Q M. Cellular and molecular mechanisms of segmentation in annelids[J]. Seminars in Cell and Developmental Biology, 1996, 7(4): 593-604. DOI:10.1006/scdb.1996.0073 (  0) 0) |
| [9] |
Zackson S L. Cell clones and segmentation in leech development[J]. Cell, 1982, 31(3): 761-770. DOI:10.1016/0092-8674(82)90330-0 (  0) 0) |
| [10] |
Hessling R, Westheide W. Are Echiura derived from a segmented ancestor? Immunohistochemical analysis of the nervous system in developmental stages of Bonellia viridis[J]. Journal of Morphology, 2002, 252(2): 100-113. DOI:10.1002/jmor.1093 (  0) 0) |
| [11] |
Mchugh D. Molecular evidence that echiurans and pogonophorans are derived annelids[J]. Proceedings of the National Academy of Sciences of the United States of America, 1997, 94(15): 8006-8009. DOI:10.1073/pnas.94.15.8006 (  0) 0) |
| [12] |
Bleidorn C V L, Bartolomaeus T. A contribution to sedentary polychaete phylogeny using 18S rRNA sequence data[J]. Journal of Zoological Systematics & Evolutionary Research, 2010, 41(3): 186-195. (  0) 0) |
| [13] |
Bleidorn C, Vogt L, Bartolomaeus T. New insights into polychaete phylogeny (Annelida) inferred from 18S rDNA sequences[J]. Molecular Phylogenetics and Evolution, 2003, 29(2): 279-288. DOI:10.1016/S1055-7903(03)00107-6 (  0) 0) |
| [14] |
Struck T H, Schult N, Kusen T, et al. Annelid phylogeny and the status of Sipuncula and Echiura[J]. BMC Evolutionary Biology, 2007, 7(1): 57. DOI:10.1186/1471-2148-7-57 (  0) 0) |
| [15] |
Hou X, Wei M, Li Q, et al. Transcriptome analysis on larval segment formation and secondary loss in the echiuran worm Urechis unicinctus[J]. International Journal of Molecular Sciences, 2019, 20(8): 1806. DOI:10.3390/ijms20081806 (  0) 0) |
| [16] |
Moldovan G L, Pfander B, Jentsch S. PCNA, the maestro of the replication fork[J]. Cell, 2007, 129(4): 665-679. DOI:10.1016/j.cell.2007.05.003 (  0) 0) |
| [17] |
Jumars P A, Dorgan K M, Lindsay S M. Diet of worms emended: An update of polychaete feeding guilds[J]. Annual Review of Marine Science, 2015, 7(1): 497-520. DOI:10.1146/annurev-marine-010814-020007 (  0) 0) |
| [18] |
Ma Y, Zhang Z, Shao M, et al. Response of sulfide: quinone oxidoreductase to sulfide exposure in the echiuran worm Urechis unicinctus[J]. Marine Biotechnology, 2012, 14(2): 245-251. DOI:10.1007/s10126-011-9408-1 (  0) 0) |
| [19] |
Goto R, Monnington J, Sciberras M, et al. Phylogeny of Echiura updated, with a revised taxonomy to reflect their placement in Annelida as sister group to Capitellidae[J]. Invertebrate Systematics, 2020, 34(1): 101-111. DOI:10.1071/IS19020 (  0) 0) |
| [20] |
Goto R, Okamoto T, Ishikawa H, et al. Molecular phylogeny of echiuran worms (Phylum: Annelida) reveals evolutionary pattern of feeding mode and sexual dimorphism[J]. PLoS One, 2013, 8(2): e56809. DOI:10.1371/journal.pone.0056809 (  0) 0) |
2. Key Laboratory of Tropical Aquatic Germplasm of Hainan Province, Sanya Oceanographic Institute, Ocean University of China, Sanya 572000, China
 2023, Vol. 53
2023, Vol. 53


