2. 青岛海洋科学与技术试点国家实验室,海洋药物与生物制品功能实验室,山东 青岛 266237;
3. 中国海洋大学 物理海洋教育部重点实验室,海洋高等研究院,山东 青岛 266100;
4. 青岛海洋生物医药研究院,海洋药物与生物制品功能实验室,山东 青岛 266061
藤壶Amphibalanus (Balanus) 是分布广泛的海洋污损生物[1],其幼体可以随海洋流移动,成体可以附着在船只和大型海洋生物体上,因此对海防、海运交通、工业和渔业等均有危害[2]。藤壶亚目是目前为止海洋生物群落中种类最为丰富和最重要的类群之一。常见的藤壶外型有两种[3]:一是鹅颈型藤壶,俗称“海鸡脚”或“狗爪螺”隶属围胸目茗荷科[4],背甲呈两片对称扁平外壳,由金星幼体经变态发育后成为成体;另一种是圆椎型藤壶,它的外壳由复杂石灰质组成,外型类似缩小的火山。
藤壶的生活史分为两个阶段:营浮游生活幼虫阶段和成体固着生活阶段[5],其黏附过程又可细分为四个阶段[6]。(1)藤壶胶分泌[7]:藤壶幼虫发育到腺介幼虫时期后,会游到材料表面利用触角进行探索,判断此处基底是否适合生长[8],找到合适的表面时,幼虫体内的水泥腺体等结构组织中就会产生相应的生理反应,开始分泌藤壶胶进行黏附。藤壶胶是藤壶分泌的一种多蛋白复合物,它使藤壶牢固附着在各种基质表面[9],藤壶胶的主要成分是蛋白质,约占藤壶胶总量的90%,其余为碳水化合物、脂质和无机灰分等[10];(2)永久黏附:基底材料的质地、粗糙度、表面能、颜色等都与幼虫附着密切相关,当附着基质适宜生长时,腺介幼虫分泌胶质[11]黏附在基底上,之后将开始其不可逆的永久性附着过程;(3)变态反应:藤壶幼体黏附在基底表面后将开启为期一周左右的变态反应过程[12];(4)成长阶段:牢固黏附的藤壶在不断蜕皮过程中逐渐成长[13]。在鹅颈藤壶黏附过程中,其幼体中合成了一种沉降诱导糖蛋白复合物(Settlement Inducing Protein Complex, SIPC),诱导其沉降。SIPC是一种高分子量多糖也是一种接触信息素,已被确定为鹅颈藤壶定居的主要媒介,由分子量为76、88和98 kDa的三个主要亚基组成[14],均具有扁豆凝集素结合糖链[15],SIPC亚基中的糖链单元对鹅颈藤壶的幼体附着有重要作用[16],可以高效诱导同物种的幼体附着[17]。SIPC涉及成体-幼体和幼体-幼体的相互作用,在鹅颈藤壶的整个生命周期中均有表达[18]。
糖链是三大高分子化合物之一[19],在自然界中广泛存在,N-糖链最初是在卵清蛋白的生化分析中发现的,其通过乙酰氨基葡萄糖(GlcNAc)与天冬酰胺(Asn)残基的氨基侧链共价相连,N-糖基化是蛋白质翻译后重要的修饰形式[20],细胞内至少超过50%的蛋白质都是有糖链修饰的,多糖的糖链部分承载着重要的生物学信息[21],在粘附识别、分化发育、信号转导免疫应答以及蛋白受体调节中发挥着重要作用[22]。SIPC亚基中的糖链单元对鹅颈藤壶的幼体附着有重要作用,为了进一步研究N-糖链在鹅颈藤壶幼体沉降中的作用以及糖链单元在鹅颈藤壶附着黏附过程中的作用,本研究分别提取鹅颈藤壶肌肉质柄和背甲中的多糖,对其分子量分布、单糖组成、总糖含量及蛋白质含量等基本理化性质进行分析;采用液质联用分析方法对鹅颈藤壶成体与幼体肌肉质柄中的N-糖链进行分析比较,以期从糖链的角度,为探寻鹅颈藤壶附着机理提供糖组分依据。
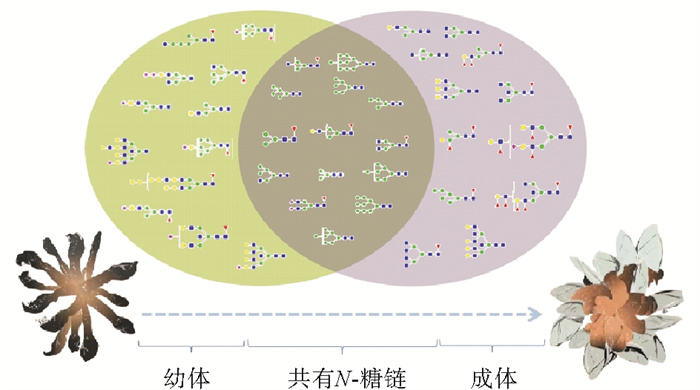
|
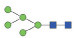
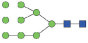
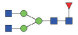
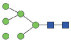
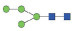
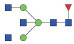
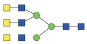
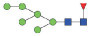
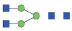
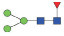
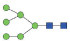
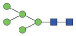
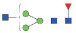
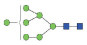
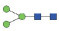
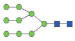
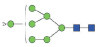
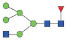
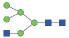
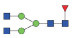
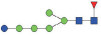
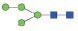
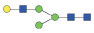
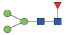
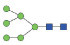
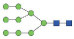
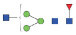
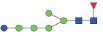
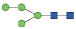
图 1 鹅颈藤壶N-糖链表达谱示意图 Fig. 1 The N-glycans expression profiling of Gooseneck barnacle |
鹅颈藤壶,采自中国南海海域得国家自然科学基金委员会共享航次计划项目(项目批准号:42049905)的资助,该航次(航次编号NORC2021-05)由“东方红”三号科考船实施;PNGase F酶购自New England BioLabs(USA);氰基硼氢化钠,碳酸氢铵购自Sigma-Aldrich(USA);甲醇,乙腈(色谱纯)购自德国Merck公司;醋酸钠,硼酸购自国药集团化学试剂有限公司;木瓜蛋白酶(Papain),购自美国Amresco公司;L-半胱氨酸(L-cysteine)、甘露糖(Man)、氨基葡萄糖(GlcN)、鼠李糖(Rha)、葡萄糖醛酸(GlcA)、半乳糖醛酸(GalA)、氨基半乳糖(GalN)、葡萄糖(Glc)、半乳糖(Gal)、阿拉伯糖(Ara)、岩藻糖(Fuc)、1-苯基-3-甲基5-吡唑啉酮(PMP)、Pronase酶、邻氨基苯甲酸(2-AA)购自Sigma-Aldrich(USA)。
1.2 实验仪器Bioprep-24生物样品均质仪,杭州奥盛仪器有限公司产品;5430R离心机,德国Eppendorf公司产品;RVC 2-18真空离心浓缩仪,德国Christ公司产品;ME204E电子分析天平,瑞士Mettler Toledo公司产品;R-3 HB水浴锅,瑞士Buchi公司产品;FD-1C-50冷冻干燥仪,北京博医康实验仪器有限公司产品;TM-1F涡旋振荡器,德国Wiggens公司产品;Hypercarb色谱柱(150 mm×2.1 mm, 3 μm),美国Thermo Scientific公司产品;Agilent 1290超高效液相色谱仪,美国Agilent Technology公司产品;LTQ Orbitrap XL质谱仪,美国Thermo Scientific公司产品;高效液相色谱仪,天津博纳艾杰尔。
2 实验方法 2.1 鹅颈藤壶多糖的提取鹅颈藤壶背甲和肌肉质柄在烘箱内干燥,研磨并粉碎。取外壳粉末20 g于10 mL氯仿/甲醇(4∶1,v/v) 溶液中浸泡脱脂24 h,离心弃去上清液,沉淀晾干后,加500 mL 1% NaOH溶液于30 ℃水浴加热12 h,用1% HCl中和。中和后离心保留上清液,加4倍体积95%乙醇,4 ℃冰箱静置过夜沉淀多糖。离心去掉上清液得沉淀,于60 ℃下干燥0.5 h。将干燥沉淀复溶,于截留分子量为7 000 Da的透析袋中透析除盐,最后,透析液减压浓缩、冷冻干燥得到鹅颈藤壶背甲多糖。取肌肉质柄处粉末10 g加至250 mL 0.1 mol·L-1乙酸钠缓冲液(pH=6.0)、1 g木瓜蛋白酶、5 mmol·L-1 EDTA二钠和5 mmol·L-1半胱氨酸的混合液中,于60 ℃水浴搅拌反应24 h。反应混合物离心(5 000 r·min-1,30 min)除去沉淀,向上清液中加入4倍体积95%乙醇,4 ℃冰箱静置过夜沉淀多糖,离心得沉淀,于60 ℃下干燥0.5 h。将干燥沉淀加水复溶,于截留分子量为7 000 Da的透析袋中透析除盐,最后,透析液减压浓缩、冷冻干燥得到藤壶肌肉质柄处多糖粗品。
2.2 鹅颈藤壶多糖理化性质分析 2.2.1 单糖组成单糖组成采用PMP柱前衍生高效液相色谱法测定。样品浓度为5 mg/mL;色谱柱:Agilent Eclipse XDB-C18 (150 mm×4.6 mm,5 μm);流动相为0.1 mol·L-1磷酸盐缓冲液(pH=6.7)-乙睛(体积比=83∶17);流速1 mL/min;柱温30 ℃;进样体积10 μL;检测器:紫外检测器;检测波长:245 nm;信号采集:45 min;样品处理:完全酸水解,准确称取背甲、肌肉质柄所得多糖1 mg,加200 μL水,在加200 μL 4.0 mol·L-1三氟乙酸,于安瓿瓶中密封保存,105 ℃水解反应6 h后,加入甲醇除去过量三氟乙酸,再用少量蒸馏水复溶,得酸水解产物;PMP衍生:使用微量移液器,准确移取两种多糖及甘露糖、氨基葡萄糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、氨基半乳糖、葡萄糖、半乳糖、阿拉伯糖、岩藻糖标准品各100 μL,分别加入100 μL 0.3 mol·L-1 NaOH水溶液和120 μL PMP溶液,置于70 ℃水浴中,反应1 h,反应结束后室温下冷却,加入100 μL 0.3 mol·L-1的稀盐酸中和,加入500 μL氯仿萃取三次,萃取后保留水层,离心过膜,用于高效液相色谱分析。
2.2.2 总糖、蛋白质含量测定总糖含量以甘露糖为标准品,采用苯酚-硫酸法测定。蛋白质含量以标准牛血清蛋白(BSA)为标准品,采用考马斯亮蓝法测定。
2.2.3 分子量测定平均分子量采用高效凝胶渗透色谱与十八角度激光散射仪HPGPC-MALLS联用法测定。样品浓度:5 mg/mL;色谱柱:Shodex Ohpak SB-804 HQ (8.0 μm×300 mm) 和Shodex Ohpak SB-802.5 HQ (8.0 μm×300 mm)色谱柱串联;流动相:0.1 mol·L-1 NaNO3溶液;流速:0.6 mL/min;柱温:35 ℃;进样体积:100 μL;检测器:示差检测器(RI)及多角度激光散射检测器(MALLS);信号采集:45 min;样品处理:分别取每位点处背甲、肌肉质柄所得多糖粗品2 mg,各加400 μL 0.1 mol·L-1的NaNO3溶液,12 000 r·min-1转速下离心10 min,过0.22 μm膜。采用Astra5.3.4.20软件处理数据。
2.3 N-糖链的释放分别取鹅颈藤壶幼体和成体组织20 mg于匀浆管内,加适量双蒸水充分匀浆后加入10倍体积的丙酮,涡旋,超声30 min,重复3次,弃上清,沉淀置于通风橱内吹干。每份加200 μL Pronase酶溶液,于50 ℃水浴酶解12 h,100 ℃水浴灭活,12 000 r·min-1离心10 min。向上清加4倍体积无水乙醇,-20 ℃静置过夜,12 000 r·min-1离心10 min,弃上清。沉淀复溶于45 μL蒸馏水中加5 μL 10×多糖变性缓冲液(含0.5% SDS,40 mmol·L-1 DTT),混匀后于100 ℃煮沸变性,再加10 μL 10% NP-40和10 μL 10×GlycoBuffer2反应缓冲液,补水至100 μL,加1.3 μL PNGase F酶,37 ℃ 130 r·min-1摇床反应过夜。反应后100 ℃煮沸10 min使酶变性失活,冷却后加3倍体积的冰乙醇,-20 ℃条件下静置2 h,离心取上清液,离心浓缩至干。
2.4 N-糖链的标记首先制备含4%的醋酸钠(w/v)和2%的硼酸(w/v)甲醇溶液,新鲜配制标记试剂,即将0.32 mol·L-1的2-AA和1.0 mol·L-1的NaBH3CN溶于1.0 mL上述甲醇-醋酸钠-硼酸溶液。标记反应时,样品溶于20 μL双蒸水中,然后快速地将20 μL的2-AA标记试剂加至样品中,混合物在65 ℃下避光水浴反应2 h。高速离心取上清,待PGC-ESI-MS/MS分析。
2.5 N-糖链的液质分析在Agilent 1290超高效液相色谱仪上实现对N-糖链的分析,色谱柱:Hypercarb(150 mm×2.1 mm,3 μm);柱温:35 ℃;流动相:10 mmol·L-1碳酸氢铵水溶液和含10 mmol·L-1碳酸氢铵的乙腈溶液;流速:0.12 mL/ min;样品进样量:5 μL;自动进样器温度:4 ℃。
2.6 N-糖链的信息化数据处理使用Xcalibur 2.0.7软件采集PGC-ESI-MS/MS数据,然后用DeconTools软件对液质数据进行去卷基化。根据离子丰度归一化,利用GlycResoft软件对DeconTools处理的数据进行匹配,并进行相对定量分析。最后通过GlycoWorkBench软件进行数据的匹配和筛选。
3 实验结果 3.1 鹅颈藤壶多糖提取鹅颈藤壶隶属围胸目茗荷科,背甲坚硬,用氯仿/甲醇(4∶1,v/v)溶液中浸泡24 h脱脂,除去鹅颈藤壶中的脂质和色素等杂质成分,经过碱水解/蛋白酶解、乙醇沉淀方法提取得到两种多糖粗品,背甲组织中多糖粗品ZW6-1和肌肉质柄组织中多糖粗品ZW6-2,产率分别为0.87%、4.84%。
3.2 鹅颈藤壶多糖理化性质分析为了研究两种多糖粗品ZW6-1、ZW6-2的基本理化性质,本实验分别测定了2种多糖的总糖含量、蛋白质含量、相对分子质量和单糖组成,结果如表 1所示。单糖组成主要含有甘露糖、半乳糖、半乳糖胺、岩藻糖和葡萄糖,在肌肉质柄组织中富含甘露糖和葡萄糖,少部分样品中含有氨基葡萄糖和岩藻糖,相比之下背甲组织中糖含量较低。背甲及肌肉质柄的总糖含量分别为4.70%、11.99%;蛋白质含量分别为36.21%、60.14%。高甘露糖组分的单糖组成及蛋白质含量结果表明,鹅颈藤壶多糖中可能是一种糖蛋白且含有较丰富的N-糖链表达,因此进一步分析不同生长时期N-糖链表达谱的差异性并比较,为探寻鹅颈藤壶附着机理提供糖组分依据。
|
|
表 1 两种鹅颈藤壶多糖理化性质分析结果 Table 1 Physical and chemical properties of two kinds of Gooseneck barnacle glycoproteins |
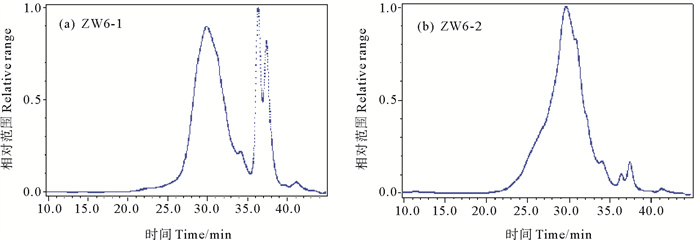
通过高效液相色谱法获得多糖分子量色谱图,检测分析多糖样品的分子量,并同时对样品的纯度进行评价,检测结果如图 2(a)和图 2(b),所得背甲多糖和肌肉质柄多糖样品在相应图谱上均上显示为单一峰,纯度较高,两者分子量分别为为19.81和18.40 kDa。
|
图 2 两种鹅颈藤壶多糖的HPGPC-MALLS色谱图 Fig. 2 HPGPC-MALLS chromatogram of two kinds of Gooseneck barnacle glycoproteins |
从鹅颈藤壶背甲和肌肉质柄中得到的两种多糖,通过基本理化性质分析,肌肉质柄中蛋白质含量高达60.14%,单糖组成以甘露糖为主,因此采用液质分析方法对鹅颈藤壶成体与幼体肌肉质柄中的N-糖链表达谱进行分析,鹅颈藤壶成体中高表达的N-糖链如表 2所示,在成体中共鉴定得到26种N-糖链,其中13种N-糖链稳定高表达。高甘露糖型N-糖链占总糖链的20%以上,而其中F1H3N2含量最高,约占总糖链的39.06%。幼体中高表达的N-糖链,如表 3所示,共在幼体鉴定得到26种N-糖链,其中14种N-糖链稳定高表达表达,高甘露糖型N-糖链占总糖链的50%以上,而其中F1H3N2含量最高,约占总糖链的21.65%。如表 4所示,在成体与幼体高表达的N-糖链中有9种是二者共同拥有的,但含量有所不同。
|
|
表 2 A-GB中高表达的N-糖链 Table 2 Highly expressed N-glycans in A-GB |
|
|
表 3 L-GB中高表达的N-糖链 Table 3 Highly expressed N-glycans in L-GB |
|
|
表 4 A-GB与L-GB中共有N-糖链 Table 4 N-glucans common to A-GB and L-GB |
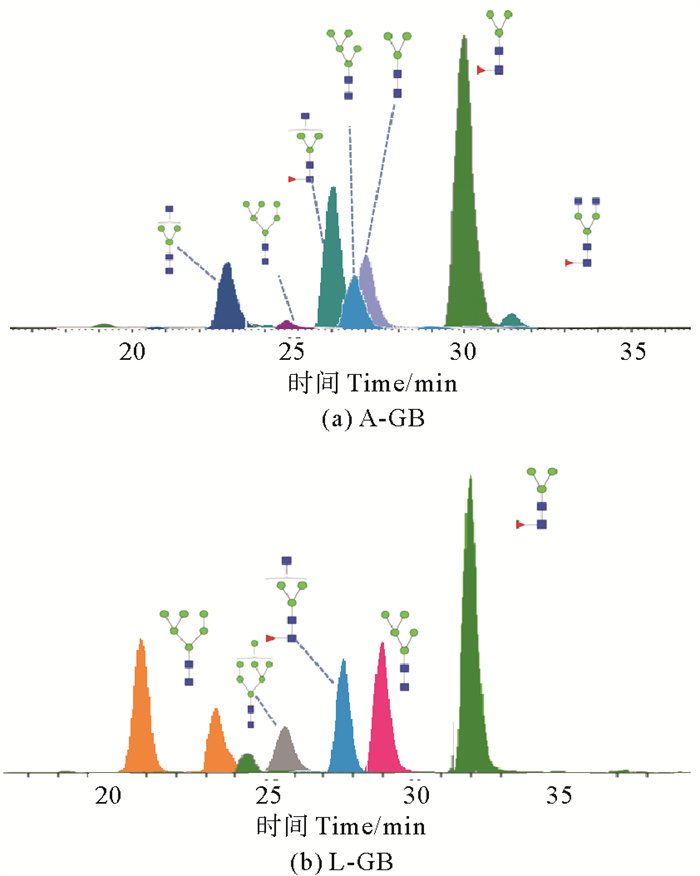
通过PGC-ESI-MS/MS方法获得鹅颈藤壶成体、幼体中N-糖链表达谱,鹅颈藤壶成体主要N-糖链分析离子流图如图 3所示,相对丰度较高的糖型组成为F1H3N2(39.06%)、F1H3N3(24.44%)、H3N3(9.35%)、H3N2(8.29%)、H5N2(6.74%)。鹅颈藤壶幼体主要N-糖链分析离子流图如图 3所示,相对丰度较高的糖型组成为F1H3N2(21.65%)、H6N2(15.93%)、H5N2(14.75%)、F1H3N3(11.64%)、H7N2(7.13%)。
|
图 3 不同生长时期鹅颈藤壶中主要N-糖链提取离子流图 Fig. 3 Extraction of Ion current diagram of N-glycans extraction from Barnacles at different growth stages |
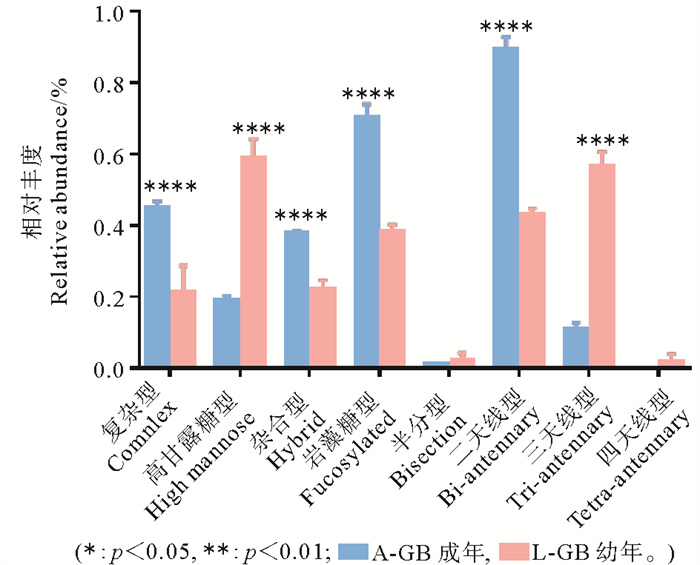
如图 4根据N-糖链的结构类型、天线数量和不同修饰差异分析,高丰度的高甘露糖型N-糖链是鹅颈藤壶的显著特征,不同生长时期鹅颈藤壶N-糖链均主要以高甘露糖型为主,特别在幼体中高甘露糖型N-糖链含量显著高于成体,相比之下藤壶成体杂合型、复杂型、双天线型和岩藻糖基化型N-糖链含量均高于幼体。
|
图 4 不同生长时期鹅颈藤壶中N-糖链差异分析 Fig. 4 Analysis of N-glycochain difference in Barnacles with different growth stages |
本文以南海海域鹅颈藤壶为原料,经过脱脂、碱水解/蛋白酶解、乙醇沉淀方法提取得到多糖,基本理化性质分析发现肌肉质柄中含有丰富的甘露糖和葡萄糖,已有研究证明单糖组成对藤壶幼虫附着沉降能力有显著影响,甘露糖对其沉降的影响最大,其次是岩藻糖,木糖的影响力最弱[17],这与本文鹅颈藤壶单糖组成以甘露糖为主的结果相吻合,并且蛋白质含量测定结果显示肌肉质柄中的蛋白质含量高达60.14%,推测鹅颈藤壶多糖是一种糖蛋白有较丰富的N-糖链表达,因此,基于PGC-ESI-MS/MS的方法进一步对不同生长时期鹅颈藤壶肌肉质柄中的N-糖链进行分析,结果显示在藤壶成体和幼体中N-糖链的种类大致相同,但丰度各不相同,整体来说藤壶成体与幼体中均发现26条N-糖链,含量最高的均为F1H3N2,高丰度的高甘露糖型是鹅颈藤壶的显著特征,分别占总糖链的20.81%和52.17%。结合鹅颈藤壶单糖组成及N-糖链分析的结果显示高甘露糖型N-糖链可能与藤壶的沉降粘附过程有着密切的关联。
SIPC蛋白中有三条亚基,当单独分析每个亚基时,发现它们对诱导腺介幼体沉降与完整的SIPC一样有效[18],每个亚基都含有凝集素结合位点,凝集素能够识别附着诱导蛋白复合物(SIPC)上的糖链,SIPC的活性糖链是活性所必需的[23],用过氧化物酶缀合的凝集素特异性屏蔽SIPC糖链结构中的Man,发现SIPC诱导幼虫附着的活性丧失[16],因此我们认为Man可能是藤壶幼虫沉降过程中SIPC蛋白发送附着信号的识别位点。Helen E[24]等人通过液相色谱和荧光检测对SIPC的N-聚糖谱进行表征,发现高甘露糖型聚糖是天然SIPC中最普遍的聚糖,形成了由低聚甘露糖系列M2-9组成的甘露糖阶梯。SIPC的N-聚糖谱表征发现以下几种主要N-糖链:F1H3N2、H3N2、H3N2,这几种N-糖链在鹅颈藤壶成体与幼体中均有高丰度表达,对SIPC的N-聚糖谱进行表征时还发现有一种N-糖链:H3N3,该糖链在鹅颈藤壶成体中高度表达,在幼体的N-糖链中未见表达,推测该糖链在鹅颈藤壶沉降附着过程中发挥重要作用。
高甘露糖型N-糖链具有强烈的诱导藤壶幼体附着的活性。本文对不同生长时期鹅颈藤壶肌肉质柄中的N-糖链含量进行分析,发现高甘露糖型N-糖链是其优势糖链,成体与幼体高甘露糖型含量有显著性差异,幼体中高甘露糖型含量远远高于成体。处于浮游阶段的鹅颈藤壶幼体,急于寻找合适的基质附着[24],在其发现合适的附着基质时,幼虫感知外源信号,然后将外源信号转换成体内信号发送给特定的部位,并开始附着,SIPC蛋白开始活跃,与SIPC蛋白活性密切相关的糖链表达增加。因此可以解释幼体中高甘露糖型N-糖链远远高于成体的现象。相比之下,藤壶成体杂合型、复杂型、双天线型和岩藻糖基化型均高于幼体,这可能与高甘露糖型是其他糖型加工的最初形式有关,表明在藤壶的生长发育过程中伴随着N-糖链修饰的改变[25],藤壶成体沉降结束后,牢固黏附的藤壶在不断蜕皮过程中逐渐成长,其组织中N-糖型也不断丰富。本文从糖链的角度,为鹅颈藤壶附着机理提供糖组分的依据,不同生长时期鹅颈藤壶N-糖链均以高甘露糖型为主,鹅颈藤壶幼体中高甘露糖型N-糖链含量为成体中高甘露糖型N-糖链含量的2.5倍,推测N-糖链在鹅颈藤壶长发育过程中发挥着至关重要的作用,可能高甘露糖型N-糖链与其附着黏附能力密切相关。
| [1] |
赵梅英, 陈立侨, 禹娜. 藤壶——高度适应附着的海洋污损生物[J]. 生物学教学, 2004, 29(5): 56-57. Zhao M Y, Chen L Q, Yu N. Barnacles: Highly adaptable Marine fouling organisms[J]. Biology Teaching, 2004, 29(5): 56-57. DOI:10.3969/j.issn.1004-7549.2004.05.040 (  0) 0) |
| [2] |
陈新, 唐敏, 刘秋妤, 等. 藤壶黏附研究进展[J]. 海洋科学, 2017, 41(7): 150-156. Chen X, Tang M, Liu Q Y, et al. Research progress in barnacle adhesion[J]. Marine Sciences, 2017, 41(7): 150-156. (  0) 0) |
| [3] |
武弦. 藤壶和茗荷儿[J]. 海洋世界, 2016(7): 12-13. Wu X. Barnacles and Minghe[J]. Ocean World, 2016(7): 12-13. (  0) 0) |
| [4] |
马晓惠. 小夜藤壶: 强行搭乘的霸王客[J]. 百科探秘(海底世界), 2017, 12: 8-16. Ma X H. Xiao Y. Barnacles: A bully on a forced ride[J]. Encyclopedia Exploration (Underwater World), 2017, 12: 8-16. (  0) 0) |
| [5] |
肖扬. 藤壶的表面附着机制研究[D]. 北京: 中国石油大学(华东), 2017. Xiao Y. Study on Surface Adhesion Mechanism of Barnacle[D]. Beijing: China University of Petroleum (East China), 2017. (  0) 0) |
| [6] |
He L S, Zhang G, Qian P Y, et al. Characterization of two 20 kDa-cement protein (cp20k) homologues in Amphibalanus amphitrite[J]. Public Library of Science One, 2013, 8(5): 64130. (  0) 0) |
| [7] |
Chen Z F, Matsumura K, Wang H, et al. Toward an understanding of the molecular mechanisms of barnacle larval settlement: A comparative transcriptomic approach[J]. Public Library of Science One, 2011, 6(7): 22913. (  0) 0) |
| [8] |
Wang X, Chao W, Xu B, et al. Adsorption of intrinsically disordered barnacle adhesive proteins on silica surface[J]. Applied Surface Science, 2017, 427: 942-949. (  0) 0) |
| [9] |
He L S, Zhang G, Wang Y, et al. Toward understanding barnacle cementing by characterization of one cement protein-100 kDa in Amphibalanus amphitrite[J]. Biochemical Biophysicai Research Communications, 2018, 495: 969-975. DOI:10.1016/j.bbrc.2017.11.101 (  0) 0) |
| [10] |
徐臻臻. 藤壶Cp19k蛋白的表达及其粘性检测[D]. 保定: 河北大学, 2020. Xu Z Z. Expression and Viscosity Detection of Cp19k Protein in Barnacles[D]. Baoding: Hebei University, 2020. (  0) 0) |
| [11] |
黄敬亮, 刘欢, 李伟华. 藤壶幼虫附着的分子机理研究进展: 转录组和蛋白质组[J]. 水产学报, 2022, 46(9): 1743-1756. Huang J L, Liu H, Li W H. Advances in molecular mechanisms of barnacle larval attachment: Transcriptome and proteome[J]. Aquaculture and Fisheries, 2022, 46(9): 1743-1756. (  0) 0) |
| [12] |
Gan K, Liang C, Bi X, et al. Adhesive materials inspired by barnacle underwater adhesion: Biological principles and biomimetic designs[J]. Frontiers Bioengineering Biotechnology, 2022, 10: 870445. DOI:10.3389/fbioe.2022.870445 (  0) 0) |
| [13] |
De Gregoris T B, Borra M, Biffali E, et al. Construction of an adult barnacle (Balanus amphitrite) cDNA library and selection of reference genes for quantitative RT-PCR studies[J]. Biomedcentral Molecular Biology, 2009, 10(1): 62. (  0) 0) |
| [14] |
Jouuchi T, Satuito C G, Kitamura H, et al. Sugar compound products of the periphytic diatom navicula ramosissima induce larval settlement in the barnacle, Amphibalanus amphitrite[J]. Marine Biology, 2007, 152(5): 1065-1076. DOI:10.1007/s00227-007-0753-6 (  0) 0) |
| [15] |
Matsumura K, Mori S, Nagano M, et al. Lentil lectin inhibits adult extract-induced settlement of the barnacle, Balanus amphitrite[J]. Experimental Zoology, 1998, 280(3): 213-219. DOI:10.1002/(SICI)1097-010X(19980215)280:3<213::AID-JEZ2>3.0.CO;2-Q (  0) 0) |
| [16] |
尤嘉杰, 平双双, 刘琪, 等. 单糖组合对藤壶金星幼体附着的影响研究[J]. 水产养殖, 2021, 42(2): 30-36. You J J, Ping S S, Liu Q, et al. Effect of monosaccharide combination on attachment of Barnacle Venus larvae[J]. Aquaculture, 2021, 42(2): 30-36. DOI:10.3969/j.issn.1004-2091.2021.02.006 (  0) 0) |
| [17] |
Matsumurad K, Nagano M, Kato-Yoshinaga Y, et al. Immunological studies onthe settlement-inducing protein complex (SIPC) of the barnacle Balanus amphitrite and its possible involvement in larva-larva interactions[J]. Proceedings Biological Sciences, 1998, 265(1408): 1825-1830. DOI:10.1098/rspb.1998.0508 (  0) 0) |
| [18] |
Aoki K, Kumagai T, Ranzinger R, et al. Serum N-Glycome diversity in teleost and chondrostrean fishes[J]. Frontier in Molecular Biosciences, 2021, 8: 778383. DOI:10.3389/fmolb.2021.778383 (  0) 0) |
| [19] |
Shingo H, Takahiro Y, Yasuhiro H, et al. Significance of serum N-glycan profiling as a diagnostic marker in testicular germ cell tumor[J]. Journal of Clinical Oncology, 2016, 34(2): 489-489. (  0) 0) |
| [20] |
Trastoy B, Du J J, Klontz E H, et al. Structural basis of mammalian high-mannose N-glycan processing by human gut Bacteroides[J]. Nature Communications, 2020, 11(1): 899. DOI:10.1038/s41467-020-14754-7 (  0) 0) |
| [21] |
Wang R, Liu Y, Wang C, et al. Comparison of the methods for profiling N-glycans-hepatocellular carcinoma serum glycomics study[J]. RSC Advances, 2018, 8(46): 26116-26123. DOI:10.1039/C8RA02542H (  0) 0) |
| [22] |
王婷, 羊欢欢, 赵弘巍. 蛋白质N-糖基化在拟南芥生长周期中的变化规律及去糖基化对根发育的影响[J]. 植物学报, 2021, 56(3): 262-274. Wang T, Yang H H, Zhao H W. Changes of protein N-glycosylation during the growth cycle of Arabidopsis Thaliana and effects of deglycosylation on root development[J]. Journal of Integrative Plant Biology, 2021, 56(3): 262-274. (  0) 0) |
| [23] |
Pagett H E, Abrahams J L, Bones J, et al. Structural characterisation of the N-glycan moiety of the barnacle settlementinducing protein complex (SIPC)[J]. Journal of Experimental Biology, 2012, 215(7): 1192-1198. (  0) 0) |
| [24] |
陈长春, 项凌云, 刘汉奇. 海洋污损生物藤壶的附着与防除[J]. 海洋环境科学, 2012, 31(4): 621-624. Chen C C, Xiang L Y, Liu H Q. Attachment and prevention of barnacles in Marine fouling[J]. Marine Environmental Science, 2012, 31(4): 621-624. (  0) 0) |
| [25] |
Endo N, Nogata Y, Yoshimura E, et al. Purification of a larval settlement-inducing protein complex (SIPC) of the barnacle, Balanus amphitrite[J]. Journal of Experimental Zoology, 1998, 281(1): 429-434. (  0) 0) |
2. Laboratory for Marine Drugs and Bioproducts, Pilot National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266237, China;
3. Physical Oceanography Laboratory, Institute for Advanced Marine Studies, Ocean University of China, Qingdao 266100, China;
4. Function Laboratory of Marine Medicine and Biological Products, Qingdao Academy of Marine Biomedicine, Qingdao 266061, China
 2024, Vol. 54
2024, Vol. 54