长期以来,集约化水产养殖为中国渔业经济的发展做出了巨大贡献,但也造成过量氮、磷化合物流入水环境,对水体营养状态和水生动植物健康产生了不利影响[1]。海水养殖作为水产养殖的重要组成部分,近年来,其养殖面积总体保持稳定,水产品产量逐年上升[2]。相应地,海水养殖也面临着严峻的氮、磷污染问题。据报道,用于集约化海水养殖的饲料只有小部分能转化为水生动物的生物量,约75%的氮、磷残留在饲料和动物粪便中,并通过微生物分解释放入水体[3]。一方面,高浓度的溶解性无机营养物(尤其是氨和亚硝酸盐)会导致水质恶化、病原微生物增加,并对鱼、虾类养殖动物具有毒害作用,加剧了水产病害爆发的风险[4]。另一方面,富含氮、磷的养殖废水往往未经适当处理就排入邻近水域,迅速改变邻近水域水体营养水平,导致其富营养化[5]。因此,采用适当的技术处理海水养殖水和海水养殖废水以减少海水生态系统的氮、磷含量成为确保渔业可持续发展的必要环节。生物方法因其安全、高效、二次污染少、可生产附加产品等特点成为养殖系统水质清洁技术中极具潜力的选择[6]。
对微藻-细菌的研究表明,微藻与共生细菌之间存在营养交换、信号转导和基因转移等复杂的相互作用[7],它们中的某些类群可结合成天然的净水系统,为藻-菌协同实现高效氮、磷去除提供了生态基础[8]。当前已有大量关于细菌或微藻用于生物法处理工业废水和生活污水的报道,但其用于水产养殖环境安全、高效脱氮除磷的研究相对较少[6]。根据以往的研究,大部分脱氮菌并不兼具高效除磷能力,难以完成对养殖水体氮、磷的同步去除[9]。此外,养殖水体碳氮比通常低于5,碳源不足极大限制了细菌的氮去除能力[3]。在低碳氮比条件下微藻能够进行自养代谢合成高效去除废水中氮和磷[10]。然而,微藻单独处理废水时因藻类的过度生长而大量消耗二氧化碳(CO2),从而导致水体的pH上升,同时释放大量有机碳,致使出水水质恶化[11]。研究表明,藻-菌联合培养有望解决上述问题[11]。在藻-菌联合处理废水的研究中,营养交换被认为是微藻-细菌复合体系协同高效的主要内在机制:异养细菌消耗氧气(O2),释放CO2,并将有机物分解为无机物;微藻吸收无机氮、磷和CO2合成生物质,并释放O2[12-13]。由于细菌和微藻的代谢互补性,微藻-细菌构建的复合体系对复杂的污水环境具有更强的适应性,通常能够获得高于微藻或细菌单独处理的氮、磷去除效率[12]。一项研究采用小球藻(Chlorella vulgaris)C7与细菌的耦合系统处理高强度海水养殖废水,去除了68.8%的氨,并通过收获微藻最大限度地回收资源[14]。一项采用EM菌与小球藻联合处理水产养殖废水的研究获得了99.15%的磷去除率,且与细菌或微藻单独处理相比,联合处理的水体的溶解氧含量和pH更稳定[15]。当前采用微藻与功能菌群构建的高效复合体系已被用于废水处理,但废水多变的理化成分和生物组成加之菌群自身生物结构的复杂性,使得维持复合体系的稳定性仍面临挑战,也不利于深入探究微藻-细菌的相互作用关系[16]。据此,相关研究开始采用单一细菌和微藻构建复合体系,经过实验室条件下培养和优化后投入实际应用,以增加废水处理效益[8]。目前单藻-单菌复合体系多被用于处理氮、磷含量较高的淡水废水,应用其处理氮、磷含量相对较低且具有一定盐度的海水养殖水和海水养殖废水的研究仍有待扩充[11]。
本研究采用海水小球藻(Chlorella sp.)MACC/C95和分离自海水养殖池塘的一株具有脱氮功能的芽孢杆菌(Bacillus sp.)SD148BN14构建了一种微藻-细菌复合体系。对该复合体系中小球藻和菌株SD148BN14的相互作用以及环境因素对藻-菌复合体系氮去除率的影响进行详细探究,并将该复合体系应用于实际海水养殖水和海水养殖废水处理。此研究为采用原位脱氮细菌与小球藻协同提高水体氮、磷去除效率,实现水产养殖环境氮、磷污染的资源化处理提供了重要参考。
1 材料与方法 1.1 微藻、细菌和培养基海水小球藻MACC/C95由中国海洋大学微藻种质库提供,采用灭菌的f/2培养基[15],在光照强度4 000 lx、温度25 ℃、光暗比12 h∶12 h条件下培养。采用浓度分别为100 mg/L的氨苄青霉素、链霉素、卡那霉素、庆大霉素联合处理小球藻以去除其携带的细菌:将小球藻以10%的比例接种在含混合抗生素的f/2液体培养基中培养5 d后,转入无抗生素的f/2液体培养基中继续培养。重复2次后,在f/2琼脂平板上反复划线,获得纯化藻株并转入无抗生素的f/2液体培养基中继续培养,定期取培养物涂布于LB琼脂平板上,在28 ℃下黑暗培养7 d。LB平板上没有细菌生长,视为小球藻除菌成功。
芽孢杆菌SD148BN14(Genbank登录号: MN988752.1)由中国海洋大学水产动物环境生理学研究室从山东东营的凡纳滨对虾(Litopenaeus vannamei)养殖池塘中分离并置于25%甘油中-80 ℃保存[17]。菌株在使用前接种于LB液体培养基,在28 ℃,160 r/min下活化24 h。
合成废水培养基:葡萄糖0.25 g/L,NH4Cl 0.038 2 g/L,NaNO2 0.024 6 g/L,NaNO3 0.030 4 g/L,NaH2PO4·2H2O 0.010 1 g/L,MgSO4·7H2O 0.25 g/L。每1 000 mL上述溶液加入微量元素溶液1 mL,微量元素溶液为:FeCl3·6H2O 3.15 g/L,Na2EDTA 4.36 g/L,MnCl2·4H2O 0.18 g/L,ZnSO4·7H2O 0.022 g/L,CoCl2·6H2O 0.01 g/L,CuSO4·5H2O 0.009 8 g/L,Na2MoO4·2H2O 0.006 3 g/L。所有溶液采用过滤海水(盐度为30,pH为8.1,总氮浓度低于0.01 mg/L)配制,初始pH调整为7.5,灭菌后使用。
1.2 菌株SD148BN14的鉴定和生物安全性评价使用通用引物27F/1492R进行聚合酶链式反应(PCR)扩增菌株SD148BN14的16S rRNA基因序列,扩增产物由生工生物技术有限公司(上海,中国)进行电泳和测序分析。获得的核苷酸序列通过BLAST在线比对(http://www.ncbi.nlm.nih.gov/BLAST/Blast.cgi)。使用MAGE 7.0软件采用邻接法构建系统发育树。菌株SD148BN14的形态、生理生化特性、溶血活性以及抗生素敏感性均按照现有的方法进行鉴定[18]。
1.3 藻-菌复合体系氮磷去除能力分析将离心收集培养8 d的小球藻与活化24 h的菌株SD148BN14用无菌过滤海水洗涤,将微藻和细菌的细胞悬液密度分别调整为1×108 cell/mL和1×108 CFU/mL。将上述两种细胞悬液分别以0.5%的比例接种到250 mL锥形瓶中(瓶内含有100 mL合成废水培养基),构建藻-菌复合体系。复合体系中微藻和细菌的初始接种密度分别为5×105 cell/mL和5×105 CFU/mL。培养条件设置为:温度25 ℃、光照强度4 000 lx、转速140 r/min、光暗比12 h∶12 h。以仅接种5×105 cell/mL的小球藻纯培养系统和仅接种5×105 CFU/mL菌株SD148BN14的芽孢杆菌纯培养系统作为对比。每2 d取样一次分析以下指标:(a)细胞生长和生物量生产参数(包括细胞干质量(DCW)、活细菌数目、叶绿素a(Chl a)浓度和蛋白质、碳水化合物、脂质含量);(b)微藻光合活性参数最大光化学效率(Fv/Fm);(c)水质参数(包括铵态氮(NH4+-N)、亚硝酸盐氮(NO2--N)、硝酸盐氮(NO3--N)、总氮(TN)、活性磷酸盐(PO43--P)、总磷(TP)浓度以及pH和溶解氧(DO)浓度)。
1.4 单一环境因素对藻-菌复合体系氮去除能力的影响通过单因素试验,评估温度、盐度、光照强度、pH、碳氮比(C/N)、氮磷比(N/P)和氮浓度对藻-菌复合体系的氮去除能力的影响以衡量复合体系对不同环境条件的适应能力。按照1.3方法构建藻-菌复合体系,培养8 d后取样,测定DCW和TN、NH4+-N、NO2—-N的含量。本实验的基础培养条件参考1.3。合成废水培养基基础理化参数如下:盐度为30,pH为7.5,C/N为5,N/P为10,氮浓度为20 mg/L。单个因子按以下设计调整:温度设为15、20、25、30、35、40 ℃;盐度设为0、5、10、20、30、40;光照强度设为1 000、2 000、4 000、8 000、12 000和16 000 lx;pH设为6、7、7.5、8、8.5、9;C/N设为0、1、2.5、5、10、15(保持氮浓度为20 mg/L不变,调整葡萄糖浓度);N/P设为4、5、7、10、20、40(保持氮浓度不变,调整NaH2PO4·2H2O浓度);氮浓度设为1、2.5、5、10、20、50 mg/L。
1.5 藻-菌复合体系去除实际海水养殖水和海水养殖废水中氮磷的能力分析海水养殖水(MW-1)取自凡纳滨对虾集约化养殖池塘,其理化性质如下:TN、TP、NH4+-N、NO2--N的浓度分别为3.99、0.70、2.08、1.11 mg/L;盐度为30;pH为7.78。海水养殖废水(MW-2)为凡纳滨对虾集约化养殖池塘的排出废水,其理化性质如下:TN、TP的浓度分别为13.10、2.04 mg/L;盐度为30;pH为7.81。将藻细胞悬液(1×108 cell/mL)和细菌悬液(1×108 CFU/mL)以不同的接种量添加到100 mL海水养殖水或100 mL海水养殖废水中,使微藻和细菌的初始接种密度和比例分别为1×104 cell/mL∶1×104 CFU/mL、1×105 cell/mL∶1×105 CFU/mL、1×106 cell/mL∶1×106 CFU/mL,构建起不同梯度的藻-菌复合体系,下文分别记为104、105、106。各体系在25 ℃、4 000 lx、140 r/min、12 h光照∶12 h黑暗条件下培养,定期取样,测定水体中TN、TP、NH4+-N、NO2--N的含量。
1.6 测定方法生长指标按照如下方法测定。细菌生长:菌悬液的细菌密度由细菌浊度计(TA-2XJ,北京,中国)测定;活细菌数目用平板菌落计数法测定。微藻生长:微藻细胞密度在光学显微镜下用血球计数板计数测定。微藻光合活性:叶绿素a根据Wang等的研究[16]采用90%甲醇提取,并采用分光光度法定量,公式为:Chlorophyll a(mg/L)=16.82×A665- 9.28×A652,式中A652、A665分别为叶绿素提取液在波长652 nm、665 nm下的吸光度;藻细胞最大光化学效率(Fv/Fm)由调制叶绿素荧光仪(Junior-PAM, Heinz Walz GmbH, Effeltrich, Germany)测定,并沿用现有的方法对待测样品进行预处理[19]。
生物量指标按照如下方法测定。生物量用细胞干质量表示,样品经孔径为0.22 μm的干燥过滤器过滤,在105 ℃下干燥至恒重,细胞干质量为含有样品的过滤器在干燥后的重量与过滤前的重量之差[8];蛋白质、碳水化合物和脂肪的提取方法参考Li等[11],采用Bradford法测定提取物的蛋白质含量(以牛血清白蛋白为标样),采用苯酚-浓硫酸比色法测定碳水化合物含量(以葡萄糖为标样),采用甲醇-氯仿法测定脂质含量。
水质指标按照以下方法测定。待测样品于4 000 g离心15 min后取上清液,采用次溴酸盐氧化法测定NH4+-N浓度,采用萘乙二胺分光光度法测定NO2--N浓度,采用紫外分光光度法测定NO3--N浓度,采用碱性过硫酸钾紫外分光光度法测定TN浓度,采用钼锑抗分光光度法测定PO43--P浓度,采用过硫酸钾氧化法测定TP浓度。去除率=(C0-C1)/C0×100%,C0为初始浓度,C1为最终浓度。溶液的pH和DO浓度分别采用pH计和溶解氧仪测定。
1.7 数据处理及统计分析本实验以非接种组作为对照组,每个实验进行3个重复,实验结果以平均值±标准差(Mean ± SD)表示。采用SPSS 24.0软件进行单因素方差分析和Duncan检验,比较组间差异,p < 0.05表示差异具有统计学意义。
2 结果 2.1 菌株SD148BN14的鉴定和生物安全性评价菌株SD148BN14的16S rRNA基因序列比对结果表明,菌株SD148BN14与芽孢杆菌属的Bacillus niabensis strain X16(Genbank登录号: JQ946065.1)相似性最高,为97.16%。系统发育树显示了菌株SD148BN14与其他系统发育相关菌株的同源性(见图 1)。由此,菌株SD148BN14初步鉴定为芽孢杆菌属,命名为Bacillus sp. SD148BN14。菌株SD148BN14在LB琼脂平板上形成的菌落呈圆形、淡黄色、半透明、表面光滑、边缘清晰。对菌株SD148BN14进行生理生化鉴定,鉴定结果显示,其革兰氏染色、明胶液化、过氧化氢酶、脲酶、淀粉酶、硝酸还原酶试验表现阳性,V-P、甲基红、吲哚、产氨试验表现阴性,葡萄糖氧化发酵试验表现为发酵型。
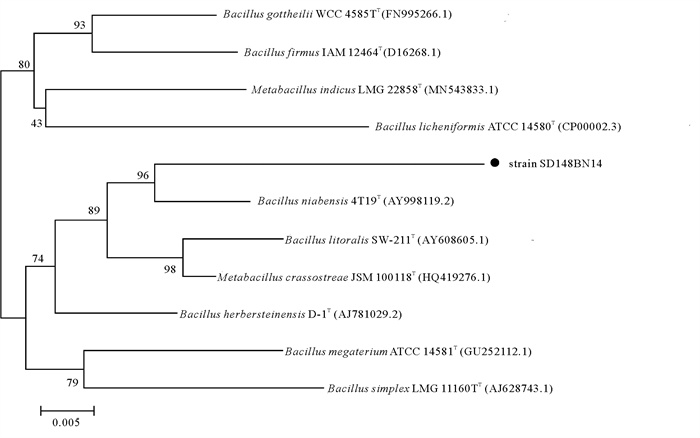
|
( 遗传距离为0.005。0.005 denotes the genetic distance. ) 图 1 菌株SD148BN14与参考菌株的16S rRNA基因序列构建的系统进化树 Fig. 1 Phylogenetic tree based on the partial 16S rRNA gene sequences of Bacillus sp. SD148BN14 and comparative reference strains |
在血平板上培养菌株SD148BN14过程中,未观察到溶血圈,说明该菌株不具有溶血活性(见图 2)。菌株SD148BN14的抗生素敏感性如表 1所示,链霉素、杆菌肽和磺胺异噁唑的抑菌圈直径为0 mm,说明该菌株对上述抗生素具有耐药性。菌株对氨苄青霉素、诺氟沙星、四环素的敏感性较低,抑菌圈直径小于15 mm。除此之外,该菌株对其他抗生素具有较高的敏感性。
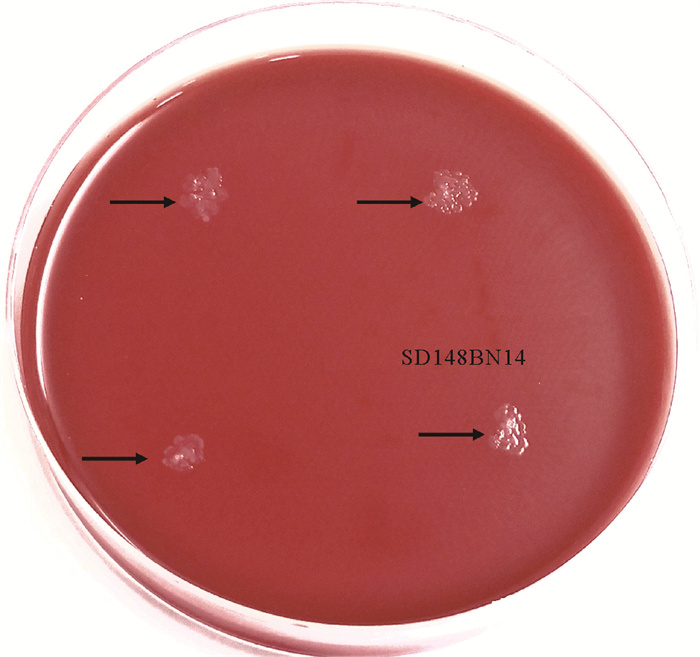
|
图 2 菌株SD148BN14的溶血活性 Fig. 2 Hemolysis activity of Bacillus sp. SD148BN14 |
|
|
表 1 菌株SD148BN14对不同抗生素的敏感性 Table 1 Antibiotic susceptibility of Bacillus sp. SD148BN14 to different antibiotics |
藻-菌复合体系的氮去除性能如图 3a、3b所示,培养8 d内,藻-菌复合体系能够快速去除合成废水中的氮。其中TN浓度从21.71 mg/L降低到3.69 mg/L,NH4+-N、NO2--N、NO3--N浓度分别降低到0、0.01、2.07 mg/L。8 d后,藻-菌复合体系对无机氮的去除趋于停滞,藻-菌复合体系最终去除90.66%的TN、100%的NH4+-N、99.75%的NO2--N和84.67%的NO3--N,无NH4+-N和NO2--N积累。芽孢杆菌纯培养系统中,菌株SD148BN14在2 d内迅速生长,NH4+-N浓度从10.24 mg/L降至4.86 mg/L。随着葡萄糖的消耗,菌株对NH4+-N的去除趋于停止,实验结束时,菌株SD148BN14共去除19.50%的TN。小球藻纯培养系统中,NH4+-N含量在6 d时达到最低,为0.084 mg/L。实验结束时小球藻对TN、NH4+-N、NO2--N、NO3--N的去除率分别为75.34%、99.76%、98.92%和55.45%。对水体中PO43--P和TP的去除效果如图 3c、3d所示。藻-菌复合体系对磷的去除量始终显著高于其他系统(p < 0.05)。在8 d时,藻-菌复合体系将TP浓度从2.04 mg/L降至0.25 mg/L,PO43--P浓度从2.02 mg/L降至0.18 mg/L,藻-菌复合体系的TP去除率分别是小球藻纯培养和芽孢杆菌纯培养的2.01和2.92倍,最终水体中93.04%的TP和96.81%的PO43--P通过藻-菌复合体系被去除。
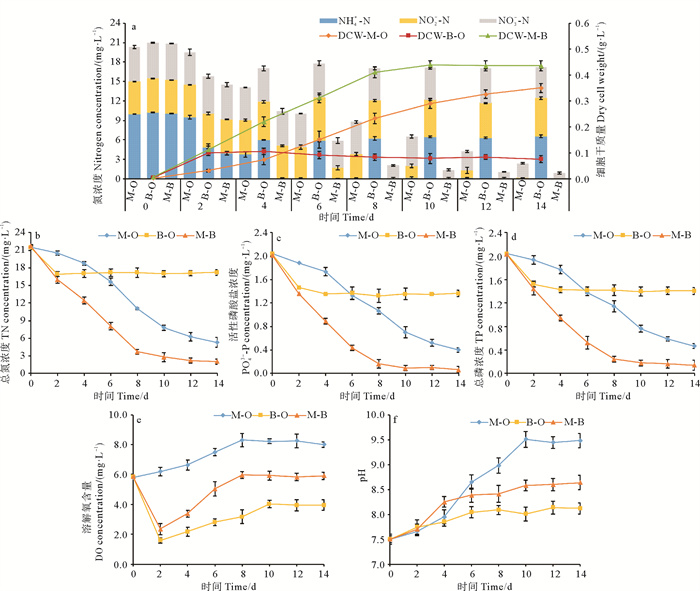
|
( NH4+-N, NO2--N, NO3--N分别表示水体内该种无机氮的浓度;DCW表示细胞干质量;M-O表示小球藻纯培养系统;B-O表示菌株SD148BN14纯培养系统;M-B表示小球藻-菌株SD148BN14复合体系。下图同。NH4+-N, NO2--N, NO3--N denote the concentration of the 3 kinds of inorganic nitrogen; DCW denotes the dry cell weight; M-O denotes the Chlorella sp.-only system; B-O denotes the Bacillus sp. SD148BN14-only system; M-B denotes the Chlorella sp.-Bacillus sp. SD148BN14 consortium system. The same below. ) 图 3 小球藻、菌株SD148BN14、小球藻-菌株SD148BN14复合体系处理的合成废水中各项水化指标变化情况 Fig. 3 Fluctuations of the chemical measurements of synthetic wastewater treated by the Chlorella sp.-only, the Bacillus sp. SD148BN14-only, the Chlorella sp.-Bacillus sp. SD148BN14 consortium |
藻-菌复合体系和芽孢杆菌纯培养系统中,DO浓度在2 d内迅速下降(见图 3e)。随着小球藻的光合作用,藻-菌复合体系的DO浓度从2.35 mg/L增加到5.92 mg/L,藻-菌复合体系的DO浓度始终介于菌纯培养和藻纯培养之间。芽孢杆菌纯培养的DO浓度最终加到3.95 mg/L。小球藻纯培养的DO浓度始终高于初始值,实验后期,DO浓度超过8 mg/L。在培养过程中,3种培养系统的pH较初始值均有所增加(见图 3f)。芽孢杆菌纯培养的pH变化范围较小,从7.5增加至8.12。小球藻纯培养的pH继续上升,达到9.51。藻-菌复合体系的pH介于芽孢杆菌纯培养和小球藻纯培养之间,最终增加至8.64,细菌的添加改变了小球藻纯培养中普遍存在水体pH过高的现象。
2.3 藻-菌复合体系的生长和生物量生产表现 2.3.1 微藻、细菌细胞生长性能藻细胞叶绿素a含量和Fv/Fm如图 4(a)和4(b)所示,培养8 d后,藻-菌复合体系中叶绿素a浓度达到3.31 mg/L,是小球藻纯培养的1.27倍。培养10 d后,藻-菌复合体系中小球藻的Fv/Fm由0.66上升至0.72,随后下降至0.68。小球藻纯培养过程中,Fv/Fm从0.66增长至0.70。芽孢杆菌纯培养过程中活菌数量迅速增加,在2 d时达到峰值9.35×108 CFU/mL,随后迅速降至5×107 CFU/mL(见图 4(c))。藻-菌复合体系中活细菌数目较芽孢杆菌纯培养增加缓慢,4 d时出现最大活菌数(6.05×108 CFU/mL),此后藻-菌复合体系中活菌数高于芽孢杆菌纯培养。上述结果表明,藻-菌共培养有利于在培养前期促进小球藻细胞的生长和光合活性,并在培养后期维持高于芽孢杆菌纯培养的活菌数。
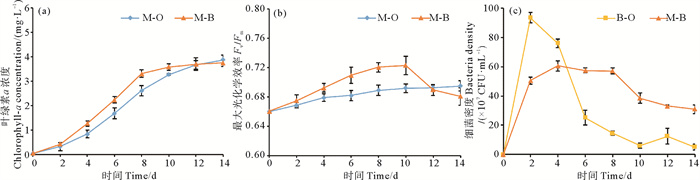
|
图 4 小球藻、菌株SD148BN14、小球藻-菌株SD148BN14复合体系处理的合成废水中叶绿素a浓度(a)、最大光化学效率(b)、活细菌数的变化情况(c) Fig. 4 Fluctuations of concentration of Chlorophyll-a (a), maximal photochemical efficiency (Fv/Fm) (b), number of viable bacteria (c) of the Chlorella sp.-only, the Bacillus sp. SD148BN14-only and the Chlorella sp.-Bacillus sp. SD148BN14 consortium in synthetic wastewater |
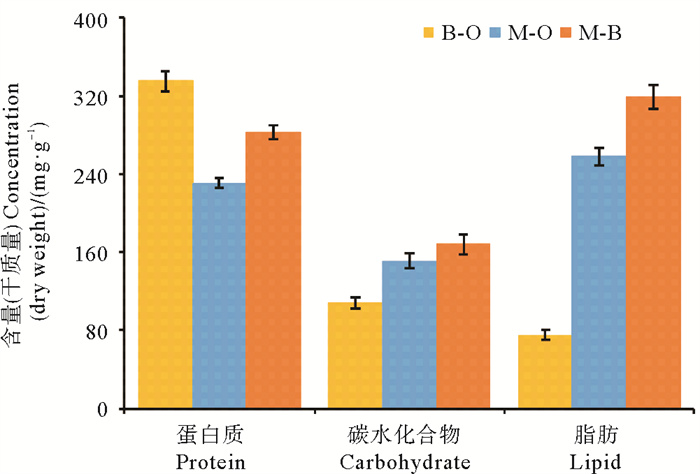
各培养系统生产的生物量以细胞干质量表示,培养8 d时,藻-菌复合体系细胞干质量达到0.41 g/L,高于小球藻纯培养(0.26 g/L)和芽孢杆菌纯培养(0.08 g/L)的总和,培养结束时藻-菌复合体系干质量达到0.44 g/L(见图 3a)。在小球藻纯培养系统中细胞干质量继续增加,最终达到0.35 g/L。在芽孢杆菌纯培养系统中细胞干质量在2 d达到峰值0.10 g/L后逐渐下降。在合成废水中培养14 d后,各培养系统生产的生物量中主要营养成分的含量如图 5所示。藻-菌复合体系中蛋白质、碳水化合物、脂质产量分别达到123.19、73.45、138.94 mg/L,分别占细胞干质量的28.25%、16.84%、31.87%,其中蛋白质和脂质的占比显著高于小球藻纯培养(p < 0.05),碳水化合物占比在不同处理组之间无显著差异(p>0.05)。
|
图 5 小球藻、菌株SD148BN14、小球藻-菌株SD148BN14复合体系各营养成分含量 Fig. 5 Nutritional composition contents of the Chlorella sp.-only, the Bacillus sp. SD148BN14-only, the Chlorella sp.-Bacillus sp. SD148BN14 consortium |
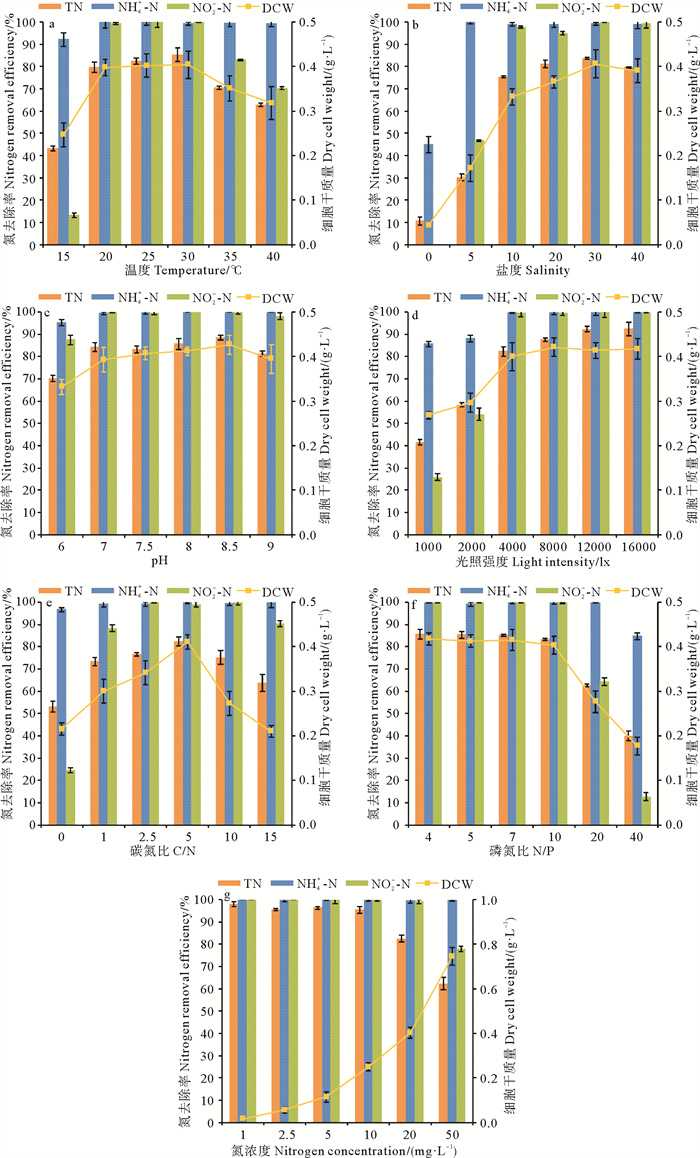
由图 6a可知,在20~30 ℃,藻-菌复合体系对NH4+-N和NO2--N去除率超过99%,TN去除率和细胞干质量随温度升高而增加。在15和40 ℃,复合体系的氮去除率和细胞干质量均受到显著抑制(p < 0.05)。
|
图 6 不同环境条件对小球藻-菌株SD148BN14复合体系氮去除率和细胞干质量的影响 Fig. 6 Effects of different environmental conditions on nitrogen removal efficiency and dry cell weight of the Chlorella sp.-Bacillus sp. SD148BN14 consortium |
如图 6b所示,在盐度20~40之间,NH4+-N去除率超过99%。在盐度30时,TN去除率和细胞干质量最高。小于10的低盐度不利于氮去除,在该范围内,氮去除率和细胞干质量随盐度增加而显著提高(p < 0.05)。当盐度为0时,藻-菌复合体系脱氮性能受到显著抑制(p < 0.05)。
2.4.3 pH由图 6c可知,在pH为7~9时,藻-菌复合体系对TN、NH4+-N、NO2--N的去除率分别超过80%、99%和98%。pH=8.5时,TN去除率最高,为88.53%,细胞干质量达到0.43 g/L。pH=6时,TN去除率显著降低(p < 0.05),但仍达到70.19%。
2.4.4 光照强度由图 6d可知,当光照强度为4 000~16 000 lx时,TN去除效率随光照强度的增加而提高(82%~92%)。不同处理组间NH4+-N、NO2--N去除率和细胞干质量无显著差异(p>0.05)且分别超过99.5%、99.5%和0.40 g/L。当光照强度在4 000 lx以下,光照强度的增强显著提高了复合体系的氮去除率和细胞干质量(p < 0.05)。
2.4.5 C/N由图 6e可知,C/N为1~10时,藻-菌复合体系去除超过70%的TN和超过99%的NH4+-N。复合体系的TN去除率和细胞干质量在C/N为5时达到最高。C/N为0时不利于细菌的生长,氮去除主要依靠微藻,氮去除率显著降低(p < 0.05)。当C/N为15时,细菌迅速生长并消耗营养,从而抑制微藻,最终导致氮去除率和细胞干质量下降。
2.4.6 N/P如图 6f所示,当N/P为4~10时,藻-菌复合体系对TN、NH4+-N、NO2--N的去除率分别超过83%、99%、99%,细胞干质量超过0.40 g/L,不同处理组之间无显著差异(p>0.05)。N/P提高到20、40,藻-菌复合体系的氮去除率和细胞干质量显著降低(p < 0.05)。
2.4.7 氮浓度如图 6g所示,氮浓度在1~10 mg/L,藻-菌复合体系能去除水体中超过95%的TN和全部NH4+-N、NO2--N。氮浓度增加到20 mg/L时,TN去除率降低至82.55%;氮浓度增加到50 mg/L时,TN去除率降低至66.33%。氮浓度在1~50 mg/L范围内,随着氮浓度的升高,藻-菌复合体系的细胞干质量显著增加(p < 0.05)。
综上,在温度为20~35 ℃、盐度为10~40、光照强度为4 000~16 000 lx、pH为6~9、C/N为1~10、N/P为4~10、氮浓度为1~20 mg/L的条件下,藻-菌复合体系呈现出良好的氮去除能力。
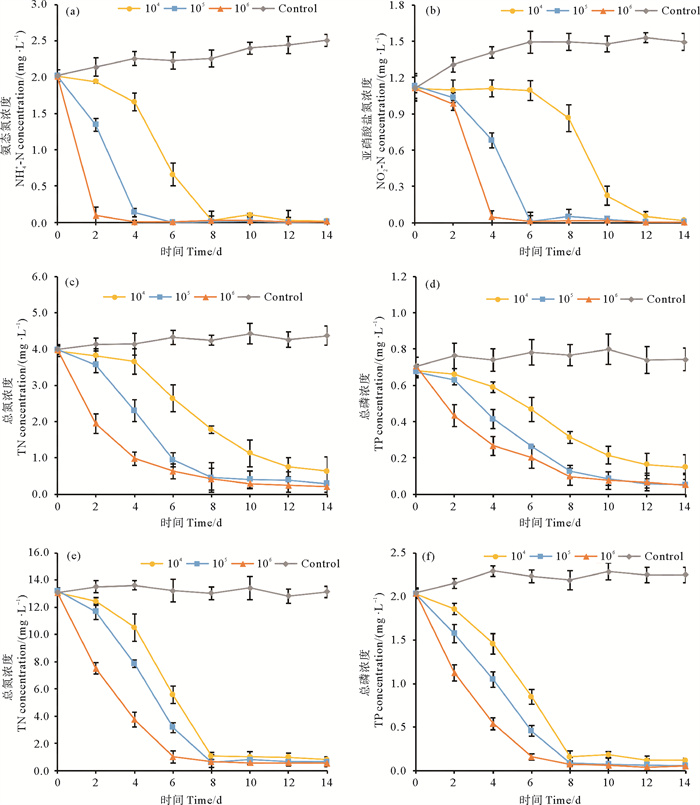
2.5 藻-菌复合体系对实际海水养殖水和海水养殖废水中氮磷的去除性能图 7(a)—7(d)显示藻-菌复合体系对海水养殖水(MW-1)中氮、磷的去除效果。连续处理14 d后,当藻-菌复合体系接种量分别为104、105、106,养殖水中NH4+-N浓度从2.01 mg/L分别降低到0.02、0.01、0.01 mg/L, NO2--N浓度从1.11 mg/L分别降低到0.02、0.01、0 mg/L,TN去除率分别达到83.82%、92.72%、94.84%,TP的去除率分别为78.14%、92.26%、92.81%。藻-菌复合体系对海水养殖废水(MW-2)的处理效果如图 7(e)和7(f)所示。藻-菌复合体系接种量分别为104、105、106时,经14 d处理,养殖废水中TN浓度从13.1 mg/L降至0.80、0.66、0.54 mg/L,TP浓度从2.04 mg/L降至0.12、0.06、0.05 mg/L。在实验前期,增加藻-菌复合体系的初始接种量有利于提高TN、TP的去除速率。
|
( 104、105、106分别表示小球藻与菌株SD148BN14的初始接种密度和接种比例为1×104 cell/mL∶1×104 CFU/mL、1×105 cell/mL∶1×105 CFU/mL、1×106 cell/mL∶1×106 CFU/mL;Control表示接种量为0。104, 105, 106 denote the initial inoculation densities and ratios of Chlorella sp. and Bacillus sp. SD148BN14 are 1×104 cell/mL∶1×104 CFU/mL, 1×105 cell/mL∶1×105 CFU/mL, 1×106 cell/mL∶1×106 CFU/mL; Control denotes the initial inoculation density is 0. ) 图 7 小球藻-菌株SD148BN14复合体系对海水养殖水中氮(a)(b)(c)、磷(d)和海水养殖废水中氮(e)、磷(f)的去除表现 Fig. 7 Removal performances of nitrogen (a) (b) (c), phosphorus (d) in mariculture water and nitrogen (e), phosphorus (f) in mariculture wastewater after inoculation with the Chlorella sp.-Bacillus sp. SD148BN14 consortium |
本研究构建了一种海水小球藻(MACC/C95)-芽孢杆菌(SD148BN14)复合体系,在有氧条件下,该复合体系能够有效地同步去除水体中的氮和磷,并累积生物量。芽孢杆菌SD148BN14分离自海水养殖池塘,对于水体中的无机氮具有去除能力。细菌产生的溶血素能够造成膜损伤、细胞溶解和细胞凋亡,是细菌致病性的代表特征之一[6]。菌株SD148BN14在血平板上无溶血反应,表明其不产生溶血素,致病风险较低。当前我国水产养殖应用的抗生素至少包括8类20种,其中喹诺酮类、磺胺类、大环内酯类、四环素类药物在养殖环境中含量最丰富[20]。本研究中,菌株SD148BN14对磺胺异噁唑(磺胺类)表现出耐药性,对其余3类药物均表现出不同程度的敏感性。此外,研究证明芽孢杆菌向水生生物(尤其是条件致病菌)转移和扩散抗生素抗性基因的风险较小[21],对人类和养殖动物相对安全。上述研究初步验证了菌株SD148BN14的生物安全性,有助于其在海水养殖环境中的应用。
当C/N为5时,氮浓度为20 mg/L的合成废水中,藻-菌复合体系能够在8 d内去除82.98% 的TN,高于芽孢杆菌纯培养(19.66%)和小球藻纯培养(48.70%)去除率的总和,小球藻的同化吸收是藻-菌复合体系脱氮的主要途径。Han等利用藻-菌结合生物膜技术处理鱼虾混养废水,氮去除率达到88.5%[22],与本研究的结果相似。此外,藻-菌复合体系对水体中严重威胁养殖动物健康的NH4+-N和NO2--N表现出优异的去除能力,其去除率分别达到100%和99.70%,且实验后期无NH4+-N和NO2--N的释放和积累。Lananan等的一项研究表明,使用Chlorella sp.和Effective Microorganism(EM-1)联合处理水产养殖废水可去除其中97%以上的氨,但单独采用EM-1处理养殖废水,后期氨含量显著上升[15]。当3种氮源共存时,NH4+-N首先被藻-菌复合体系去除,这是由于NH4+-N作为氮的还原形态,在同化过程中所需的能量成本较低,而成为多数脱氮细菌和微藻优先利用的氮源[6, 10]。在海水养殖水和海水养殖废水中,NH4+-N是无机氮的主要存在形式之一,藻-菌复合体系能够从上述水体中快速去除NH4+-N,防止其大量积累加剧水质恶化。藻-菌复合体系对水体TP的最高去除率达到93.04%,对PO43--P的最高去除率达到96.81%。与氮去除过程类似,8 d时,藻-菌复合体系对磷的去除率高于芽孢杆菌纯培养和小球藻纯培养去除率之和。类似的研究认为共培养条件下,在实验初期,细菌快速生长并发挥一定的氮、磷去除作用,由于有机碳含量的限制,细菌对氮、磷去除的贡献有限,在培养的中后期,氮、磷去除主要依靠微藻[11]。与纯培养相比,藻-菌复合体系中菌株SD148BN14促进了小球藻的生长和吸收氮、磷的能力,这可能是复合体系获得更高氮、磷去除率的主要原因[23]。
水体DO浓度和pH对养殖动物的健康至关重要,同时也影响着氮、磷等离子的存在形式。本研究中,经藻-菌复合体系处理,合成废水的DO浓度维持在5.90 mg/L左右,介于芽孢杆菌纯培养和小球藻纯培养,这意味着藻-菌共培养过程中小球藻通过光合作用释放的氧气可能持续被芽孢杆菌用于细胞代谢,改善了采用芽孢杆菌纯培养处理废水过程中的低溶解氧水平。据报道,海水养殖系统的pH在7~9之间,由于CO2大量被消耗,小球藻纯培养后期pH高达9.51,而藻-菌复合体系中水体pH增加缓慢并最终维持在8.6左右,研究普遍认为这得益于细菌代谢释放CO2溶于水体[11, 23]。
综上所述,本研究基于海水养殖环境,构建了一种海水小球藻-芽孢杆菌复合体系,该复合体系能够去除90.66%的TN和93.04%的TP,几乎完全去除NH4+-N和NO2--N,并将水体的溶解氧和pH维持在适宜的水平,作用效果优于芽孢杆菌纯培养和小球藻纯培养。此研究拓展了海水小球藻及菌株SD148BN14的应用前景,为当前处于发展阶段的高盐水体氮、磷去除技术提供了参考。
3.2 氮磷去除过程中藻-菌的相互关系藻-菌复合体系中小球藻和菌株SD148BN14的相互关系与复合体系的氮、磷去除效率密切相关。在10 d内,藻-菌复合体系内小球藻的叶绿素a含量和Fv/Fm高于小球藻纯培养,表明与菌株SD148BN14共培养可有效提高小球藻的光合活性,对藻细胞代谢和生长起到协同作用。另外,复合体系中更高的Fv/Fm也表明藻细胞受到更低的环境胁迫[24]。4 d内复合体系中活菌数增长速率和峰值均低于芽孢杆菌纯培养,4~8 d复合体系内活菌数维持在相对稳定且高于芽孢杆菌纯培养的水平。根据现有的研究,藻-菌共培养初期小球藻可能通过营养竞争抑制菌株SD148BN14生长,经过短暂适应,这种竞争关系将转变为协同关系[11]。实验后期,合成废水中营养耗尽,复合体系中活菌数仍明显高于芽孢杆菌纯培养,这可能由于小球藻新陈代谢释放营养物质(如溶解性有机碳),使更多的细菌得以生存[25-26]。上述现象意味着共培养的菌株SD148BN14和小球藻并非独立生存,而是存在某些相互作用。相关研究表明,CO2/O2依赖关系是微藻-细菌在废水处理过程中的基本相互作用之一[16]。本研究中,藻-菌复合体系和芽孢杆菌纯培养、小球藻纯培养系统DO浓度的差异暗示了小球藻光合作用释放的O2提供给菌株SD148BN14进行细胞代谢。相应地,菌株SD148BN14将通过呼吸释放CO2,为小球藻提供无机碳并促进其光合活性。综上所述,小球藻与菌株SD148BN14在细胞生长、光合活性和物质交换方面以协同为主的相互作用,为藻-菌复合体系的生长和高效氮、磷去除提供支持。
3.3 藻-菌复合体系的生物量生产性能藻-菌复合体系通过回收废水中氮、磷营养元素,积累生物量,实现了废水的资源化处理。经过8 d培养,藻-菌复合体系细胞干质量达到0.41 g/L,超过芽孢杆菌纯培养(0.08 g/L)和小球藻纯培养(0.23 g/L)的总和,其中小球藻是复合体系中主要的生物量提供者,菌株SD148BN14通过促进小球藻光合作用和生长提高其生物量可能是藻-菌复合体系收获细胞干质量远高于小球藻纯培养的主要原因。小球藻纯培养系统中,小球藻蛋白质、碳水化合物和脂质含量符合文献[27-29]报道的小球藻营养成分含量。与小球藻纯培养相比,藻-菌复合体系中蛋白质与脂质占比均有提高,碳水化合物比例得到维持。值得注意的是,复合体系中脂质含量(占细胞干质量的31.87%)在当前报道的小球藻以及其他用于废水处理的微藻的脂质含量中仍处于较高水平[11, 27-29]。研究报道,微量元素缺乏条件下,绿藻更容易累积脂质[28]。此外,一些小球藻属的微藻在氮饥饿的条件下培养,其生物量中脂质占比较氮充足时有显著提升[29]。这为小球藻和菌株SD148BN14共培养时脂质的有效积累提供了一种可能的解释。近年来,藻-菌技术在养殖水质调节以及养殖废水处理方面极具前景,从中收获的藻-菌絮凝体可用作水产动物饲料或用于生产其它增值产品,成本效益突出[30]。本研究为应用藻-菌技术进行可持续的海水养殖提供了具有竞争力的生物材料。
3.4 藻-菌复合体系的环境适应性评价单因素实验表明,藻-菌复合体系能够在较广的环境参数范围内保持稳定的氮去除率,为复合体系的实际应用提供了理论支持。复合体系在光照强度为4 000~16 000 lx、pH为6~9、C/N为1~10、N/P为4~10、氮浓度为1~20 mg/L的条件下具有可观的氮去除效率。海水养殖池塘中,水温一般高于20 ℃[31-32],C/N通常低于5[33],N/P通常低于20[22, 31, 34-35],pH在7~9[6],养殖水体氮含量一般控制在5 mg/L以内[33],养殖废水中氮含量通常低于20 mg/L[36]。在上述条件下,藻-菌复合体系能维持较高的氮(尤其是NH4+-N和NO2--N)去除率,并对养殖环境理化参数的波动具备良好的适应能力。据此,藻-菌复合体系有望用于中、高盐度海水养殖系统水质清洁和高效养殖废水处理。此外,一些高强度海水养殖废水的氮含量在50 mg/L左右[14]。当合成废水的氮浓度提高到50 mg/L,藻-菌复合体系能在8 d内去除62.33%的TN和99.86%的NH4+-N,表明该复合体系在更多类型的废水处理中也具有潜在的应用价值,其去除性能可通过优化水体碳、氮、磷的比例或提高光能供给的方式进一步强化。
3.5 藻-菌复合体系应用于实际海水养殖水和海水养殖废水处理藻-菌复合体系在无菌的合成废水中具有优异的氮磷去除表现,但在实际应用中,海水养殖水和海水养殖废水具有更复杂的理化成分和生物组成,对藻-菌复合体系的存活和氮、磷的去除有所影响[36],因此有必要采用实际养殖介质进一步评估藻-菌复合体系脱氮除磷能力。本研究中,微藻-细菌的接种量设置为104、105和106,在6 d内,复合体系对氮、磷的去除量随着接种量的增加而显著提高(p < 0.05)。经过8~14 d处理,不同接种量的藻-菌复合体系处理的海水养殖水和海水养殖废水中氮、磷残留量趋近,高接种量不再具有优势。综合考虑处理效率和成本,接种量控制在105为宜。经藻-菌复合体系处理,海水养殖水中NH4+-N、NO2--N浓度分别低至0.01和0 mg/L,达到海水养殖水中二者含量的安全水平[1]。根据《海水养殖水排放要求(SC/T 9103—2007)》中的二级标准,海水养殖用水排放时无机氮含量不高于1 mg/L,活性磷酸盐含量不高于0.10 mg/L,藻-菌复合体系处理后,海水养殖废水中TN含量低至0.54 mg/L,TP含量低至0.05 mg/L,均达到排放标准。上述研究初步表明,该藻-菌复合体系具有高效去除实际海水养殖水和海水养殖废水中氮、磷使其含量符合相关标准的潜力,为复合体系实际应用于海水养殖环境修复和海水养殖废水处理奠定了基础,但其实际应用效果仍有待大量后续实验验证。
4 结语本研究将小球藻(MACC/C95)与芽孢杆菌(SD148BN14)结合,构建了一种能够有效去除水体中氮、磷并生产生物量的藻-菌复合体系。该藻-菌复合体系对环境变化具有良好的适应能力,能够高效去除海水养殖水和海水养殖废水中氮、磷。培养过程中,小球藻与菌株SD148BN14在氮、磷去除和细胞生长方面的相互作用主要表现为协同促进。此外,实验证明菌株SD148BN14用于海水养殖环境具有较高的生物安全性。本研究为海水养殖环境修复和养殖废水的稳定、高效、资源化处理提供了可靠的微藻-细菌复合体系,丰富了水产养殖环境脱氮除磷的工艺研究。
| [1] |
Yang P, Lai D Y F, Jin B S, et al. Dynamics of dissolved nutrients in the aquaculture shrimp ponds of the Min River estuary, China: Concentrations, fluxes and environmental loads[J]. Science of the Total Environment, 2017, 603-604-256-267. (  0) 0) |
| [2] |
鲁泉, 陈新军. 改革开放40年来中国渔业产业发展及十四五产量预测[J]. 上海海洋大学学报, 2021, 30(2): 339-347. Lu Q, Chen X J. Development of Chinese fishery industry in 40 years of reform and opening up and production forecast in the 14th five-year plan[J]. Journal of Shanghai Ocean University, 2021, 30(2): 339-347. (  0) 0) |
| [3] |
Hou P F, Sun X L, Fang Z M, et al. Simultaneous removal of phosphorous and nitrogen by ammonium assimilation and aerobic denitrification of novel phosphate-accumulating organism Pseudomonas chloritidismutans K14[J]. Bioresource Technology, 2021, 340: 125621. DOI:10.1016/j.biortech.2021.125621 (  0) 0) |
| [4] |
Mohsenpour S F, Hennige S, Willoughby N, et al. Integrating micro-algae into wastewater treatment: A review[J]. Science of the Total Environment, 2021, 752: 142168. DOI:10.1016/j.scitotenv.2020.142168 (  0) 0) |
| [5] |
Malibari R, Sayegh F, Elazzazy A M, et al. Reuse of shrimp farm wastewater as growth medium for marine microalgae isolated from Red Sea-Jeddah[J]. Journal of Cleaner Production, 2018, 198: 160-169. DOI:10.1016/j.jclepro.2018.07.037 (  0) 0) |
| [6] |
Su Z P, Li Y, Pan L Q, et al. Nitrogen removal performance, quantitative detection and potential application of a novel aerobic denitrifying strain, Pseudomonas sp. GZWN4 isolated from aquaculture water[J]. Bioprocess and Biosystems Engineering, 2021, 44(6): 1237-1251. DOI:10.1007/s00449-021-02523-9 (  0) 0) |
| [7] |
Kouzuma A, Watanabe K. Exploring the potential of algae/bacteria interactions[J]. Current Opinion in Biotechnology, 2015, 33: 125-129. DOI:10.1016/j.copbio.2015.02.007 (  0) 0) |
| [8] |
Ji X Y, Jiang M Q, Zhang J B, et al. The interactions of algae-bacteria symbiotic system and its effects on nutrients removal from synthetic wastewater[J]. Bioresource Technology, 2018, 247: 44-50. DOI:10.1016/j.biortech.2017.09.074 (  0) 0) |
| [9] |
Zhang M Y, Pan L Q, Liu L P, et al. Phosphorus and nitrogen removal by a novel phosphate-accumulating organism, Arthrobacter sp. HHEP5 capable of heterotrophic nitrification-aerobic denitrification: Safety assessment, removal characterization, mechanism exploration and wastewater treatment[J]. Bioresource Technology, 2020(312): 123633. (  0) 0) |
| [10] |
Su Y Y. Revisiting carbon, nitrogen, and phosphorus metabolisms in microalgae for wastewater treatment[J]. Science of the Total Environment, 2020, 762: 144590. (  0) 0) |
| [11] |
Li Y T, Wang Y F, Gao Y Z, et al. Seawater toilet flushing sewage treatment and nutrients recovery by marine bacterial-algal mutualistic system[J]. Chemosphere, 2018, 195: 70-79. DOI:10.1016/j.chemosphere.2017.12.076 (  0) 0) |
| [12] |
Saravanan A, Kumar P S, Varjani S, et al. A review on algal-bacterial symbiotic system for effective treatment of wastewater[J]. Chemosphere, 2021, 271: 129540. DOI:10.1016/j.chemosphere.2021.129540 (  0) 0) |
| [13] |
Ferro L, Colombo M, Posadas E, et al. Elucidating the symbiotic interactions between a locally isolated microalga Chlorella vulgaris and its co-occurring bacterium Rhizobium sp. in synthetic municipal wastewater[J]. Journal of Applied Phycology, 2019, 31(4): 2299-2310. DOI:10.1007/s10811-019-1741-1 (  0) 0) |
| [14] |
Zhang Z S, Guo L, Liao Q R, et al. Bacterial-algal coupling system for high strength mariculture wastewater treatment: Effect of temperature on nutrient recovery and microalgae cultivation[J]. Bioresource Technology, 2021, 338: 125574. DOI:10.1016/j.biortech.2021.125574 (  0) 0) |
| [15] |
Lananan F, Hamid S H A, Din W N S, et al. Symbiotic bioremediation of aquaculture wastewater in reducing ammonia and phosphorus utilizing Effective Microorganism (EM-1) and microalgae (Chlorella sp.)[J]. International Biodeterioration & Biodegradation, 2014, 95(127): 134. (  0) 0) |
| [16] |
Wang Y Y, Wang S Y, Sun L Q, et al. Screening of a Chlorella-bacteria consortium and research on piggery wastewater purification[J]. Algal Research, 2020, 47: 101840. DOI:10.1016/j.algal.2020.101840 (  0) 0) |
| [17] |
Huang F, Pan L Q, He Z Y, et al. Identification, interactions, nitrogen removal pathways and performances of culturable heterotrophic nitrification-aerobic denitrification bacteria from mariculture water by using cell culture and metagenomics[J]. Science of the Total Environment, 2020, 732: 139268. DOI:10.1016/j.scitotenv.2020.139268 (  0) 0) |
| [18] |
Zhang M Y, Pan L Q, Su C, et al. Simultaneous aerobic removal of phosphorus and nitrogen by a novel salt-tolerant phosphate-accumulating organism and the application potential in treatment of domestic sewage and aquaculture sewage[J]. Science of the Total Environment, 2021, 758: 143580. DOI:10.1016/j.scitotenv.2020.143580 (  0) 0) |
| [19] |
Wang X F, Miao J J, Pan L Q, et al. Toxicity effects of p-choroaniline on the growth, photosynthesis, respiration capacity and antioxidant enzyme activities of a diatom, Phaeodactylum tricornutu[J]. Ecotoxicology and Environmental Safety, 2019, 169: 654-661. DOI:10.1016/j.ecoenv.2018.11.015 (  0) 0) |
| [20] |
Liu X, Steele J C, Meng X Z. Usage, residue, and human health risk of antibiotics in Chinese aquaculture: A review[J]. Environmental Pollution, 2017, 223: 161-169. DOI:10.1016/j.envpol.2017.01.003 (  0) 0) |
| [21] |
Zhao Y T, Zhang X X, Zhao Z H, et al. Metagenomic analysis revealed the prevalence of antibiotic resistance genes in the gut and living environment of freshwater shrimp[J]. Journal of Hazar-dous Materials, 2018, 350: 10-18. DOI:10.1016/j.jhazmat.2018.02.004 (  0) 0) |
| [22] |
Han W, Mao Y F, Wei Y P, et al. Bioremediation of aquaculture wastewater with algal-bacterial biofilm combined with the production of selenium rich biofertilizer[J]. Water, 2020, 12(7): 2071. DOI:10.3390/w12072071 (  0) 0) |
| [23] |
Liu H, Lu Q, Wang Q, et al. Isolation of a bacterial strain, Acinetobacter sp. from centrate wastewater and study of its cooperation with algae in nutrients removal[J]. Bioresource Technology, 2017, 235: 59-69. DOI:10.1016/j.biortech.2017.03.111 (  0) 0) |
| [24] |
He Q N, Yang H J, Wu L, et al. Effect of light intensity on physiological changes, carbon allocation and neutral lipid accumulation in oleaginous microalgae[J]. Bioresource Technology, 2015, 191: 219-228. DOI:10.1016/j.biortech.2015.05.021 (  0) 0) |
| [25] |
Peng H X, De-Bashan L E, Higgins B T. Comparison of algae growth and symbiotic mechanisms in the presence of plant growth promoting bacteria and non-plant growth promoting bacteria[J]. Algal Research, 2021, 53: 102156. DOI:10.1016/j.algal.2020.102156 (  0) 0) |
| [26] |
Natrah F M I, Bossier P, Sorgeloos P, et al. Significance of microalgal-bacterial interactions for aquaculture[J]. Reviews in Aquaculture, 2014, 6(1): 48-61. DOI:10.1111/raq.12024 (  0) 0) |
| [27] |
Cao M, Kang J M, Gao Y M, et al. Optimization of cultivation conditions for enhancing biomass, polysaccharide and protein yields of Chlorella sorokiniana by response surface methodology[J]. Aquaculture Research, 2020, 51(6): 2456-2471. DOI:10.1111/are.14589 (  0) 0) |
| [28] |
Rasouli Z, Valverde-Pérez B, D'este M, et al. Nutrient recovery from industrial wastewater as single cell protein by a co-culture of green microalgae and methanotrophs[J]. Biochemical Engineering Journal, 2018, 134: 129-135. DOI:10.1016/j.bej.2018.03.010 (  0) 0) |
| [29] |
Guccione A, Biondi N, Sampietro G, et al. Chlorella for protein and biofuels: From strain selection to outdoor cultivation in a Green Wall Panel photobioreactor[J]. Biotechnology for Biofuels and Bioproducts, 2014, 7(1): 84. DOI:10.1186/1754-6834-7-84 (  0) 0) |
| [30] |
Ramanan R, Kim B H, Cho D H, et al. Algae-bacteria interactions: Evolution, ecology and emerging applications[J]. Biotechnology Advances, 2016, 34(1): 14-29. DOI:10.1016/j.biotechadv.2015.12.003 (  0) 0) |
| [31] |
Chang Z Q, Neori A, He Y Y, et al. Development and current state of seawater shrimp farming, with an emphasis on integrated multi-trophic pond aquaculture farms, in China-a review[J]. Reviews in Aquaculture, 2020, 12(4): 2544-2558. DOI:10.1111/raq.12457 (  0) 0) |
| [32] |
Kumlu M, Kumlu M, Turkmen S. Combined effects of temperature and salinity on critical thermal minima of pacific white shrimp Litopenaeus vannamei (Crustacea: Penaeidae)[J]. Journal of Thermal Biology, 2010, 35(6): 302-304. DOI:10.1016/j.jtherbio.2010.06.008 (  0) 0) |
| [33] |
Huang F, Pan L Q, He Z Y, et al. Culturable heterotrophic nitrification-aerobic denitrification bacterial consortia with cooperative interactions for removing ammonia and nitrite nitrogen in mariculture effluents[J]. Aquaculture, 2020, 523: 735211. DOI:10.1016/j.aquaculture.2020.735211 (  0) 0) |
| [34] |
Hoang M N, Nguyen P N, Bossier P. Water quality, animal performance, nutrient budgets and microbial community in the biofloc-based polyculture system of white shrimp, Litopenaeus vannamei and gray mullet, Mugil cephalus[J]. Aquaculture, 2020, 515: 734610. DOI:10.1016/j.aquaculture.2019.734610 (  0) 0) |
| [35] |
Xu W J, Xu Y, Huang X S, et al. Addition of algicidal bacterium CZBC1 and molasses to inhibit cyanobacteria and improve microbial communities, water quality and shrimp performance in culture systems[J]. Aquaculture, 2019, 502: 303-311. DOI:10.1016/j.aquaculture.2018.12.063 (  0) 0) |
| [36] |
Huang F, Pan L Q, He Z Y, et al. Heterotrophic nitrification-aerobic denitrification characteristics and antibiotic resistance of two bacterial consortia from Marinomonas and Halomonas with effective nitrogen removal in mariculture wastewater[J]. Journal of Environmental Management, 2021, 279: 111786. DOI:10.1016/j.jenvman.2020.111786 (  0) 0) |
 2022, Vol. 52
2022, Vol. 52


