2. 青岛海洋科学与技术国家实验室海洋药物与生物制品功能实验室, 山东 青岛 266235
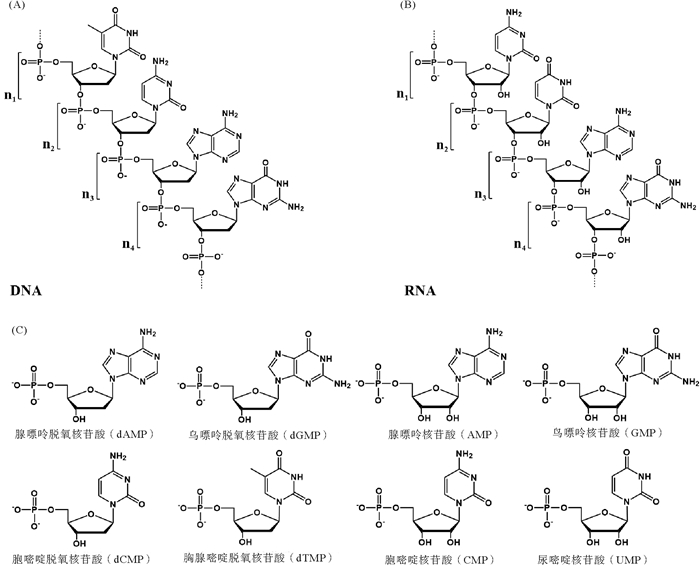
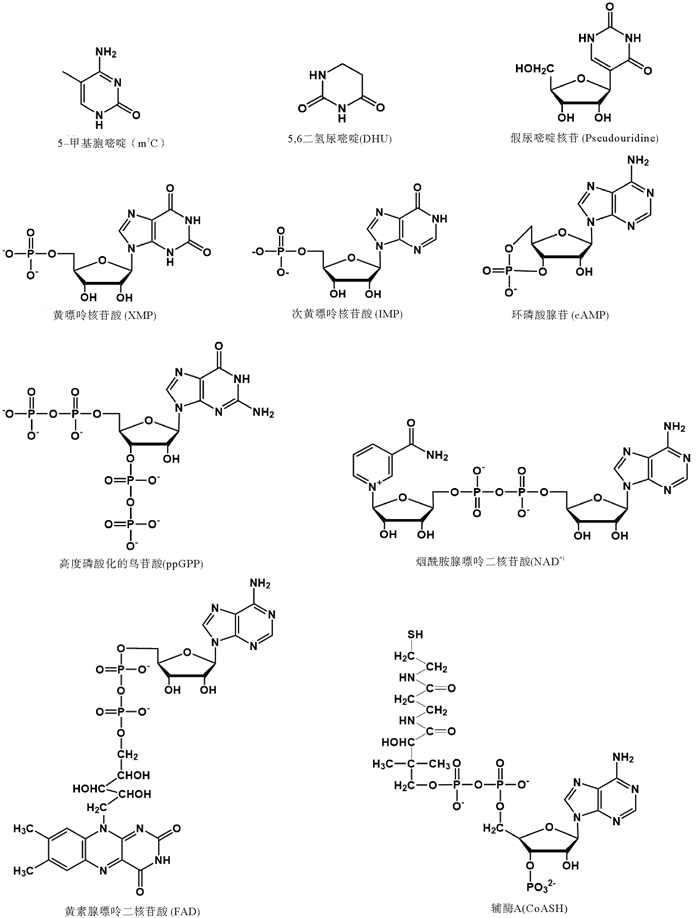
核酸一般指生物大分子的DNA(Deoxyribonucleic acid)和RNA(Ribonucleic acid),而核酸类物质(NAS,Nucleic Acid Substance)还包括核苷酸(NT,Nucleotide)及其衍生物等小分子物质。构成DNA的单体是脱氧核糖核苷酸(dNMP),有dAMP,dGMP,dCMP和dTMP四种;而构成RNA的单体是核糖核苷酸(NMP),除AMP、GMP、CMP和UMP四种外,生物体中还有次黄嘌呤核苷酸(肌苷酸,IMP)和黄嘌呤核苷酸(XMP)等诸多衍生物。核苷酸可以分子内环合生成环化核苷酸(如cAMP),或附加磷酸基团生成核苷二磷酸、核苷三磷酸等。核苷酸通过相互之间形成磷酸二酯键而生成DNA和RNA(见图 1)。核苷酸脱去磷酸后生成核苷(NS,Nucleoside)。核苷酸衍生物在生物体内发挥着重要的功能,部分结构如图 2所示。以NT或NS为主要结构单元的生物大分子和小分子都属于NAS,特别是RNA种类繁多,功能多样,既可以携带和转移遗传信息,又可催化蛋白质合成和RNA加工等生物反应,还可以参与基因表达的调控。可见,NAS是一类非常重要的生物分子,它们参与遗传、基因表达与调控、生化反应等多种生物活动。NAS既是细胞构建的主要材料,又是调节细胞功能和传递信息、能量和反应基团的重要“载体”。
|
图 1 DNA(A)、RNA(B)及核苷酸(C)的分子结构 Fig. 1 Molecular structure of DNA (A), RNA (B) and nucleotide (C) |
|
图 2 主要核苷酸衍生物的分子结构 Fig. 2 Molecular structure of principle derivatives of nucleotide |
在多糖、蛋白质、脂质和核酸四种生物大分子物质中,核酸是组成单元相对简单(A、G、C、T、U五种主要碱基),而又功能多样的分子。但人类对于核酸的认识却晚于其他生物大分子,直到1953年Watson和Crick发现DNA双螺旋结构以后,核酸的相关研究才快速发展。另外,对于核酸仍然有许多难解之谜,如对于近几年发现的人体内数以万计的环状单链RNA(circRNA)的功能,我们仍然知之甚少[1-3]。最为神奇的是,早在1970年代初期,美国植物病理学家Diener等发现了类病毒(Viroids),它只由数百碱基长的环状单链RNA构成[4]。类病毒不含蛋白质外壳等其他分子,但能感染高等植物致病或致死[5-6]。
核酸营养是指外源核酸类物质(NAS)被分解、吸收和利用,具有为生物体提供材料、能量和调控因子的功能。虽然早在1960年代,生物学家就开始对核酸营养开展研究[7],但科学家们的兴趣还主要在于研究NAS在细胞内的功能,发展《分子生物学》和《生物信息学》等新兴学科。核酸营养研究没有引起科学家足够兴趣的另一个原因是,即使食物中短期缺乏核酸也不会造成生物体的死亡或严重病症,而且核酸摄入被认为可能会诱发痛风[8]。长期以来,由于在营养功能和作用机理未被阐明之前,市场上就出现了核酸类功能性食品、添加核苷酸的婴儿奶粉、饲料添加剂、肥料添加剂等各种人为添加核苷酸的产品,人们在对核酸营养功能的认识上产生了不少争议。目前,学术界和社会上都存在认识上的相互矛盾。例如,我们的食物原料都来源于由细胞组成的生物,而细胞中都会有NAS(如活细菌中含量约为7%,酵母中约为10%,富含精子的鱼白中含量高达15%以上),科学家们也大都认为人体会对其进行吸收和利用,但在营养学领域对其研究甚少;虽然研究表明添加核苷酸具有改善生物或细胞活力的功效,但也有人认为食品中的核酸已经足够,无需额外补充;由于摄入核酸过多会加重痛风患者的症状,也有人认为核酸不但营养价值低,还是有害物质。总之,一方面是核苷酸的生产和应用越来越多,另一方面,多数人仍对其营养价值半信半疑,甚至是避而远之。
随着分子生物学和营养学(特别是分子营养学)等学科的发展,再加上人们对健康的要求逐步提高,近年来对核酸营养作用的研究热度增加,并产生了一些新的认识。另一方面,由于仍然缺乏基础研究,相关知识比较零散,特别是对于食物中核酸被生物体利用的程度和机制几乎仍然是空白。在现有的营养学教科书中,也很少涉及核酸或核苷酸相关的内容。
虽然有关核苷酸营养的综述较多,也有相关的专著出版,但涉及大分子核酸的综述较少。有关核苷酸对人的营养作用的代表性综述出现在1995年[9],1995年之后的综述主要是针对免疫、肠道或婴儿奶粉中添加核苷酸等某一个主题[9-16],或有关核苷酸对于动物养殖的营养作用的综述[17-21]。本文在对核酸营养的理论基础及发展历程进行说明的基础上,就核酸营养功能的最新研究成果进行介绍,并对一些矛盾和争议进行讨论,希望能引起更多的生物、水产养殖、药物、食品、海洋生态等交叉学科的学者的关注,并促进核酸在生物工程、土壤与海洋环境、水产养殖、禽畜养殖、食品添加剂等领域的应用发展。
1 核酸代谢与营养的理论基础作为异养生物,动物从食物中汲取营养,一方面作为生长和新陈代谢的原料,一方面用于补充维持正常生命活动所需能量。虽然一些异养微生物(如大肠杆菌)可以在只含有葡萄糖等有机碳源和必需的无机盐(含N、P、S等必需元素)的环境中繁殖,但高等动物需要更为均衡和全面的营养才能保持健康,同时需要摄入维生素等辅助或调控生化反应。人类也一直在寻找和利用营养丰富的食物,以高效吸收食物中的重要营养成分,减少自身合成的负担。例如,虽然人体可以合成精氨酸和组氨酸等非必需氨基酸,但这些氨基酸的摄入无疑对人体是有益的,也属于营养物质。从进化的角度说,这些非必需氨基酸可能对于人体至关重要,所以人体即使在缺乏时也能自己合成;而对于苯丙氨酸和色氨酸等必需氨基酸,一般的食物中可能不易缺乏(否则很容易造成相应物种的灭绝)。那核酸类物质的情况如何呢?
因核酸是细胞最为重要的组成成分之一,NAS(特别是RNA)几乎存在于所有的食物中,似乎不容易造成缺乏。另一方面,几乎所有的生物都会自身合成核酸类物质,这也是一些科学家认为人体无需补充核酸的依据。但正是因为NAS极其重要,生物体才建立起了能够自身合成的机制。事实表明,NAS的缺乏虽不足以致命,但会对生物体的健康产生较大影响。例如,食物中缺乏核苷酸可损害肝脏[22-24]、心脏[25]、肠道[26-29]和免疫系统[10, 30-33];而外源添加核苷酸能够促进淋巴细胞的成熟、激活和增殖,改善巨噬细胞的吞噬作用[12, 34-36]等。
核苷酸是核酸分解代谢的产物,也是合成核酸的单体。而脱氧核糖核苷酸(dNMP)可以在体内由核糖核苷酸(NMP)转化而得,且其在体内的含量一般也大大低于NMP,因此NMP是核酸营养研究的主要研究对象。NMP的合成代谢一般分为从头合成和补救合成两种途径。从头合成是指利用氨基酸、5’-磷酸核糖焦磷酸(5’-PRPP)和一碳单位(如甲酸和CO2)等合成NMP。从头合成主要在肝脏中进行,而肠粘膜、骨髓造血细胞和大脑的从头合成能力较低。补救合成是指以碱基或核苷等核酸分解产物为原料合成NMP,如碱基与5’-磷酸核糖焦磷酸反应生成相应的NMP;嘧啶碱基或腺嘌呤与1-磷酸核糖反应生成核糖核苷;核糖核苷在相应的核苷酸激酶作用下与ATP反应生成NMP等。补救合成既包括体内RNA分解产物的循环使用,也包括以摄入核酸的分解产物为原料进行合成。值得注意的是,从头合成NMP的原料甘氨酸、天冬氨酸和谷氨酰胺等都是非必需氨基酸。
其实,在细胞中每时每刻都发生着RNA的降解,降解的主要产物是NMP。这些NMP会被磷酸化成相应的NTP,重新用于合成RNA。可见,只要不发生致命性的结构破坏,NMP在细胞内一直被循环利用。可以认为,如果不需要细胞分化,一个正常的健康细胞对于核苷酸营养的需求是有限的。而那些新陈代谢快的细胞在增殖过程中需要大量的NMP,甚至dNMP,以满足生成新细胞的需求。
在体内,核苷酸在不同的结构形式之间转换,以维持相应的平衡。因此,核苷酸可作为核酸的合成材料、外界刺激的信使、能量转换(如ATP和GTP)的中介、辅酶以及生化反应的调节者等发挥多种功能。核苷酸包括核苷单磷酸(NMP和dNMP)、核苷二磷酸(NDP和dNDP)和核苷三磷酸(NTP和dNTP),和环状分子cAMP和cGMP等结构形式。这些分子及其合成前体必须在体内保持一定的浓度范围,并根据需要及时发生变化。如细胞繁殖时,对NTP和dNTP的需求会增加,特别是要大大提高dNTP的浓度。核苷酸浓度的高低直接影响其从头合成的速度,浓度达到一定高度时会抑制其合成。特别是ATP与其他NTP不同,一般浓度偏高。因此,各种核苷酸从头合成和补救合成也存在平衡。从头合成步骤繁多并需要十几种酶的参与,且需大量ATP提供能量;补救途径可以节省能量和减轻代谢压力,并为缺少从头合成途径的细胞提供核苷酸原料。一旦平衡遭到破坏就容易产生相应的疾病,例如,当鸟嘌呤和次黄嘌呤补救途径产生障碍时,相应的碱基不能被重新合成NMP,而不得不被分解成尿酸。如肾脏排泄尿酸能力不足,尿酸逐渐积累,导致肾结石或痛风[37]。值得注意的是,血液中维持足够高的尿酸浓度对人体有益,尿酸浓度过低也会引起一些疾病。
普通食物中的NAS一般以RNA为主,DNA一般只在鱼精或花粉等富含精子的物质中含量丰富。在鲑鱼的鱼白中,DNA含量高时可占干重的40%以上。活细菌中的RNA含量约占总重的6%(干重的20%),DNA占0.5%,核苷酸占0.5%[38]。动物和植物细胞中的NAS含量差异很大,如肉类,海鲜和豆类食品中含量较丰富,有些情况下NAS能占到细胞干重的10%以上。人乳中含有游离的核苷酸,核苷和碱基,也含有大分子核酸。如人乳中DNA含量为1~12 mg/dL,RNA为10~60 mg/dL,而牛奶中两者分别为1~4 mg/dL和5~19 mg/dL[39]。NAS被分解后主要以核苷的形式被人体吸收,少量以寡核苷酸、核苷酸和碱基的形式吸收。人体内核苷酸的分解产物为核糖(或脱氧核糖)、磷酸以及源于嘧啶的β-丙氨酸和β-氨基异丁酸等。生物种类不同分解产物也不近相同,例如只有灵长类,鸟类和一些爬行动物的嘌呤代谢终产物为尿酸,而其他生物为尿素或CO2等。
可见,核酸营养是一个复杂的问题,需要考虑多种因素,进行全面分析,并在不同层面进行回答。特别是不同的个体,甚至同一个体在不同生长阶段都对核酸营养有不同的需求。例如,体内合成能力降低时(如老年人和某些病人),需要多摄入外源核酸;体内NMP转化为dNMP的能力强时可能无需摄入DNA或dNMP,而转化能力低时需要摄入;身体对核酸的消化吸收能力降低时可能需要补充核苷酸或其它容易消化的核酸分解产物。
2 核苷酸代谢与营养的研究发展历程1940—1970年代,为了研究痛风(血液中尿酸过高)的机制以治疗痛风,Buchanan[40]等科学家们对于嘌呤的代谢进行了大量研究。例如,1948年采用同位素示踪技术证实鸽子体内合成嘌呤的原料为甘氨酸、天冬氨酸、谷氨酰胺、CO2和甲酸等。随后,嘌呤的合成过程得到阐明,并发现了转甲酰基酶、合成酶、羧化酶等相关的酶。而嘧啶核苷酸的体内合成相对简单,研究较少。值得注意的是,由于尿酸是嘌呤碱基的代谢产物,人们往往会过分强调摄入核酸对人体的危害。
1970年代前后开始,人们开始从营养学的角度,通过在食物中添加核苷酸或采用缺乏核苷酸的饮食配方等研究核苷酸的代谢及功能。对于大分子核酸的营养作用研究相对较少。到1990年代末,虽然也存在一些争议和片面的理解,但基本上形成了对核酸营养作用比较系统的认识[16, 41-44]。一般认为核苷酸是半必需或条件必需营养物质,当内源性的供应不足时,人体需要摄入膳食核苷酸。内源性核苷酸不足的原因可能是某些疾病,营养不良或快速生长需要等。
1990年代末部分科学家已经对外源核苷酸的功能形成了以下认识:
(1) 膳食核酸被分解为核苷等后经肠吸收,参与补救合成,可以部分代替能耗高和步骤繁多的从头合成,用于维持体内核苷酸池的水平。
(2) 对于处于快速生长期的婴儿,配方奶粉中需要补充核苷酸,以促进肠道发育和提高肠道免疫力。
(3) 对淋巴(免疫系统)、小肠和肝组织及脂质代谢有益。饮食提供的外源核苷酸有助于刺激白细胞(包括淋巴细胞)的更新,也有助于促进细胞免疫,如促进正常肠细胞的生长和成熟,且对于肠损伤的恢复有益。肝损伤后膳食核苷酸有助于肝细胞快速合成DNA和RNA来完成组织再生。饮食中缺乏核酸或核苷酸时,会造成肝脏重量降低。膳食核苷酸还有助于长链多不饱和脂肪酸和血清脂蛋白的合成。
(4) 促进肠道菌群的平衡,有益于健康。如能提高双歧杆菌的比例,降低致病菌的比例等。
(5) 一些临床实验表明,饮食中核苷酸源的充足有利于某些病人的健康恢复。静脉注射腺苷对血管,心脏和神经组织具有显著的改善作用,已经被批准用于治疗阵发性室上性心动过速。动脉内输注腺苷到小肠可增加到肠壁和粘膜层的血流量[45]。
在实际应用方面,美国医生班杰明·富兰克等于1970年代开发和推销过核酸营养品,并引起了争议。1980年代初日本科学家森重福美(1983年成立了“日本分子协调医学营养学研究所”)著作了《核酸的营养学》一书,使日本大众开始了解核酸的营养作用。1983年,小越章平先生(后来的日本功能性食品医用学会创立者)在世界上第一次明确提出核苷酸和脱氧核苷酸是重要的营养素。并研究发现在器官切除或器官功能下降的情况下,核酸会被更为积极地利用,因此手术后输液时添加核苷酸有益。
1991年,欧盟提出在奶粉中添加核酸的建议。日本从1995年开始,也在奶粉中添加了核苷酸。目前,大多数国家的婴儿奶粉中都要添加核苷酸。1992年开始,《从细胞层次变年轻-基因DNA核酸营养学:你也年轻10岁!》[46]和《培育聪明健康的宝宝核酸(核苷酸)是必要的!》[47]、《核酸与健康寿命》[48]等一些科普类的书籍在日本相继出版。同时,在详细机理还没有明确的情况下,市场上也出现了一些核酸营养类功能性食品(以片剂为主,也有一些营养液),而且也开发了一些化妆品和增发剂等产品。但由于相关的机理仍然不清楚,核酸的提取也主要限于酵母和鱼白,相关的研究和产品开发还是受到了很大限制。
2016年北京大学李勇教授出版的专著《核苷酸营养学》中指出[49],外源性核苷酸对于孕产妇、婴幼儿、老年人等特殊人群具有重要的营养作用。大量研究资料表明,外源核酸在特定生理条件下(某些疾病状态,营养摄入不足、快速生长时期及存在内源合成障碍)是不可缺少的营养成分,并视个体的生长发育阶段和特定的生理条件不同而有差异。补充外源核酸具有增强免疫、促进生长发育、调节肠道菌群、辅助降血脂、抗疲劳、改善记忆等多种功能;补充外源核酸对于一些患病或亚健康人群有益,如能够降低酒精对大鼠肝脏、肾脏造成的损伤,或减轻多种营养相关疾病的发生和发展。而且,以大鼠为实验模型的研究表明,添加15.0 g/kg bw的外源核苷酸未观察到有害作用,认为剂量为1.28 g/kg bw属于无毒级[49]。目前,科学家们正在分子水平开展核酸摄入对于一些组织器官产生作用的机理研究,特别是通过研究核酸代谢相关酶的表达来探究其发生作用的路径。同时,也有一些临床研究通过实验来验证其功能。另外,在禽畜饲养等农业领域也在分子水平展开了相关研究,核酸类物质(NAS)的研究正在快速发展。
3 1996年以后的核苷酸代谢与营养的研究成果毋庸置疑,当蛋白质摄入量减少或核苷酸合成需求量高的情况下(肠道损伤后、手术创伤后、脓毒症、快速生长的胎儿或新生儿等),一些快速周转的组织(肠道和免疫系统)可能会增加对饮食中外源核苷酸的利用。近20多年来,随着一些核酸营养类功能食品和饲料添加剂的开发和应用,以及生命科学的迅速发展,人们对核酸类物质的营养功能的兴趣逐渐增加。已经相继有数十篇综述发表,如2012年Hess等在题为《核苷酸在免疫和胃肠系统中的作用:潜在的临床应用》[50]的综述中指出,危重病患者、受伤患者、免疫抑制患者或慢性胃肠道疾病患者的临床结果有所改善;婴儿配方食品中添加核苷酸有助于促进肠道的成熟和发育,并增强免疫功能。以下分别就核酸对于一些组织器官或细胞的功能作用等进行简单介绍。
3.1 摄入核苷酸有益于肝脏健康一般认为只有在肝损伤等肝功能不足的情况下摄食核酸的作用才更明显[51]。但1997年Lopez-Navarro[22]等证明,饮食核苷酸有助于补充肝脏RNA池,核苷酸缺乏对肝脏RNA池的影响与饥饿的影响相似,并表明这种影响与年龄有关。2013年Le等[52]研究了小鼠模型中尿苷稳态的破坏与肝嘧啶代谢与脂质积累的关系。尿苷磷酸化酶的过表达和二氢乳清酸脱氢酶的表达抑制都可以导致肝微泡脂肪变性;尿苷的补充完全抑制了以上两个原因引起的微泡脂肪变性,并改变了肝脏的NAD(+)/NADH和NADP(+)/NADPH的比值,以及代谢、氧化还原和抗氧化酶的乙酰化情况。作者认为尿苷通过调节肝蛋白乙酰化来抑制脂肪肝;尿苷稳态的破坏可能是肝嘧啶代谢造成脂质积累的原因。可见,摄入核酸的补救合成同从头合成对于维护肝脏健康都很重要。
3.2 摄入核苷酸有益于肠道发育、成熟与修复肠道作为吸收营养分子和更新较快的器官,可以直接利用肠道内分解的核苷和核苷酸。这比利用肝脏等器官合成的核苷酸效率更高,也更为合理。1998年McCauley[53]在一篇有关肠细胞核苷酸合成的综述中提到,核苷酸在肠道发育、成熟和修复过程中对肠细胞尤为重要。从头合成和补救合成途径的相对贡献似乎受到隐绒毛轴内肠细胞的位置以及饮食摄入的核酸和谷氨酰胺的相对量的影响。研究表明[54],核苷酸补充并不能增强Caco-2细胞的增殖,但能显著增强大鼠正常小肠隐窝细胞系(IEC-6)的增殖。特别是CMP丰富的核苷酸混合物能最有效地促进细胞的增殖和成熟。2000年Sato[55]等以Caco-2细胞为模型,发现是核苷而不是核苷酸有助于肠微绒毛的产生。而当添加三碘甲状腺原氨酸以提高刷状缘膜碱性磷酸酶活性时,核苷酸也有类似效果。他们得出结论,核苷酸和核苷的补充可以促进Caco-2的形态分化。2005年Kimura[56]等研究发现,肠道内的腺苷和AMP能迅速增加小肠对葡萄糖的转运。
1999年Sukumar等[57]报道,虽然在肠内和肠外补充核苷酸可加速吲哚美辛诱导的肠炎大鼠小肠溃疡的愈合,但补充核苷酸会加重右旋糖酐硫酸钠(DSS)诱导的大鼠结肠炎。2006年Dancey等[58]以成人为研究对象,表明补充膳食核苷酸可改善肠易激综合征的部分症状。2008年Vieites等[59]研究发现外源性核苷可被小肠细胞(iEC-6细胞)选择性地吸收,以增加细胞内核苷酸池和GTP等的浓度,有利于肠细胞分化和功能变化,并得出外源性核苷促进大鼠肠上皮细胞分化的结论。
3.3 核苷酸的摄入有助于保持肾、脾脏、脑等其他组织器官的健康近年也出现了一些对于摄入核苷酸影响其他脏器的研究。如2006年Elwi等[60]综述了肾核苷转运蛋白的研究,论述了其生理和临床意义。已发现的7种人类转运蛋白(膜蛋白)之间会协同作用,主要功能是保持胞内和胞外的核苷酸平衡。并指出肾脏对核苷的再吸收或分泌是有选择性的。
2018年Cheng等[61]通过研究喂食5’-AMP对经γ射线照射造成损伤的小鼠脾脏组织的作用发现,添加5’-AMP可调节细胞周期和凋亡,修复经γ射线照射造成的脾脏受损,提高多项脾脏指标。并指出5’-AMP可以动态调节小鼠脾脏组织氧化还原平衡,增加细胞因子,因此可对小鼠的免疫系统受损起到改善作用。
1996年Chen等[62]通过小鼠模型试验发现,内源性核苷酸供应不足可能是衰老导致记忆不足或遗传性记忆不足的原因之一,通过饮食添加核苷和核苷酸可以改善以上原因引起的记忆力下降。大脑依赖于体液中的循环核苷。2003年Kunii等[63]研究发现,饮食补充核苷和核酸混合物能够降低老年小鼠脂褐素特异性脑细胞百分比,减少脑区空泡数量,并增加老年小鼠的记忆力。2011年Ipata等[64]对脑核苷代谢进行了综述,认为缺氧/缺血条件下的精神错乱可能与脑核苷酸代谢有关。
3.4 核苷酸有助于促进肠道菌群的平衡微生物一般被认为完全依靠从头合成途径满足菌体对NAS的需求,但越来越多的研究发现,微生物也能吸收利用NAS。1997年Sgarrella等[65]发现,细菌培养液中加入核苷酸可增加细菌的脱氧核糖醛缩酶活性,使核糖成为细菌的碳源。在反刍动物中,微生物源性核酸是氮的主要来源之一,主要以核苷的形式被小肠吸收。
2010年Sauer等[66]研究了膳食核苷酸(从酵母中提取)对仔猪小肠内微生物生长的影响,发现3种大肠杆菌菌株(DSM 2840、PS 37和PS 79)、罗伊氏乳杆菌、淀粉样乳杆菌和粪肠球菌等都可以利用核苷酸,表明了核苷酸在影响肠道细菌生长方面的潜在作用。2017年Doo等[67]研究了在婴儿配方食品中添加核苷酸和核苷对肠道微生物群的影响,揭示了核苷和核苷酸对婴儿肠道微生物群组成和代谢活性调节有很强剂量依赖性。研究发现,添加核苷酸和核苷可以使厌氧菌、消化道杆菌、梭杆菌、乳酸杆菌/葡萄球菌/明串珠菌和面纱菌的含量增加,而使沙门氏菌减少;添加后与核苷酸和硫代谢及铁获得有关的转录物增加,而共因子和维生素的生物合成减少。与成人相比,老年肠道微生物群的特征是稳定性降低,并受生活条件和饮食的影响。2019年Doo等[68]研究了酵母提取物对老年人结肠微生物群组成和代谢活性的累积影响,发现可增加乳酸杆菌和双歧杆菌的数量,由此增加丁酸盐产量。建议饮食补充核苷酸类物质以稳定和促进老年肠道微生物群的平衡。
3.5 补充核苷酸有助于提高免疫力早在1996年Jyonouchi等[69]的研究表明,无核苷酸饮食会抑制启动的T细胞产生抗原驱动的细胞因子,而补充核苷酸可能在抗原驱动的Th细胞激活中发挥作用,并且这种作用受饮食脂肪酸的影响。1996年Jyonouchi等[70]发现,口服补充的单核苷酸混合物可防止喂食无核苷酸饮食的C57BL/6小鼠的T细胞依赖性体液免疫下降。外源核苷酸有作为免疫功能调节器的潜在作用。饮食核苷酸刺激体液对T依赖性抗原的免疫反应,并提高总抗体水平。2001年Maldonaldo[71]的研究进一步证明,在婴儿配方食品中添加核苷酸似乎有利于免疫,如免疫球蛋白增加,对疫苗的反应改善,发病率降低,对膳食抗原的耐受性增加。2001年Jyonouchi等[72]发现,饮食核苷酸调节小鼠中1型(Th1)和2型T辅助细胞(Th2)对卵白蛋白的免疫反应平衡;在产生Th2偏多的BALB/cJ小鼠中,饮食核苷酸仅增加小鼠对Ova的Th1应答。松永政司等[73]的研究表明,核苷酸有助于促进一些细胞的凋亡,但不促进癌细胞的生长。但由于使用的是核蛋白,不能定量分析核酸和蛋白质的贡献比例。
3.6 核苷酸营养与婴儿健康1998年Boza[14, 74]讨论了膳食核苷酸对婴儿的小肠(成熟和恢复)和肠道菌群、脂质和肝脏代谢以及免疫系统的可能有益影响。指出母乳是婴儿核苷酸的最佳来源,其核苷酸/核苷谱显示,与嘌呤相比嘧啶具有明显的优势。与嘌呤核苷酸相比,嘧啶核苷酸似乎在母乳中能更稳定,且在小肠消化过程中也不容易被破坏,因此更容易被吸收并用于合成组织RNA。2004年Schaller等[75]通过常规婴儿免疫的抗体反应进行测量等临床实验,证明了婴儿配方食品核苷酸补充的免疫益处。2006年Vasquez-Garibay等[76]通过临床实验发现,核苷酸摄入有助于提高严重营养不良儿童胰岛素类生长因子I和其他激素生物标志物的水平。2006年Hawkes等[77]研究了添加核苷酸对足月婴儿生长和免疫功能的影响,研究表明以33.5 mg/L剂量补充核苷酸的配方奶粉有助于提高抗体的产生。2007年Lerner[78]发表综述指出,对受核苷酸强化的足月和早产儿进行的研究显示,核苷酸对细胞和肱骨的免疫有益,并且病弱的婴儿受益更多。
2002年Yu[11]对临床研究进行了综述,指出添加核苷酸的婴儿配方食品在增强免疫力和降低败血症风险方面具有功效;对于极度早产、出生前和出生后营养摄入明显低于最佳水平,儿肠道损伤严重的婴儿相关研究需要大大加强。2010年Singhal等[79]通过临床研究表明,补充核苷酸会增加配方奶粉喂养婴儿的体重和头围等,进而认为补充核苷酸可能对大脑早期生长发育有益。
3.7 大分子DNA和RNA的代谢与营养膳食DNA在胃肠道降解为较短的DNA片段和单个核苷,主要以单个核苷和碱基形式被摄取,但即使是几百碱基对的膳食DNA片段也被发现能穿过肠屏障进入血流。2013年Johannessen等[80]研究DNA片段(633 bp PCR产物)转运进入Caco-2细胞的情况,结果表明,DNA片段通过吸附性内吞作用和囊泡介导而转运到Caco-2细胞中,并且DNA结合蛋白参与了这一过程。还发现,在Caco-2细胞间的DNA转运不与脱氧寡核苷酸、岩藻聚糖、肝素、硫酸肝素和硫酸右旋糖酐竞争,而线性化质粒DNA则将DNA片段的转运减少约2倍。作者提出假设,认为这种转运机制在免疫系统中可能有作用。
从1990年代开始,以松永政司为代表的日本学者对于鱼精中的DNA进行了大量研究,并以鱼精蛋白和鱼精DNA为原料开发出了相应的功能食品。认为鱼精DNA和鱼精蛋白具有提高免疫力、减肥、抗氧化、美容、增发等功能。但是由于有些研究所用的原料中含有鱼精蛋白和鱼精DNA两种组分,具体是否由DNA起主要作用不是很明确。但对于精母细胞等对脱氧核糖核苷酸需求旺盛的细胞,补充DNA有明显的效果。
3.8 其他核酸营养的相关研究1996年,Boza等[81]通过喂养怀孕小鼠,研究了膳食和从头合成的核苷酸在体内核糖核酸合成中的作用,进一步验证了膳食碱基和核糖参与补救途径,并发现膳食尿苷比嘌呤核苷的利用率更高。2000年Leite等[82]研究发现,同时供应多不饱和脂肪酸和核苷酸有利于逆转脂质代谢异常。在肝硬化实验模型中,饮食中同时含有长链多不饱和脂肪酸和核苷酸,可使肠内积累的[H-3]花生四烯酸减少,而在肝脏和血浆中有所增加。2004年Yokoyama等[83]发现,无核苷酸饮食中添加核苷可抑制非肿瘤性病变的发生,如淀粉样变,而不会促进CF-252辐射诱发的癌变。
2013年Ostojic等[84]通过对30名健康男性的临床实验,研究了含服核苷酸(50 mg/d,共14 d)对耐力表现和免疫反应的影响。与安慰剂组相比,服用核苷酸使耗竭时间、血清免疫球蛋白A和NKC细胞毒性活性均显著升高,认为口服核苷酸对于高活动量的男性的能量代谢和免疫刺激等有益。2013年Riera等[85]的研究结果表明,在4周内补充核苷酸类产品可以抵消寒冷环境下的剧烈运动对免疫功能的损害。
脱氧核糖磷酸醛缩酶(DERA)将2-脱氧-D-核糖-5-磷酸转化为甘油醛-3-磷酸和乙醛。2014年Salleron[86]等的研究揭示了具有DERA(主要表达于肺、肝和结肠)活性的肝细胞通过脱氧核苷降解产生能量来减少或延迟应激诱导的损伤。此外,DERA的表达被证明允许无法生产ATP的细胞利用细胞外脱氧肌苷来维持ATP水平。
根据1996年以来的核苷酸营养功能研究所用实验模型及作用机制分类汇总为表 1。可以看出,核苷酸的摄入可能关系到人体健康的各个方面,对于细胞的生长、发育以及维持新陈代谢平衡有着重要作用。
|
|
表 1 核苷酸的营养作用相关研究 Table 1 Related researches on nutritional effect of nucleotides |
RNA一般从酵母中提取,而DNA主要从鲑鱼鱼白中提取,日本的年产量达数百吨。松永政司等将DNA作为过滤材料用于除去环境中的污染物等[87]。李敬等[88-89]也将DNA和壳聚糖等作为材料用于包载虾青素等活性物质。另外,梁兴国等深入研究了大分子核酸在消化道内的分解代谢[90-94]。安然等[90]详细研究了胃中的酸性条件对于DNA脱嘌呤的影响,如在pH=2的条件下,37 ℃反应2 h,可使约7%的嘌呤碱基脱落。嘌呤碱基可以在肠道内为腺苷脱氨酶所分解[9, 91],可能是因为人体避免造成体内嘌呤代谢的紊乱,尽量在代谢后以核苷的形式吸收。董平等[92-94]的研究显示,胃蛋白酶在胃液中能够分解DNA和RNA,提出了核酸代谢起始于胃的观点,打破了认为核酸的分解代谢源于小肠的传统认识。也有研究表明,口腔也会分泌相应的核酸酶分解核酸,但这可能主要是起破坏核酸的作用,以避免病菌病毒核酸的入侵。
3.9 核酸营养的相关争议尽管科学家们相信NAS的正面作用,但相关争议并没有平息。比如,对于痛风患者NAS的摄入一般会增加血液中尿酸浓度,但没有核酸代谢疾病的正常人摄入NAS过多是否会引起痛风?对于我们每一个人,什么样的阶段和什么情况下需要额外补充核苷酸?大分子DNA和RNA(如MicroRNA)的片段是否会广泛被人体吸收,并在人体内发生作用?摄入的外源基因的信息是否会影响生物体的基因并遗传给下一代?tRNA等含有的修饰碱基是否体内可以合成?这些问题都需要深入而全面的研究才有可能回答。
最近,新的争议还在不断产生。如烟酰胺腺嘌呤二核苷酸(NAD+)补充剂作为一种长寿保健品已经在市场上销售,并日益受到追捧,可能有上百亿美元正在进入该领域。但有研究机构发现吸收NAD+可能会刺激肿瘤细胞生长,并认为其抗衰老的功效可能是建立在促进肿瘤发展的情况下产生的[95]。因此,我们应慎重考虑其潜在的致癌等副作用,谨慎使用。
我们也必须注意到,一方面NAS可以作为体内合成大分子核酸的材料(“宏量营养素”),另一方面也可以作为类似于激素或维生素等的功能分子,调节体内的生物化学反应。人体的代谢与营养作用是一个复杂的系统,目前还远未达到能够对任何一个营养学问题进行全面解答的水平,需要继续利用先进技术和大数据处理等新手段进行研究。NAS同其他生物分子一样,一方面对于人体具有重要的营养作用;另一方面,如果使用不当则可能对人体无益甚至有害。所有的争议大多源于商业利益或产生了颠覆性的新观点,而在核苷酸领域也是如此。只有加大相应的科研投入和更多的科研人员潜心研究,才可能尽量排除商业利益等的诱惑,真正全面深入认识NAS的代谢、调控及营养作用等。
4 作为饲料添加剂的核苷酸在各个领域的应用同样,从1970年代前后开始,人们开始研究添加核苷酸对于其他生物的生长及健康的影响,进而用于水产、猪、禽等动物的养殖中。其中研究最多的是水产动物的营养。
4.1 添加核苷酸促进水产动物的健康生长1973年有研究表明核苷酸对于水产动物具有诱食性,可以增进其食欲[20]。研究还发现不同的鱼类对于核苷酸的诱食性差异比较大;后来发现在饲料中添加NMP可促进鱼类的生长发育及抗病能力等。这同以小鼠和大鼠为模型或临床研究所得的结果类似,即对于处于免疫低下、应激、快速生长、肠道和肝损伤的动物,摄入的核苷酸可使免疫系统恢复正常功能,促进肠道生长发育和肝功能等方面发挥着重要作用。相关研究可参照相关的综述,这里只做简单介绍。
在1991—2000年间,水产动物核苷酸营养研究重点偏向于对生长性能的影响。如Ramadan和Atef[96]在1991年发现商业核苷酸产品对于罗非鱼仔稚鱼的促生长作用;Adamek等[97]在1996年发现商业核苷酸产品对于虹鳟幼鱼的促生长作用;Kubitza等[98]1997年证实了IMP对于大口黑鲈的诱食作用及在低鱼粉配方下的促生长作用等;在2001—2005年,核苷酸营养的研究重点偏向于对免疫及抗病力的影响。2010年Burrellsetal等[99]首次证明饲料中添加核苷酸产品全面提高了鲑鱼对于病毒、细菌及寄生虫的抵抗能力,以及特异性免疫力;证明饲料中添加商业核苷酸产品改善肠道结构。李鹏和Gatlin[100]证明了饲料中添加核苷酸产品提高了杂交条纹鲈对于海豚链球菌的抵抗能力,以及非特异性免疫力等;2007—2010年,水产动物核苷酸营养的研究转向对于核苷酸产品新配方的开发。胡俊茹等[101]用核苷酸混合物饲喂凡纳滨对虾幼体,发现核苷酸具有促进摄食、促进生长、增加肝胰腺及肠道中RNA含量、提高溶菌酶和酚氧化酶含量以及提高血细胞总数等效果。2011年以来,水产动物核苷酸营养的研究也同人体研究类似,偏重于肠道健康,如改善鱼类胃肠道结构,增加褶皱和微绒毛高度等。同时,水产动物核苷酸营养的研究开始走向多样化。市场上出现了超过二十种的核苷酸产品,特别是有很多关于核苷酸添加对各种水产动物生长及健康指标影响的研究。
4.2 添加核苷酸对其它(非水产)动物健康生长的影响添加核酸或核苷酸对于猪、鸡、牛等的营养和抗病能力等也有益。2007年Gil等[102]在哺乳仔猪的空肠外植体培养液中加入核苷酸混合物,研究了猪肠上皮对核苷酸的摄取情况。结果显示外源RNA和核苷酸能够被有效地水解成核苷并被吸收。意味深长的是,作者认为肠外植体能够在没有腔酶的情况下将RNA水解为核苷酸,然后水解为核苷。
2012年Sauer等[103]通过研究膳食核苷酸对断奶仔猪生长性能、体液免疫、肠道结构及肠道细菌数量的影响发现,膳食核苷酸能够增加仔猪日摄食量及血浆IgA水平,因此得出结论,膳食核苷酸有助于增加仔猪体液免疫。但同时作者认为,膳食核苷酸对仔猪生长性能影响不大。2012年Sauer等[104]还研究了日粮酵母核苷酸对仔猪肠道及肠道微生物的影响。研究发现,饲料中添加1 g/kg含有游离核苷酸的酵母提取物,对仔猪小肠酶活性、回肠内肠道菌群及其代谢产物、回肠营养消化率均无影响。可能由于摄入营养不同等,核苷酸对仔猪生长的影响也不同,因此得出了不同的结论。
2014年Weaver等[105]通过在喂食断奶猪仔的饲料中添加肌苷酸含量高的核苷酸混合物,研究了核苷酸对于促进仔猪生长和改善健康状况的作用。研究发现,添加1.0 g/kg的核苷酸对仔猪的生长性能最有利;而添加0.5 g/kg核苷酸添加剂即能降低免疫应答和氧化应激。得出核苷酸可以提高仔猪生长性能,并能减轻断奶后的不适症状。
2005年Deng等[106]通过评估补充酵母RNA对鸡生长、淋巴器官重量和免疫反应的遗留效应表明,酵母RNA作为核苷酸来源可选择性地刺激幼鸡脾脏的发育,但这种效果并没有持续到其成年阶段。2012年Jung等[107]通过在玉米-大豆膳食饲料中添加酵母RNA,探究了核苷酸对肉鸡生长性能和胃肠道形态发育的影响。研究发现,当雏鸡处于压力环境(如高密度饲养或卫生条件较差)时,日粮中添加0.25%或2%酵母RNA能够增加雏鸡肠道绒毛高度,并提高雏鸡生长性能。
也有研究发现添加核苷酸可能对鸡的生长作用较小,但可以提高免疫或肌肉风味。2018年Seifi等[108]研究了饲喂酵母提取物对肉鸡肠道微生物菌群、内脏及生长特性的影响。研究发现,酵母提取物对肉鸡肠道菌群影响不显著,但能够降低营养不足导致的肉鸡体重降低及肝脏损伤。这可能是提取物中的核酸类物质起到主要作用。2018年Yan等[109]研究了日粮中添加IMP对鸡肉生长的影响,发现日粮中添加0.2%~0.3%的外源性IMP对鸡肉的生长性能没有影响,但可以促进乳腺肌碱性磷酸酶(ALP)、大腿肌中的三磷酸腺苷(ATP)酶和环水解酶等的活性或表达,因此可以提高鸡肉风味品质。
牛主要食物以草为主,牛是否能利用核苷酸作为营养也引起了大家的兴趣。一般认为奶牛中约20%的瘤胃微生物氮来源于嘌呤和嘧啶,为深入研究核苷酸类物质对牛核酸代谢的作用,2015年Stentoft等[110]研究了饲料中添加核苷、碱基及其分解产物后奶牛体内含量的变化。数据显示嘌呤核苷、嘧啶核苷、嘌呤碱基、嘧啶碱基和嘧啶碱基分解产物(β-丙氨酸和β-氨基异丁酸)都能进入牛的体内循环氮池而被重复利用;有意思的是嘌呤碱基分解产物之一的尿酸在静脉含量很高,认为尿酸不能进入体内循环氮池。2008年Liao等[111]研究发现,增加核苷酸或葡萄糖的肠内供应可以增加小肠上皮中的核苷转运mRNA的丰度,进一步证明牛可以通过小肠吸收核苷。
也有少量研究核苷酸对于其他动物的作用,如2008年Mydland等[112]研究了膳食核苷酸对水貂的作用,研究表明,核苷碱基的平均消化率为95%,其中尿嘧啶最高(平均96.8%),胸腺嘧啶最低(平均93.6%)。
5 添加核苷酸对植物生长的影响核苷酸(主要作为植物生长调节剂)在农业上应用的研究始于1970年代。例如早在1973年,Moustafa等[113]在Nature发表论文,报道了在培养液中添加二丁基环腺苷酸能抑制三种豆类、三叶草(白三叶)、苜蓿和荷花梗等通过根瘤固定大气中氮,但cAMP和AMP能增强这些结节的固氮作用,表明植物也能利用核苷酸。之后对粮食作物、果蔬、茶叶等多种作物进行研究表明,核苷酸具有给植物补充营养的作用,如明显改善作物的品质、提高产量及抗病能力等。相关作物包括水稻、小麦、棉花、油菜、番茄、白菜、橙子、冬瓜、小青菜、菠菜、花椰菜、卷心菜、茭白、乳黄瓜、龙眼、西瓜等,增产10%~28%不等[114]。除生长调节剂外,核苷酸等还可以作为肥料增效剂、抗菌防病剂、新型肥料环保剂等使用。杨扬等[115]发表综述指出,在1970年代核酸在作物方面的应用面积已达700多万亩。
1990年代末,市场上出现了一种“双酸肥”,它富含核苷酸和氨基酸,喷洒在水稻叶片表面,可对水稻叶片叶绿素的形成和光合作用、呼吸酶活性和ATP形成、氮素的吸收与同化、DNA和RNA的合成、根系吸收能力、孕穗期茎鞘贮存性碳水化合物的积累及抽穗后向穗部的转移均有明显的促进作用,最终导致水稻产量的增加和谷粒蛋白质含量的提高[116]。邵吉安等[114]用核苷酸复配剂处理番茄种子后发现,发芽后根系生长更迅速,侧根比未处理的高出23.8%。2013年Salmi等[117]在一篇综述指出,在植物细胞生长过程中,核苷酸被释放到细胞外基质中,这些细胞外核苷酸会诱导信号变化,从而以剂量依赖性的方式增加或减少细胞生长。而这与引起细胞溶质Ca2+浓度和一氧化氮(NO)水平的增加等有关。
6 总结及展望综上所述,有关核酸类物质的代谢与营养,一方面我们已经有了广泛而又具有一定深度的认识,另一方面相关研究还不足以产生足够系统和全面的知识;一方面可以积极进行临床实验等检验其功效,另一方面需要加大基础研究的力度,提供理论支撑;一方面不能盲目进行商业炒作,另一方面要看到在人类健康领域的广阔前景,进行深入的探索。对于核酸营养作用,我们也需要从平衡的角度去分析,包括浓度、磷酸化程度、各类核苷酸之间的转化、合成方式(补救和从头合成)、甚至其他营养的摄入等。
根据目前的研究状况,我们可明确以下事实:(1)我们每个人每天都在摄入核酸,核酸在体内被消化分解后吸收并被利用;(2)体内必须维持足够高的核苷酸水平,并有足够的NAS储备以对损伤等快速应激;(3)饮食外是否需要补充NAS,以何种方式何种用量补充等因人而异,不能一概而论;(4)摄入NAS既可以作为原料合成体内大分子核酸,又可以调节体内的各种生物化学反应;(5)NAS的摄入会引起血液中尿酸水平的变化,但不是痛风的病因。
我们需要深入回答如下问题:(1)摄入核酸所携带的基因信息虽不会轻易进入我们人类的基因并传递给下一代,但其概率和对进化的影响如何?(2)凋亡细胞中核酸等组分被回收利用的细节和机制如何?(3)核酸营养研究主要以RNA和核糖核苷酸为主,DNA和脱氧核糖核苷酸如何?(4)是否可以给病人以输液的方式补充合理复配的核苷酸(包括DNA和RNA的比例等)?(5)寡核苷酸进入体内循环系统的作用及危害?(6)体内回收核酸中内切酶与外切酶的分工等。
随着生物科学与科技的发展,将会在多个学科的交叉领域开展深入研究,我们相信众多的谜团会被相继解开,我们拭目以待。
| [1] |
Jeck W R, Sharpless N E. Detecting and characterizing circular RNAs[J]. Nature Biotechnology, 2014, 32(5): 453-461. DOI:10.1038/nbt.2890
(  0) 0) |
| [2] |
Bach D H, Lee S K, Sood A K. Circular RNAs in cancer[J]. Molecular Therapy-Nucleic Acids, 2019, 16: 118-129. DOI:10.1016/j.omtn.2019.02.005
(  0) 0) |
| [3] |
Yu C Y, Kuo H C. The emerging roles and functions of circular RNAs and their generation[J]. Journal of Biomedical Science, 2019, 26(1): 29. DOI:10.1186/s12929-019-0523-z
(  0) 0) |
| [4] |
Diener T O, Smith D R, O'Brien M J. Potato spindle tuber viroid: VⅡ. Susceptibility of several solanaceous plant species to infection with low molecular-weight RNA[J]. Virology, 1972, 48(3): 844-846. DOI:10.1016/0042-6822(72)90166-3
(  0) 0) |
| [5] |
Adkar-Purushothama C R, Perreault J P. Suppression of RNA-dependent RNA polymerase 6 favors the accumulation of potato spindle tuber viroid in nicotiana benthamiana[J]. Viruses, 2019, 11(4): 345. DOI:10.3390/v11040345
(  0) 0) |
| [6] |
Dissanayaka Mudiyanselage S, Qu J, Tian N, et al. Potato spindle tuber viroid RNA-templated transcription: Factors and regulation[J]. Viruses, 2018, 10(9): 503. DOI:10.3390/v10090503
(  0) 0) |
| [7] |
Kubota A. Nutritional study of nucleotide components in the milk[J]. Nippon Shonika Gakkai Zasshi Acta Paediatrica Japonica, 1969, 73(2): 197-209.
(  0) 0) |
| [8] |
Choi H K, Liu S, Curhan G. Intake of purine-rich foods, protein, and dairy products and relationship to serum levels of uric acid: The third national health and nutrition examination survey[J]. Arthritis & Rheumatism, 2005, 52(1): 283-289.
(  0) 0) |
| [9] |
Carver J D, Walker W A. The role of nucleotides in human nutrition[J]. Nutrtion Biochemistry, 1995, 6: 58-72. DOI:10.1016/0955-2863(94)00019-I
(  0) 0) |
| [10] |
Carver J D. Dietary nucleotides: Effects on the immune and gastrointestinal systems[J]. Acta Paediatr, 1999, 88(430): 83-88.
(  0) 0) |
| [11] |
Yu V Y H. Scientific rationale and benefits of nucleotide supplementation of infant formula[J]. Journal of Paediatrics and Child Health, 2002, 38(6): 543-549. DOI:10.1046/j.1440-1754.2002.00056.x
(  0) 0) |
| [12] |
Gil A. Modulation of the immune response mediated by dietary nucleotides[J]. European Journal of Clinical Nutrition, 2002, 56(Suppl 3): 1-4.
(  0) 0) |
| [13] |
Carver J D, Stromquist C I. Dietary nucleotides and preterm infant nutrition[J]. Journal of Perinatology, 2006, 26(7): 443-444. DOI:10.1038/sj.jp.7211516
(  0) 0) |
| [14] |
Boza J. Nucleotides in infant nutrition[J]. Monatsschrift Kinderheilkunde, 1998, 146(Suppl 1): 39-48.
(  0) 0) |
| [15] |
Lerner A, Shamir R. Nucleotides in infant nutrition: A must or an option[J]. Israel Medical Association Journal Imaj, 2000, 2(10): 772-774.
(  0) 0) |
| [16] |
Uauy R, Quan R, Gil A. Role of nucleotides in intestinal development and repair: Implications for infant nutrition[J]. Journal of Nutrition, 1994, 124(Suppl 8): 1436-1441.
(  0) 0) |
| [17] |
Sauer N, Mosenthin R, Bauer E. The role of dietary nucleotides in single-stomached animals[J]. Nutrition Research Reviews, 2011, 24(1): 46-59. DOI:10.1017/S0954422410000326
(  0) 0) |
| [18] |
Barekatain M R, Swick R A. Composition of more specialised pre-starter and starter diets for young broiler chickens: A review[J]. Animal Production Science, 2016, 56(8): 1239-1247. DOI:10.1071/AN15333
(  0) 0) |
| [19] |
Sauer N, Bauer E, Vahjen W, et al. Nucleotides modify growth of selected intestinal bacteria in vitro[J]. Livestock Science, 2010, 133(1-3): 161-163. DOI:10.1016/j.livsci.2010.06.053
(  0) 0) |
| [20] |
Li P, Gatlin Ⅲ D M. Nucleotide nutrition in fish: Current knowledge and future applications[J]. Aquaculture, 2006, 251(2-4): 141-152. DOI:10.1016/j.aquaculture.2005.01.009
(  0) 0) |
| [21] |
Singhal A, Macfarlane G, Macfarlane S, et al. Dietary nucleotides and fecal microbiota in formula-fed infants: A randomized controlled trial[J]. The American Journal of Clinical Nutrition, 2008, 87(6): 1785-1792. DOI:10.1093/ajcn/87.6.1785
(  0) 0) |
| [22] |
López-Navarro A T, Gil A, Sánchez-Pozo A. Age-related effect of dietary nucleotides on liver nucleic acid content in rats[J]. Annals of Nutrition and Metabolism, 1997, 41(5): 324-330. DOI:10.1159/000177963
(  0) 0) |
| [23] |
Valdés R, Ortega M A, Casado F J, et al. Nutritional regulation of nucleoside transporter expression in rat small intestine[J]. Gastroenterology, 2000, 119(6): 1623-1630. DOI:10.1053/gast.2000.20183
(  0) 0) |
| [24] |
Haider M, Tarver H. Effect of diet on protein synthesis and nucleic acid levels in rat liver[J]. The Journal of Nutrition, 1969, 99(4): 433-445. DOI:10.1093/jn/99.4.433
(  0) 0) |
| [25] |
Van Buren C T, Kulkarni A D, Rudolph F B. The role of nucleotides in adult nutrition[J]. The Journal of Nutrition, 1994, 124(Suppl 1): 160-164.
(  0) 0) |
| [26] |
Meng Y, Ma R, Ma J, et al. Dietary nucleotides improve the growth performance, antioxidative capacity and intestinal morphology of turbot (Scophthalmus maximus)[J]. Aquaculture Nutrition, 2017, 23(3): 585-593. DOI:10.1111/anu.12425
(  0) 0) |
| [27] |
Che L, Hu L, Liu Y, et al. Dietary nucleotides supplementation improves the intestinal development and immune function of neonates with intra-uterine growth restriction in a pig model[J]. Plos One, 2016, 11(6): e157314.
(  0) 0) |
| [28] |
Miao X, Cao J J, Xu W, et al. Effects of dietary nucleotides on growth performance, intestinal morphology and anti-oxidative capacities of large yellow croaker (Larimichthys crocea)[J]. Journal of Fisheries of China, 2014, 38(8): 1140-1148.
(  0) 0) |
| [29] |
Xu L, Ran C, He S X, et al. Effects of dietary yeast nucleotides on growth, non-specific immunity intestine growth and intestinal microbiota of juvenile hybrid tilapia Oreochromis niloticus♀×Oreochromis aureus♂[J]. Animal Nutrition, 2015(3): 244-251.
(  0) 0) |
| [30] |
Hester S. Impact of Formula Additives on Immune and Gastrointestinal Development in the Piglet[D]. Chicago: Nutritional Sciences in the Graduate College, University of Illinois at Urbana-Champaign, 2013.
(  0) 0) |
| [31] |
Yamamoto S, Wang M F, Adjei A A, et al. Role of nucleosides and nucleotides in the immune system, gut reparation after injury, and brain function[J]. Nutrition, 1997, 13(4): 372-374. DOI:10.1016/S0899-9007(96)00376-0
(  0) 0) |
| [32] |
Hess J R, Greenberg N A. The role of nucleotides in the immune and gastrointestinal systems: Potential clinical applications[J]. Nutrition in Clinical Practice, 2012, 27(2): 281-294. DOI:10.1177/0884533611434933
(  0) 0) |
| [33] |
RingøE, Olsen R E, Vecino J L G, et al. Use of immunostimulants and nucleotides in aquaculture: A review[J]. Journal of Marine Science(Research and Development), 2011, 2(1): 104.
(  0) 0) |
| [34] |
Xu M, Zhao M, Yang R, et al. Effect of dietary nucleotides on immune function in Balb/C mice[J]. International Immunopharmacology, 2013, 17(1): 50-56. DOI:10.1016/j.intimp.2013.04.032
(  0) 0) |
| [35] |
Kulkarni A D, Fanslow W C, Drath D B, et al. Influence of dietary nucleotide restriction on bacterial sepsis and phagocytic cell function in mice[J]. Archives of Surgery, 1985, 121(2): 169-172.
(  0) 0) |
| [36] |
Carver J D. Dietary nucleotides: Cellular immune, intestinal and hepatic system effects[J]. American Institute of Nutrition, 1994, 124(Suppl 1): 144-148.
(  0) 0) |
| [37] |
王镜岩, 朱圣庚, 徐长法. 生物化学-下册[M]. 北京: 高等教育出版社, 2002: 396-396. WANG Jing-Yan, ZHU Sheng-Geng, XU Chang-Fa. Biochemistry - Volume Ⅱ[M]. Beijing: Higher Education Press, 2002: 396-396. (  0) 0) |
| [38] |
Lewin B, Dover G. Genes[M]. Oxford: Oxford University Press, 1994: 6-6.
(  0) 0) |
| [39] |
Sanguansermsri J, Gyørgy P, Zilliken F. Polyamines in human and cow's milk[J]. American Journal of Clinical Nutrition, 1974, 27(8): 859-865. DOI:10.1093/ajcn/27.8.859
(  0) 0) |
| [40] |
Buchanan J M, Sonne J C, Delluva A M. Biological precursors of uric acid; the role of lactate, glycine, and carbon dioxide as precursors of the carbon chain and nitrogen atom 7 of uric acid[J]. Journal of Biological Chemistry, 1948, 173(1): 81-98.
(  0) 0) |
| [41] |
Yamamoto S, Wang M F, Adjei A A, et al. Role of nucleosides and nucleotides in the immune system, gut reparation after injury, and brain function[J]. Nutrition, 1997, 13(4): 372-374. DOI:10.1016/S0899-9007(96)00376-0
(  0) 0) |
| [42] |
Carver J D, Pimentel B, Cox W I, et al. Dietary nucleotide effects upon immune function in infants[J]. Pediatrics, 1991, 88(2): 359-363.
(  0) 0) |
| [43] |
Carver J D, Walker W A. The role of nucleotides in human nutrition[J]. Journal of Nutritional Biochemistry, 1995, 6(2): 58-72. DOI:10.1016/0955-2863(94)00019-I
(  0) 0) |
| [44] |
Pickering L K, Granoff D M, Erickson J R, et al. Modulation of the immune system by human milk and infant formula containing nucleotides[J]. Pediatrics, 1998, 101(2): 242-249. DOI:10.1542/peds.101.2.242
(  0) 0) |
| [45] |
Iijima S, Tsujinaka T, Kido Y, et al. Intravenous administration of nucleosides and a nucleotide mixture diminishes intestinal mucosal atrophy induced by total parenteral nutrition[J]. Jpen Journal of Parenteral and Enteral Nutrition, 1993, 17(3): 265-265. DOI:10.1177/0148607193017003265
(  0) 0) |
| [46] |
松永政司, 宇住晃治. 細胞から若返る遺伝子DNA核酸栄養学: あなたも10歳若返る![M]. 東京: 東急エージェンシー出版事業部, 1992.
(  0) 0) |
| [47] |
白川太郎, 松永政司, 宇住晃治. タイトルかしこく元気な赤ちゃんを育てるには核酸(ヌクレオチド)が必要です!![M]. 東京: メタモル出版, 2003.
(  0) 0) |
| [48] |
松永政司. 核酸が健康寿命を伸ばす[M]. 東京: 致知出版社, 2010.
(  0) 0) |
| [49] |
李勇, 徐美虹. 核苷酸营养学[M]. 北京: 北京大学医学出版社, 2016: 223-285. LI Yong, XU Mei-Hong. Nucleotide Nutrition[M]. Beijing: Peking University Medical Press, 2016: 223-285. (  0) 0) |
| [50] |
Hess J R, Greenberg N A. The role of nucleotides in the immune and gastrointestinal systems: Potential clinical applications[J]. Nutrition in Clinical Practice, 2012, 27(2): 281-294. DOI:10.1177/0884533611434933
(  0) 0) |
| [51] |
Cai X, Bao L, Wang N, et al. Dietary nucleotides protect against alcoholic liver injury by attenuating inflammation and regulating gut microbiota in rats[J]. Food & Function, 2016(7): 2898-2908.
(  0) 0) |
| [52] |
Le T T, Ziemba A, Urasaki Y, et al. Disruption of uridine homeostasis links liver pyrimidine metabolism to lipid accumulation[J]. Journal of Lipid Research, 2013, 54(4): 1044-1057. DOI:10.1194/jlr.M034249
(  0) 0) |
| [53] |
McCauley R, Kong S E, Hall J. Glutamine and nucleotide metabolism within enterocytes[J]. Jpen Journal of Parenteral and Enteral Nutrition, 1998, 22(2): 105-111. DOI:10.1177/0148607198022002105
(  0) 0) |
| [54] |
Sato N, Nakano T, Kawakami H, et al. In vitro and in vivo effects of exogenous nucleotides on the proliferation and maturation of intestinal epithelial cells[J]. Journal of Nutritional Science and Vitaminology, 1999, 45(1): 107-118. DOI:10.3177/jnsv.45.107
(  0) 0) |
| [55] |
Sa to, Kawakami H, Idota T. Nucleotide and nucleoside supplementation may morphologically promote the differentiation of human caco-2 cells[J]. Journal of Nutritional Science and Vitaminology, 2000, 46(4): 175-179. DOI:10.3177/jnsv.46.175
(  0) 0) |
| [56] |
Kimura Y, Turner J R, Braasch D A, et al. Lumenal adenosine and AMP rapidly increase glucose transport by intact small intestine[J]. American Journal of Physiology-Gastrointestinal and Liver Physiology, 2005, 289(6): 1007-1014. DOI:10.1152/ajpgi.00085.2005
(  0) 0) |
| [57] |
Sukumar P, Loo A, Adolphe R, et al. Dietary nucleotides augment dextran sulfate sodium-induced distal colitis in rats[J]. Journal of Nutrition, 1999, 129(7): 1377-1381. DOI:10.1093/jn/129.7.1377
(  0) 0) |
| [58] |
Dancey C P, Attree E A, Brown K F. Nucleotide supplementation: a randomised double-blind placebo controlled trial of IntestAidIB in people with Irritable Bowel Syndrome[J]. Nutrition Journal, 2006, 5(1): 16. DOI:10.1186/1475-2891-5-16
(  0) 0) |
| [59] |
Vieites J M, de la Torre R, del Carmen Ramírez M, et al. Exogenous nucleosides accelerate differentiation of rat intestinal epithelial cells[J]. British Journal of Nutrition, 2008, 99(4): 732-738. DOI:10.1017/S0007114507837457
(  0) 0) |
| [60] |
Elwi A N, Damaraju V L, Baldwin S A, et al. Renal nucleoside transporters: Physiological and clinical implications[J]. Biochemistry and Cell Biology, 2006, 84(6): 844-858. DOI:10.1139/o06-198
(  0) 0) |
| [61] |
Cheng C, Yi J, Wang R, et al. Protection of spleen tissue of γ-ray irradiated mice against immunosuppressive and oxidative effects of radiation by adenosine 5'-monophosphate[J]. International Journal of Molecular Sciences, 2018, 19(5): 1273. DOI:10.3390/ijms19051273
(  0) 0) |
| [62] |
Chen T H, Huang H P, Matsumoto Y, et al. Effects of dietary nucleoside-nucleotide mixture on memory in aged and young memory deficient mice[J]. Life Sciences, 1996, 59(21): 325-330.
(  0) 0) |
| [63] |
Kunii D, Wang M F, Chan Y C, et al. Ameliorative effects of nucleosides on senescence acceleration and memory deterioration in senescence-accelerated mice[C].//International Congress Series 1260. Amsterdam: Elsevier, 2004: 143-149.
(  0) 0) |
| [64] |
L Ipata P, Camici M, Micheli V, et al. Metabolic network of nucleosides in the brain[J]. Current Topics in Medicinal Chemistry, 2011, 11(8): 909-922. DOI:10.2174/156802611795347555
(  0) 0) |
| [65] |
Sgarrella F, Poddie F P A, Meloni M A, et al. Channelling of deoxyribose moiety of exogenous DNA into carbohydrate metabolism: Role of deoxyriboaldolase[J]. Comparative Biochemistry and Physiology Part B Biochemistry and Molecular Biology, 1997, 117(2): 253-257. DOI:10.1016/S0305-0491(96)00325-2
(  0) 0) |
| [66] |
Sauer N, Bauer E, Vahjen W, et al. Nucleotides modify growth of selected intestinal bacteria in vitro[J]. Livestock Science, 2010, 133(1): 161-163.
(  0) 0) |
| [67] |
Doo E H, Chassard C, Schwab C, et al. Effect of dietary nucleosides and yeast extracts on composition and metabolic activity of infant gut microbiota in PolyFermS colonic fermentation models[J]. FEMS Microbiology Ecology, 2017, 93(8): 1-14.
(  0) 0) |
| [68] |
Doo E H, Schwab C, Chassard C, et al. Cumulative effect of yeast extract and fructooligosaccharide supplementation on composition and metabolic activity of elderly colonic microbiota in vitro[J]. Journal of Functional Foods, 2019, 52: 43-53. DOI:10.1016/j.jff.2018.10.020
(  0) 0) |
| [69] |
Jyonouchi H, Sun S, Sato S. Nucleotide-free diet suppresses antigen-driven cytokine production by primed T cells: Effects of supplemental nucleotides and dietary fatty acids[J]. Nutrition, 1996, 12(9): 608-615. DOI:10.1016/S0899-9007(96)00176-1
(  0) 0) |
| [70] |
Jyonouchi H, Sun S. An orally supplemented mononucleotide mixture prevents the decrease in T cell-dependent humoral immunity in C57BL/6 mice fed a nucleotide-free diet[J]. Journal of Nutrition, 1996, 126(6): 1586-1593. DOI:10.1093/jn/126.6.1586
(  0) 0) |
| [71] |
Maldonado J, Navarro J, Narbona E, et al. The influence of dietary nucleotides on humoral and cell immunity in the neonate and lactating infant[J]. Early Human Development, 2001, 65(Suppl 5): 69-74.
(  0) 0) |
| [72] |
Jyonouchi H, Sun S, Winship T, et al. Dietary ribonucleotides modulate type 1 and type 2 T-helper cell responses against ovalbumin in young BALB/cJ mice[J]. Journal of Nutrition, 2001, 131(4): 1165-1170. DOI:10.1093/jn/131.4.1165
(  0) 0) |
| [73] |
松永政司, 宇住晃治, 林玲. DNA营养素:还您青春与健康[M]. 北京: 人民军医出版社, 2007: 110-116. SONG Yong-Zheng-Si, YU Zhu-Huang-Zhi, LIN Ling. DNA Nutrition: Restoring Your Youth and Health[M]. Beijing: People's Military Medical Publisher, 2007: 110-116. (  0) 0) |
| [74] |
Martinezaugustin O, Boza J, Delpino J, et al. Influence of dietary nucleotides on the intestinal permeability and the development of circulating antibodies in preterm neonates[J]. Pediatric Research, 1995, 38(3): 443.
(  0) 0) |
| [75] |
Schaller J P, Kuchan M J, Thomas D L, et al. Effect of dietary ribonucleotides on infant immune status. Part 1: Humoral responses[J]. Pediatric Research, 2004, 56(6): 883-890. DOI:10.1203/01.PDR.0000145576.42115.5C
(  0) 0) |
| [76] |
Vásquez-Garibay E, Stein K, Kratzsch J, et al. Effect of nucleotide intake and nutritional recovery on insulin-like growth factor I and other hormonal biomarkers in severely malnourished children[J]. British Journal of Nutrition, 2006, 96(4): 683-690.
(  0) 0) |
| [77] |
Hawkes J S, Gibson R A, Roberton D, et al. Effect of dietary nucleotide supplementation on growth and immune function in term infants: A randomized controlled trial[J]. European Journal of Clinical Nutrition, 2006, 60(2): 254-264. DOI:10.1038/sj.ejcn.1602310
(  0) 0) |
| [78] |
Lerner A. Nucleotides in infant nutrition: an update[J]. Agro Food Industry Hi-Tech, 2007, 18(Suppl 2): 19-24.
(  0) 0) |
| [79] |
Singhal A, Kennedy K, Lanigan J, et al. Dietary nucleotides and early growth in formula-fed infants: A randomized controlled trial[J]. Pediatrics, 2010, 126(4): 946-953. DOI:10.1542/peds.2009-2609
(  0) 0) |
| [80] |
Johannessen L E, Spilsberg B, Wiik-Nielsen C R, et al. DNA-fragments are transcytosed across CaCo-2 cells by adsorptive endocytosis and vesicular mediated transport[J]. PLoS One, 2013, 8(2): e56671. DOI:10.1371/journal.pone.0056671
(  0) 0) |
| [81] |
Boza J J, Jahoor F, Reeds P J. Ribonucleic acid nucleotides in maternal and fetal tissues derive almost exclusively from synthesis de novo in pregnant mice[J]. Journal of Nutrition, 1996, 126(7): 1749-1758.
(  0) 0) |
| [82] |
Leite L R M, Moreira-Vaz E, Rosa G, et al. The influence of dietary nucleotides and long-chain polyunsaturated fatty acids on the incorporation of[J]. Archivos Latinoamericanos de Nutricion, 2000, 50(3): 257-264.
(  0) 0) |
| [83] |
Yokoyama H, Fujiwara H, Watanabe H. Dietary nucleosides and nucleotides do not affect tumor incidence but reduce amyloidosis incidence in B6C3F1 mice irradiated with californium-252[J]. Nutrition, 2004, 20(4): 383-389. DOI:10.1016/j.nut.2003.12.012
(  0) 0) |
| [84] |
Ostojic S, Idrizovic K, Stojanovic M. Sublingual nucleotides prolong run time to exhaustion in young physically active men[J]. Nutrients, 2013, 5(11): 4776-4785. DOI:10.3390/nu5114776
(  0) 0) |
| [85] |
Riera J, Pons V, Martinez-Puig D, et al. Dietary nucleotide improves markers of immune response to strenuous exercise under a cold environment[J]. Journal of the International Society of Sports Nutrition, 2013, 10(1): 1-8. DOI:10.1186/1550-2783-10-1
(  0) 0) |
| [86] |
Salleron L, Magistrelli G, Mary C, et al. DERA is the human deoxyribose phosphate aldolase and is involved in stress response[J]. Biochimica et Biophysica Acta (BBA)-Molecular Cell Research, 2014, 1843(12): 2913-2925. DOI:10.1016/j.bbamcr.2014.09.007
(  0) 0) |
| [87] |
Liu X D, Matsunaga M, Nishi N. Method for removing harmful substances and filter for removing harmful substances: U. S. Patent Application 12/055, 558[P]. 2008-7-24.
(  0) 0) |
| [88] |
赵英源.虾青素/DNA/壳聚糖纳米复合物的制备及其稳定性研究[D].青岛: 中国海洋大学, 2015. ZHAO Ying-Yuan. Preparation and Stability of Astaxanthin /DNA/ Chitosan Nanocomposites[D]. Qingdao: Ocean University of China, 2015. (  0) 0) |
| [89] |
Wang Q, Zhao Y, Guan L, et al. Preparation of astaxanthin-loaded DNA/chitosan nanoparticles for improved cellular uptake and antioxidation capability[J]. Food Chemistry, 2017, 227: 9-15. DOI:10.1016/j.foodchem.2017.01.081
(  0) 0) |
| [90] |
An R, Jia Y, Wan B, et al. Non-enzymatic depurination of nucleic acids: Factors and mechanisms[J]. PLoS One, 2014, 9(12): e115950. DOI:10.1371/journal.pone.0115950
(  0) 0) |
| [91] |
Witte D P, Wiginton D A, Hutton J J, et al. Coordinate developmental regulation of purine catabolic enzyme expression in gastrointestinal and postimplantation reproductive tracts[J]. Journal of Cell Biology, 1991, 115(1): 179-190. DOI:10.1083/jcb.115.1.179
(  0) 0) |
| [92] |
Liu Y, Zhang Y, Jiang W, et al. Nucleic acids digestion by enzymes in the stomach of snakehead (Channa argus) and banded grouper (Epinephelus awoara)[J]. Fish Physiology and Biochemistry, 2017, 43(1): 127-136. DOI:10.1007/s10695-016-0273-8
(  0) 0) |
| [93] |
Liu Y, Zhang Y, Dong P, et al. Digestion of nucleic acids starts in the stomach[J]. Scientific Reports, 2015, 5(1): 11936. DOI:10.1038/srep11936
(  0) 0) |
| [94] |
Zhang Y, Li C, Liu Y, et al. Mechanism of extraordinary DNA digestion by pepsin[J]. Biochemical and Biophysical Research Communications, 2016, 472(1): 101-107. DOI:10.1016/j.bbrc.2016.02.073
(  0) 0) |
| [95] |
Nacarelli T, Lau L, Fukumoto T, et al. NAD+ metabolism governs the proinflammatory senescence-associated secretome[J]. Nature Cell Biology, 2019, 21(3): 397-407. DOI:10.1038/s41556-019-0287-4
(  0) 0) |
| [96] |
Ramadan A, Atef M, Afifi N A. Effect of the biogenic performance enhancer (Ascogen "S") on growth rate of tilapia fish[J]. Experimental Cell Research, 1991, 283(1): 36-50.
(  0) 0) |
| [97] |
Adamek Z, Hamakova J, Kouril J, et al. Effect of Ascogen probiotics supplementation on farming success in rainbow trout (Oncorhynchus mykiss) and wels (Silurus glanis) under conditions of intensive culture[J]. Krmiva: asopis o hranidbi životinja, proizvodnji i tehnologiji krme, 1996, 38(1): 11-20.
(  0) 0) |
| [98] |
Kubitza F, Lovshin L L, Lovell R T. Identification of feed enhancers for juvenile largemouth bass Micropterus salmoides[J]. Aquaculture, 1997, 148(2-3): 191-200. DOI:10.1016/S0044-8486(96)01417-2
(  0) 0) |
| [99] |
Burrells C, Williams P D, Forno P F. Dietary nucleotides: A novel supplement in fish feeds: 1. Effects on resistance to disease in salmonids[J]. Aquaculture, 2001, 199(1-2): 159-169. DOI:10.1016/S0044-8486(01)00577-4
(  0) 0) |
| [100] |
Li P, Gatlin Ⅲ D M. Dietary brewers yeast and the prebiotic Grobiotic AE influence growth performance, immune responses and resistance of hybrid striped bass (Morone chrysops×M. saxatilis) to Streptococcus iniae infection[J]. Aquaculture, 2004, 231(1): 445-456.
(  0) 0) |
| [101] |
胡俊茹, 曹俊明, 朱选, 等.诱食剂对凡纳滨对虾生长、血清生化、肝胰腺消化酶以及抗氧化能力的影响[C]. //中国水产学会学术年会论文摘要集.海口: 中国水产学会, 2009. HU Jun-Ru, CAO Jun-Ming, ZHU Xuan, et al. Effect of feeding simulant on growth performance, body composition, serum biochemical composition index, digestive enzyme activity and total-antioxidative activity of shrimp Litopenaeus vannamei[C]. // Abstracts of Papers from the Annual Conference of China Society of Fisheries. Haikou: China Society of Fisheries, 2009. (  0) 0) |
| [102] |
Gil A, Gómez-León C, Rueda R, et al. Exogenous nucleic acids and nucleotides are efficiently hydrolysed and taken up as nucleosides by intestinal explants from suckling piglets[J]. British Journal of Nutrition, 2007, 98(2): 285-291. DOI:10.1017/S000711450770908X
(  0) 0) |
| [103] |
Sauer N, Eklund M, Bauer E, et al. The effects of pure nucleotides on performance, humoral immunity, gut structure and numbers of intestinal bacteria of newly weaned pigs[J]. Journal of Animal Science, 2012, 90(9): 3126-3134. DOI:10.2527/jas.2011-4417
(  0) 0) |
| [104] |
Sauer N, Eklund M, Roth S, et al. Short-term effect of dietary yeast nucleotide supplementation on small intestinal enzyme activities, bacterial populations and metabolites and ileal nutrient digestibilities in newly weaned pigs[J]. Journal of Animal Physiology and Animal Nutrition, 2012, 96(4): 700-708. DOI:10.1111/j.1439-0396.2011.01198.x
(  0) 0) |
| [105] |
Weaver A C, Kim S W. Supplemental nucleotides high in inosine 5'-monophosphate to improve the growth and health of nursery pigs[J]. Journal of Animal Science, 2014, 92(2): 645-651. DOI:10.2527/jas.2013-6564
(  0) 0) |
| [106] |
Deng K, Wong C W, Nolan J V. Carry-over effects of dietary yeast RNA as a source of nucleotides on lymphoid organs and immune responses in Leghorn-type chickens[J]. British Poultry Science, 2005, 46(6): 673-678. DOI:10.1080/00071660500395426
(  0) 0) |
| [107] |
Jung B, Batal A B. Effect of dietary nucleotide supplementation on performance and development of the gastrointestinal tract of broilers[J]. British Poultry Science, 2012, 53(1): 98-105. DOI:10.1080/00071668.2012.659654
(  0) 0) |
| [108] |
Seifi S, Khoshbakht R, Sayrafi R, et al. Evaluation of a liquid yeast product on growth performance, anatomical structure, and gut microbiota of broilers challenged with suboptimal diet and heat stress[J]. Revue de Medecine Veterinaire, 2018, 169(4-6): 93-102.
(  0) 0) |
| [109] |
Yan J, Liu P, Xu L, et al. Effects of exogenous inosine monophosphate on growth performance, flavor compounds, enzyme activity, and gene expression of muscle tissues in chicken[J]. Poultry Science, 2018, 97(4): 1229-1237. DOI:10.3382/ps/pex415
(  0) 0) |
| [110] |
Stentoft C, Røjen B A, Jensen S K, et al. Absorption and intermediary metabolism of purines and pyrimidines in lactating dairy cows[J]. The British Journal of Nutrition, 2015, 113(4): 560-573. DOI:10.1017/S0007114514004000
(  0) 0) |
| [111] |
Liao S F, Alman M J, Vanzant E S, et al. Basal expression of nucleoside transporter mRNA differs among small intestinal epithelia of beef steers and is differentially altered by ruminal or abomasal infusion of starch hydrolysate1[J]. Journal of Dairy Science, 2008, 91(4): 1570-1584. DOI:10.3168/jds.2007-0763
(  0) 0) |
| [112] |
Mydland L T, Frøyland J R K, Skrede A. Composition of individual nucleobases in diets containing different products from bacterial biomass grown on natural gas, and digestibility in mink (Mustela vison)[J]. Journal of Animal Physiology and Animal Nutrition, 2010, 92(1): 1-8.
(  0) 0) |
| [113] |
Moustafa E, Hastings A. Effect of dibutyryl cyclic AMP and other nucleotides on nitrogen fixation by legume root nodules[J]. Nature, 1973, 244(5416): 461-462. DOI:10.1038/244461a0
(  0) 0) |
| [114] |
邵吉安, 孙云祥, 石兆魁, 等. 核苷酸复配剂在农业上的应用[J]. 土壤, 1992(4): 210-212. SHAO Ji-An, SUN Yun-Xiang, SHI Zhao-Kui, et al. Application of nucleotide compound in agriculture[J]. Soil, 1992(4): 210-212. (  0) 0) |
| [115] |
杨扬. 核酸在作物上应用机理与功效[J]. 农民致富之友, 2014(8): 70-71. YANG Yang. Application mechanism and efficacy of nucleic acid in crops[J]. Friends of Farmers, 2014(8): 70-71. DOI:10.3969/j.issn.1003-1650.2014.08.065 (  0) 0) |
| [116] |
刘强, 罗泽民, 荣湘民, 等. 喷施双酸肥对水稻代谢机能及产量影响初探[J]. 中国农业科学, 1998, 31(5): 13-18. LIU Qiang, LUO Ze-Min, RONG Xiang-Min, et al. Study on the effects of spraying double acid fertilizer on metabolic function and yield of rice[J]. Cientia Agricultura Sinica, 1998, 31(5): 13-18. (  0) 0) |
| [117] |
Salmi M L, Clark G, Roux Jr S J. Current status and proposed roles for nitric oxide as a key mediator of the effects of extracellular nucleotides on plant growth[J]. Frontiers in Plant Science, 2013, 4: 427.
(  0) 0) |
2. Laboratory for Marine Drugs and Bioproducts, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266235, China
 2019, Vol. 49
2019, Vol. 49


