2. 青岛海洋科学与技术国家实验室,山东 青岛 266237
在水产养殖中,高浓度的氨态氮和亚硝酸态氮往往会对养殖动物产生严重的胁迫,甚至导致死亡,因此如何将有毒形态的氮元素转化为无毒的硝酸态氮一直是水产养殖环境管理重要内容之一[1]。然而,随着水产养殖业的进一步发展及对周围环境的影响,包括硝酸态氮在内的氮污染物在水产养殖水体中积累问题也越来越受到人们的关注。实际上,氮污染物的去除一直以来都是人们在污水处理中非常关心的问题,而生物脱氮是被认为目前处理污水和废水氮污染物最经济有效的方法之一[2]。但传统的生物脱氮过程往往是由好氧硝化与厌氧反硝化两个相互独立的过程构成的,且作用于两个反应阶段的菌群及环境条件都不相同,因此传统脱氮工艺比较复杂,致使生物脱氮的应用在一定程度上受到了限制[3]。然而,随着越来越多的异养硝化菌-好氧反硝化菌被分离出,像产碱菌属(Alcaligenes)、芽孢杆菌属(Bacillus)、假单孢菌属(Pseudomonas)、戴尔夫特菌属(Delftia)等,传统的生物脱氮理论正在逐步被打破[4-5]。异养硝化菌和好氧反硝化菌具有生长快,脱氮效率高,可有效地去除水体氮素的过度积累,而且在处理过程中也可避免好氧区和厌氧区隔开分别进行的麻烦等优点。鉴于此,不同于工业和生活污水处理,如何筛选出适合水产养殖系统使用的异养硝化-好氧反硝化菌成为了相关领域研究的热门。目前尽管异养硝化细菌对无机氮的去除特性的研究已有较多报道,但系统地对其无机氮降解机制和脱氮途径的研究却少见报道。本研究的所用短小芽孢杆菌(Bacillus pumilus,编号BP-171)分离于海水虾蟹养殖池塘。前期初步的研究发现,此菌株可有效降低水体中氨态氮和亚硝态氮浓度(未发表数据)。本研究在此基础上进一步研究了不同环境因子和碳氮源条件下其脱氮特性,以查明环境因子对其脱氮性能的影响并对其脱氮机制进行初步探究,从而为其在水产养殖中的水质管理中的可能应用提供理论参考和技术支撑。
1 材料与方法 1.1 菌株来源本研究所使用短小芽孢杆菌菌株BP-171来自于本实验室保种库,是由本实验分离自虾蟹养殖池塘。
1.2 试剂实验过程中的所使用的化学试剂除了过硫酸钾购自Sigma公司外,其余的化学试剂均从国药集团公司购买。
1.3 培养基本研究所使用的培养液主要如下:
经适当改进的2216E液体培养液:向1 000 mL海水中加入酵母2~2.5 g,胰蛋白胨6 g,121 ℃,20 min灭菌。
氨氮单一氮源培养液:2.080 8 g C6H12O6·H2O+0.160 5 g NH4Cl +1 L海水,121 ℃,20 min灭菌。
亚硝酸态氮单一氮源培养液:2.080 8 g C6H12O6·H2O+0.207 g NaNO2 +1 L海水,121 ℃,20 min灭菌。
硝酸态氮单一氮源培养液:2.080 8 g C6H12O6·H2O+0.255 g NaNO3 +1 L海水,121 ℃,20 min灭菌。
混合氮源培养液:2.080 8 g C6H12O6·H2O+0.085 g NaNO3+0.069 g NaNO2+0.053 5 g NH4Cl+1 L海水,121 ℃,20 min灭菌。
1.4 不同环境因子及碳源对菌株BP-171脱氮特性影响的实验本研究选择的环境因素分别为pH、C/N、盐度3个因素以及不同的碳源,每个处理分别设置了5个重复。各因子具体设置如下:
(1) 碳源:乙酸钠、丁二酸钠、柠檬酸钠、蔗糖、乳糖和葡萄糖;
(2) C/N:3、6、12、18、24;
(3) pH:4、5、6、7、8、9;
(4) 盐度:0、10、20、30、40、50、60。
实验前将菌株BP-171预培养至对数期,按5%的接种量即吸取5 mL对数期菌液分别接种至含有100 mL灭菌后的氨氮单一氮源培养液、亚硝酸态氮单一氮源培养液和硝酸态氮单一氮源培养液中,氨氮初始浓度、亚硝酸盐氮初始浓度、硝酸盐氮初始浓度均约为42 mg/L,并分别设置不加入菌液的相应培养液作为空白对照。实验中除研究因子外,其它实验条件均设为:温度28 ℃、盐度30、pH=7.0、碳源为葡萄糖、C/N为18、振荡器转速为160 r/min。
实验第5天检测不同处理下降解液中菌体的生长量(OD600)、氨态氮(NH4+-N)、亚硝酸态氮(NO2--N)、和硝酸态(NO3--N)浓度。
1.5 菌株BP-171对不同氮源的脱氮性能研究的实验以氯化铵、亚硝酸钠、硝酸钠为单一氮源以及三者按1:1:1比例配制的混合氮源的4种培养液作为菌株BP-171的脱氮测试液,分别设置单一氨态氮浓度、单一亚硝酸态氮浓度、单一硝酸态氮浓度以及三氮混合总无机氮浓度均为42 mg/L,分别设置不加入菌液的相应培养液作为空白对照,研究菌株BP-171对不同氮源的脱氮特性。
将预培养的处于对数增长期的菌液(OD600约为1.0)接入盛有高温灭菌后的100 mL测试液的250 mL的三角瓶中,实验设置5个重复,实验条件设置温度为28 ℃、盐度为30、pH为7.0、碳源为葡萄糖、C/N为18、振荡器转速为160 r/min、菌接种量为5%。连续培养5天,每天检测培养液中菌体的生长量(OD600),氨态氮、亚硝酸态氮、硝酸态氮、菌体有机氮、菌液有机氮以及总氮的浓度。
1.6 分析方法菌体生长吸光度(OD600)的测定采用吸光度法,即取菌液2mL于比色皿中并用DR2700型可见分光光度计测定菌液在600 nm下的光密度值;NH4+-N浓度的测定、NO2--N浓度的测定、总氮的测定方法参照雷衍之版《养殖水环境实验》进行[6],其中NH4+-N浓度的测定采用靛酚蓝法测定,NO2--N浓度的测定采用磺胺盐酸奈乙二胺法,总氮采用总磷、总氮联合消化的测定方法;而NO3--N浓度的测定采用紫外分光光度法[7];细菌总蛋白含量采用Lowry法测定,并经适当改进[8]。
计算菌株BP-171对降解液中无机氮的去除率所依据公式:
| $ {\text{NH}}_4^ + -{\text{N去除率}}(\%)=(1-{\text{NH}}_4^ + -{\text{N}}_5/{\text{NH}}_4^ + -{\text{N}}_0)\times 100\%;$ |
| $ {\text{NO}}_2^ - -{\text{N去除率}}(\%)=(1-{\text{NO}}_2^ - -{\text{N}}_5/{\text{NO}}_2^ - -{\text{N}}_0)\times 100\%;$ |
| $ {\text{NO}}_2^ - -{\text{N去除率}}(\%)=(1-{\text{NO}}_2^ - -{\text{N}}_5/{\text{NO}}_2^ - -{\text{N}}_0)\times 100\%。$ |
式中:NH4+-N0和NH4+-N5分别代表第0天和第5天降解溶液中NH4+-N的浓度;NO2--N0和NO2--N5分别代表第0天和第5天降解溶液中NO2--N的浓度;NO3--N0和NO3--N5分别代表第0天和第5天降解溶液中NO3--N的浓度。使用SPSS Statistics21.0对数据进行统计,单因素方差分析(One-Way ANOVA)和Duncan多重比较对数据进行分析,使用Sigmaplot12.5进行作图,以P<0.05作为差异显著水平。
2 结果 2.1 不同环境因子及碳源对菌株BP-171脱氮特性的影响 2.1.1 不同碳源对菌株BP-171脱氮特性的影响在不同碳源下,相应空白对照中的氨态氮、亚硝酸态氮和硝酸态氮含量在实验前后均未发生改变,菌株BP-171对氨态氮、亚硝酸态氮和硝酸态氮去除情况如图 1所示。当以乙酸钠和乳糖作为碳源时,菌株BP-171几乎没有脱氮能力,且菌株生长状况也不好;而以蔗糖和葡萄糖作为氮源时菌株BP-171对无机氮的去除效果都较好,对氨态氮、亚硝态氮、硝态氮的去除率分别为74.07%和73.36%、37.39%和54.26%、87.88%和76.31%。综合该菌对3种氮源的去除率,当碳源为葡萄糖时,菌株BP-171对无机氮氮的去除能力最佳。
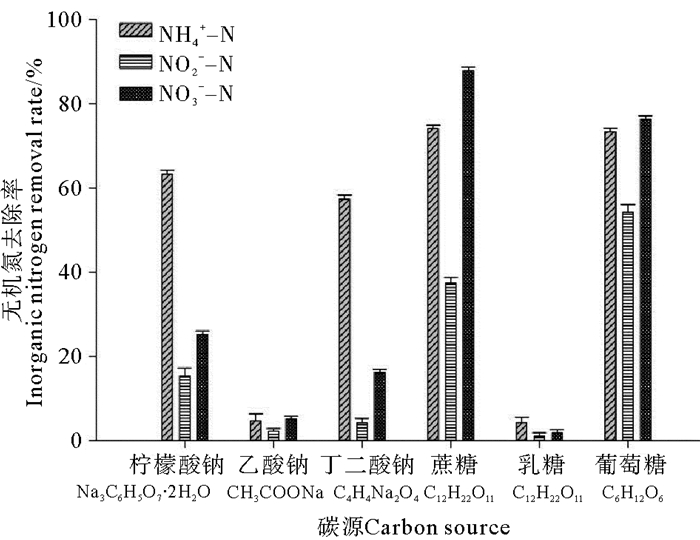
|
图 1 不同碳源对菌株BP-171对无机氮去除的影响 Fig. 1 Effect of carbon resource on the inorganic nitrogen removal capacity of strainBP-17 |
在不同C/N下,相应空白对照中的氨态氮、亚硝酸态氮和硝酸态氮含量在实验前后均未发生改变,菌株BP-171对氨态氮、亚硝酸态氮和硝酸态氮去除情况如图 2所示。当C/N在12~24之间时,菌株BP-171对氨态氮、亚硝酸态氮和硝酸态氮均有较好的去除率;且当C/N比为18左右时,菌株对氨态氮和亚硝态氮的去除率最大,分别为76.88%和48.81%;而菌株对硝酸态氮的降解能力是随着碳氮比的增加而增加的,当C/N比为18和24时,菌株BP-171对硝酸态氮的降解率分别为78.21%和83.07%。综合碳氮比对菌株BP-171脱氮特性的影响,当C/N为18时菌株BP-171对无机氮去除能力最佳。
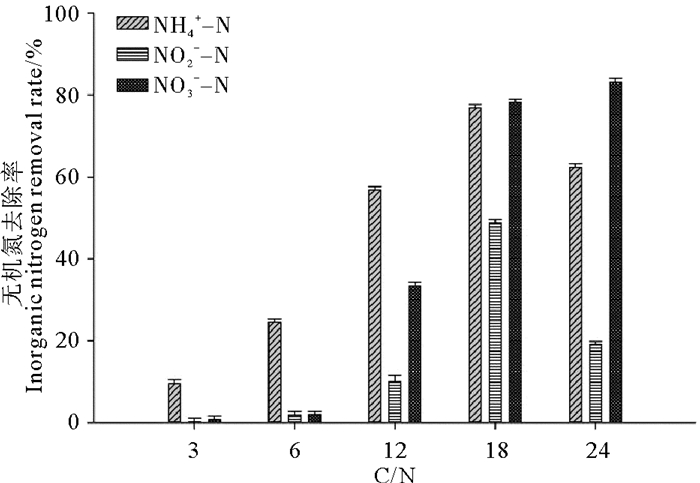
|
图 2 碳氮比对菌株BP-171对无机氮去除的影响 Fig. 2 Effect of C/N ratio on the inorganic nitrogen removal capacity of strain BP-171 |
在不同盐度下,相应空白对照中的氨态氮、亚硝酸态氮和硝酸态氮含量在实验前后均未发生改变,菌株BP-171对氨态氮、亚硝酸态氮和硝酸态氮去除情况如图 3所示。菌株BP-171对氨态氮、亚硝酸态氮和硝酸态氮的去除效果均是先随盐度增高而增强,当盐度超过30后,其去除效果又随盐度增高的而降低。总体来说,在盐度20~40条件下,菌株BP-171对氨态氮、亚硝酸态氮和硝酸态氮均有较好的去除率,但在盐度为30时菌株BP-171对氨态氮、亚硝酸态氮和硝酸态氮去除效果最好,最高去除率分别为72%、53.95%和71.48%。
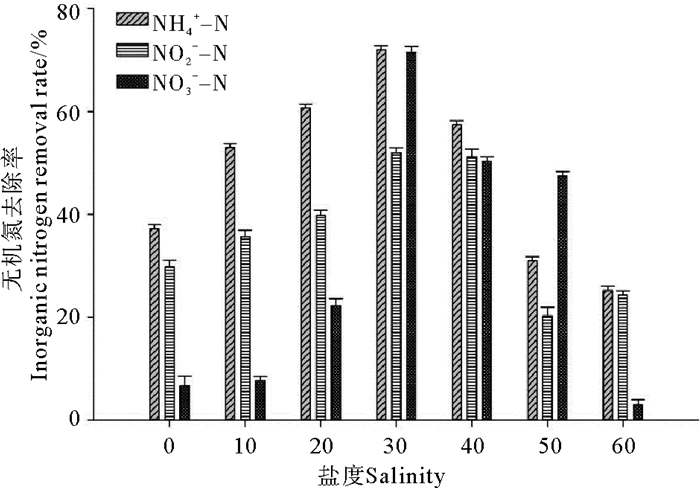
|
图 3 盐度对菌株BP-171对无机氮去除的影响 Fig. 3 Effect of salinity on the inorganic nitrogen removal capacity of strain BP-171 |
在不同pH下,相应空白对照中的氨态氮、亚硝酸态氮和硝酸态氮含量在实验前后均未发生改变,菌株BP-171对氨态氮、亚硝酸态氮和硝酸态氮去除情况如图 4所示。菌株BP-171在pH为5~9范围内对氨态氮均有较好的去除率,说明菌株在较广的pH范围内有较强的异养硝化作用。菌株在pH为6~9范围内对亚硝酸氮有较好的去除效果,菌株在pH为7~9的范围内对硝酸氮有较好的去除效果。故综合pH对菌株BP-171的脱氮特性的影响,在pH为7~8时菌株BP-171对氨态氮、亚硝酸态氮和硝酸态氮均有较高的去除率,特别在pH为7.0左右,菌株BP-171对无机氮的去除效果最佳,对氨态氮、亚硝酸态氮和硝酸态氮的去除率分别为74.02%、55.79%和72.52%。
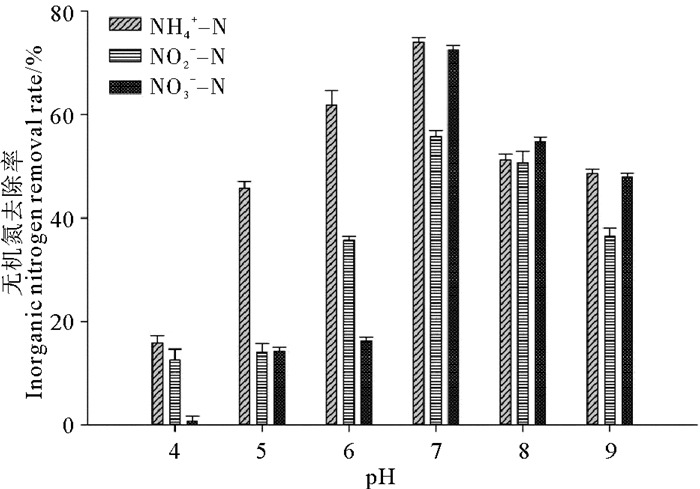
|
图 4 pH对菌株BP-171对无机氮去除的影响 Fig. 4 Effect of pH on the inorganic nitrogen removal capacity of strain BP-171 |
以氯化铵为单一氮源时,空白对照中氨氮和总氮含量实验前后均未发生改变,实验后未检测出亚硝氮、硝氮和有机氮成份,菌株BP-171对降解液中不同形态氮影响如图 5所示。在实验的前两天菌体处于生长对数期,菌体生长迅速,OD600值第二天已达到0.452 3,5天内对氨氮有持续降解效果且去除率达到74.49%;实验过程中亚硝氮未出现积累,但有少许的硝酸态氮的积累。由于预培养细菌的2216E培养液中含有蛋白,所以当把5%菌体量接种到以氨氮为单一氮源的培养液中后,初始菌液中含有一定浓度的有机蛋白氮,但随着细菌的生长,菌体有机氮含量显著增加,菌液中的有机氮含量显著降低;总氮浓度仅有极少量的减少(2.91%),但这可能是由于测量误差导致的。推测菌株在利用氨态氮时主要在于内部的转化,即将NH4+-N转变成菌体有机氮用于自身生长以及转变成少量硝酸态氮,并未有含氮气体从系统中脱除。
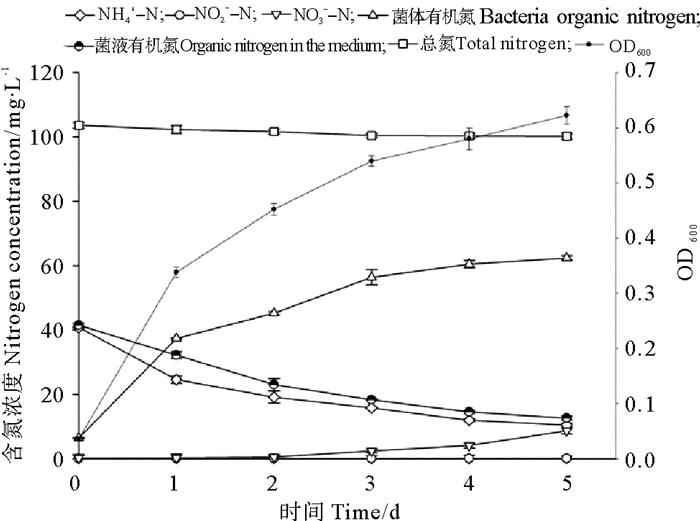
|
图 5 氨氮培养液中各指标的动态变化 Fig. 5 Dynamic changes of each index in the ammonia culture medium |
在以亚硝酸钠为唯一氮源时,空白对照中亚硝氮和总氮含量实验前后均未发生改变,实验后未检测出氨氮、硝氮和有机氮成份,菌株BP-171对降解液中不同形态氮的影响如图 6所示。当以亚硝酸钠为唯一氮源时,菌体BP-171的生长相对较慢。在实验第2天,亚硝酸氮的去除率达到51.21%,而在后3天亚硝态氮含量变化不大,第5天后菌株对亚硝酸态氮去除率为53.61%;实验过程中没有氨氮的积累,实验初期有部分硝酸态氮的积累,之后降解液中的硝酸态氮含量逐渐减少;菌体有机氮随着菌体的生长不断增加,菌液中的有机氮不断减少;降解液中总氮显著降低了23.89%。总体上看,菌株BP-171主要将部分亚硝态氮通过菌体同化,另有部分转变为硝态氮,还有部分氮被从系统中脱除。
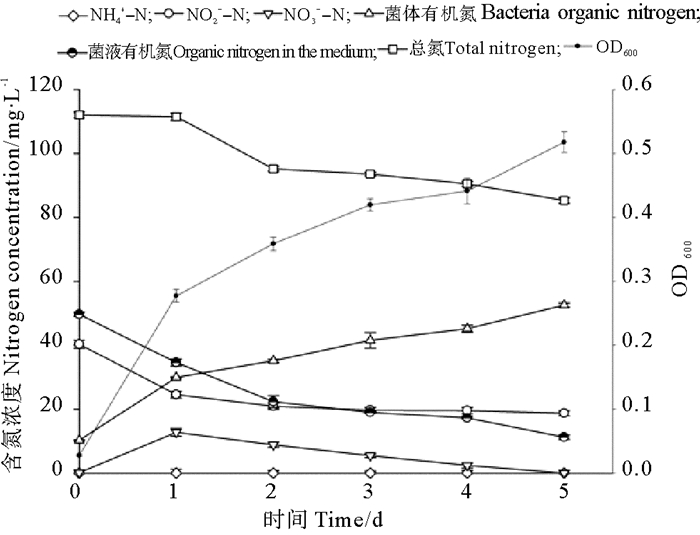
|
图 6 亚硝酸盐氮培养液中各指标的动态变化 Fig. 6 Dynamic changes of each index in the nitrite nitrogen medium |
在以硝酸钠为单一氮源时,空白对照中硝氮和总氮含量实验前后均未发生改变,实验后未检测出氨氮、亚硝氮和有机氮成份,菌株BP-171对降解液中不同形态氮的影响如图 7所示。菌株BP-171对降解液中硝酸态氮去除率高达83.39%,期间伴随少量的氨态氮和亚硝态氮的积累;菌体有机氮有所积累,菌液有机氮则显著减少;总氮含量显著降低30.98%。总体上看,菌株BP-171对无机氮的去除主要通过反硝化作用和菌体生长的同化,以及少量向氨态氮和亚硝态氮的转化。
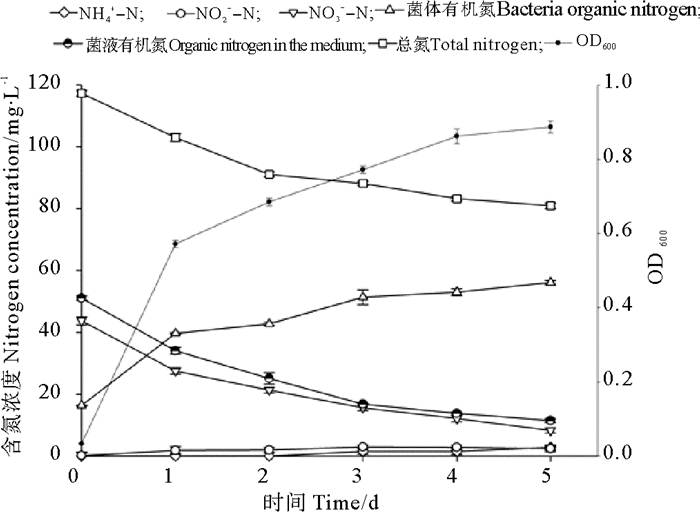
|
图 7 硝酸盐氮培养液中各指标的动态变化 Fig. 7 Dynamic changes of each index in the nitrate nitrogen medium |
在以3种氮源为混合氮源时,空白对照中3种无机氮和总氮含量实验前后均未发生改变,实验后未检测出有机氮成份,菌株BP-171对降解液中不同形态氮的影响如图 8所示。当3种氮源同时存在时,菌株优先利用氨态氮,其次是亚硝态氮,最后是硝态氮。在实验的第一天后菌株对混合氮源中的氨态氮去除率即达97.89%;降解液中亚硝态氮和硝酸态氮浓度均逐渐降低,实验结束时,二者的去除率分别78.73%和46.57%;总氮含量明显减少,总体降低15.14%;随着细菌的生长,菌体有机氮含量增加,但菌液中的有机氮显著降低。
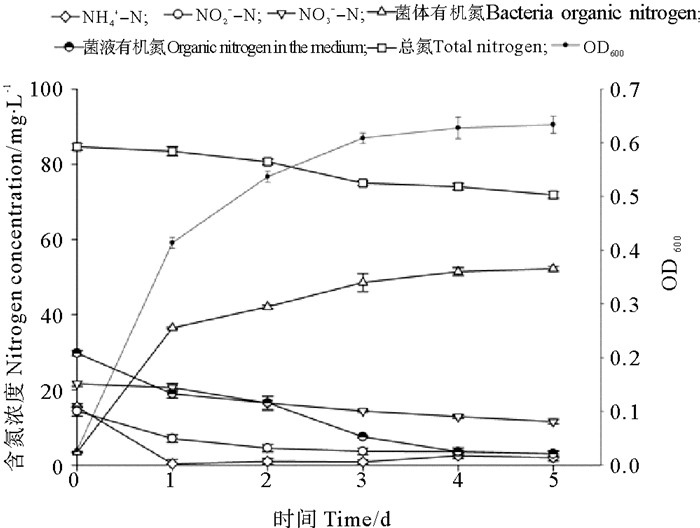
|
图 8 混合三氮源培养液中各指标的动态变化 Fig. 8 Dynamic changes of each index in the three mixed nitrogen medium |
微生物在处理含氮废水中有较大的研究和应用价值,而一株益生菌菌株能否成功应用于生产实践中,不仅需要菌株本身具有较高转化和脱氮性能,也需要其对环境条件具有较宽泛的适应性[9]。本研究所用菌株分离于虾蟹养殖池塘,故测试温度设置在了28℃。在此设置温度条件下,主要研究了碳源、C:N(质量比)、盐度、pH等对菌株BP-171无机氮去除能力的影响。
碳源在菌株的反硝化过程中提供能量和电子,而不同的碳源对应着不同的分子量和空间结构,其能被利用的难易程度也不相同,所以不同碳源下菌株的生长状况和脱氮能力也不同[10-13]。研究发现,位于细胞质膜和细胞壁之间的周质还原酶是起好氧反硝化作用的主要硝酸盐还原酶,其活性大小与添加的碳源还原性有关。安健等[14]的研究结果表明凝结芽孢杆菌(Bacillus coagulans)对小分子碳源乙酸钠和丁二酸钠的利用率相对高于对大分子碳源乳酸、蔗糖和水杨酸钠的利用。但本研究中,当碳源为乙酸钠和乳糖时,菌株BP-171几乎无法体现其乎异养硝化作用和好氧反硝化作用,但在利用蔗糖和葡萄糖作为碳源时,菌株对无机氮的降解效果较好。相比较,蔗糖是非还原性二糖,葡萄糖和乳糖是还原性单糖,可见菌株BP-171对碳源的利用与碳源分子量大小及其还原性并无直接相关关系,这与前人的研究结果并不一致[14]。这表明,不同种属菌株之间对碳源的利用特性也不尽相同,这或许与菌株自身特性存在的差异有关,尚待进一步研究确定。
除了菌株对碳源的利用有显著差异外,细菌异养硝化-好氧反硝化过程中的碳氮比对于菌株脱氮能力的影响也有显著差别。一般来讲,异养菌的生长繁殖通常需要有机物作为碳源和能源,有机碳不足时不利于菌体生长,相应的生理功能也会降低[15]。异养硝化-好氧反硝化菌对C/N的要求也较高, 李卫芬等[10]研究表明,在一定范围内,碳氮比值越高,异养硝化菌的好氧反硝化速率越快。但不同菌种和菌株之间,适宜的碳氮比差异也比较大。例如,施氏假单胞菌( Pseudomonas stutzeri)菌株F1的最佳C/N为5[10],雷氏普罗威登斯菌株(ProvidenciarettgeriYL)为C/N为10[16],而假单胞菌属(Pseudomonas sp.)菌株XS76[1]去除氨氮的最适C/N则为15。本研究发现,菌株BP-171对氨态氮和亚硝酸态氮的去除率在C/N为18时最高,分别为76.88%和48.81%,对硝酸态氮的脱氮率也大大提高,达到78.21%。但当进一步增加C/N到24时,尽管对硝酸态氮的脱氮率显著提高,但对氨态氮和亚硝酸态氮的去除率却显著下降,可能与过多的碳源会嵌入酶结构会导致酶活性降低,进而硝化能力导致下降有关[17]。值得注意的是,在水产养殖水体中,实际上的C/N一般会很低[18],因此关于养殖水体的碳源种类选择、碳源的添加方式乃至水处理的工艺等方面均尚需进一步加强研究。
pH也是影响不同脱氮菌株对氮转化和脱除性能的重要环境因子之一。Gupta等[19]研究表明,当pH为中性或偏弱碱性时细菌的生长及反硝化酶活性最强,pH过高或过低都不利于菌株生长及反硝化性能的发挥,王弘宇等[20]和廖绍安等[21]的研究也同样表明,pH为中性条件最有利于菌株生长及反硝化性能的发挥,这与本研究结果一致。本研究结果显示在pH为7~8时菌株BP-171对氨态氮、亚硝酸态氮、硝酸态氮均有较高的去除率,特别在pH为7.0左右脱氮效果最佳,对氨态氮、亚硝酸态氮和硝酸态氮的去除率分别为74.02%、55.79%和72.52%。
微生物可以通过渗透压调节自身新陈代谢,因而对盐度有一定的适应能力[22],但不同菌株对盐度的适应能力也存在较大差异。本研究中菌株BP-171分离自海水虾蟹养殖池塘,可以看出对盐度的适应范围较宽,在0~60范围内均可生长,在盐度20~40条件下,对氨态氮、亚硝酸态氮、硝酸态氮均有较好的去除率。但相比较,以盐度为30时菌株BP-171对氨态氮、亚硝酸态氮和硝酸态氮去除效果最好,最高去除率分别为72.00%、53.95%和71.48%。可以看出,本研究中的短小芽孢杆菌BP-171是一株比较适宜海水养殖水体无机氮去除中应用的益生菌。
3.2 不同氮源对菌株BP-171的无机氮去除能力的影响目前研究中比较认可的氨氮的异养硝化途径主要有两种[23-25]:一种是NH4+-N经AMO氧化为NH2OH,再经HAO氧化为NO2--N和NO3--N;另一种是NH2OH直接转化为N2O和N2。而本研究发现,在以氨态氮为唯一氮源时,随着氨态氮浓度的显著降低,降解液中菌体有机氮浓度迅速增加,表明菌株BP-171对氨态氮去除作用可能主要在于菌体的同化作用,也就是菌株在生长、繁殖过程中通过同化将NH4+-N大量利用,转变为菌体蛋白氮。与此同时,尽管未产生NO2--N的积累,但确有少许硝酸态氮积累,降解液中总氮浓度在误差允许范围内,几乎没变。由此推测,菌株在以氨氮为唯一氮源时,主要通过同化将NH4+-N转变为菌体蛋白氮,同时转化为了少量的NO3--N,但未产生含氮气体从降解液中脱除。当以亚硝酸钠为唯一氮源时,菌株BP-171对亚硝酸态氮5天的累积去除率为53.61%。反应过程中没有发现氨态氮的积累,但是有明显的硝酸态氮的积累,说明亚硝酸盐被氧化为了硝酸盐,证实了异养硝化作用的存在[26]。与此同时,还观察到降解液中总氮含量显著降低了23.89%,表明部分积累的硝酸盐可能被还原成气态氮排出了系统,也就是说发生了好氧反硝化作用。这一结果与孙庆花[23]和梁贤[27]等的研究结果有所差异,这可能与菌株BP-171自身特性有关。
而以硝酸盐为唯一氮源时,降解液中硝酸态氮去除率高达83.39%,总氮含量则显著降低了30.98%,期间伴随少量的氨态氮和亚硝态氮的积累,表明部分NO3--N的可能还原为NO2--N,部分还原为气态氮溢出系统。这一结果说明在以硝酸盐为唯一氮源时,菌株BP-171可能发生了明显的好氧反硝化作用[28]。也就是说,菌株BP-171对无机氮的去除主要通过反硝化作用和菌体生长的同化,以及少量向氨态氮和亚硝态氮的转化。
本研究还测试了以氨态氮、亚硝态氮和硝态氮3种氮源同时存在时菌株BP-171无机氮去除特性。从利用程度看,对氨态氮的去除效率高于以氯化铵为唯一氮源的情况,在实验的第一天后菌株对混合氮源中的氨态氮几乎全部去除,去除率已高达97.89%;对亚硝酸氮的去除效率也高于以亚硝酸钠为唯一氮源的情况,去除率最高可达53.61%。这表明硝酸盐的加入促进菌体对氨氮以及亚硝氮的代谢。可以看出,当3种氮源同时存在时,菌株BP-171会同时利用三者进行同步异养硝化-好氧反硝化作用[23, 29-30]。不过相比较,在多氮源存在的情况下,菌株BP-171对硝酸盐的去除率有所降低,硝酸态氮的降解率总体低于以硝酸钠为唯一氮源的情况(46.57%和83.39%)。可以看出,由于氨态氮与亚硝态氮的存在,菌株对硝酸态氮的利用主要发生在实验后3天。降解液中总氮的减少与硝态氮的减少步调基本一致,因此,推测降解液总氮的减少是由于菌株利用硝酸态氮进行反硝化作用产生了气态形式的氮,如N2O或N2。不过,具体产生了何种气体还需要进一步研究确定。
4 结论(1) 短小芽孢杆菌菌株BP-171是一株异养硝化-好氧反硝化菌。
(2) 在温度28 ℃条件下,菌株BP-171在碳源为葡萄糖、C/N=18、盐度20~40和pH=7.0~8.0条件下对降解液中无机氮有较好的去除作用。
(3) 菌株BP-171对无机氮的转化和去除包括菌体细胞的同化作用、异养硝化作用和好氧反硝化作用等生物学过程,不同氮源条件下具体机制有所差异。
| [1] |
吴建江, 王兆阳, 许培雅. 一株高效异养硝化菌的分离、鉴定及其氨氮去除特性[J]. 中国环境科学, 2013, 33(7): 1309-1315. Wu J J, Wang Z Y, Xu P Y. Isolation and identification of an efficiently heterotrophic nitrifier, and its removal characterization of ammonia nitrogen[J]. China Environmental Science, 2013, 33(7): 1309-1315. (  0) 0) |
| [2] |
曾庆梅, 司文攻, 李志强, 等. 一株高效异养硝化菌的选育、鉴定及其硝化条件[J]. 微生物学报, 2010, 50(6): 803-810. Zeng Q M, Si W G, Li Z Q, et al. Isolation, identification and characterization of a high efficient heterotrophic nitrifier[J]. Acta Microbiologica Sinica, 2010, 50(6): 803-810. (  0) 0) |
| [3] |
Ahn Y H. Sustainable nitrogen elimination biotechnologies: A review[J]. Process Biochemistrry, 2006, 41(8): 1709-1721. DOI:10.1016/j.procbio.2006.03.033
(  0) 0) |
| [4] |
何霞, 赵彬, 吕剑, 等. 异养硝化细菌Bacillus sp.LY脱氮性能研究[J]. 环境科学, 2007, 28(6): 1404-1408. He X, Zhao B, He Y L, et al. Nitrogen removal by Bacillus sp.LY with heterotrophic nitrification ability[J]. Environmental Science, 2007, 28(6): 1404-1408. DOI:10.3321/j.issn:0250-3301.2007.06.042 (  0) 0) |
| [5] |
孙雪梅, 李秋芬, 张艳, 等. 一株海水异养硝化-好氧反硝化菌系统发育及脱氮特性[J]. 微生物学报, 2012, 52(6): 687-695. Sun X M, Li Q F, Zhang Y, et al. Phylogenetic analysis and nitrogen removal characteristicsof a heterotrophic nitrifying-aerobic denitrifying bacteriastrain from marine environment[J]. Acta Microbiologica Sinica, 2012, 52(6): 687-695. (  0) 0) |
| [6] |
雷衍之. 养殖水环境化学实验[M]. 北京: 中国农业出版社, 2006: 31-35. Lei Y Z. The Chemical Experiment of Water in Aquaculture Environment[M]. Beijing: China Agriculture Press, 2006: 31-35. (  0) 0) |
| [7] |
王红卫, 赵新鲜, 张晶. 紫外分光光度计测定水中硝酸盐氮方法的探讨[J]. 水利技术监督, 2007(4): 4-5. Wang H W, Zhao X X, Zhang J. Determine of the nitrate nitrogen in water by ultraviolet speetrophotometry[J]. Water Conservancy and Technical Supervision, 2007(4): 4-5. DOI:10.3969/j.issn.1008-1305.2007.04.002 (  0) 0) |
| [8] |
薛爱群, 贾锋, 齐顺章.细菌总蛋白含量测定方法的改进[J].微生物学通报, 1994(1): 58-59. Xue A Q, J, Q. Improvement of determination method for baeterial total proteins[J]. Microbiology China, 1994(1): 58-59. http://www.cnki.com.cn/Article/CJFDTotal-WSWT401.018.htm (  0) 0) |
| [9] |
李秋芬, 有小娟, 张艳, 等. 象山港中部养殖区细菌群落结构的特征及其在生境修复过程中的变化[J]. 中国水产科学, 2013, 20(6): 1234-1246. Li Q F, You X J, Zhang Y, et al. Changes in the characteristics of the bacterial community structureduring habitat restoration of aquaculture sites in Xiangshan Bay[J]. Journalof Fishery Sciences ofChina, 2013, 20(6): 1234-1246. (  0) 0) |
| [10] |
李卫芬, 傅罗琴, 邓斌, 等. 1株好氧反硝化菌的分离鉴定及反硝化特性研究[J]. 环境科学, 2011, 32(8): 2403-2408. Li W F, Fu L Q, Deng B, et al. Identification and denitrification characteristics of an aerobic denitrifier[J]. Environmental Science, 2011, 32(8): 2403-2408. (  0) 0) |
| [11] |
姜磊, 徐成斌, 马溪平, 等. 1株好氧反硝化菌的分离鉴定和反硝化特性研究[J]. 环境科学与技术, 2013, 36(3): 12-15. Jiang L, Xu C B, Ma X P, et al. Identification and denitrification characteristics of an aerobic denitirfier[J]. Environmental Science & Technology, 2013, 36(3): 12-15. (  0) 0) |
| [12] |
陈玲, 白洁, 赵阳国, 等. 分离于河口区芦苇湿地1株好氧反硝化菌的鉴定及其反硝化特性[J]. 微生物学报, 2016, 56(8): 1314-1325. Chen L, Bai J, Zhao Y G, et al. Identification and denitrification characteristics of an aerobicdenitrifier in estuary phragmites wetland[J]. Acta Microbiologica Sinica, 2016, 56(8): 1314-1325. (  0) 0) |
| [13] |
李兵, 林炜铁. 1株好氧反硝化芽孢杆菌的脱氮特性研究[J]. 水生态学杂志, 2009, 30(3): 48-52. Li B, Lin W T. Study on aerobic denitrification characteristics of bacillus strain D5[J]. Journal of Hydroecology, 2009, 30(3): 48-52. (  0) 0) |
| [14] |
安健, 宋增福, 杨先乐, 等. 好氧反硝化细菌YX-6特性及鉴定分析[J]. 中国水产科学, 2010, 17(3): 561-569. An J, Song Z F, Yang X L, et al. Characteristics of aerobic denitrifying strain YX-6 and identification[J]. Journal of Fishery Sciences of China, 2010, 17(3): 561-569. (  0) 0) |
| [15] |
鲜思淑, 陈茂霞, 熊蓉, 等. 异养硝化-好氧反硝化影响因素研究进展[J]. 水处理技术, 2016, 42(1): 1-6. Xian S S, Chen M X, Xiong R, et al. Research advances of heterotrophic nitrification-aerobic denitrification under different factors[J]. Technology of Water Treatment, 2016, 42(1): 1-6. (  0) 0) |
| [16] |
席星林, 潘玉洁. 基于环境因子的异养硝化菌Providenciarettgeristrain YL脱氮性能研究[J]. 环境工程, 2014, 32(S1): 144-147. Xi X L, Pan Y J. The denitrification performance study of heterotrophic nitrifying bacteria Providencia rettgeri strain YL based on environmental factors[J]. Environmental Engineering, 2014, 32(S1): 144-147. (  0) 0) |
| [17] |
宋宇杰, 李屹, 刘玉香, 等. 碳源和氮源对异养硝化好氧反硝化菌株Y1脱氮性能的影响[J]. 环境科学学报, 2013, 33(9): 2491-2497. Song YJ, Li Y, Liu YX, et al. Effect of carbon and nitrogen sources on nitrogen removal by a heterotrophicnitrification-aerobic denitrificationstrain Y1[J]. Acta Scientiae Circumstantiae, 2013, 33(9): 2491-2497. (  0) 0) |
| [18] |
陈月, 郭亮, 孙美. 好氧颗粒污泥对污泥碳源的反硝化出水处理效果[J]. 中国海洋大学学报(自然科学版), 2017, 47(9): 104-109. Chen Y, Guo L, Sun M. Study on effect of aerobic granules treatment on denitrification effluent used sludge hy-drolysate as carbon sources[J]. Periodical of Ocean University of China, 2017, 47(9): 104-109. (  0) 0) |
| [19] |
Gupta A B. Thiosphaerapantotropha: A sulphur bacterium capable of simultaneous heterotrophic nitrification and aerobic denitrification[J]. Enzyme and Microbial Technology, 1997, 21(8): 589-595. DOI:10.1016/S0141-0229(97)00070-7
(  0) 0) |
| [20] |
王弘宇, 马放, 苏俊峰, 等. 好氧反硝化菌株的鉴定及其反硝化特性研究[J]. 环境科学, 2007(7): 1548-1552. Wang H Y, Ma F, Su J F, et al. Identification and characterization of a bacterial strain C3 capable of aerobic denitrification[J]. Environmental Science, 2007(7): 1548-1552. DOI:10.3321/j.issn:0250-3301.2007.07.025 (  0) 0) |
| [21] |
廖绍安, 郑桂丽, 王安利, 等. 养虾池好氧反硝化细菌新菌株的分离鉴定及特征[J]. 生态学报, 2006(11): 3718-3724. Liao S A, Zheng G L, Wang A L, et al. Isolation and characterization of a novel aerobic denitrifier from shrimp pond[J]. Acta Ecologica Sinica, 2006(11): 3718-3724. DOI:10.3321/j.issn:1000-0933.2006.11.026 (  0) 0) |
| [22] |
张彦灼, 李军, 陈光辉, 等. NaCl对好氧颗粒污泥短程硝化反硝化的影响[J]. 环境科学研究, 2015, 28(5): 823-830. Zhang YZ, Li J, Chen GH, et al. Effects of NaCl concentration on partial nitrification and denitrification by aerobic granular sludge[J]. Research of Environmental Sciences, 2015, 28(5): 823-830. (  0) 0) |
| [23] |
孙庆花, 于德爽, 张培玉, 等. 1株海洋异养硝化-好氧反硝化菌的分离鉴定及其脱氮特性[J]. 环境科学, 2016, 37(2): 647-654. Sun Q H, Yu D S, Zhang P Y, et al. Identification and nitrogen removal characteristics of a heterotrophic nitrification-aerobic denitrification strainIsolated from marine environment[J]. Environmental Science, 2016, 37(2): 647-654. (  0) 0) |
| [24] |
Zhang Qing Ling, Liu Ying, Ai Guo Min, et al. The characteristics of a novel heterotrophic nitrification-aerobic denitrification bacterium, Bacillus methylotrophicus strain L7[J]. Bioresource Technology, 2012, 108: 35-44. DOI:10.1016/j.biortech.2011.12.139
(  0) 0) |
| [25] |
Soumesh Kumar Padhi, Nikhil Kumar Maiti. Molecular insight into the dynamic central metabolic pathways of Achromobacter xylosoxidans CF-S36 during heterotrophic nitrogen removal processes[J]. Journal of Bioscience and Bioengineering, 2017, 123(1): 46-55. DOI:10.1016/j.jbiosc.2016.07.012
(  0) 0) |
| [26] |
Zheng Hai-Yan, Liu Ying, Gao Xi-Yan, et al. Characterization of a marine origin aerobic nitrifying-denitrifying bacterium[J]. Journal of Bioscience and Bioengineering, 2012, 114(1): 33-37. DOI:10.1016/j.jbiosc.2012.02.025
(  0) 0) |
| [27] |
梁贤, 任勇翔, 杨垒, 等. 异养硝化-好氧反硝化菌YL的脱氮特性[J]. 环境科学, 2015, 36(5): 1749-1756. Liang X, Ren Y X, Yang L, et al. Characteristics of nitrogen removal by a heterotrophic nitrification-aerobic denitrification bacterium YL[J]. Environmental Science, 2015, 36(5): 1749-1756. (  0) 0) |
| [28] |
Richardson D J, Wehrfritz J M, Keech A. The diversity of redox proteins involved in bacterial heterotrophic nitrification and aerobic denitrification[J]. Biochemical Society Transactions, 1998, 26(3): 401-408. DOI:10.1042/bst0260401
(  0) 0) |
| [29] |
Stewart V. Nitrate respiration in relation to facultative metabolism in enterobacteria[J]. Microbiological Reviews, 1988, 52(2): 190-232.
(  0) 0) |
| [30] |
闫法军, 田相利, 董双林, 等. 一株低温降解菌的分离鉴定及其降解特性研究[J]. 中国海洋大学学报(自然科学版), 2011, 41(3): 24-30. Yan F J, Tian X L, Dong S L, et al. Isolation, Identification and characterization of a low-temperature degrading bacterium[J]. Periodical of Ocean University of China, 2011, 41(3): 24-30. (  0) 0) |
2. Key Laboratory of Qingdao Marine science and technology, Qingdao 266237, China
 2019, Vol. 49
2019, Vol. 49


