危险化学品因具有毒性、腐蚀、爆炸和燃烧风险而对生态系统和人类健康威胁很大[1]。随着工业化的发展,全球海上危险化学品运输数量和危险化学运输船数量不断增加,相应的,因装卸作业以及海上碰撞、搁浅而造成的海上危险化学品泄漏的风险也不断增加。近年来,全球已发生了数百起危险化学品泄漏到海洋环境中的事故[2]。在全球经海上运输的2 000多种化学品中,有机化学品的运输量、频次明显多于无机化学品,且其泄漏后会造成更严重的海洋生态损害[3]。为了评估危险化学品海上泄漏所造成的风险,研究其对海洋生物的毒性效应尤为重要。
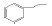
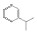
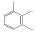
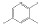
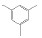
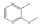
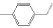
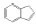
碳九芳烃(C9芳烃)是石油原料经催化重整与裂解生成乙烯的副产品中含有9个碳原子芳烃的馏分,主要组分有异丙苯(i-PBZ)、正丙苯(n-PBZ)、2-乙基甲苯(2-ET)、3-乙基甲苯(3-ET)、4-乙基甲苯(4-ET)、均三甲苯(1, 3, 5-TMB)、偏三甲苯(1, 2, 4-TMB)、邻三甲苯(1, 2, 3-TMB)和茚(Ind)。其中,丙苯、三甲苯和乙基甲苯等均为重要的化工生产原料,例如,正丙苯主要用于生产油漆、涂料和溶剂[4]; 异丙苯是合成苯酚、丙酮和苯乙酮等有机物的重要原料,并可用作表面活性剂、阻垢剂、搪瓷稀释剂、航空燃料[5]; 均三甲苯和偏三甲苯主要用于制造油漆稀释剂、有机溶剂和清洁剂[6]; 乙基甲苯则在生产油漆催干剂、木材防腐剂、合成洗涤剂、杀虫剂、大孔径阴离子交换树脂等方面应用广泛[7]。
这些组分在工业生产中的大量应用,很可能导致其随着工业废水排入地表水、地下水中,最终进入海洋。例如,中国辽河水系的太子河河水中三甲苯、丙苯的浓度分别约为0.2~3和0.05~0.1 μg/L[8]。德国首都柏林西北部斯潘道区的地下水中,1, 3, 5-TMB、1, 2, 4-TMB和1, 2, 4-TMB的浓度分别为0.08~0.36、0.4~1.3和0.2~0.5 mg/L[9]。胶州湾海水中i-PBZ、n-PBZ、1, 3, 5-TMB、1, 2, 4-TMB的浓度范围分别为8.4~73.1、6.9~79.4、10.9~35.9、10.0~38.0 ng/L[10]。当发生海上泄漏事故时,大量C9芳烃将在短时间内直接入海,引起海水中C9芳烃浓度激增。例如,2018年11月福建泉港区C9芳烃泄漏事故中,约69.1 t工业用裂解C9芳烃进入该区域海水中。虽然至今尚无该海域C9芳烃各组分浓度的相关报道,但是这种泄漏事故曾对当地海洋生态和环境造成严重影响[11]。根据美国国家海洋和大气管理局(NOAA)的“化学品水环境归宿及其效应数据库”[12],25 ℃下C9芳烃各组分的溶解度大多处于48.2~75.2 mg/L之间(茚为248.6 mg/L),由此估计,泄漏事故附近海水中C9芳烃各组分的初始浓度应在每升几十毫克左右。为有效应对未来C9芳烃泄漏对海洋生态安全的威胁,必须确定其中的各种组分对于海洋生物的毒性,以便为针对高毒组分开发生物修复技术提供依据,同时,各种组分的生物毒性也是海洋生态风险评价所必需的基础信息。
微藻是海洋生态系统中最重要的初级生产者,是构成海洋食物链的基础,同时,因为微藻对污染物具有很高敏感性,所以常被作为化学品毒理学和环境风险研究的试验生物[13]。但是,目前有关C9芳烃对海洋生物的毒性研究仅限于少数鱼类和甲壳类动物:i-PBZ对杂色鳉(Cyprinodon variegatus)的96 h半致死浓度(96 h LC50)为4.7 mg/L[14],i-PBZ对卤虫(Artemia sp.)的48 h半效应浓度(48 h EC50)为7.4 mg/L[15]; 1, 2, 4-TMB对邓杰内斯蟹(Cancer magister)和梳齿片钩虾(Elasmopus pectenicrus)的96 h LC50分别为5.1 mg/L[5]和4.35 mg/L[16]。然而,有关C9芳烃各组分对海洋微藻的急性毒性研究尚为空白。本研究拟以三角褐指藻(Phaeodactylum tricornutum)和中肋骨条藻(Skeletonema costatum) 作为试验生物,通过生长抑制试验测定C9芳烃各组分对这2种海洋硅藻的96 h半效应浓度(96 h EC50),为评价C9芳烃的海洋生态风险和进行污染海域的生物修复提供基础数据和科学依据。
1 材料与方法 1.1 材料海水:取自青岛市沙子口海域(pH=7.90、盐度32),经0.45 μm醋酸纤维滤膜过滤,于高压灭菌锅中灭菌(121 ℃、20 min)后冷却备用。
试剂:C9芳烃9种组分(i-PBZ,大于99.0%;n-PBZ,大于99.0%;2-ET,大于99.0%;3-ET,大于98.0%;4-ET,大于97.0%;1, 2, 3-TMB,大于97.0%;1, 2, 4-TMB,大于98.0%;1, 3, 5-TMB,大于80.0%;Ind,大于98.0%),均为色谱纯,购自梯希爱化工有限公司。它们的主要理化性质列于表 1中。
|
|
表 1 碳九芳烃9种组分的理化性质[5, 12] Table 1 Physico-chemical properties of the nine components of C9 aromatics[5, 12] |
用于配制F/2培养基的试剂中,除VB12、VB1和生物素(生化试剂,购自上海恒远生物科技有限公司)外,均为分析纯(购自上海源叶生物科技有限公司)。N, N-二甲基甲酰胺(DMF,色谱纯),购自天津市科密欧化学试剂有限公司。分析纯NaHCO3购自上海源叶生物科技有限公司。
C9芳烃各组分的储备液:分别称取一定质量的C9芳烃各组分,用DMF溶解并定容,得到储备液(100 mg/mL),经0.22 μm尼龙滤膜过滤后避光密封,现用现配。
微藻:中肋骨条藻和三角褐指藻均由中国海洋大学微藻种质库提供。这2种硅藻均为美国国家环保局(USEPA)《生态效应试验指南:藻毒性》中指定的试验藻种[17]。硅藻在海洋中分布非常广泛,其中,中肋骨条藻和三角褐指藻因为其易于培养、对有机化合物敏感性高而成为研究时污染物毒性经常使用的模式海洋藻种[18-21]。每种微藻均采用F/2培养基[22]在温度20 ℃、光强60 μmol/(m2·s)、光暗周期14 h∶10 h的条件下预培养2周至指数生长期。
1.2 方法对于每种组分,根据预试验结果,采用等对数间距法设置5个暴露浓度(见表 2)。同时设置空白对照组(不含DMF和任何C9组分)。参照USEPA的方法[17]:首先将培养至指数生长期的微藻接种于含20 mL培养基的50 mL样品瓶中,其中,三角褐指藻和中肋骨条藻的初始接种密度分别为5×104和1×104 cells/mL。由于后续暴露培养期间样品瓶处于完全密封状态,因此,向培养基中加入NaHCO3(初始浓度为500 mg/L),作为藻细胞生长的无机碳源[23]。然后,准确加入一定体积的该组分储备液,使其在培养基中的浓度达到表 2的设计水平,立即密封。由此引入每个处理组的DMF浓度(v/v)均小于0.01%(预试验发现,培养96 h期间,培养基中DMF浓度低于该水平时对微藻生长无显著影响)。对照组为不加C9组分储备液但接种同样密度微藻的培养基。对照组和各处理组均设12个重复。在培养箱中连续培养(条件同预培养),每天定时摇瓶3次,并随机更换样品瓶的位置。在培养开始后的24、48、72和96 h,各取出3瓶,用流式细胞仪(BD Accuri C6 Plus型, 美国BD公司)测定其中的藻细胞密度。
|
|
表 2 生长抑制试验中C9芳烃各主要组分的浓度设置 Table 2 Concentrations of the nine components of C9 aromatics in the growth inhibition assays |
对于每种C9组分,根据对照组和各处理组96 h期间的藻细胞密度变化,分别绘制微藻生长曲线,并计算各生长曲线下的面积,进而计算得到不同处理组中微藻的生长抑制率(IR)。建立各组分的浓度对数值(X)与概率单位(Y,由IR转化得到)的直线回归方程,则概率单位为5.0时对应的组分浓度即为其96 h EC50值。
1.4 比生长速率(r)计算按公式(1)计算暴露于C9芳烃每种组分96 h期间的微藻比生长速率(r):
| $ r=\frac{\ln b_2-\ln b_1}{t_2-t_1} 。$ | (1) |
式中:b2和b1分别为t2和t1时刻的藻细胞密度(cells/mL)。
1.5 数据统计分析每个处理组、对照组的藻细胞密度均以3个重复试验结果的平均值±标准差(Mean±SD)表示。采用SPSS 17.0软件进行单因素分析,首先采用方差同质性检验进行判断,根据方差是否齐性分别采用Tukey检验或Games-Howell检验进行差异性检验,显著性水平为P < 0.05。
2 结果 2.1 n-PBZ和i-PBZ对2种微藻生长的影响2种微藻暴露于n-PBZ和i-PBZ后的生长曲线和比生长速率变化见图 1。对照组中,三角褐指藻、中肋骨条藻均呈现良好的指数生长态势,但是,在处理组中,随着n-PBZ或i-PBZ的浓度增大,微藻的生长趋势减弱。
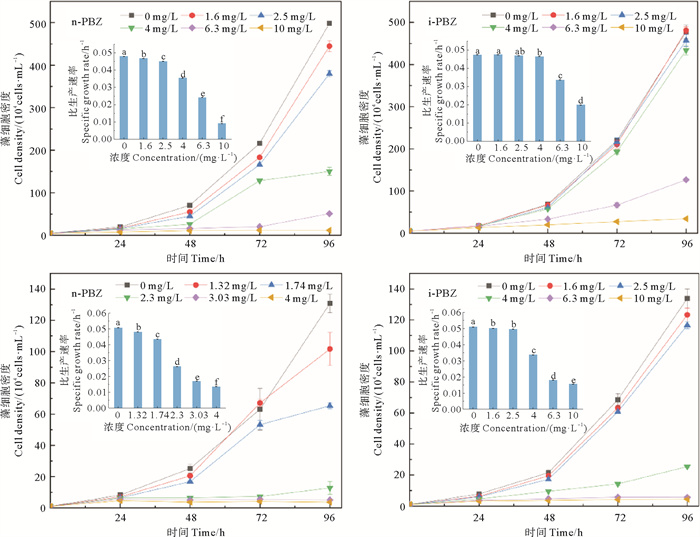
|
(字母不同代表具有显著性差异(P < 0.05, n=3)。Different letters denote statistical significance (P < 0.05, n=3). ) 图 1 三角褐指藻(上)和中肋骨条藻(下)暴露于n-PBZ和i-PBZ的生长曲线和比生长速率(内嵌图) Fig. 1 Growth curves of P. tricornutum (upper) and S. costatum (lower) exposed to n-PBZ and i-PBZ respectively, and their specific growth rates (inner set diagram) |
对于三角褐指藻(见图 1),在n-PBZ浓度为1.6 mg/L(最低值) 和10 mg/L(最高值)的处理组中,培养96 h后的细胞密度(444.72×104和11.95×104 cells/mL)分别为同期对照组的89.2%和2.4%。i-PBZ浓度≤2.5 mg/L时,对微藻生长的抑制作用较小,而较高浓度处理组中微藻生长受到较大抑制,10.0 mg/L处理组的最终藻细胞密度(34.13×104 cells/mL)降为同期对照组的7.8%。r值也表明,n-PBZ和i-PBZ的浓度分别达到1.6和4.0 mg/L时,微藻生长开始受到明显抑制(P < 0.05)。
对于中肋骨条藻(见图 1),在试验设置的n-PBZ和i-PBZ浓度范围内,培养96 h后的藻细胞密度均低于对照组,其中,最低浓度组(1.32和1.6 mg/L)的藻细胞密度分别为对照组的77.7%和92.1%;最高浓度组(4.0和10.0 mg/L)的藻细胞密度分别仅为对照组的2.8%和3.3%。r值表明,所有浓度的n-PBZ和i-PBZ均能显著抑制微藻生长。
2.2 3种乙基甲苯对2种微藻生长的影响图 2显示了2种硅藻暴露于3种乙基甲苯后的生长曲线和比生长速率。当2-ET、3-ET和4-ET浓度分别为1.6、2.5和2.5 mg/L时,三角褐指藻生长开始受到显著抑制(P < 0.05),在最高浓度(10 mg/L)处理组中,该微藻几乎不能生长,r值分别为0.006、0.018和0.017 h-1,为对照组的12.8%、38.1%和36.1%。
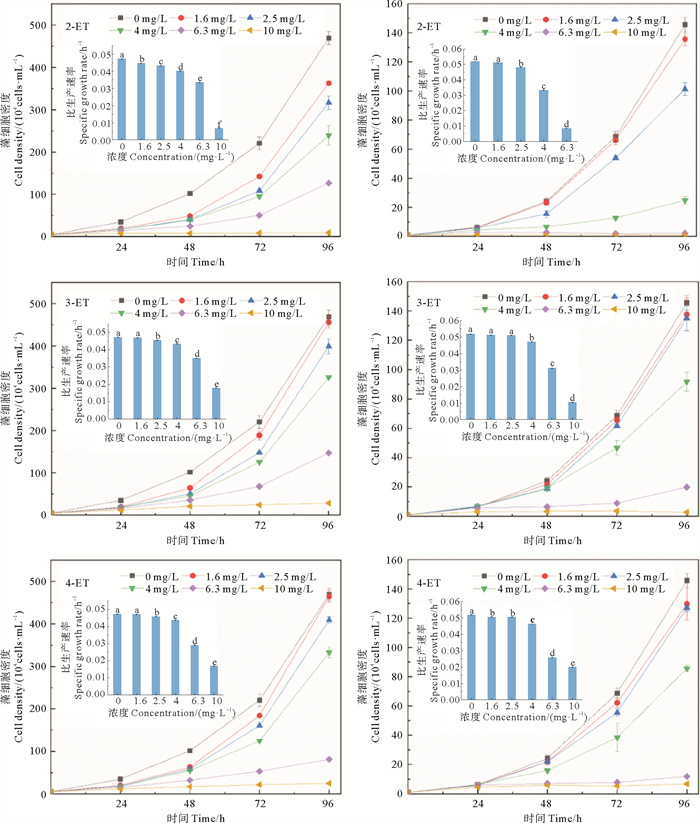
|
(字母不同代表具有显著性差异(P < 0.05, n=3)。Different letters denote statistical significance (P < 0.05, n=3). ) 图 2 三角褐指藻(左)和中肋骨条藻(右)暴露于3种乙基甲苯后的生长曲线和比生长速率(内套图) Fig. 2 Growth curves of P. tricornutum (left) and S. costatum (right) exposed to three ethyltoluene isomers respectively, and their specific growth rates (inner set diagram) |
在2-ET浓度大于2.5 mg/L、3-ET浓度大于4.0 mg/L、4-ET浓度大于1.6 mg/L时,其明显抑制中肋骨条藻生长(P < 0.05),最高浓度(10 mg/L)处理组的r值(0.001、0.010和0.020 h-1)分别为对照组的1.5%、19.1%和38.4%。
2.3 3种三甲苯对2种微藻生长的影响3种三甲苯对三角褐指藻生长均表现出抑制作用(见图 3),但是影响程度不同。例如,1, 2, 3-TMB、1, 2, 4-TMB和1, 3, 5-TMB浓度同为6.3 mg/L时,培养96 h后的藻细胞密度(5.31×104、99.70×104和201.02×104 cells/mL)分别为同期对照组的1.1%、20.0%和40.3%;当浓度升至10 mg/L时,培养结束时藻细胞密度(4.94×104、27.70×104和87.58×104 cells/mL)分别为同期对照组的1.0%、5.6%和17.6%。r值也显示,该微藻的生长随着三甲苯浓度增大而明显减弱,特别是,暴露于上述2个高浓度(6.3和10 mg/L)的1, 2, 3-TMB后,微藻几乎未见任何生长,以至于无法计算其r值。比较图 3中的r值可知,三者对三角褐指藻生长的抑制程度由大到小依次为:1, 2, 3-TMB>1, 2, 4-TMB>1, 3, 5-TMB。
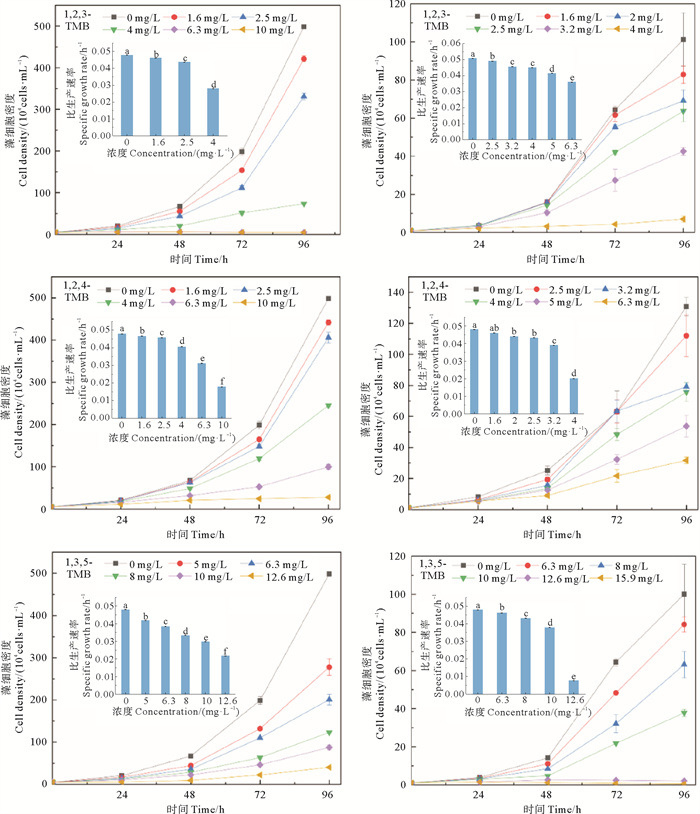
|
(字母不同代表具有显著性差异(P < 0.05, n=3)。Different letters denote statistical significance (P < 0.05, n=3). ) 图 3 三角褐指藻(左)和中肋骨条藻(右)暴露于3种三甲苯后的生长曲线和比生长速率(内套图) Fig. 3 Growth curves of P. tricornutum (left) and S. costatum (right) exposed to three trimethylbenzene isomers respectively, and their specific growth rates (inner set diagram) |
3种三甲苯对中肋骨条藻生长的抑制程度也不尽相同。例如,暴露于4.0 mg/L的1, 2, 3-TMB和1, 2, 4-TMB时,培养96 h后的藻细胞密度(7.03×104和75.73×104 cells/mL)分别降为同期对照组的7.0%和57.9%;而暴露于浓度同为6.3 mg/L的1, 2, 4-TMB和1, 3, 5-TMB后,培养结束时藻细胞密度(31.70×104和84.17×104 cells/mL)分别降为同期对照组的24.2%和84.1%。随着暴露浓度增大(例如,1, 3, 5-TMB浓度为15.9 mg/L时),微藻在培养期间完全停止生长。比较三者在相同浓度下的微藻r值同样可知,1, 2, 3-TMB对中肋骨条藻生长的抑制程度最大,其次为1, 2, 4-TMB和1, 3, 5-TMB。
2.4 Ind对2种微藻生长的影响暴露于Ind的2种微藻的生长曲线及其比生长速率如图 4所示。在试验设置的浓度范围内,微藻的生长均受到Ind的抑制,较高暴露浓度下微藻均生长缓慢。当Ind的浓度增至6.3和10.0 mg/L时,三角褐指藻的r值分别降至对照组的34.3%和2.6%;中肋骨条藻的r值分别降至对照组的18.1%和3.7%。
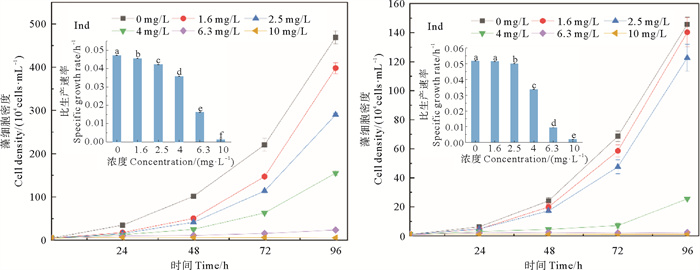
|
(字母不同代表具有显著性差异(P < 0.05, n=3)。Different letters denote statistical significance (P < 0.05, n=3). ) 图 4 三角褐指藻(左)和中肋骨条藻(右)暴露于Ind后的生长曲线和比生长速率(内套图) Fig. 4 Growth curves of P. tricornutum (left) and S. costatum (right) exposed to Ind respectively, and their specific growth rates (inner set diagram) |
根据图 1~图 4中的微藻生长曲线,按照本文1.3节的方法,计算得到C9芳烃的各种组分对三角褐指藻和中肋骨条藻的96 h EC50值(见表 3和表 4)。
|
|
表 3 C9芳烃9种组分对三角褐指藻的96 h EC50值 Table 3 The 96 h EC50 values of each component of C9 aromatics for P. tricornutum |
|
|
表 4 C9芳烃9种组分对中肋骨条藻的96 h EC50值 Table 4 The 96 h EC50 values of the main components of C9 aromatics for S. costatum |
9种组分对2种海洋微藻的96 h EC50值均在1.97~8.36 mg/L之间。据此,它们对三角褐指藻的毒性顺序为:Ind(2.51 mg/L)>1, 2, 3-TMB(2.70 mg/L)>2-ET(2.96 mg/L)>n-PBZ(3.51 mg/L)>4-ET(4.02 mg/L)>3-ET(4.12 mg/L)>1, 2, 4-TMB(4.32 mg/L)>i-PBZ(5.88 mg/L)>1, 3, 5-TMB(6.11 mg/L); 而对中肋骨条藻的毒性顺序为:n-PBZ(1.97 mg/L)>1, 2, 3-TMB(2.77 mg/L)>Ind(2.93 mg/L)>2-ET(3.12 mg/L)>i-PBZ(3.50 mg/L)>4-ET(4.20 mg/L)>3-ET(4.39 mg/L)>1, 2, 4-TMB(4.89 mg/L)>1, 3, 5-TMB(8.36 mg/L)。可见,除了2种丙苯外,其他7种组分对三角褐指藻的毒性均高于中肋骨条藻。虽然2种硅藻对这些组分的敏感性顺序有所差异,但是,二者均对Ind和1, 2, 3-TMB较敏感,而对1, 3, 5-TMB最不敏感。
3 讨论 3.1 C9芳烃对硅藻的毒性与海上泄漏事故中常见苯系物之间的比较根据联合国海洋环境保护科学问题联合专家组(GESAMP)提出的海洋生物急性毒性分级方案[24],C9芳烃的9种组分对三角褐指藻、中肋骨条藻均具有中等毒性(1 mg/L < 96 h EC50 ≤10 mg/L)。很多苯系物(苯酚、甲苯、乙苯、二甲苯、苯乙烯等)都是海上运输量较大的危险化学品[25],它们发生海上泄漏事故的频率也较高,因此,近年来这些苯系物对海洋微藻的急性毒性研究也受到重视。如表 5所示,与这些苯系物相比,C9芳烃9种组分(1, 3, 5-TMB除外)对三角褐指藻、中肋骨条藻的毒性普遍较高。这意味着,在泄漏量相同的条件下,C9芳烃的海上泄漏将比甲苯、二甲苯、苯酚、乙苯等造成更大的生态破坏,因此,需要重视C9芳烃海上泄漏事故的预防和污染控制,即采取有效措施降低海水中C9芳烃各组分的浓度,以缩短其残留期和减轻其危害。
|
|
表 5 不同种类苯系物对2种海洋硅藻的急性毒性比较 Table 5 Comparison of acute toxicity of several benzene homogeneous to two species of marine diatoms |
由表 5还可以看出,随着苯环上烷基取代数量的增多(甲苯→对二甲苯→三甲苯; 乙苯→乙基甲苯)以及支链延长(甲苯→乙苯→丙苯),苯系物对硅藻的毒性逐渐增强,这与它们的正辛醇-水分配系数(lg Kow)存在差异有关。按照Verhaar等[26]提出的分类方法,这些苯系物均属于非极性麻醉型(惰性)化合物,即性质不活泼且不与生物体内特殊受体(生物大分子)发生反应的化合物,也称为基线化合物。一般认为,此类化合物的急性毒性主要依靠其疏水性通过非特异性扩散穿过生物膜,引起组织细胞的破坏,因此其毒性与疏水性(即lg Kow)呈正相关[27-28]。根据相关文献检索,这些苯系物的lg Kow值分别为:甲苯(2.79)[29]、对二甲苯(3.15)[30]、三甲苯(3.42~3.66)[5, 12]、乙苯(3.15)[31]、乙基甲苯(3.53~3.98)[5, 12]、丙苯(3.66~3.69)[5, 12],可见,它们的疏水性基本上随着取代甲基增多和碳链加长而增大。
3.2 茚对硅藻的毒性在C9芳烃的9种组分中,茚的lg Kow最低,即疏水性最小,但是其对2种硅藻的毒性均较高(分别居于首位或第三位)。这可能有以下几种原因:①茚在水中的溶解度明显大于其他组分(见表 1)。已有研究报道,有机污染物的溶解度越大,对生物的毒性越强[37]。②茚在海水中较稳定。作者之前研究C9芳烃9种组分在海水中的自然衰减发现[38],茚的衰减速度最慢,这意味着其能在较长时间内对微藻保持稳定的毒性作用。③茚的分子结构有所不同。与其他8种组分相比,茚的苯环上连接着烯烃基(或环丙烯)而非烷基。而烯烃在可见光照射下可通过得电子形成自由基负离子[39],进入藻细胞内的自由基将造成膜脂质过氧化,进而对藻细胞造成较大的氧化损伤。
3.3 C9芳烃中其他组分对硅藻的毒性C9芳烃的其他8种组分互为同分异构体,其分子式均为C9H12,且苯环上的取代基均为烷基,但是它们对硅藻的急性毒性仍存在一定差异。其中,2种丙苯(n-PBZ和i-PBZ)的lg Kow虽然相差无几(见表 1),但是,前者对2种硅藻的急性毒性均大于后者。这可能与2种丙苯在暴露体系中的稳定性有关。戴朝霞等[40]认为,取代芳香烃对生物体的毒性主要是由两个过程引起:化合物首先穿透细胞膜(与lg Kow有关),然后与机体发生反应(与化合物分子稳定存在而能持续与生物体内结合位点发生作用有关)。有研究发现,与n-PBZ相比,i-PBZ容易被恶臭假单胞菌(Pseudomonas putida)降解[41],由此推测,本研究的暴露体系中,i-PBZ可能较容易受到硅藻降解而浓度降低较快,因此其对硅藻生长的抑制较低。
3种三甲苯对硅藻的毒性由大到小依次为1, 2, 3-TMB > 1, 2, 4-TMB > 1, 3, 5-TMB,这与它们的lg Kow逐渐降低趋势(见表 1)相一致。但是,1, 2, 3-TMB的毒性较大,也可能与其分子较稳定而难以被硅藻降解有关。该化合物的分子中,3个甲基分别与苯环上相邻碳原子相结合,而1, 2, 4-TMB和1, 3, 5-TMB苯环上3个取代甲基并非完全相邻,所以1, 2, 3-TMB更稳定和不易被生物降解[9, 42]。Haner等[43]报道,从柴油污染含水层中富集的微生物能够利用1, 3, 5-TMB和1, 2, 4-TMB进行生长,但不能降解1, 2, 3-TMB。类似的,Fichtner等[9]从德国柏林一个工业场地收集到受芳香烃混合物(包括TMB同分异构体)污染的土壤和地下水,在反硝化条件下进行生物降解,观察到1, 3, 5-TMB和1, 2, 4-TMB能被连续和完全降解,而1, 2, 3-TMB的降解在较长滞后期后才开始; 一级生物降解速率常数分别为:0.05~0.21 d-1(1, 3, 5-TMB和1, 2, 4-TMB)和0.01~0.11d-1(1, 2, 3-TMB)。由此认为,1, 2, 3-TMB中的邻位取代基结构使芳香环失稳需要较长时间和较高生物活性[9]。笔者最近研究C9芳烃在天然海水中的自然衰减(光解+水解+生物降解)也发现[38],1, 2, 3-TMB的拟一级动力学衰减速率低于1, 2, 4-TMB和1, 3, 5-TMB,表明其在海水中较稳定,不易被生物和非生物作用转化。
3种乙基甲苯中,lg Kow最高(3.98)的3-ET对硅藻的毒性最低,而lg Kow最低(3.53)的2-ET毒性最高。这表明,lg Kow大小并不是三者对硅藻毒性差异的原因。相反,其分子结构的不同带来的稳定性差异可能是关键因素。2-ET的苯环上甲基和乙基的邻位取代,造成其难以通过生物降解或非生物过程而被转化。虽然目前尚未见到微藻降解乙基甲苯的研究报道,但是,在Haner等[43]的研究中,除了测定柴油污染含水层中富集的微生物对3种TMB的降解性以外,还同时测定了乙基甲苯的生物降解程度,结果显示,3-ET能被完全降解,4-ET可被部分降解,而2-ET则完全不能被微生物代谢。Haner等由此做出如下推断:所富集的微生物只能降解分子中至少含有一个烷基取代基且邻位无取代基的单环芳烃。为了阐明C9芳烃8种组分的毒性存在差异的原因,进一步研究和比较海洋硅藻对它们的降解程度十分必要。
3.4 研究C9芳烃对更多海洋生物的毒性效应的必要性正如前文所提到的,有关C9芳烃对海洋生物急性毒性的研究较少,仅限于i-PBZ和1, 2, 4-TMB对少数鱼类(杂色鳉)和甲壳类动物(卤虫、邓杰内斯蟹、梳齿片钩虾),这些数据介于4.35~7.40 mg/L之间,这表明i-PBZ和1, 2, 4-TMB对鱼类、甲壳类也具有中等毒性[24],与本研究测得的9种组分对海洋硅藻的毒性处于同一等级。这意味着泄漏入海的C9芳烃将对多种海洋生物产生危害。因此,建立C9芳烃各组分的海洋生态安全浓度,对于泄漏事故海域的水质监测评价以及实施生物修复十分必要。
近十年来,物种敏感性分布法(SSD)已成为国际上生态风险评价常用的方法,主要是因为该方法在考虑不同物种对某一污染物敏感性(LC50、EC50、无可观察效应浓度NOEC等毒理学数据)差异的基础上,进一步评价污染物在生态系统层面上的危害,可减少基于单物种的毒性数据外推到其他生物带来的不确定性[44-46]。基于SSD可估算目标污染物的最大环境容许浓度阈值(HC5,即:达到95%物种保护水平时的浓度),用于评价污染区域的生态风险[47]。但是,SSD构建至少需要8个物种的毒性数据[48]。显然,目前已有的C9芳烃各组分急性毒性数据尚难以符合该要求,因此,今后应进一步开展这些组分对更多海洋物种(浮游动物、浮游植物、底栖动植物等)的毒性研究。
4 结论(1) C9芳烃9种组分对2种海洋硅藻的生长均有抑制作用,对三角褐指藻的96 h EC50值介于2.51~6.11 mg/L之间,对中肋骨条藻的96 h EC50值介于1.97~8.36 mg/L之间,均属于中等毒性。
(2) 各组分中,Ind、n-PBZ、1, 2, 3-TMB和2-ET对硅藻的毒性较大,而1, 3, 5-TMB的毒性最低。因此,未来的研究应重视前4种组分的生物降解技术研究。
(3) 除了Ind以外,C9芳烃的各组分互为同分异构体,但它们的毒性差异不总是决定于lg Kow,还可能与它们在暴露体系中的稳定性(生物降解程度)有关。
(4) 与甲苯、二甲苯、苯酚等苯系物相比,C9芳烃各组分对海洋微藻的毒性普遍较高,C9芳烃入海后对海洋初级生产力的危害较大,因此应重视其泄漏事故的预防和污染海域的生物修复。
| [1] |
Kim Y-R, Lee M, Jung J-Y, et al. Initial environment-tal risk assessment of hazardous and noxious substances (HNS) spill accidents to mitigate its damages[J]. Marine Pollution Bulletin, 2019, 139: 205-213. DOI:10.1016/j.marpolbul.2018.12.044 (  0) 0) |
| [2] |
Häkkinen J, Posti A. Overview of maritime accidents involving chemicals worldwide and in the Baltic Sea[M]//Maritime Transport & Shipping-Marine Navigation and Safety at Sea Transportation. Abingdon: Chemical Rubber Company Press, 2013.
(  0) 0) |
| [3] |
Mamaca E, Girin M, Le Floch S, et al. Review of chemical spills at sea and lessons learnt[C]//White Paper for Interspill Conference & Exihibition 2009. Marseille: The 4th IMO R & D Forum, 2009: 35.
(  0) 0) |
| [4] |
Nikfar S, Behboudi A F. Cumene[J]. Encyclopedia Toxicology, 2014, 8(4): 1082-1085. (  0) 0) |
| [5] |
National Center for Biotechnology Information (NCBI). PubChem compound data-base[DB/OL]. (2020-05-25)[2021-07-30]. https://www.ncbi.nlm.nih.gov/pccompound.
(  0) 0) |
| [6] |
Firth M J. Derivation of a chronic reference dose and reference concentration for trimethylbenzenes and C9 aromatic hydrocarbon solvents[J]. Regulatory Toxicology and Pharmacology, 2008, 52(3): 248-256. DOI:10.1016/j.yrtph.2008.08.017 (  0) 0) |
| [7] |
于深波. 重整碳九芳烃的综合利用技术[J]. 石油化工技术与经济, 2020, 36(5): 41-44. Yu S B. Comprehensive utilization techonlogy of reforming C9 aromatics[J]. Technology & Economics in Petrochemicals, 2020, 36(5): 41-44. DOI:10.3969/j.issn.1674-1099.2020.05.011 (  0) 0) |
| [8] |
毕丽姣, 周岩梅, 张林林, 等. 太子河中游河段有机污染物分布特征研究[J]. 环境科学与技术, 2016, 39(S1): 164-168. Bi L J, Zhou Y M, Zhang L L, et al. Distribution characteristics of organic contaminant in middle reaches of Tazihe River[J]. Environmental Science & Technology, 2016, 39(S1): 164-168. (  0) 0) |
| [9] |
Fichtner T, Fischer A R, Dornack C. Biodegradability of trimethylbenzene isomers under denitrifying and sulfate-reducing conditions[J]. International Journal of Environmental Research and Public Health, 2019, 16(4): 615. DOI:10.3390/ijerph16040615 (  0) 0) |
| [10] |
Cui X Z, Cui H. Determination of trace benzene hydrocarbons in Jiaozhou Bay by enrichment and capillary column gas chromatography[J]. Chinese Journal of Oceanology and Limnology, 1996, 14(2): 54-59. (  0) 0) |
| [11] |
陈鼎豪, 陈思莉, 潘超逸, 等. 福建泉港"碳九"事件中海洋水体超标面积及大气影响范围的确定[J]. 环境工程学报, 2021, 15(8): 2536-2546. Chen D H, Chen S L, Pan C Y, et al. Determination of over-standard area of marine water and atmospheric impact range in Quangang C9 event in Fujian province[J]. Chinese Journal of Environmental Engineering, 2021, 15(8): 2536-2546. (  0) 0) |
| [12] |
National Oceanic and Atmospheric Administration (NOAA). Chemical Aquatic Fate and Effects Database[DB/OL]. (2020-05-25) [2021-07-30]. https://response.restoration.noaa.gov/cafe.
(  0) 0) |
| [13] |
Weyers A, Vollmer G. Algal growth inhibition: Effect of the choice of growth rate or biomass as endpoint on the classification and labelling of new substances notified in the EU[J]. Chemosphere, 2000, 41(7): 1007-1010. DOI:10.1016/S0045-6535(99)00518-4 (  0) 0) |
| [14] |
Glickman A H, Alexander H C, Buccafusco R J, et al. An evaluation of the aquatic hazard of cumene (isopropylbenzene)[J]. Ecotoxicology and Environmental Safety, 1995, 31(3): 287-289. DOI:10.1006/eesa.1995.1076 (  0) 0) |
| [15] |
Environmental Protection Agency, U.S. ECOTOX Ecotoxicology Database: Isopropylbenzene[DB/OL]. (2020-05-25) [2021-07-30]. https://cfpub.epa.gov/ecotox/.
(  0) 0) |
| [16] |
Lee M Y, Nicol J A C. Individual and combined toxicity of some petroleum aromatics to the marine amphipod Elasmopus pectenicrus[J]. Marine Biology, 1978, 48(3): 215-222. DOI:10.1007/BF00397147 (  0) 0) |
| [17] |
United States Environmental Protection Agency. Ecological Effects Test Guidelines OCSPP 850. 4500: Algal Toxicity[S]. Washington, DC: United States Environmental Protection Agency, 2012.
(  0) 0) |
| [18] |
Deng X Y, Hu X L, Cheng J, et al. Growth inhibition and oxidative stress induced by 1-octyl-3-methylimidazolium bromide on the marine diatom Skeletonema costatum[J]. Ecotoxicology and Environmental Safety, 2016, 132: 170-177. DOI:10.1016/j.ecoenv.2016.06.009 (  0) 0) |
| [19] |
Zhang L, Jiang F H, Kong X F, et al. Toxic effect of BDE-47 on the marine alga Skeletonema costatum : Population dynamics, photosynthesis, antioxidation and morphological changes[J]. Chemosphere, 2022, 286: 131674. DOI:10.1016/j.chemosphere.2021.131674 (  0) 0) |
| [20] |
Deng X Y, Li D, Wang L, et al. Potential toxicity of ionic liquid ([C12mim]BF4) on the growth and biochemical characteristics of a marine diatom Phaeodactylum tricornutum[J]. Science of the Total Environment, 2017, 586: 675-684. DOI:10.1016/j.scitotenv.2017.02.043 (  0) 0) |
| [21] |
Pavlic Z, Vidakovic-Cifrek Z, Puntaric D. Toxicity of surfactants to green microalgae Pseudokirchneriella subcapitata and Scenedesmus subspicatus and to marine diatoms Phaeodactylum tricornutum and Skeletonema costatum[J]. Chemosphere, 2005, 61(8): 1061-1068. DOI:10.1016/j.chemosphere.2005.03.051 (  0) 0) |
| [22] |
Guillard R L L. Culture of phytoplankton for feeding marine invertebrates[M]//Culture of Marine Invertebrates Animals. New York: Plenum Press, 1975.
(  0) 0) |
| [23] |
Cushman J R, Rausina G A, Cruzan G, et al. Ecotoxicity hazard assessment of styrene[J]. Ecotoxicology and Environmental Safety, 1997, 37(2): 173-180. DOI:10.1006/eesa.1997.1540 (  0) 0) |
| [24] |
Group of Experts on the Scientific Aspects of Marine Pollution. Revised GESAMP hazard evaluation procedure for chemical substances carried by ships, 2nd Edition[R]. London: International Maritime Organization, 2014.
(  0) 0) |
| [25] |
Neuparth T, Moreira S, Santos M, et al. The Atlantic Regions′ Coastal Pollution Response: Identify chemicals that pose major environmental risk[R]. [S. l. ]: European Commission (Atlantic Area), 2010.
(  0) 0) |
| [26] |
Verhaar H, Van Leeuwen C J, Hermens J L M. Classifying environmental pollutants. 1: Structure-activity relationships for prediction of aquatic toxicity[J]. Chemosphere, 1992, 25(4): 471-491. DOI:10.1016/0045-6535(92)90280-5 (  0) 0) |
| [27] |
李金杰, 张栩嘉, 赵元慧. 有机污染物对水生生物毒性作用机理的判别及影响因素[J]. 环境化学, 2013, 32(7): 1236-1245. Li J J, Zhang X J, Zhao Y H. Discrimination of the mechanisms of toxic action for organic pollutants to aqueous organisms and its influencing factors[J]. Environmental Chemistry, 2013, 32(7): 1236-1245. (  0) 0) |
| [28] |
于洋, 王晓红, 闻洋, 等. 应用Abraham方程研究有机污染物对七种水生生物的毒性[J]. 环境化学, 2015, 34(1): 23-36. Yu Y, Wang X H, Wen Y, et al. Study on the toxicity of organic pollutants to seven aquatic organisms based on Abraham model[J]. Environmental Chemistry, 2015, 34(1): 23-36. (  0) 0) |
| [29] |
莫汉宏, 杨克武, 安凤春, 等. 农药和其它有机化合物环境参数的相关性及其预测[J]. 环境化学, 1994, 13(5): 401-408. Mo H H, Yang K W, An F C, et al. The relationship and prediction of environmental parameter of pesticides and other organic compounds[J]. Environmental Chemistry, 1994, 13(5): 401-408. (  0) 0) |
| [30] |
Gherini S A, Summers K V, Munson R K, et al. Chemical data for predicting the fate of organic compounds in water: Volume 1, Technical basis: Final report[R]. Palo Alto, CA: Electrical Power Research Institute, 1989.
(  0) 0) |
| [31] |
Mackay D, Shiu W Y, Ma K C. Physical-Chemical Properties and Environmental Fate Handbook[M]. [S.l.]: Chemical Rubber Company Press, 1999.
(  0) 0) |
| [32] |
江玉, 吴志宏, 韩秀荣, 等. 多环芳烃对海洋浮游植物的生物毒性研究[J]. 海洋科学, 2002, 26(1): 46-50. Jiang Y, Wu Z H, Han X R, et al. Toxicity of Polycyclic aromatic hydrocarbons(PAHs) to marine algae[J]. Marine Sciences, 2002, 26(1): 46-50. DOI:10.3969/j.issn.1000-3096.2002.01.015 (  0) 0) |
| [33] |
Shemer H, Linden K G. Photolysis, oxidation and subsequent toxicity of a mixture of polycyclic aromatic hydrocarbons in natural waters[J]. Journal of Photochemistry and Photobiology A: Chemistry, 2007, 187(2-3): 186-195. DOI:10.1016/j.jphotochem.2006.10.018 (  0) 0) |
| [34] |
Li F, Duan W Y, Du S H, et al. Toxicological assessment of intermediates in natural attenuation of p-xylene to marine microalgae[J]. Bulletin of Environmental Contamination and Toxicology, 2019, 103(3): 441-446. DOI:10.1007/s00128-019-02646-6 (  0) 0) |
| [35] |
Duan W Y, Meng F P, Lin Y F, et al. Toxicological effects of phenol on four marine microalgae[J]. Environmental Toxicology and Pharmacology, 2017, 52: 170-176. DOI:10.1016/j.etap.2017.04.006 (  0) 0) |
| [36] |
Pesticide Action Network (PAN) North America, US. PAN Pesticide Database: Styrene[DB/OL]. (2018-11-20)[2021-07-30]. https://www.panna.org/search/node/Styrene.
(  0) 0) |
| [37] |
Luo Y, Zang Y, Zhong Y, et al. Toxicological study of two novel pesticides on earthworm Eisenia foetida[J]. Chemosphere, 1999, 39(13): 2347-2356. DOI:10.1016/S0045-6535(99)00142-3 (  0) 0) |
| [38] |
Li D W, Wu J Y, Liu J Q, et al. Natural attenuation characteristics and comprehensive toxicity changes of C9 aromatics under simulated marine conditions[J]. Journal of Environmental Sciences, 2021, 109: 25-35. (  0) 0) |
| [39] |
Ischay M A, Anzovino M E, Du J, et al. Efficient visible light photocatalysis of [2+2] enone cycloadditions[J]. Journal of the American Chemical Society, 2008, 130(39): 12886-12887. DOI:10.1021/ja805387f (  0) 0) |
| [40] |
戴朝霞, 赵劲松, 陈振翔, 等. 取代芳香族化合物对4种水生生物的毒性研究[J]. 中国环境科学, 2005, 25(2): 165-168. Dai Z X, Zhao J S, Chen Z X, et al. Studies on toxicology of substituted aromatic compounds to four kinds of aquatic organism[J]. China Environmental Science, 2005, 25(2): 165-168. (  0) 0) |
| [41] |
Gibson D T, Koch J R, Kallio R E. Oxidative degradation of aromatic hydrocarbons by microorganisms. Ⅰ. Enzymic formation of catechol from benzene[J]. Biochemistry, 1968, 7(7): 2653-2662. (  0) 0) |
| [42] |
George S C, Boreham C J, Minifie S A, et al. The effect of minor to moderate biodegradation on C5 to C9 hydrocarbons in crude oils[J]. Organic Geochemistry, 2002, 33(12): 1293-1317. (  0) 0) |
| [43] |
Haner A, Hohener P, Zeyer J. Degradation of trimethylbenzene isomers by an enrichment culture under N2O-reducing conditions[J]. Applied and Environmental Microbiology, 1997, 63(3): 1171-1174. (  0) 0) |
| [44] |
杜建国, 赵佳懿, 陈彬, 等. 应用物种敏感性分布评估重金属对海洋生物的生态风险[J]. 生态毒理学报, 2013, 8(4): 561-570. Du J G, Zhao J Y, Chen B, et al. Assessing ecological risks of heavy metals to marine organisms by species sensitivity distributions[J]. Asian Journal of Ecotoxicology, 2013, 8(4): 561-570. (  0) 0) |
| [45] |
He J, He H, Yan Z, et al. Comparative analysis of freshwater species sensitivity distributions and ecotoxicity for priority pesticides: Implications for water quality criteria[J]. Ecotoxicology and Environmental Safety, 2019, 176: 119-124. (  0) 0) |
| [46] |
Van den Brink P J, Buijert-de Gelder D M, Brock T C M, et al. Exposure pattern-specific species sensitivity distributions for the ecological risk assessments of insecticides[J]. Ecotoxicology and Environmental Safety, 2019, 180: 252-258. (  0) 0) |
| [47] |
曾勇, 孙霄, 赖雨薇, 等. 基于物种敏感性分布的多环芳烃水生态系统风险评价方法与应用[J]. 生态毒理学报, 2020, 15(5): 235-243. Zeng Y, Sun X, Lai Y W, et al. Aquatic ecosystem risk assessment of Polycyclic aromatic hydrocarbons based on species sensitivity distribution[J]. Asian Journal of Ecotoxicology, 2020, 15(5): 235-243. (  0) 0) |
| [48] |
Signore A D, Hendriks A J, Lenders H J R, et al. Development and application of the SSD approach in scientific case studies for ecological risk assessment[J]. Environmental Toxicology and Chemistry, 2016, 35(9): 2149-2161. (  0) 0) |
 2023, Vol. 53
2023, Vol. 53