2. 中国海洋大学海洋环境与生态教育部重点实验室,山东 青岛 266100
纳米二氧化钛(n-TiO2)是在个人消费品(防晒霜、牙膏等)和工业生产(颜料、纸、油墨添加剂、塑料等)中应用最广泛的一种纳米材料。在n-TiO2大量使用过程中,其不可避免地被释放到城市和工业废水中,并最终进入河流、湖泊、海洋等水环境中。Mueller和Nowack[1]利用n-TiO2全球生产量、n-TiO2在各类产品中的分配比例,纳米颗粒从产品中的释放比例及其在各环境要素中的流量系数等参数,估算出瑞士地表水中n-TiO2的预测环境浓度(PECs)约为0.7~16 μg·L-1。Tiede等[2]预测地表水(饮用水净化厂进水)中n-TiO2的PECs为164 μg·L-1。
进入水相和沉积物中的n-TiO2可能会与重金属等相互作用,从而引起重金属在水生生物体内积累量或毒性效应的改变[3]。已有学者研究了n-TiO2与重金属(尤其是Cd)的联合暴露对淡水和海洋生物的影响[4-6]。n-TiO2能够降低Cd在莱茵衣藻(Chlamydomonas reinhardtii)中的积累和毒性效应[5]; 但能够增强大型溞(Daphnia magna)[4]、斑马鱼(Brachydanio rerio)[7]对Cd的吸收积累。Balbi等[6]则发现,在联合暴露条件下,n-TiO2不会影响到Cd在地中海贻贝(Mytilus galloprovincialis)中的生物积累程度,也未增加Cd对贻贝免疫和消化腺功能及胚胎发育的不良影响。可见n-TiO2对Cd生物积累和生物毒性的影响可能存在种间特异性,并且因介质种类(如淡水和海水)以及纳米材料在介质中的性质和形态而变。因此,需要进行更多的研究以确定n-TiO2入海后对重金属的生物蓄积性与毒性效应的影响。
生物体在环境胁迫等逆境条件下能够产生大量活性氧物质(ROS),攻击细胞内的DNA、蛋白质等生物大分子,引起生物膜发生脂质过氧化反应(MDA则是脂质过氧化的主要产物),而生物体可以通过改变抗氧化酶(超氧化物歧化酶SOD、过氧化氢酶CAT和谷胱甘肽S-转移酶GST等)或非酶类抗氧化的水平,以清除ROS,维持细胞内的正常氧化还原环境。而金属离子能够诱导双壳类动物金属硫蛋白(MT)的合成,从而表现出一定的金属毒性[6]。
海洋中的双壳类动物能够通过大量过滤海水而捕获微粒物质和悬浮性污染物,因而常被作为模式生物用于评估纳米颗粒(NPs)对水生生物影响以及NPs与其他污染物之间的交互作用[6, 8]。菲律宾蛤仔(Ruditapes philippinarum )是中国沿海分布较为广泛的底栖双壳类动物,从潮间带到水深10 m左右的水域均有栖息[9]。本研究拟以菲律宾蛤仔为试验物种,将其单独和联合暴露到n-TiO2和Cd,评估n-TiO2与Cd单独暴露条件下海洋双壳类对Cd蓄积性及生物响应的影响。需要指出的是,前人多采用高浓度(mg·L-1)[3-4]对n-TiO2或Cd进行水生毒性研究,这些浓度远高于目前水环境中两种污染物的预测浓度或实测浓度。为此,本研究将n-TiO2或Cd的试验浓度设置为100 μg·L-1,同时将暴露时间延长至2周,以便在接近实际污染水平的单独和联合暴露条件下研究Cd在海洋双壳类中的蓄积量及其亚致死毒性(包括SOD、CAT、GST的活性以及MDA、MT含量)变化。
1 材料与方法 1.1 材料纳米二氧化钛(n-TiO2,纯度>99.7%,锐钛矿型,粒径 < 25 nm)购于Sigma-Aldrich。氯化镉(CdCl2·2.5H2O,分析纯)、硝酸(HNO3,ρ=1.42 g·mL-1,超纯)和H2O2(30%,优级纯)购于国药集团化学试剂有限公司。
人工海水(ASW):将一定量的海水晶(购于潍坊市海佳海水晶厂)溶于超纯水配制而成,使用前经0.45 μm的微孔滤膜过滤。
硝酸溶液:1体积的硝酸和99体积的水混合得到。
n-TiO2溶液:将n-TiO2加入到0.45 μm过滤后的ASW中,冰水浴超声15 min,得到n-TiO2储备液(10 mg·L-1),随后立即稀释到暴露浓度100 μg·L-1。
Cd溶液:将1 g CdCl2加至超纯水中,配成CdCl2储备液(10 mg·L-1),随后立即稀释到暴露浓度100 μg·L-1。
菲律宾蛤仔(R. philippinarum)购于青岛市红岛区海鲜市场,选取反应灵敏、大小相近的个体(壳长(3.42±0.12) cm,壳宽(2.3±0.14) cm,壳高(1.46±0.09) cm),采用ASW驯养7 d,驯养期间每24 h更换1次ASW,并持续曝气。
1.2 主要仪器T18型高速组织匀浆机(德国IKA公司); UV2550型紫外-可见光分光光度计(日本岛津公司); KQ3200B型超声波清洗器(江苏省昆山市超声仪器有限公司); MIKRO 200R型高速冷冻离心机(德国Hettich公司); MARS-Xpress型微波消解仪(美国CEM公司); RT-6000型酶标仪(深圳雷杜公司); ICAP-6300型电感耦合等离子体发射光谱仪(ICP-AES,美国Thermo公司)。
1.3 暴露培养方法将经过驯养的菲律宾蛤仔随机分组后放入各玻璃缸(30 cm×22 cm×18 cm)中,每个玻璃缸加入7 L的ASW后放入35只蛤仔。共分为4组进行暴露实验(污染物浓度设置见表 1),每24 h换水一次,实验期间不投喂饵料,且没有蛤仔死亡。暴露期间测定各水质参数为水温(18.9±0.6) ℃、盐度(33±0.1)、DO(8.29±0.2) mg·L-1和pH=7.6±0.05。在暴露的0、3、7和14 d,分别从每个玻璃缸中取5只,立即冰上解剖并分离消化腺,转移到液氮中速冻后于-80 ℃保存待测。
|
|
表 1 不同处理组中n-TiO2与Cd的浓度 Table 1 Concentrations of n-TiO2 and Cd in different treatments |
称取适量解冻后的消化腺组织,按质量体积比1:9加入Tris-HCl(pH=7.4, 0.01 mol·L-1)缓冲溶液[10],用高速组织匀浆机匀浆后离心(3 000 r·min-1, 4 ℃)15 min得到上清液,用于测定SOD、CAT、GST、MDA和MT的活性或含量以及蛋白质浓度。上述生物化学指标均使用南京建成生物工程研究所生产的试剂盒进行测定。
SOD测定:通过黄嘌呤及黄嘌呤氧化酶反应系统产生超氧阴离子自由基后者氧化羟胺形成亚硝酸盐,在显色剂的作用下呈现紫红色,用可见光分光光度计测其吸光度。当被测样品中含SOD时,则对超氧阴离子自由基有专一性的抑制作用,使测定管的吸光度值低于对照管的吸光度值,由此可计算被测样品中的SOD活力(U·mg prot-1)。
CAT测定:CAT分解H2O2的反应可通过加入钼酸铵而迅速中止,剩余的H2O2与钼酸铵作用产生淡黄色的络合物,根据其在405 nm处的吸光度变化可计算得到CAT活力(U·mg prot-1)。
GST测定:GST具有催化还原型谷胱甘肽(GSH)与1-氯-2, 4-二硝基苯(CDNB)结合的能力,在一定的反应时间内,其活性高低与反应前后底物浓度的变化呈线性关系。根据GSH浓度的降低幅度可计算GST活力(U·mg prot-1)。
MDA测定:过氧化脂质降解产物中的MDA可与硫代巴比妥酸(TBA)缩合,形成红色产物,在532 nm处有最大吸收峰,由此可计算MDA的含量(nmol·mg prot-1)。
MT测定:向预先包被了软体动物MT单克隆抗体的酶标孔中加入上清液,温育; 然后加入生物素标记的抗MT抗体,再与链霉亲和素-HRP结合,形成免疫复合物,再次温育后,用PBS洗涤,去除未结合的酶,然后加入底物H2O2和TMB,在酸的作用下转化成最终的黄色。在450 nm处的吸光度与样品中MT的浓度呈正相关,由此可计算MT含量(ng·mL-1)。
1.5 消化腺中Cd含量测定准确称取冷冻干燥后的消化腺样品(100±0.1) mg,加入9 mL硝酸,待反应平稳后,再加入3 mL过氧化氢,然后放入微波消解仪中。消解过程分两步:120 ℃,升温时间8 min,保持5 min(1 600 W); 180 ℃,升温时间8 min,保持25 min(1 600 W)。冷却后,将样品转入聚四氟乙烯容器中,置于电热板上120 ℃赶酸至近干。最后将样品全量转移到25 mL比色管中,冷却至室温后加入硝酸溶液(1体积硝酸:99体积水)定容混匀。用ICP-AES分析,每个样品设3个平行,根据测定结果计算Cd含量(ng·g-1·dw)。
1.6 数据统计分析每个生化指标或Cd含量的测定结果均以3次重复测定的(平均值±标准差)表示; 采用单因素方差分析(ANOVA)进行处理组和对照组的差异显著性检验,统计显著性水平为p<0.05。通过XLStat2010Ⓡ进行统计分析,OriginLab OriginPro 9.2作图。
2 结果 2.1 不同处理组中蛤仔消化腺中Cd的含量比较由图 1可见,暴露3 d后,与对照组相比,Cd处理组、n-TiO2+Cd处理组中蛤仔消化腺的Cd含量显著升高(p<0.05),分别为对照组的6.8和4.5倍。随着暴露时间延长,这两个处理组的消化腺Cd的含量继续增加,暴露7 d后分别达到对照组的9.7和6.6倍; 暴露14 d后分别达到对照组的50.1、28.4倍。而n-TiO2处理组消化腺中的Cd含量始终与对照组差异不显著。

|
(不同字母表示相同暴露时间下不同处理组之间存在显著差异(p<0.05)。Different letters represent significant differences among treatment groups at the same exposure time (p < 0.05).) 图 1 n-TiO2和Cd单独和联合暴露14 d后蛤仔消化腺中的Cd含量(平均值±标准差) Fig. 1 Cd concentrations in digestive glands of clams R. philippinarum exposed to n-TiO2 and Cd (alone and in combination) for 14 days (mean ± Std) |
由图 2可见,无论是Cd、n-TiO2单独暴露,还是两者共同存在的情况下,蛤仔消化腺的SOD活性总是与同期的对照组差异不显著(p>0.05)。消化腺的CAT活性仅在Cd暴露3 d后受到显著诱导(p<0.05),为对照组的1.3倍。GST活性的诱导出现在Cd暴露7、14 d后,均为对照组的1.6倍; 而单独的n-TiO2处理及其与Cd联合暴露均不能引起GST活性的显著变化(与同期对照组相比)。
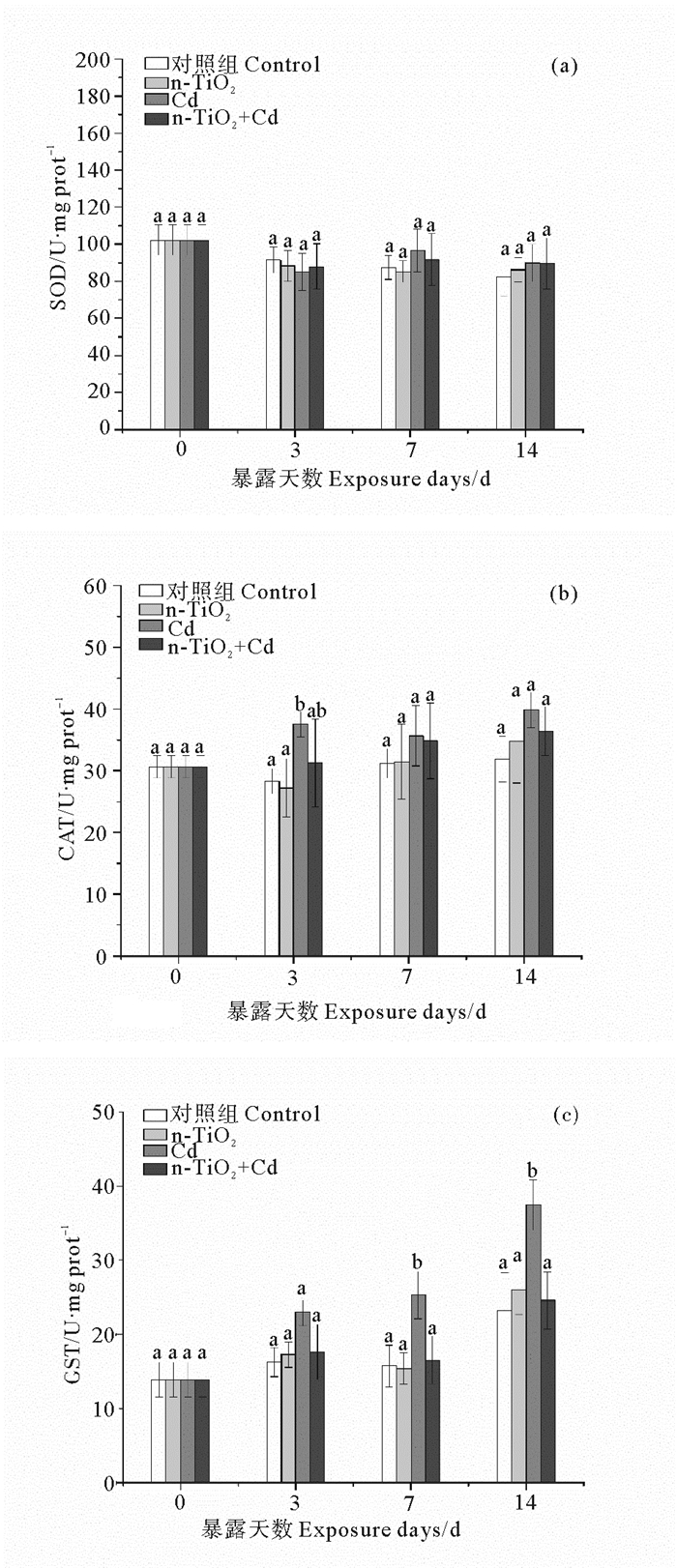
|
(不同字母表示相同暴露时间下不同处理组之间存在显著差异(p<0.05)。Different letters represent significant differences among treatment groups at the same exposure time (p < 0.05).) 图 2 n-TiO2和Cd单独与联合暴露下菲律宾蛤仔消化腺的SOD (a)、CAT (b)、GST (c)活性变化 Fig. 2 Activities of antioxidant enzyme (a: SOD, superoxide dismutase; b: CAT, catalase; c: GST, glutathione-S-transferase) in digestive glands of clams R. philippinarum exposed to n-TiO2 and Cd(alone and in combination) for 14 days |
3个处理组中消化腺MDA含量的显著变化均出现在暴露中后期(见图 3)。n-TiO2单独暴露7 d后,消化腺MDA含量显著上升,但随着暴露时间延长,MDA含量增幅降低,至暴露结束时与对照组无显著差异。Cd处理组中,MDA含量的显著增加出现在暴露结束时。当2种污染物同时存在时,MDA含量在暴露7 d后显著高于对照组,其后逐渐降低到与对照组差异不显著的水平。
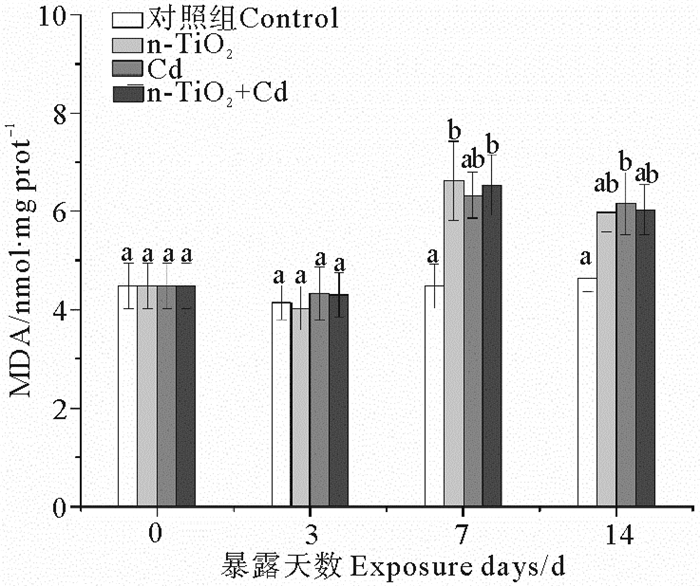
|
(不同字母表示相同暴露时间下不同处理组之间存在显著差异(p<0.05)。Different letters represent significant differences among treatment groups at the same exposure time (p < 0.05).) 图 3 n-TiO2和Cd单独与联合暴露下蛤仔消化腺的MDA含量变化 Fig. 3 Change in malondialdehyde (MDA) contents in digestive glands of clams R. philippinarum exposed to n-TiO2 and Cd (alone and in combination) for 14 days |
根据图 4,3个处理组中,只有Cd能够显著诱导消化腺MT的合成,随暴露时间延长,这种诱导效应持续增大,暴露3、7、14 d后的MT含量分别达到同期对照组的6.5、9.7和50.1倍。同样浓度的n-TiO2不能诱导MT合成。Cd与n-TiO2共存时也不会引起MT含量显著变化。
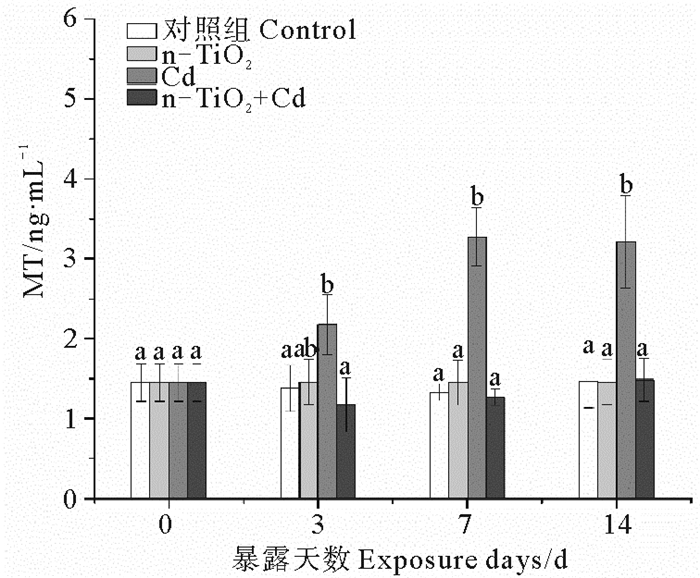
|
(不同字母表示相同暴露时间下不同处理组之间存在显著差异(p<0.05)。Different letters represent significant differences among treatment groups at the same exposure time (p < 0.05).) 图 4 n-TiO2和Cd单独与联合暴露下蛤仔消化腺的MT含量变化 Fig. 4 Change in metallothionein (MT) contents in digestive glands of clams R. philippinarum exposed to n-TiO2 and Cd (alone and in combination) for 14 days |
镉(Cd)是水生生态系统中分布广泛的一种重金属,美国国家环保局(USEPA)和欧洲水框架指令(WFD)均将该金属列为优先控制污染物[11-12]。根据近年来的文献报道,中国某些海域表层海水中的Cd已达到较高污染水平,例如,南中国海的Cd浓度范围为47.0~324.2 μg·L-1,平均257.3 μg·L-1[13]。在这种污染形势下,作为纳米材料的n-TiO2入海后,究竟会增加还是减轻Cd在海洋生物体内的积累与毒害值得关注。双壳类动物因其分布广泛、营固着生活以及对重金属的高富集性、低转化能力和较高耐受性而常被用作海洋环境污染的指示生物。其中,菲律宾蛤仔(R. philippinarum)是研究重金属吸收积累及生物学效应的常用物种,通过急性毒性试验得到的Cd对菲律宾蛤仔(R. philippinarum)的96 h LC50在2.843 ~ 4.740 mg·L-1之间[14, 15]。
本研究所设置的Cd暴露浓度(100 μg·L-1)大约相当于上述96 h LC50的1/30~1/50。暴露于该浓度Cd的蛤仔未见死亡,但是消化腺中Cd的积累十分明显(见图 1),并引起一定的亚致死毒性,表现为GST和MT持续受到诱导和暴露后期MDA含量的上升(见图 2~4)。GST是Ⅱ相代谢酶,能够催化GSH的-SH与亲电子化合物或Ⅰ相代谢产物结合,生成低毒或无毒的水溶性化合物而排出体外[16]。之前的研究已发现[17],Cd、Zn、Pb、Hg、Cu等重金属均能诱导栉孔扇贝(Chlamys farreri)消化腺GST的活性。MTs是一类普遍存在于生物体内的低分子量、富含半胱氨酸(约30%)的蛋白质,其通过半胱氨酸的-SH与金属离子结合而起到解毒作用。很多研究表明,重金属可在转录水平上诱导双壳类MTs合成,根据MTs含量的变化可反映海洋环境重金属污染水平[18-19]。可见,Cd胁迫下的GST活性上升和MT含量增加是生物体的一种主动防御机制,其作用是控制细胞内溶解态Cd的数量,进而阻止其对其它酶(包括抗氧化酶)活性中心的破坏,以保持机体的抗氧化防御能力。本研究中,暴露于Cd的蛤仔消化腺中SOD、CAT活性并未发生变化或只有短暂增加(见图 2)支持上述推断。Ji等[20]的研究同样发现,经亚致死浓度(20和200 μg·L-1)Cd暴露48 h后,菲律宾蛤仔消化腺SOD活性均与对照组差异不显著(p >0.05)。SOD、CAT是生物细胞内两种重要的抗氧化酶(前者的主要作用是清除机体产生的超氧阴离子自由基(O2·-),生成H2O2; 后者则催化H2O2水解以减轻其对细胞的氧化损伤)[21]。SOD活性保持稳定,表明在暴露于该浓度Cd的机体内没有O2·-的积累。作为脂质过氧化的最终产物,MDA常作为生物体遭受逆境胁迫的重要指标。本研究中,消化腺的MDA含量只在暴露后期出现上升,可能是因为,随着Cd不断摄入,GST所催化的底物(GSH)因不断消耗而逐渐减少[22],无法充分结合Cd; 同时,MT的诱导量已达到稳定水平,无法螯合更多的Cd,由此造成新摄入的Cd较多以溶解态存在,抑制抗氧化酶的活性,由此造成ROS积累而引起细胞的氧化损伤[23-24]。
有文献报道[25],n-TiO2在海水中表现出强烈的团聚倾向,ASW中100 μg·L-1的n-TiO2形成的团聚体平均水力直径为(345±32) nm。这种团聚行为造成海水中的分散性纳米颗粒因沉降而从液相中去除,使得实际暴露浓度与理论浓度之间存在差异。Balbi等[26]的研究表明,由于纳米颗粒的水溶性低以及容易凝聚、吸附和沉淀,以n-TiO2形式加入ASW中的Ti只有一小部分(约10%)以悬浮态存在(即具有生物可利用性),但是,在ASW(含100 μg·L-1的n-TiO2)中培养96 h后,地中海贻贝(M. galloprovincialis)消化腺中Ti含量显著升高,约为对照组(在不含n-TiO2的ASW中生长的贻贝)的18倍。从本研究结果看,单独暴露于n-TiO2的蛤仔消化腺中未观察到Cd的积累(见图 1),表明这种纳米颗粒向ASW中引入的Cd数量很少; 3种抗氧化酶以及MT也无显著变化(见图 2),只有MDA含量在暴露中期显著增加,但暴露结束时降至对照水平(见图 3)。这表明进入消化腺的Ti不足以引起蛤仔抗氧化防御系统的改变,对MT的诱导能力也很小。虽然有研究证明水中的n-TiO2自身能够产生O2-·、H2O2和·OH等ROS[27],但是,在目前海水的n-TiO2污染水平下,蛤仔组织内并不会受到持续的氧化损伤。n-TiO2的这种低毒性在其它研究中也有报道:菲律宾蛤仔经同样浓度n-TiO2 暴露26 d期间,消化腺的GST活性无变化,CAT、SOD活性仅在14 d后分别出现短时的增加和受抑,MDA含量则仅在暴露26 d后有显著增加[28]。可见,在同样浓度下,n-TiO2对蛤仔的毒性不及Cd。
与Cd处理组相比,n-TiO2和Cd的联合暴露会显著降低蛤仔消化腺中Cd的积累量(见图 1)。由此认为,海水中n-TiO2和Cd之间会产生拮抗作用,进而造成蛤仔对Cd(毒性较低)和Ti(毒性较低)的摄入量降低。与此相应的是,本研究观察到,n-TiO2和Cd的联合暴露不能引起蛤仔消化腺的抗氧化酶活性和MT含量的显著变化,只是造成表征氧化损伤程度的MDA含量在暴露中期的短暂增加(但在暴露结束时已回落到对照水平)。这种变化与n-TiO2单独暴露下的生化响应非常相似,表明n-TiO2与Cd共存下的蛤仔亚致死毒性减轻主要是由于前者抑制后者的生物积累所致。前人的研究同样发现,n-TiO2能够抑制Cd在莱茵衣藻(C. reinhardtii)[5]中的蓄积。这种影响与n-TiO2对Cd的强吸附能力有很大关系:pH在4~7范围内,吸附率可达97%以上[29]; 当pH>7时,吸附率大于99%[30]。由此推断,在本研究所用介质ASW(pH=7.6±0.05)中,部分Cd被吸附于n-TiO2表面,并随着后者的凝聚、沉降而转移到介质底层,进而阻止双壳类对Cd的摄入。
4 结论(1) 在Cd浓度100 μg·L-1的ASW中暴露培养14 d,蛤仔消化腺中的Cd积累量持续增加,但是,同样浓度的n-TiO2与Cd共存时,暴露结束时Cd积累量降低近一半。
(2) 相同浓度条件下,Cd对蛤仔的亚致死毒性高于n-TiO2,表现为GST和MT的显著诱导以及暴露后期MDA含量显著上升; 而n-TiO2单独暴露只是造成MDA含量在暴露中期显著增加。
(3) Cd和n-TiO2联合暴露对蛤仔的亚致死毒性与n-TiO2单独暴露的结果相似,表明n-TiO2能够通过抑制Cd的生物积累而减轻后者对蛤仔的毒性。这种影响与n-TiO2对Cd的吸附作用有关。
| [1] |
Mueller N C, Nowack B. Exposure modeling of engineered nanoparticles in the environment[J]. Environmental Science and Technology, 2008, 42(12): 4447-4453. DOI:10.1021/es7029637
(  0) 0) |
| [2] |
Tiede K, Westerhoff P, Hansen S F, et al. Review of the Risks Posed to Drinking Water by Man-Made Nanoparticles[R]. Sand Hutton, York: Food and Environment Research Agency, 2010
(  0) 0) |
| [3] |
Hartmann N B, Von d K F, Hofmann T, et al. Algal testing of titanium dioxide nanoparticles-testing considerations, inhibitory effects and modification of cadmium bioavailability[J]. Toxicology, 2010, 269(2-3): 190-197. DOI:10.1016/j.tox.2009.08.008
(  0) 0) |
| [4] |
Hartmann N B, Legros S, Von d K F, et al. The potential of TiO2 nanoparticles as carriers for cadmium uptake in Lumbriculus variegatus and Daphnia magna[J]. Aquatic Toxicology, 2012, 118(2): 1-8.
(  0) 0) |
| [5] |
Yang W W, Miao A J, Yang L Y. Cd2+ toxicity to a green alga Chlamydomonas reinhardtii as influenced by its adsorption on TiO2 engineered nanoparticles[J]. Plos One, 2012, 7(3): e32300. DOI:10.1371/journal.pone.0032300
(  0) 0) |
| [6] |
Balbi T, Smerilli A, Fabbri R, et al. Co-exposure to n-TiO2 and Cd2+ results in interactive effects on biomarker responses but not in increased toxicity in the marine bivalve M. galloprovincialis[J]. Science of the Total Environment, 2014, 493: 355-364. DOI:10.1016/j.scitotenv.2014.05.146
(  0) 0) |
| [7] |
Hu X L, Chen Q Q, Jiang L, et al. Combined effects of titanium dioxide and humic acid on the bioaccumulation of cadmium in zebrafish[J]. Environmental Pollution, 2011, 159(5): 1151-1158. DOI:10.1016/j.envpol.2011.02.011
(  0) 0) |
| [8] |
Canesi L, Ciacci C, Fabbri R, et al. Bivalve molluscs as a unique target group for nanoparticle toxicity[J]. Marine Environmental Research, 2012, 76: 16-21. DOI:10.1016/j.marenvres.2011.06.005
(  0) 0) |
| [9] |
韩庆喜, 高雯芳, 李宝泉, 等. 胶州湾菲律宾蛤仔生物量与资源评估[J]. 动物学杂志, 2004, 39(5): 60-62. Han Q X, Gao W F, Li B Q, et al. Evaluation on the biomass and resource of Ruditapes philippinarum from Jiaozhou Bay[J]. Chinese Journal of Zoology, 2004, 39(5): 60-62. DOI:10.3969/j.issn.0250-3263.2004.05.013 (  0) 0) |
| [10] |
彭玲, 曾江宁, 陈全震, 等. 镉对厚壳贻贝急性毒性及对其鳃抗氧化酶活性的影响[J]. 环境科学与技术, 2015, 38(2): 13-18. Peng L, Zeng J N, Chen Q Z, et al. Effects of cadmium on antioxidant enzyme activity in gill of Mytilus coruscus and acute toxicity of cadmium on Mytilus coruscus[J]. Environmental Science & Technology, 2015, 38(2): 13-18. (  0) 0) |
| [11] |
EPA. Priority Pollutant List[EB/OR]. (2014-12-1)[2018-01-15]. https://www.epa.gov/sites/production/files/2015-09/documents/priority-pollutant-list-epa.pdf
(  0) 0) |
| [12] |
European Union. Decision No. 2455/2001/EC of the European Parliament and of the Council of 20 November 2001 establishing the list of priority substances in the field of water policy and amending Directive 2000/60/EC[J]. Official Journal of the European Communities, 2001, 331: 1-5.
(  0) 0) |
| [13] |
刘慧杰, 刘文君, 刘继平, 等. 南中国海表层海水重金属含量及其潜在生态风险分析[J]. 中国环境科学, 2017, 37(10): 3891-3898. Liu H J, Liu W J, Liu J P, et al. Heavy metals concentration and its potential ecological risk assessment of surface seawater in South China Sea[J]. China Environmental Science, 2017, 37(10): 3891-3898. DOI:10.3969/j.issn.1000-6923.2017.10.034 (  0) 0) |
| [14] |
Figueira E, Cardoso P, Freitas R. Ruditapes decussatus and Ruditapes philippinarum exposed to cadmium: Toxicological effects and bioaccumulation patterns[J]. Comp Biochem Physiol C-Toxicol Pharmacol, 2012, 156(2): 80-86. DOI:10.1016/j.cbpc.2012.04.004
(  0) 0) |
| [15] |
于庆云, 王悠, 徐彦, 等. 镉和铅对菲律宾蛤仔脂质过氧化及抗氧化酶活性的影响[J]. 生态毒理学报, 2013, 8(4): 504-512. Yu Q Y, Wang Y, Xu Y, et al. Eeffects of cadmium and lead on the lipid peroxidation and levels of antioxidant enzymes in Ruditapes philippinarum[J]. Asian Journal of Ecotoxicology, 2013, 8(4): 504-512. (  0) 0) |
| [16] |
Sheehan D, Meade G, Foley V M, et al. Structure, function and evolution of glutathione transferases: Implications for classification of non-mammalian members of an ancient enzyme superfamily[J]. Biochem J, 2001, 360: 1-16. DOI:10.1042/bj3600001
(  0) 0) |
| [17] |
张英.扇贝体内生物标志物对重金属与多环芳烃胁迫的应答[D].青岛: 中国科学院研究生院(海洋研究所), 2010. Zhang Y, Biomarker Responses to Heavy Metals and Polyeyelic Aromatic Hydroearbons Exposure in Bivalve (Chlamys Farreri)[D].Qingdao: The Institute of Oceanology, Chinese Academy of Scince, 2010. http://cdmd.cnki.com.cn/Article/CDMD-80068-2010147094.htm (  0) 0) |
| [18] |
Amiard J C, Amiard-Triquet C, Barka S, et al. Metallothioneins in aquatic invertebrates: Their role in metal detoxification and their use as biomarkers[J]. Aquatic Toxicology, 2006, 76(2): 160-202. DOI:10.1016/j.aquatox.2005.08.015
(  0) 0) |
| [19] |
Mourgaud Y, Martinez E, Geffard A, et al. Metallothionein concentration in the mussel Mytilus galloprovincialis as a biomarker of response to metal contamination: Validation in the field[J]. Biomarkers, 2002, 7(6): 479-490. DOI:10.1080/1354750021000034528
(  0) 0) |
| [20] |
Ji C, Wu H, Zhou M, et al. Multiple biomarkers of biological effects induced by cadmium in clam Ruditapes philippinarum[J]. Fish & Shellfish Immunology, 2015, 44(2): 430-435.
(  0) 0) |
| [21] |
Yang C Y, Liu S J, Zhou S W, et al. Allelochemical ethyl 2-methyl acetoacetate (ema) induces oxidative damage and antioxidant responses in Phaeodactylum tricornutum[J]. Pesticide Biochemistry and Physiology, 2011, 100(1): 93-103. DOI:10.1016/j.pestbp.2011.02.014
(  0) 0) |
| [22] |
Cuypers A, Plusquin M, Remans T, et al. Cadmium stress: An oxidative challenge[J]. Biometals, 2010, 23(5): 927-940. DOI:10.1007/s10534-010-9329-x
(  0) 0) |
| [23] |
Harris E D. Regulation of antioxidant enzymes[J]. Journal of Nutrition, 1992, 122(3): 625-626.
(  0) 0) |
| [24] |
Stohs S J, Bagchi D, Hassoun E, et al. Oxidative mechanisms in the toxicity of chromium and cadmium ions[J]. Journal of Environmental Pathology Toxicology and Oncology, 2000, 19(3): 201-213.
(  0) 0) |
| [25] |
Canesi L, Frenzilli G, Balbi T, et al. Interactive effects of n-TiO2 and 2, 3, 7, 8-TCDD on the marine bivalve Mytilus galloprovincialis[J]. Aquatic Toxicology, 2014, 153: 53-65. DOI:10.1016/j.aquatox.2013.11.002
(  0) 0) |
| [26] |
Balbi T, Smerilli A, Fabbri R, et al. Co-exposure to n-TiO2 and Cd2+ results in interactive effects on biomarker responses but not in increased toxicity in the marine bivalve M. galloprovincialis[J]. Science of The Total Environment, 2014, 493: 355-364. DOI:10.1016/j.scitotenv.2014.05.146
(  0) 0) |
| [27] |
Cherchi C, Chernenko T, Diem M, et al. Impact of nano titanium dioxide exposure on cellular structure of Anabaena variabilis and evidence of internalization[J]. Environ Toxicol Chem, 2011, 30(4): 861-869. DOI:10.1002/etc.v30.4
(  0) 0) |
| [28] |
Sendra M, Pintado-Herrera M G, Aguirre- Martínez G V, et al. Are the TiO2 NPs a "Trojan horse" for personal care products (PCPs) in the clam Ruditapes philippinarum?[J]. Chemosphere, 2017, 185: 192-204. DOI:10.1016/j.chemosphere.2017.07.009
(  0) 0) |
| [29] |
刘雪岩, 杨丽君, 金燕利, 等. 纳米TiO2对镉(Ⅱ)的吸附性能[J]. 中国有色金属学报, 2011, 21(11): 2971-2977. Liu X Y, Yang L J, Jin Y L, et al. Adsorption properties of nano-TiO2 for Cd(Ⅱ)[J]. The Chinese Journal of Nonferrous Metals, 2011, 21(11): 2971-2977. (  0) 0) |
| [30] |
肖丽华, 李大光. 纳米TiO2对铅镉离子的吸附性能研究[J]. 广州化工, 2006, 34(3): 35-37. Xiao L H, Li D G. Adsorption of Pb(Ⅱ) and Cd(Ⅱ) on nano size titanium(Ⅳ) qxide[J]. Guangzhou Chemical Industry, 2006, 34(3): 35-37. DOI:10.3969/j.issn.1001-9677.2006.03.015 (  0) 0) |
2. Key Laboratory of Marine Environment and Ecology, Ministry of Education, Ocean University of China, Qingdao 266100, China
 2019, Vol. 49
2019, Vol. 49


