2. 青岛海洋科学与技术试点国家实验室,山东 青岛 266237
维生素D作为一种类固醇激素在维持动物体内钙磷代谢稳态、促进骨骼发育等方面发挥至关重要的作用[1]。维生素D的主要形式包括维生素D2(VD2,麦角钙化醇)和维生素D3(VD3,胆钙化醇);前者主要存在于植物中,后者是动物体内的主要存在形式。VD3可以通过动物皮肤中7-脱氢胆固醇经阳光中紫外线照射形成,也可以通过食物获取;而动物体内的VD3可被代谢转变为25-羟基维生素D3 [25(OH)D3]以及1α, 25-二羟基维生素D3 [1α, 25(OH)2D3]。最初的研究显示VD具有预防佝偻病的作用,近些年越来越多的研究表明VD除了传统已知的调节体内钙磷吸收以及骨质矿化的作用以外,还具有十分广泛的生理学作用,包括调控免疫系统、抗炎抗感染、抵御癌症、调节营养代谢以及肠道菌群等功能[1-2]。已有的研究表明VD主要通过与维生素D受体(VDR)结合发挥其广泛的生理学功能。
与高等动物相比,鱼体内VD3的代谢调控及其功能的研究相对较少。本文总结了动物体内VD3的来源以及不同鱼类VD的需求量,同时重点比较了鱼类和高等动物对于VD3的来源、代谢以及VDR的差异,并概述了VD3对于鱼类生理功能调控的研究进展。
1 维生素D3的来源对于大多数陆生高等动物而言,VD主要是通过皮肤由太阳紫外线的能量光化学转化而成,也可以通过食物获取部分VD。高等动物皮肤暴露在阳光的波长290~320 nm紫外线下,可诱导7-脱氢胆固醇光解,然后再通过热异构转化为VD3[1]。与陆生动物相比,许多鱼类生活在紫外线无法穿透的深水中。早期的研究结果发现利用紫外线照射斑点叉尾鮰(Ictalurus punctatus)并不能提高其体内VD的含量[3],而大西洋鲈(Roccus saxtilis)皮肤中的7-脱氢胆固醇也不能通过紫外线照射转化为VD3,同时大西洋鲈肝脏匀浆液与同位素标记的7-脱氢胆固醇混合后也没有形成同位素标记的VD3[4]。尽管有研究发现紫外线照射能使冷藏的鲣鱼(Katsuwonus pelamis)肌肉中的VD3含量显著增加[5],并且莫桑比克罗非鱼(Oreochromis mossambicus)在接受紫外线照射之后其体内的7-脱氢胆固醇明显减少,而VD3显著增加[6],但是这两篇报道都认为在自然环境中鱼体无法把7-脱氢胆固醇转变成VD3。另一方面,一些报道证实了暴露在水面紫外线下的浮游动物和浮游植物含有维生素D,因此目前普遍认为鱼类自身无法合成VD3,其肝脏和脂肪组织中的VD3主要来自于食物链[7]。但是Pierens等在2015年报道虹鳟(Oncorhynchus mykiss)皮肤中的7-脱氢胆固醇可被波长为380~480 nm的可见光转变成VD3[8]。考虑到鱼类生活的水环境相对复杂,可接受光照的情况差异巨大,因此不同习性的鱼类是否存在不同的VD来源还值得进一步探究。
2 维生素D的需求量Barnett等以虹鳟为研究对象,于1979年首次证明了鱼类饲料中添加VD的重要性[9],而鱼类VD缺乏症表现为表皮层变薄、底层肌肉组织坏死以及血钙浓度明显降低等[10]。根据美国科学院国家研究委员会(NRC)在2011发布的水产动物营养需求量,不同鱼类的VD营养需求量有很大的差异。重要的淡水养殖鱼类罗非鱼(Oreochromis niloticus ×O. aureus)、斑点叉尾鮰(Ictalurus punctatus)以及虹鳟达到最佳生长状态时,其饲料中VD的最低添加量分别为360、500和1 600 IU/kg;而具有代表性的几种海水鱼类的VD最低需求量未见报道[11]。根据中国水产饲料行业标准,冷向军总结了中国几种常见养殖鱼类(草鱼、青鱼、鲤鱼、鲫鱼、罗非鱼和长吻鮠)配合饲料中维生素D推荐添加量为400~2 000 IU/kg[12]。
尽管大部分鱼对过量的VD3表现出较高的耐受性,饲料中添加过量VD3并不会明显影响鱼体的生长指标[13-14]。例如挪威食品安全局建议鱼类,尤其是鲑科类,饲料中VD3含量的安全上限可达60 000 IU/kg(1.5 mg/kg)[14]。但是在其它鱼类的研究中发现,用添加过量VD3(200 000 IU/kg)的饲料投喂团头鲂(Megalobrama amblycephala)3个月之后,其肠道和肝脏组织结构表现出不同程度的损伤,同时鱼体的免疫功能及抗感染能力都明显下降[15]。与此相似,当饲料添加过量的VD3(200 000 IU/kg)或1α, 25(OH)2D3(20 000 IU/kg)时,牙鲆(Paralichthys olivaceus)幼鱼的死亡率及腹面色素沉着比例升高,脊柱畸形比例显著增加[16];而用含有过量VD3(≥19 200 IU/kg)的饲料投喂欧洲鲈(Dicentrachus labrax)的幼鱼也会严重影响鱼体的骨质矿化,并导致骨骼发育畸形,同时损伤其肠道发育及钙吸收功能[17]。因此欧洲食品安全局的动物饲料添加剂专责组设定鱼类饲料中的VD3安全添加上限为3 000 IU/kg(0.075 mg/kg)[14]。
由于不同生活习性、不同食性以及不同生长阶段的鱼类对于维生素D需求量可能存在巨大的差异,而目前研究数据显示的鱼类最佳生长状态时饲料中VD的添加量范围也并不一定与其最佳免疫状态的需求量吻合,因此在未来的研究中需要进一步完善不同鱼类在不同生长阶段以及不同生理状态下维生素D需求量的精准数据库。
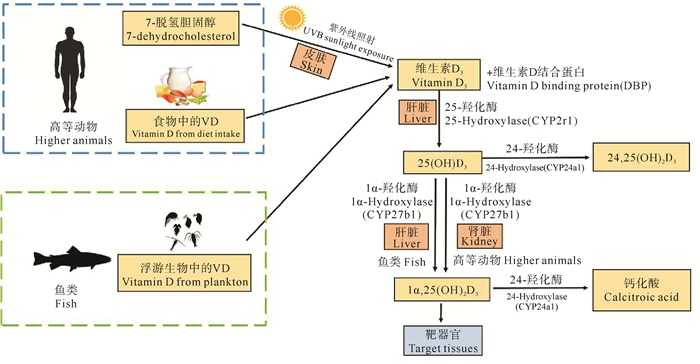
3 维生素D3的代谢过程动物体内VD3主要通过三种细胞色素P450(Cytochrome P450, CYP)羟化酶进行代谢激活和降解,这三种酶分别是25-羟化酶(25-hydroxylase,由CYP2R1基因编码)、1α-羟化酶(1 alpha-hydroxylase,由CYP27B1基因编码)以及24-羟化酶(24-hydroxylase,由CYP24A1基因编码)。食物中摄入的VD3以及皮肤生成的VD3进入血液后,由血浆中的维生素D3结合蛋白(DBP)转运至肝脏,在25-羟化酶的作用下转化为25(OH)D3[18]。在肝脏中生成的25(OH)D3再次与DBP结合转运至肾脏,之后被1α-羟化酶第二次羟基化,形成有生物活性的1α, 25(OH)2D3,又称为活性维生素D3[13, 19]。而活性1α, 25(OH)2D3以及过量的25(OH) D3会被24-羟化酶进一步代谢为不同的23-或24-羟化产物,并被排出体外[20](见图 1)。Zhu等在对CYP2R1基因敲除小鼠的研究中发现,这些小鼠的血清中25(OH)D3水平下降超过一半,但并未完全消失,而血清中1α, 25(OH)2D3的水平保持不变,因此推测小鼠中极有可能存在其他未知的酶作用于活性维生素D3的合成[18]。
|
图 1 动物体内维生素D3的代谢过程图示 Fig. 1 The metabolic process of vitamin D3 in animals |
维生素D的代谢过程具有较高的进化保守性[20]。已有研究发现,鱼类具有与高等动物相似的维生素D体内代谢途径以及维生素D代谢酶,但是两者之间仍存在一定的差异。首先,高等动物中25(OH)D3被转运至肾脏进行第二次羟基化,但是鱼类的肝脏也具有1α-羟化酶活性,因此25(OH)D3也能在鱼类的肝脏中进行第二次羟基化[21-22],而Graff等在检测了不同鱼种的不同组织器官中VD3代谢物的含量之后也推测VD3代谢的组织特异性在鱼类中比人类要低[23]。其次,人类血液中25(OH)D3含量通常比1α, 25(OH)2D3要高得多,血液25(OH)D3含量也是评价人体VD3含量的主要指标,但是鱼类血液中1α, 25(OH)2D3是VD3代谢物的主要循环形式,其含量可达到人类血液中的几倍甚至几十倍[13]。此外,某些深海鱼类的肝脏与脂肪组织中VD3的含量远远高于陆地脊椎动物[4]。这些鱼类肝脏与脂肪组织中的VD3大部分是以长链脂肪酸酯化的形式贮存,在正常情况下不会被分解代谢,而长链脂肪酸酯化VD3仅是哺乳动物组织中VD3非常小的组成部分[8]。
在高等动物中1α, 25(OH)2D3的合成与代谢受到严格的调控,已有的研究发现血钙浓度、甲状旁腺激素(Parathyroid hormone, PTH)、成纤维细胞生长因子23(FGF23)以及1α, 25(OH)2D3本身都能够调节肾脏中CYP27B1的表达以及1α, 25(OH)2D3的合成[1, 20],而最近的研究结果阐明小鼠的肠道菌群通过影响FGF23的表达进而调控体内VD3代谢[24]。在鱼类中有关VD3代谢调控的研究相对较少,早期以虹鳟以及银鳗(Anguilla anguilla)为研究对象的实验结果表明水环境中的钙离子浓度影响鱼体内VD3的代谢[25-26];进一步的研究也证实虹鳟肝脏和肾脏的VD3代谢能力在淡水和海水中表现出明显的差异[27]。而最新发表的研究结果发现虹鳟在缺氧的条件下体内CYP2R1和CYP27B1的基因表达显著下降,从而导致维生素D代谢异常[28]。此外,皮质醇也能够调节斑马鱼(Danio rerio)体内VD3代谢进而促进鱼体的钙吸收[29]。
在高等动物中肾脏合成1α, 25(OH)2D3的能力随着年龄的增长而逐渐下降[30]。与此相似,研究结果也发现超过3月龄达到性成熟之后斑马鱼肝脏中CYP2R1和CYP27B1的表达急剧降低,而CYP24A1的表达明显升高,同时血清中的1α, 25(OH)2D3含量显著降低[31]。由于1α, 25(OH)2D3调控动物体肠道钙吸收,这些发现也部分解释了与年龄相关的骨质流失现象。
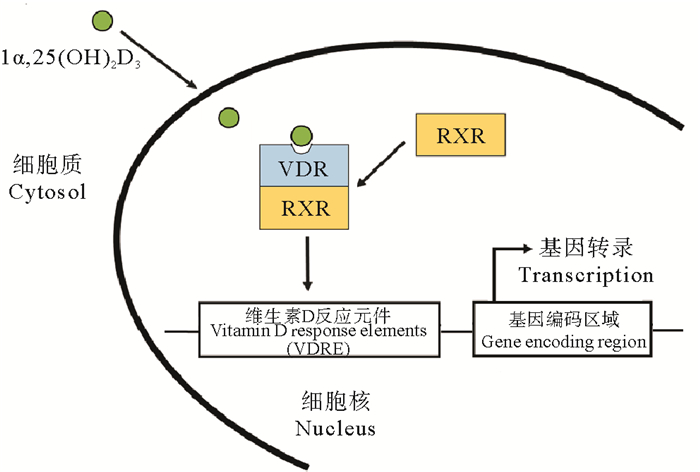
4 维生素D受体(VDR)维生素D3主要是通过其活性形式1α, 25(OH)2D3与核受体VDR结合以完成其生理学功能。当游离的1α, 25(OH)2D3以自由扩散的方式进入细胞后,迅速与VDR结合形成复合物[32]。该复合物与维甲酸视黄醇X受体(RXR)形成异二聚体,VDR-RXR异二聚体可与目标基因启动子区域VDR反应元件(VDRE)结合,调控其mRNA的转录[33](见图 2)。VDR不仅存在于与骨骼生长和维持矿物质稳态有关的细胞中,在大多数组织细胞中均有分布[33],这也间接表明了1α, 25(OH)2D3具有广泛的生理学作用。
|
图 2 维生素D受体(VDR)的作用机制 Fig. 2 The mechanism of vitamin d receptor (VDR) function |
目前已经测定VDR基因序列的鱼种如下:比目鱼(Paralichthys olivaceus)、青鳉(Oryzias latipes)、河豚(Takifugu rubripes)、棘鱼(Gasterosteus aculeatus)、大西洋鲑(Salmo salar)、鲤鱼(Cyprinus carpio)、欧洲鲈、斑马鱼和虹鳟等[34-36]。与哺乳动物只具有一个VDR不同,大多数鱼类的VDR存在两个亚型(VDRα和VDRβ),两者的基因与蛋白质序列极为相似,但通常分布于不同的组织器官中[34, 37-38]。在斑马鱼中的研究结果显示几乎在所有不同的组织中都能检测到VDRα的基因表达,但是VDRβ基因仅仅在肌肉和卵巢中高表达[31]。在对斑马鱼和青鳉中两个VDR亚型进行研究之后发现,尽管两种鱼的VDRα和VDRβ对1α, 25(OH)2D3具有相似的亲和力,但是VDRα与DNA结合能力显著高于VDRβ,同时两者对于转录辅因子的结合能力也有所不同,最终导致1α, 25(OH)2D3与VDRα的结合表现出更高的转录激活效应[35]。此外,当斑马鱼VDRα与1α, 25(OH)2D3结合时的活性构象与人源VDR活性构象极为相似,因此推测VDRα基因很可能与高等动物的同源[39]。而对于斑马鱼VDR功能的研究也进一步证实,VDRα主要与钙磷代谢调节有关[40],而VDRβ与心脏、内耳等器官的发育密不可分[37, 41]。但是对于两种VDR在鱼体内具体的分子作用机制仍需要更深入的研究。
5 维生素D3的生理功能大量的研究结果已经证实VD3除了调节动物体内钙磷稳态,还具有十分广泛的生理学作用,尤其是VD3对机体免疫系统的调控已成为高等动物中相关领域的研究热点。在鱼类的研究中,通过转录组学的研究方法发现在黄颡鱼(Pelteobagrus fulvidraco)饲料中添加不同含量VD3会对鱼体生长代谢以及相关调控基因表达产生广泛的影响[42];而水体中加入微量1α, 25(OH)2D3也影响斑马鱼早期胚胎中千余种RNA的表达,包括编码不同的转录因子、多肽激素以及多种与脂肪酸和氨基酸代谢相关蛋白质的RNA[43]。此部分将小结VD3调控鱼体钙磷及骨质代谢、免疫系统以及其它生理学功能的研究进展。
5.1 维生素D3对钙磷及骨质代谢的影响与高等动物相似,VD3也能够调节鱼体中钙磷水平[13, 44]。早期的研究结果表明VD3可以促进胡鲶(Clarias batrachus)[45]、鲤(Cyprinus carpio)[46]、大西洋真鳕(Gadus morhua)[47]和黄鳝(Monopterus albus)[48]等不同鱼种血钙水平的升高。在斑马鱼中进一步的机理研究发现1α, 25(OH)2D3通过VDRα刺激上皮钙通道(Epithelial calcium channel)基因表达,从而促进机体钙离子的吸收以及血钙水平的增加[40]。此外,鳃是鱼类从环境中摄入Ca2+的重要器官之一,在很多硬骨鱼类的鳃中均有VDR的表达[49-50]。与钙离子不同的是,水体中磷含量通常很低,所以鱼类主要从食物中摄取磷。已有的研究也报道了VD3提高美洲鳗(Anguilla rostrata)[51]、刺鲶(Heteropneustes fossilis)[52]、胡鲶[45]和虹鳟[53]等血磷水平。肠道是动物体钙磷吸收的重要场所,大量的研究也报道了鱼类肠道高表达VDR[34, 49];而VD3也能够调节美洲鳗肾脏对磷的再吸收[54]。近几年的一项研究发现饲料中添加适量的VD3可以提高黄颡鱼肠道和肾脏中磷转运体SLC34基因的表达,从而促进鱼体内磷的吸收利用[55]。维生素D3对鱼类骨质矿化和代谢的影响也有诸多报道,例如腹腔注射VD3能有效提高南极岩鳕鱼(Pagothenia bernacchii)的骨质矿化[56],而水体添加VD3也增强斑马鱼幼鱼的骨质矿化[57]。此外,VD3也能够直接影响金鲫鱼(Carassius auratus)成骨细胞的生成及活性[58]。
5.2 维生素D3对免疫功能的影响在高等动物中大量的研究表明VD3具有广泛的免疫调节功能[2]。维生素D3对免疫细胞的调控主要依赖于其胞内VDR[59],而在淋巴窦、扁桃腺、胸腺等免疫相关组织中以及单核细胞、树突状细胞、B细胞和T细胞等都表达VDR[60-61]。已有的实验结果也证实1α, 25(OH)2D3对B淋巴细胞、T淋巴细胞、巨噬细胞等免疫细胞的增殖分化和细胞功能具有调控作用[2]。近些年的研究表明VD3通过调节上皮细胞及免疫细胞的功能进而调控胃肠道的稳态[62]。此外,作者及其他研究者的实验结果也进一步证实1α, 25(OH)2D3显著增强人类巨噬细胞中抗菌肽的表达[63],从而提高机体对病原菌感染的抵御[64],尤其是能有效促进巨噬细胞对胞内结核杆菌(Mycobacterium tuberculosis)的清除能力[64-68]。值得一提的是,VD3除了通过上文描述的内分泌方式发挥作用,许多研究已经阐明病原菌感染可以激活免疫细胞中CYP27B1基因,从而使免疫细胞能够将25(OH)D3代谢为活性1α, 25(OH)2D3[69],因此1α, 25(OH)2D3也能够通过旁分泌和自分泌等方式发挥免疫调节作用[70-71]。
在鱼类中的研究表明VD3影响鱼类免疫系统及其抗菌能力。在大西洋鲷(Sparus aurata L.)的投喂饲料中添加适量VD3可以显著提高头肾免疫细胞的吞噬能力和血清过氧化氢酶水平,但是对于血清补体活性以及白细胞呼吸爆发活性等免疫指标无显著差异[72],而最近的一篇研究报道发现VD3能够提高大西洋鲑原代巨噬细胞中白细胞趋化因子2(leukocyte-derived chemotaxin 2)的基因表达,同时VD3与巨噬细胞共孵育可降低沙门氏菌对巨噬细胞的粘附,从而提高巨噬细胞的抗菌能力[73]。
以建鲤(Cyprinus carpio var. Jian)原代肠细胞为研究对象的实验结果显示1α, 25(OH)2D3能有效抑制由脂多糖(LPS)激活的Toll样受体4(TLR4)-髓样分化初级应答基因88(MyD88)信号通路,进一步动物学体内实验结果也验证了VD3的抗炎作用,并能有效保护由LPS所导致的肠道损伤[74]。与此相似,在黄颡鱼中的研究也证明了VD3的抗炎作用,实验结果表明VD3可通过抑制脾脏中NF-κB信号通路来调节爱德华氏菌(Edwardsiella ictaluri)感染后所引起的鱼体固有免疫反应,包括下调促炎因子肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)等[75]。此外,免疫细胞膜上的主要组织相容性复合体(Major Histocompatibility Complex, MHC)可与抗原结合, 并呈递给T淋巴细胞, 从而激发机体适应性免疫反应。近年的一篇研究报道显示饲料中添加适量VD3显著诱导黄颡鱼小肠及肾脏中MHC class Ⅱ基因的上调表达,从而促进机体抵抗致病菌的侵入[76]。
与高等动物相似,VD3也能够提高鱼体内抗菌肽的表达。黎德兵等发现在饲料中添加500 IU /kg VD3可显著提高黄鳝肝胰脏和头肾中鱼类抗菌肽铁调素(Hepcidin)的表达量[77];Dioguardi等的研究显示VD3也能够增强欧洲鲈肠道中抗菌肽铁调素的基因表达,同时明显提高腹腔巨噬细胞的噬菌能力[78]。而大鳞大麻哈鱼(Oncorhynchus tshawytscha)胚胎细胞系CHSE-214与20 nmol/L维生素D3共孵育72 h之后,细胞中抗菌肽cathelicidin-2基因表达以及细胞的抑菌能力显著升高[79]。
总体而言,VD3对鱼类免疫系统的调控机制仍然知之甚少,尤其是VD3对鱼体适应性免疫系统的影响鲜有报道,而VD3对鱼类免疫系统的调控是否存在有别于高等动物的作用机制仍有待进一步的探究。
5.3 维生素D3的其他功能维生素D3除了上述对钙磷代谢、骨骼形成以及免疫功能的影响以外,在调控动物体的发育、组织再生、营养代谢、肠道菌群等不同方面具有广泛而重要的作用。最近在斑马鱼中的研究发现VD3能够促进其心肌细胞增殖以及受损心脏的再生[80];此外VD3也调节斑马鱼造血干细胞(HSPC)的体内生成[81]。在高等动物中的研究表明1α, 25(OH)2D3能够作用于胰岛β细胞,促使细胞内Ca2+浓度以及胰岛素受体mRNA表达水平升高从而加速胰岛素合成[82-83],因此VD3缺乏与肥胖、高血糖及相关代谢综合征紧密相关。与高等动物不同,鱼类的胰岛素分泌水平较低,因此鱼类被认为是先天的“糖尿病患者”,而能否通过补充VD3来影响鱼体内糖代谢这个科学问题仍有待更多的研究来回答。此外,VD3对动物体的脂肪代谢也产生影响。有研究发现小鼠血液中载脂蛋白含量随25(OH)D3浓度增加而增加[84],而载脂蛋白对动物体内胆固醇水平具有重要的调节作用[85];同时钙和1α, 25(OH)2D3也可调节脂肪细胞中脂肪酸氧化,并抑制脂质合成[86]。针对斑马鱼早期胚胎的转录组检测结果显示1α, 25(OH)2D3调控发育早期斑马鱼中的脂肪酸代谢[43],而Peng等通过敲除斑马鱼中CYP2R1基因阻断斑马鱼体内1α, 25(OH)2D3合成,进而导致成鱼鱼体出现明显的脂肪堆积,同时也阐明了1α, 25(OH)2D3通过线粒体生成的关键调控因子PGC-1α通路调节鱼体的脂肪代谢[31]。
近几年越来越多的研究结果揭示了VD3与肠道菌群的密切关联。在高等动物中的研究显示VDR基因突变对于肠道共生菌群具有显著的影响,而利用维生素D3代谢酶或者 VDR基因敲除动物所获得的实验结果也表明维生素D3信号通路的缺失导致肠道菌群的失衡,进而诱发各种代谢疾病[87-88];而另一方面,在无菌小鼠中VD3的代谢也显著下降[24]。到目前为止在鱼类中未见任何有关VD与肠道菌群互作关系的报道,本研究团队针对大菱鲆(Scophthalmus maximus L.)的最新研究结果表明饲料中添加不同含量VD3对大菱鲆肠道菌群组成及多样性有明显的影响(未发表数据)。
6 研究展望相较于高等动物,鱼类中维生素D相关的研究尚处于起步阶段,诸多方面的问题亟待更加深入的探究。根据现有的研究结果,进一步探查不同生活习性的鱼类在VD来源以及代谢调控方面的差异,极有可能获得一些重要的新发现,同时也有利于人类更好地利用鱼类VD作为优质的VD来源。其次,在鱼类中不仅VD内分泌的调控机制需要更深入的研究,同时VD在鱼类中能否如在高等动物中那样通过旁分泌或自分泌的方式发挥其生理作用也值得进一步的验证。此外,前期的研究已表明VD3对鱼类具有十分广泛而重要的生理调控作用,因此探明VD3在鱼类中未知的生理调控机制,尤其是在感染免疫、营养代谢、肠道菌群等方面将会是未来的研究热点,这部分的研究内容也将从比较生物学的角度为高等动物中的相关研究提供重要的参考。而深入分析鱼类中两种VDR亚型在这些生理过程中的作用机制将有助于进一步了解VD对鱼类生理功能的分子调控机理,并有可能发现有别于陆生高等动物的独特之处。以上的这些研究内容将深化人们对不同动物体如何获取和利用VD的认知,为鱼类VD的精准需求以及代谢调控提供理论指导,进而在产业上优化养殖鱼类人工饲料的配制,促进水产养殖业绿色健康的发展。
| [1] |
Christakos S, Dhawan P, Verstuyf A, et al. Vitamin D: Metabolism, molecular mechanism of action, and pleiotropic effects[J]. Physiological Reviews, 2016, 96(1): 365-408.
(  0) 0) |
| [2] |
Sassi F, Tamone C, D'amelio P. Vitamin D: Nutrient, hormone, and immunomodulator[J]. Nutrients, 2018, 10(11): 1656.
(  0) 0) |
| [3] |
Bills C E. Antiricketic substances Ⅵ. The distribution of vitamin D, with some notes on its possible origin[J]. Journal of Biological Chemistry, 1927, 72(2): 751-758.
(  0) 0) |
| [4] |
Blondin G A, Kulkarni B D, Nes W R. A study of the origin of vitamin-D from 7-dehydrocholesterol in fish[J]. Comparative Biochemistry and Physiology, 1967, 20(2): 379-390.
(  0) 0) |
| [5] |
Hidaka A, Suzuki H, Hayakawa S, et al. Conversion of provitamin D3 to vitamin D3 by monochromatic ultraviolet rays in fish dark muscle mince[J]. Journal of Food Science, 1989, 54(4): 1070-1071.
(  0) 0) |
| [6] |
Rao D S, Raghuramulu N. Vitamin D3 in Tilapia mossambica: Relevance of photochemical synthesis[J]. Journal of Nutritional Science and Vitaminology, 1997, 43(4): 425-433.
(  0) 0) |
| [7] |
Rao D S, Raghuramulu N. Food chain as origin of vitamin D in fish[J]. Comparative Biochemistry and Physiology Part A: Physiology, 1996, 114(1): 15-19.
(  0) 0) |
| [8] |
Pierens S L, Fraser D R. The origin and metabolism of vitamin D in rainbow trout[J]. Journal of Steroid Biochemistry and Molecular Biology, 2015, 145: 58-64.
(  0) 0) |
| [9] |
Barnett B J, Cho C Y, Slinger S J. The essentiality of cholecalciferol in the diets of rainbow trout (Salmo gairdneri)[J]. Comparative Biochemistry and Physiology Part A: Physiology, 1979, 63(2): 291-297.
(  0) 0) |
| [10] |
Taveekijakarn P, Miyazaki T, Matsumoto M, et al. Histopathological and haematological changes in amago salmon, Oncorhynchus rhodurus (Jordan & McGregor), fed a vitamin-D-free diet[J]. Journal of Fish Diseases, 1996, 19(4): 289-294.
(  0) 0) |
| [11] |
National Research Council of USA. Nutrient Requirements of Fish and Shrimp[M]. Pittsburgh: The National Academies Press, 2011.
(  0) 0) |
| [12] |
冷向军. 水产动物维生素营养研究进展[J]. 饲料工业, 2017, 38(16): 1-6. Leng X J. Research advance in vitamin nutrition of aquatic animals[J]. Feed Industry, 2017, 38(16): 1-6. (  0) 0) |
| [13] |
Lock E J, Waagbϕ R, Bonga S W, et al. The significance of vitamin D for fish: A review[J]. Aquaculture Nutrition, 2010, 16(1): 100-116.
(  0) 0) |
| [14] |
Rychen G, Aquilina G, Azimonti G, et al. Safety of vitamin D3 addition to feedingstuffs for fish[J]. Efsa Journal, 2017, 15(3): 4713.
(  0) 0) |
| [15] |
Miao L H, Xie J, Ge X P, et al. Chronic stress effects of high doses of vitamin D3 on Megalobrama amblycephala[J]. Fish and Shellfish Immunology, 2015, 47(1): 205-213.
(  0) 0) |
| [16] |
Haga Y, Takeuchi T, Murayama Y, et al. Vitamin D3 compounds induce hypermelanosis on the blind side and vertebral deformity in juvenile Japanese flounder Paralichthys olivaceus[J]. Fisheries Science, 2004, 70(1): 59-67.
(  0) 0) |
| [17] |
Darias M J, Mazurais D, Koumoundouros G, et al. Dietary vitamin D3 affects digestive system ontogenesis and ossification in European sea bass (Dicentrachus labrax, Linnaeus, 1758)[J]. Aquaculture, 2010, 298(3): 300-307.
(  0) 0) |
| [18] |
Zhu J G, Ochalek J T, Martin K, et al. CYP2R1 is a major, but not exclusive, contributor to 25-hydroxyvitamin D production in vivo[J]. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(39): 15650-15655.
(  0) 0) |
| [19] |
Chun R F, Peercy B E, Orwoll E S, et al. Vitamin D and DBP: The free hormone hypothesis revisited[J]. Journal of Steroid Biochemistry and Molecular Biology, 2014, 144: 132-137.
(  0) 0) |
| [20] |
Jones G, Prosser D E, Kaufmann M. Cytochrome P450-mediated metabolism of vitamin D[J]. Journal of Lipid Research, 2014, 55(1): 13-31.
(  0) 0) |
| [21] |
Takeuchi A, Okano T, Kobayashi T. The existence of 25-hydroxyvitamin D3-1 alpha-hydroxylase in the liver of carp and bastard halibut[J]. Life Sciences, 1991, 48(3): 275-282.
(  0) 0) |
| [22] |
Rao D S, Raghuramulu N. Vitamin D metabolism in tilapia (Oreochromis mossambicus)[J]. Comparative Biochemistry and Physiology Part C: Pharmacology, Toxicology and Endocrinology, 1998, 120(1): 145-149.
(  0) 0) |
| [23] |
Graff Lie Aksnes. In vitro hydroxylation of vitamin D3 and 25-hydroxy vitamin D3 in tissues of Atlantic salmon Salmo salar, Atlantic mackerel Scomber scombrus, Atlantic halibut Hippoglossus hippoglossus and Atlantic cod Gadus morhua[J]. Aquaculture Nutrition, 1999, 5(1): 23-32.
(  0) 0) |
| [24] |
Bora S A, Kennett M J, Smith P B, et al. The gut microbiota regulates endocrine vitamin D metabolism through fibroblast growth factor 23[J]. Frontiers in Immunology, 2018, 9: 408.
(  0) 0) |
| [25] |
Hayes M E, Guilland-Cumming D F, Russell R G, et al. Metabolism of 25-hydroxycholecalciferol in a teleost fish, the rainbow trout (Salmo gairdneri)[J]. General and Comparative Endocrinology, 1986, 64(1): 143-150.
(  0) 0) |
| [26] |
Bailly Du Bois M, Milet C, Garabedian M, et al. Calcium-dependent metabolism of 25-hydroxycholecalciferol in silver eel tissues[J]. General and Comparative Endocrinology, 1988, 71(1): 1-9.
(  0) 0) |
| [27] |
Sundh H, Larsson D, Sundell K. Environmental salinity regulates the in vitro production of[3H]-1, 25-dihydroxyvitamin D3 and[3H]-24, 25 dihydroxyvitamin D3 in rainbow trout (Oncorhynchus mykiss)[J]. General and Comparative Endocrinology, 2007, 152(2-3): 252-258.
(  0) 0) |
| [28] |
Hou Z S, Wen H S, Li J F, et al. Environmental hypoxia causes growth retardation, osteoclast differentiation and calcium dyshomeostasis in juvenile rainbow trout (Oncorhynchus mykiss)[J]. Science of the Total Environment, 2020, 705: 135272.
(  0) 0) |
| [29] |
Lin C H, Tsai I L, Su C H, et al. Reverse effect of mammalian hypocalcemic cortisol in fish: cortisol stimulates Ca2+ uptake via glucocorticoid receptor-mediated vitamin D3 metabolism[J]. Plos One, 2011, 6(8): 23689.
(  0) 0) |
| [30] |
Matkovits T, Christakos S. Variable in vivo regulation of rat vitamin D-dependent genes (osteopontin, Ca, Mg-adenosine triphosphatase, and 25-hydroxyvitamin D3 24-hydroxylase): implications for differing mechanisms of regulation and involvement of multiple factors[J]. Endocrinology, 1995, 136(9): 3971-3982.
(  0) 0) |
| [31] |
Peng X, Shang G, Wang W, et al. Fatty acid oxidation in zebrafish adipose tissue is promoted by 1alpha, 25(OH)2D3[J]. Cell Reports, 2017, 19(7): 1444-1455.
(  0) 0) |
| [32] |
Pike J W, Meyer M B, Lee S M, et al. The Vitamin D receptor: Contemporary genomic approaches reveal new basic and translational insights[J]. Journal of Clinical Investigation, 2017, 127(4): 1146-1154.
(  0) 0) |
| [33] |
Haussler M R, Whitfield G K, Haussler C A, et al. The nuclear vitamin D receptor: Biological and molecular regulatory properties revealed[J]. Journal of Bone and Mineral Research, 2010, 13(3): 325-349.
(  0) 0) |
| [34] |
Howarth D L, Law S H, Barnes B, et al. Paralogous vitamin D receptors in teleosts: transition of nuclear receptor function[J]. Endocrinology, 2008, 149(5): 2411-2242.
(  0) 0) |
| [35] |
Kollitz E M, Hawkins M B, Whitfield G K, et al. Functional diversification of vitamin D receptor paralogs in teleost fish after a whole genome duplication event[J]. Endocrinology, 2014, 155(12): 4641-4654.
(  0) 0) |
| [36] |
许友卿, 刘永强, 刘阳, 等. 维生素D3对鱼类的影响及其机理研究进展[J]. 饲料工业, 2014, 3(16): 26-30. Xu Y Q, Liu Y Q, Liu Y, et al. Progress of effect and mechanism of vitamin D3 on fish[J]. Feed Industry, 2014, 3(16): 26-30. (  0) 0) |
| [37] |
Kwon H J. Vitamin D receptor signaling is required for heart development in zebrafish embryo[J]. Biochemical & Biophysical Research Communications, 2016, 470(3): 575-578.
(  0) 0) |
| [38] |
Suzuki T, Suzuki N, Srivastava A S, et al. Identification of cDNAs encoding two subtypes of vitamin D receptor in flounder, Paralichthys olivaceus[J]. Biochemical and Biophysical Research Communications, 2000, 270(1): 40-45.
(  0) 0) |
| [39] |
Ciesielski F, Rochel N, Mitschler A, et al. Structural investigation of the ligand binding domain of the zebrafish VDR in complexes with 1α, 25(OH)2D3 and Gemini: Purification, crystallization and preliminary X-ray diffraction analysis[J]. The Journal of Steroid Biochemistry and Molecular Biology, 2004, 89-90(1-5): 55-59.
(  0) 0) |
| [40] |
Lin C H, Su C H, Tseng D Y, et al. Action of vitamin D and the receptor, VDRa, in calcium handling in zebrafish (Danio rerio)[J]. Plos One, 2012, 7(9): 45650.
(  0) 0) |
| [41] |
Kwon H J. Vitamin D receptor deficiency impairs inner ear development in zebrafish[J]. Biochemical and Biophysical Research Communications, 2016, 478(2): 994-998.
(  0) 0) |
| [42] |
冯美惠, 陈沛, 段鸣鸣, 等. 饲料VD3水平对黄颡鱼转录组差异基因表达的影响[J]. 水产学报, 2016, 40(9): 1289-1298. Feng M H, Chen P, Duan M M, et al. Effects of dietary vitamin D3 level on transcriptomic response in yellow catfish (Pelteobagrus fulvidraco)[J]. Journal of Fisheries of China, 2016, 40(9): 1289-1298. (  0) 0) |
| [43] |
Craig T, Zhang Y, Mcnulty M, et al. Research resource: whole transcriptome RNA sequencing detects multiple 1α, 25-dihydroxyvitamin D3-sensitive metabolic pathways in developing zebrafish[J]. Molecular Endocrinology, 2012, 26: 1630-1642.
(  0) 0) |
| [44] |
Verri T, Werner A. Type Ⅱ Na+-phosphate cotransporters and phosphate balance in teleost fish[J]. Pflügers Archiv-European Journal of Physiology, 2018, 471: 193-212.
(  0) 0) |
| [45] |
Swarup K, Norman A W, Srivastav A K, et al. Dose-dependent vitamin D3 and 1, 25-dihydroxyvitamin D3-induced hypercalcemia and hyperphosphatemia in male catfish Clarias batrachus[J]. Comparative Biochemistry and Physiology Part B: Comparative Biochemistry, 1984, 78(3): 553-555.
(  0) 0) |
| [46] |
Swarup K, Das V K, Norman A W. Dose-dependent vitamin D3 and 1, 25-dihydroxyvitamin D3-induced hypercalcemia and hyperphosphatemia in male cyprinoid Cyprinus carpio[J]. Comparative Biochemistry and Physiology Part A: Physiology, 1991, 100(2): 445-447.
(  0) 0) |
| [47] |
Sundell K, Björnsson B T. Effects of vitamin D3, 25(OH) vitamin D3, 24, 25(OH)2 vitamin D3, and 1, 25(OH)2 vitamin D3 on the in vitro intestinal calcium absorption in the marine teleost, Atlantic cod (Gadus morhua)[J]. General & Comparative Endocrinology, 1990, 78(1): 74-79.
(  0) 0) |
| [48] |
Tan Q, He R, Xie S, et al. Effect of dietary supplementation of vitamins A, D3, E, and C on yearling rice field eel, Monopterus albus: Serum indices, gonad development, and metabolism of calcium and phosphorus[J]. Journal of the World Aquaculture Society, 2010, 38(1): 146-153.
(  0) 0) |
| [49] |
Craig T A, Stacy S, Sussman C R, et al. Expression and regulation of the vitamin D receptor in the zebrafish, Danio rerio[J]. Journal of Bone and Mineral Research, 2010, 23(9): 1486-1496.
(  0) 0) |
| [50] |
Hwang P P, Lee T H. New insights into fish ion regulation and mitochondrion-rich cells[J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2007, 148(3): 479-497.
(  0) 0) |
| [51] |
Fenwick J C, Smith K, Smith J, et al. Effect of various vitamin D analogs on plasma calcium and phosphorus and intestinal calcium absorption in fed and unfed American eels, Anguilla rostrata[J]. General and Comparative Endocrinology, 1984, 55(3): 398-404.
(  0) 0) |
| [52] |
Srivastav A K, Srivastav S, Sasayama Y, et al. Vitamin D metabolites affect serum calcium and phosphate in freshwater catfish, Heteropneustes fossilis[J]. Zoological Science, 1997, 14(5): 743-736.
(  0) 0) |
| [53] |
Avila E M, Basantes S P, Ferraris R P. Cholecalciferol modulates plasma phosphate but not plasma vitamin D levels and intestinal phosphate absorption in rainbow trout (Oncorhynchus mykiss)[J]. General and Comparative Endocrinology, 1999, 114(3): 460-469.
(  0) 0) |
| [54] |
Fenwick J C, Vermette M G. Vitamin D3 and the renal handling of phosphate in American eels[J]. Fish Physiology and Biochemistry, 1989, 7(1): 351-358.
(  0) 0) |
| [55] |
Chen P, Huang Y, Bayir A, et al. Characterization of the isoforms of type Ⅱb sodium-dependent phosphate cotransporter (Slc34a2) in yellow catfish, Pelteobagrus fulvidraco, and their vitamin D3-regulated expression under low-phosphate conditions[J]. Fish Physiology and Biochemistry, 2017, 43(1): 229-244.
(  0) 0) |
| [56] |
Fenwick J, Davison B, Forster M. In vivo calcitropic effect of some vitamin D compounds in the marine Antarctic teleost, Pagothenia bernachii[J]. Fish Physiology and Biochemistry, 1994, 12: 479-584.
(  0) 0) |
| [57] |
Fleming A, Sato M, Goldsmith P. High-throughput in vivo screening for bone anabolic compounds with zebrafish[J]. Journal of Biomolecular Screening, 2006, 10: 823-831.
(  0) 0) |
| [58] |
Fenwick J C. Effect of vitamin D3 (cholecalciferol) on plasma calcium and intestinal 45 calcium absorption in goldfish, Carassius auratus L[J]. Canadian Journal of Zoology, 1984, 62(1): 34-36.
(  0) 0) |
| [59] |
Colotta F, Jansson B, Bonelli F. Modulation of inflammatory and immune responses by vitamin D[J]. Journal of Autoimmunity, 2017, 85: 78-79.
(  0) 0) |
| [60] |
Kongsbak M, Von Essen M R, Boding L, et al. Vitamin D up-regulates the vitamin D receptor by protecting it from proteasomal degradation in human CD4+ T cells[J]. Plos One, 2014, 9(5): e96695.
(  0) 0) |
| [61] |
Ooi J H, Mcdaniel K L, Weaver V, et al. Murine CD8+ T cells but not macrophages express the vitamin D 1α-hydroxylase[J]. Journal of Nutritional Biochemistry, 2014, 25(1): 58-65.
(  0) 0) |
| [62] |
Cantorna M T, Rogers C J, Arora J. Aligning the paradoxical role of vitamin D in gastrointestinal immunity[J]. Trends Endocrinol Metab, 2019, 30(7): 459-646.
(  0) 0) |
| [63] |
Gombart A F, Borregaard N, Koeffler H P. Human cathelicidin antimicrobial peptide (CAMP) gene is a direct target of the vitamin D receptor and is strongly up-regulated in myeloid cells by 1, 25-dihydroxyvitamin D3[J]. The Faseb Journal, 2005, 19(9): 1067-1077.
(  0) 0) |
| [64] |
Martineau A R, Jolliffe D A, Hooper R L, et al. Vitamin D supplementation to prevent acute respiratory tract infections: Systematic review and meta-analysis of individual participant data[J]. British Medical Journal, 2017, 356: 6583.
(  0) 0) |
| [65] |
Liu P T, Stenger S, Tang D H, et al. Cutting edge: Vitamin Dmediated human antimicrobial activity against Mycobacterium tuberculosis is dependent on the induction of cathelicidin[J]. Journal of Immunology, 2007, 179(4): 2060-2063.
(  0) 0) |
| [66] |
Yuk J M, Shin D M, Lee H M, et al. Vitamin D3 induces autophagy in human monocytes/macrophages via cathelicidin[J]. Cell Host & Microbe, 2009, 6(3): 231-243.
(  0) 0) |
| [67] |
Wan M, Tang X, Rekha R S, et al. Prostaglandin E2 suppresses hCAP18/LL-37 expression in human macrophages via EP2/EP4: Implications for treatment of Mycobacterium tuberculosis infection[J]. The Faseb Journal, 2018, 32(5): 2827-2820.
(  0) 0) |
| [68] |
Rekha R S, Rao Muvva S S, Wan M, et al. Phenylbutyrate induces LL-37-dependent autophagy and intracellular killing of Mycobacterium tuberculosis in human macrophages[J]. Autophagy, 2015, 11(9): 1688-1699.
(  0) 0) |
| [69] |
Liu P T, Stenger S, Li H, et al. Toll-like receptor triggering of a vitamin D-mediated human antimicrobial response[J]. Science, 2006, 311(5768): 1770-1773.
(  0) 0) |
| [70] |
Szymczak I, Pawliczak R. The active metabolite of vitamin D3 as a potential immunomodulator[J]. Scandinavian Journal of Immunology, 2016, 83(2): 83-91.
(  0) 0) |
| [71] |
Gois P H F, Ferreira D, Olenski S, et al. Vitamin D and infectious diseases: simple bystander or contributing factor?[J]. Nutrients, 2017, 9(7): 651.
(  0) 0) |
| [72] |
Cerezuela R, Cuesta A, Meseguer J, et al. Effects of dietary vitamin D3 administration on innate immune parameters of seabream (Sparus aurata L.)[J]. Fish and Shellfish Immunology, 2009, 26(2): 243-248.
(  0) 0) |
| [73] |
Soto Davila M, Valderrama K, Inkpen S M, et al. Effects of vitamin D2 (ergocalciferol) and D3 (cholecalciferol) on atlantic salmon (Salmo salar) primary macrophage immune response to Aeromonas salmonicida subsp. salmonicida infection[J]. Frontiers in Immunology, 2019, 10: 3011.
(  0) 0) |
| [74] |
Jiang J, Shi D, Zhou X Q, et al. Vitamin D inhibits lipopolysaccharide-induced inflammatory response potentially through the Toll-like receptor 4 signalling pathway in the intestine and enterocytes of juvenile Jian carp (Cyprinus carpio var. Jian)[J]. British Journal of Nutrition, 2015, 114(10): 1560-1568.
(  0) 0) |
| [75] |
Cheng K, Tang Q, Guo X, et al. High dose of dietary vitamin D(3) modulated the yellow catfish (Pelteobagrus fulvidraco) splenic innate immune response after Edwardsiella ictaluri infection[J]. Fish and Shellfish Immunology, 2020, 100: 41-48.
(  0) 0) |
| [76] |
冯美惠, 陈沛, 雷文, 等. 黄颡鱼MHC class Ⅱ基因全长的克隆及饲料维生素D3对其组织表达的影响[J]. 水生生物学报, 2017, 41(5): 992-999. Feng M H, Chen P, Lei W, et al. Full-Length cDNA cloning and the effect of dietary vitamin D3 on tissue expression of major histocompatibility complex Ⅱ in yellow catfish (Pelteobagrus fulvidraco)[J]. Acta Hydrobiologica Sinica, 2017, 41(5): 992-999. (  0) 0) |
| [77] |
黎德兵, 李超, 张龚炜, 等. 饲料中维生素D3水平对黄鳝抗菌肽hepcidin基因表达的影响[J]. 动物营养学报, 2012, 24(8): 1520-1526. Li D B, Li C, Zhang G W, et al. Effects of dietary vitamin D3 level on expression of antimicrobial peptide hepcidin gene in Monopterus albus[J]. Chinese Journal of Animal Nutrition, 2012, 24(8): 1520-1526. (  0) 0) |
| [78] |
Dioguardi M, Guardiola F A, Vazzana M, et al. Vitamin D(3) affects innate immune status of European sea bass (Dicentrarchus labrax L.)[J]. Fish Physiology and Biochemistry, 2017, 43(4): 1161-1174.
(  0) 0) |
| [79] |
Estevez R, Contreras Mostazo M, Rodriguez E, et al. Inducers of salmon innate immunity: An in vitro and in vivo approach[J]. Fish and Shellfish Immunology, 2017, 72: 247-258.
(  0) 0) |
| [80] |
Han Y, Chen A, Umansky K B, et al. Vitamin D stimulates cardiomyocyte proliferation and controls organ size and regeneration in zebrafish[J]. Developmental Cell, 2019, 48(6): 853.
(  0) 0) |
| [81] |
Cortes M, Chen M J, Stachura D L, et al. Developmental vitamin D availability impacts hematopoietic stem cell production[J]. Cell Reports, 2016, 17(2): 458-468.
(  0) 0) |
| [82] |
Bland R, Markovic D, Hills C E, et al. Expression of 25-hydroxyvitamin D3 -1α-hydroxylase in pancreatic islets[J]. The Journal of Steroid Biochemistry and Molecular Biology, 2004, 89(1-5): 121-125.
(  0) 0) |
| [83] |
Maestro B, Molero S, Bajo S, et al. Transcriptional activation of the human insulin receptor gene by 1, 25-dihydroxyvitamin D(3)[J]. Cell Biochemistry and Function, 2002, 20(3): 227-232.
(  0) 0) |
| [84] |
Major G C, Francine A, Jean D, et al. Supplementation with calcium + vitamin D enhances the beneficial effect of weight loss on plasma lipid and lipoprotein concentrations[J]. American Journal of Clinical Nutrition, 2007, 85(1): 54.
(  0) 0) |
| [85] |
Pennacchio L A, Olivier M, Hubacek J A, et al. An apolipoprotein influencing triglycerides in humans and mice revealed by comparative sequencing[J]. Science, 2001, 294(5540): 169-173.
(  0) 0) |
| [86] |
Jorde R, Figenschau Y, Hutchinson M, et al. High serum 25-hydroxyvitamin D concentrations are associated with a favorable serum lipid profile[J]. European Journal of Clinical Nutrition, 2010, 64(12): 1457-1464.
(  0) 0) |
| [87] |
Wang J, Thingholm L B, Skieceviciene J, et al. Genome-wide association analysis identifies variation in vitamin D receptor and other host factors influencing the gut microbiota[J]. Nature Genetics, 2016, 48(11): 1396-1406.
(  0) 0) |
| [88] |
Wang A R, Ran C, Ringø E, et al. Progress in fish gastrointestinal microbiota research[J]. Reviews in Aquaculture, 2018, 10(3): 626-640.
(  0) 0) |
2. Pilot National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266237, China
 2021, Vol. 51
2021, Vol. 51

