蛋白质含量和饲料氨基酸水平是影响鱼类生长、繁殖、健康和饲料成本的主要因素。饲料中蛋白质不足时,鱼类势必会消耗非必要组织中的蛋白质,用以维持更重要组织的正常功能,从而导致生长受阻和体质量降低[1]。氨基酸不仅是组成蛋白质的基本构件,还能够作为信号分子,发挥调节关键代谢途径的具体作用[2-3]。在多种鱼类中已经证实,一些功能性氨基酸在促进生长和增强新陈代谢功能方面发挥关键作用[4-7]。
亮氨酸作为一种支链氨基酸,它既能作为蛋白质合成的底物,也是激活蛋白质合成的“触发按钮”,在促进蛋白质合成和抑制蛋白质降解方面发挥着重要作用[8]。同时亮氨酸缺乏将导致一系列不良生长效应,例如能量代谢失衡、淋巴组织受损、动物胸腺和脾萎缩[9-10],因此在饲料中适量添加亮氨酸能够有效调节动物机体免疫能力。更重要的是,亮氨酸能够通过特殊的信号网络,尤其是磷脂酰肌醇3-激酶-蛋白激酶B-哺乳动物雷帕霉素靶标(PI3K-AKT-mTOR)信号通路,调节葡萄糖、脂肪和蛋白质的代谢,调节肠道健康和免疫,从而促进氮储留和蛋白质合成[11-12]。本实验在低蛋白饲料中添加1%饲料干物质的晶体亮氨酸,添加量参考已报道的大菱鲆研究[13]。
精氨酸是大菱鲆的必需氨基酸,除了作为蛋白质的重要组分外,它还是一种功能性氨基酸,可以通过多条途径调节动物体内的营养代谢:包括激活mTORC1促进蛋白质和脂质合成[14-15];结合NO通过NO-c-GMP通路促进脂质氧化和糖酵解作用[16];以不依赖于血糖的方式促进胰岛素的释放,从而促进葡萄糖的利用[17]。大菱鲆(Scophthalmus maximus)的精氨酸需求量为饲料干物质的3.17%[18],因此本实验中低蛋白饲料中添加1%饲料干物质的晶体精氨酸,以求达到大菱鲆精氨酸需求量。
大菱鲆(Scophthalmus maximus)俗称“多宝鱼”,是一种经济养殖鱼类,具有生长速度快、营养丰富和味道鲜美等特点。为了降低饲料蛋白含量,我们将目光聚焦到氨基酸上,氨基酸除了做为蛋白合成的底物,氨基酸还拥有许多功能,其中晶体氨基酸作为信号分子的功能最受到关注。精氨酸和亮氨酸作为能激活内源性信号通路的经典氨基酸,本课题探究其是否可以作为一种刺激蛋白合成的添加剂而非蛋白合成底物对大菱鲆的生长产生积极影响。进一步探究影响鱼体蛋白质沉积的内在因素,为提高饲料蛋白质利用率提供新思路。
1 材料与方法 1.1 实验饲料以白鱼粉为主要蛋白质来源,以鱼油和大豆卵磷脂为主要脂肪来源,制作两种脂肪相同(125 g/kg)、蛋白含量分别为45%和50%的饲料。以50%蛋白日粮为阳性对照组(High protein, HP),以45%蛋白日粮为阴性对照组(Low protein, LP),在45%蛋白日粮中分别添加1%(10 g/kg饲料)的晶体L-亮氨酸(Sigma-Aldrich,美国)为亮氨酸实验组(Low protein+Leu, LP+L),添加1%的晶体L-精氨酸(Sigma-Aldrich,美国)为精氨酸实验组(Low protein+Arg, LP+R)(见表 1)。L-丙氨酸(Sigma-Aldrich,美国)作为非必需氨基酸适量添加至45%蛋白日粮中,以保持这3组低蛋白日粮的氮含量相等(见表 1)。将所有原料研磨成细粉,与鱼油和大豆卵磷脂充分混匀,用饲料制粒机挤压成粒(直径5.0 mm)。饲料在45 ℃烘箱中干燥18 h,保存于-20 ℃。不同的日粮在物理性质和下沉速度方面没有发现差异。
|
|
表 1 实验饲料配方及成分分析(干物质) Table 1 Formulation and analytical composition of diets (dry matter) |
养殖实验在青岛市胶南大场镇营南头村养殖区的室内常流水养殖系统中进行,实验大菱鲆购自威海大菱鲆育苗场。在实验正式开始前,暂养2周,所有大菱鲆用所制4种饲料混合暂养使其适应养殖系统和制备饲料的粒径。暂养结束后禁食24 h,挑选出规格一致、体格健壮的大菱鲆(初始体质量(13.50±0.19) g)随机分配于养殖桶中(300 L),本实验有4个处理组,每个处理组3个重复,每个养殖桶内30尾鱼。养殖周期为56 d,每天7:00和19:00手动投喂饲料2次,确认大菱鲆达到饱食状态。餐后收集残饵,在42 ℃下烘干至恒重并称重,从摄食量计算中减去残饵质量。为保持水清洁,每餐后换水。实验期间每隔3 d测量一次水质参数值,用温度计和盐度计测量水温和盐度。试验期间,水温保持在13.6~15.8 ℃,盐度为29~32,氨氮小于0.1 mg·L-1,亚硝酸盐小于0.1 mg·L-1,溶解氧含量大于7 mg·L-1。
1.3 样品采集在饲养试验结束时,将鱼禁食48 h,使鱼体达到机体代谢基础水平。①禁食24 h后,每桶鱼称量总质量并计算总数,每桶随机抽取4条鱼储存在-20 ℃用于全鱼体成分分析。②在48 h禁食周期结束时从每个处理组随机抽取6条鱼(每桶2条鱼),此时取样的鱼被指定为0 h样品(禁食鱼)。随后将其余大菱鲆喂至饱食,每隔2、8和24 h采集样本。在每个间隔中,从各处理组随机抽取6条鱼(每桶2条鱼)。③将大菱鲆用丁香酚(1∶10 000,纯度99%,上海试剂,中国)麻醉后检查每条鱼的胃和肠道内是否有内容物,确保其有效地摄入了食物,随后立即解剖肝、肠和背外侧白肌,冷冻于液氮中,保存在-80 ℃。④从鱼尾静脉采血到肝素抗凝管中,全血在4 ℃条件下3 000g离心15 min,用以收集血清,随后储存于-80 ℃用于后续分析。
1.4 饲料和鱼体组成分析将样品置于105 ℃烘干至质量恒定并采用差量法测得水分含量;运用凯氏定氮法测定样品粗蛋白含量,干燥后的样品在催化剂的作用下用浓硫酸高温消化,然后采用全自动凯氏定氮仪(Kjeltec TM 8400, FOSS,瑞士)进行测定;采用索氏抽提法测定样品粗脂肪含量,干燥后的样品运用全自动索氏抽提仪(Buchi 36680,瑞士)抽掉脂肪并采用差量法测得粗脂肪含量。将样品置于电炉烧至无烟,然后转移至马弗炉550 ℃烧至质量恒定并采用差量法测得灰分含量。总能量采用全自动氧弹仪(Parr, Moline, IL,美国)测定。按国家标准(GB/T 5009.124—2003)对样品进行氨基酸分析。将样品冷冻干燥(ALPHA1-2 LDplus, Christco, Ltd,德国) 48 h至质量恒定,称取30 mg,加入6 mol·L-1盐酸15 mL,充入氮气并在110 ℃烘箱内水解22 h,最后用全自动氨基酸分析仪(L-8900, HITACHI,日本)进行分析得到饲料氨基酸组成(见表 2)。
|
|
表 2 日粮氨基酸组成(干物质) Table 2 Amino acids composition of the diets (dry matter) |
称取1 g左右肠道样品,按质量(g)∶体积(mL)=1∶9的比例加入9倍体积的生理盐水,冰水浴条件下充分匀浆,将匀浆液2 500g 4 ℃离心10 min,将上清液分装于离心管中,迅速进行后续检测。样品TP(货号: A045-2)、α-淀粉酶(货号: C016-1-1)、脂肪酶(货号: A054-2-1)、胰蛋白酶(货号: A080-2-2)、测定所使用的试剂盒均购自南京建成生物工程研究所。所有指标均严格按照说明书规定的方法操作、计算。
1.6 血清抗氧化能力与非特异性免疫指标检测大菱鲆血浆总抗氧化力(T-AOC)(货号: A015-1-2)、超氧化物歧化酶(SOD)(货号: A001-3-2)、过氧化氢酶(CAT)(货号: A007-1-1)及溶菌酶(LSZ)(货号: A050-1-1)活性均采用南京建成生物工程研究所的试剂盒,严格按照说明书上的步骤进行检测。
1.7 蛋白质提取及Western blot分析称取50 mg肝脏或肌肉样品(保持冰冻状态),加入含有蛋白酶和磷酸酶抑制剂(Roche, 德国)的RIPA裂解液(50 mmol/L Tris·HCl, 150 mmol/L NaCl, 0.5% NP-40, 0.1% SDS, 1 mmol/L EDTA, pH=7.5)匀浆旋转裂解30 min,之后12 000g离心15 min取上清液。使用BCA蛋白浓度测定试剂盒(Beyotime Biotechnology,中国)测定上清液蛋白质含量。将组织蛋白提取液用聚丙烯酰胺凝胶电泳分离,通过转膜移至0.45 μm PVDF膜上(Millipore,美国)。转膜结束后将膜浸泡于5%脱脂奶粉TBST缓冲液(20 mmol/L Tris·HCl,500 mmol/L NaCl,0.1% Tween-20)中室温封闭1 h, 然后于4 ℃下一抗孵育过夜。二抗为辣根过氧化物酶(HRP)标记山羊抗兔IgG(H+L)(Beyotime Biotechnology,中国),室温孵育1 h,用ECL试剂(Beyotime Biotechnology,中国)进行显影得到相应条带。
本实验所使用的抗体如下:mTOR(货号2972),p-mTOR Ser2448(货号2971),S6(货号2217),p-S6 Ser235/236(货号4856),4E-BP1(货号9644),p-4E-BP1 Thr37/46(货号2855),β-Tubulin(货号5568);以上抗体均购买于Cell Signaling Technology Inc;所有抗体均已在大菱鲆上得到验证并已发表相关论文[19]。
1.8 数据分析计算公式如下:
增重率(Weight gain rate, WGR, %)= 100×(终末体质量-初始体质量)/初始体质量;
特定生长率(Specific growth rate, SGR, %/d)= 100× (ln终末体质量-ln初始体质量)/养殖天数;
日摄食率(Day feed intake rate, DFI, %)=100×总摄食量/(养殖天数×(终末体质量+初始体质量)/2);
饲料效率(Feed efficiency, FE,%)=100×鱼体湿增质量/总摄食量;
蛋白质效率(Protein efficiency ratio, PER)=鱼体湿增质量/蛋白质摄入量;
存活率(Survival rate, SR,%)=100×(终末尾数/初始尾数);
肥满度(Condition factor, CF, g/cm3)=100 ×体质量/体长3;
肝体比(Hepatosomatic index, HIS,%)=100×肝质量/体质量;
脏体比(Viscerosomatic index, VSI,%)=100×内脏质量/体质量。
实验数据用平均值±标准误(Mean±SE)表示,采用SPSS 19.0版软件对所得数据进行数据分析和统计, 先对数据作单因子方差分析(ANOVA),若处理间有显著差异,再作Tukey′s检验进行多重比较, P<0.05表示差异性显著。
2 实验结果 2.1 生长性能和饲料利用率实验表明,低蛋白日粮饲喂下LP组大菱鲆的特定生长率(SGR)和增重率(WGR)显著低于HP组,当饲料分别添加1%的亮氨酸和精氨酸后能够有效缓解这种不良生长状态(P<0.05)。与LP组日粮相比,分别添加亮氨酸和精氨酸的LP+L组、LP+R组日粮显著提高了大菱鲆的饲料效率(FER)与蛋白质效率(PER)(P<0.05),不过仍与HP组日粮存在差距。此外,大菱鲆日采食量(DFI)受到日粮蛋白质含量的影响,HP组显著低于其他3个低蛋白实验组(P<0.05)。CF、HSI和VSI在不同饮食处理之间无显著差异(P>0.05)(见表 3)。
|
|
表 3 饲料添加亮氨酸、精氨酸对大菱鲆生长和饲料利用的影响 Table 3 Growth performance and feed utilization of S. maximus fed diets with Leucine and Arginine |
如表 4所示,相比于HP组,低蛋白水平饲料喂养下的LP组表现出鱼体蛋白质和脂肪含量下降。与LP组相比之,饲料添加1%亮氨酸、精氨酸显著提高了鱼体脂肪水平(P<0.05),且在一定程度上挽救了因饲料蛋白不足造成的鱼体蛋白水平下降(P<0.05)。鱼体灰分、水分含量不受各组实验日粮影响(P>0.05)。
|
|
表 4 饲料添加亮氨酸、精氨酸对大菱鲆全鱼体组成的影响(湿质量) Table 4 Body composition of S. maximus fed diets with Leucine and Arginine (wet weight) |
因各处理组鱼体蛋白、脂肪水平存在差异,首先考虑功能性氨基酸是否对消化酶活性产生影响,对肠道中的α-淀粉酶(α-amylase, AMS)、脂肪酶和胰蛋白酶进行了测定(见表 5)。与LP对照组相比,饲料中添加1%精氨酸能够有效提高淀粉酶和脂肪酶活性(P<0.05)。此外,各组间胰蛋白酶活性无明显差异(P>0.05)。
|
|
表 5 饲料添加亮氨酸、精氨酸对大菱鲆肠道消化酶的影响 Table 5 The intestinal digestive enzyme of S. maximus fed diets with Leucine and Arginine |
如表 6所示,精氨酸的添加明显提升了大菱鲆血浆CAT、LZM和T-AOC活性(P<0.05),但血清SOD活力与日粮精氨酸添加无关(P>0.05)。饲料中添加1%亮氨酸能够有效提高大菱鲆血清LZM活性。不同蛋白水平对大菱鲆血清LZM活性、SOD活力、T-AOC活性和CAT活性均无明显影响(P>0.05)。
|
|
表 6 饲料添加亮氨酸、精氨酸对大菱鲆血清生化指标的影响 Table 6 The serum biochemical indices of S. maximus fed diets with Leucine and Arginine |
亮氨酸是激活TOR信号应答通路最有效的氨基酸,本实验通过检测大菱鲆摄食亮氨酸补充剂后肝脏和肌肉中mTOR、S6和4E-BP1蛋白的磷酸化水平来监测摄食后TOR信号应答通路的活性变化。研究显示,LP组大菱鲆肝脏mTOR在摄食后2 h被激活,并持续至6 h,到12 h开始减弱,受饲料蛋白水平影响,HP组激活水平明显强于LP组。同LP组相比,LP+L组添加亮氨酸显著提高了p-mTOR活性水平,且激活可持续至12 h。大菱鲆肝脏S6和4E-BP1蛋白的磷酸化水平在各处理组显示出差异,LP组大菱鲆肝脏S6在摄食后2 h有所激活,在6 h达到顶峰,随后蛋白表达量逐渐下降。较高的饲料蛋白水平(HP)和饲料添加1%亮氨酸(LP+Leu)都能提高p-S6、p-4E-BP1的活性水平,且维持至12 h(见图 1)。
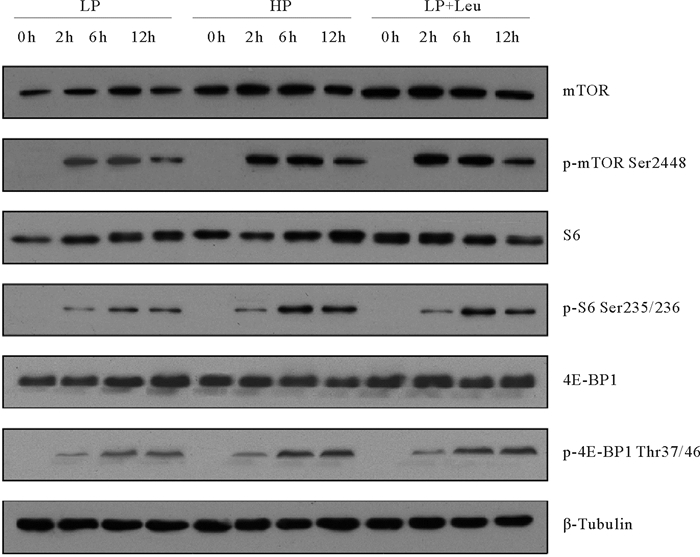
|
( 蛋白质印迹检测大菱鲆摄食后后不同时间点肝脏中mTOR、S6和4E-BP1的总水平和磷酸化形式的水平。LP:低蛋白水平饲料;HP:高蛋白水平饲料;LP+Leu:低蛋白水平饲料添加亮氨酸补充剂;mTOR:雷帕霉素靶蛋白;S6:核糖体蛋白S6;4E-BP1:真核起始因子4E结合蛋白1。The levels of total and the phosphorylated forms of mTOR, S6 and 4E-BP1 in liver at different time points after feeding were examined by western blots. LP: Low protein diet; HP: High protein diet; LP+Leu: Low protein diet with leucine supplement; mTOR: Mechanistic target of rapamycin; S6: Ribosomal protein S6; 4E-BP1: 4E-binding protein 1. ) 图 1 饲喂Leu补充剂对大菱鲆幼鱼肝脏中mTOR信号通路的影响 Fig. 1 Effects of Leu supplementation of mTOR signaling in liver of juvenile turbot |
精氨酸也能够激活哺乳动物的TOR信号通路。本研究显示,同LP组相比,LP+Arg组提高了p-mTOR活性水平。大菱鲆肝脏S6和4E-BP1蛋白的磷酸化水平受到精氨酸添加的影响,与阴性对照组相比,饲料添加1%精氨酸(LP+Arg)能提高p-S6、p-4E-BP1的活性水平,且维持至12 h(见图 2)。
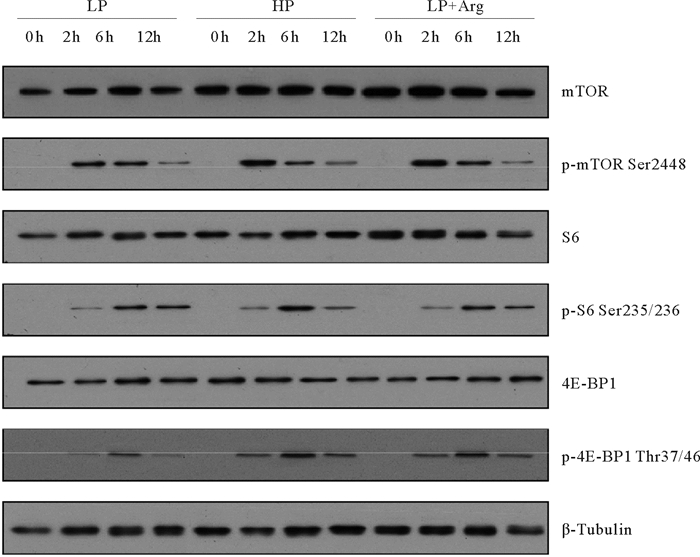
|
( 蛋白质印迹检测大菱鲆摄食后后不同时间点肝脏中mTOR、S6和4E-BP1的总水平和磷酸化形式的水平。LP:低蛋白水平饲料;HP:高蛋白水平饲料;LP+Arg:低蛋白水平饲料添加精氨酸补充剂;mTOR:雷帕霉素靶蛋白;S6:核糖体蛋白S6;4E-BP1:真核起始因子4E结合蛋白1。The levels of total and the phosphorylated forms of mTOR, S6 and 4E-BP1 in liver at different time points after feeding were examined by western blots. LP: Low protein diet; HP: High protein diet; LP+Arg: Low protein diet with arginine supplement; mTOR: Mechanistic target of rapamycin; S6: Ribosomal protein S6; 4E-BP1: 4E-binding protein 1. ) 图 2 饲喂Arg补充剂对大菱鲆幼鱼肝脏中mTOR信号通路的影响 Fig. 2 Effects of Arg supplementation on mTOR signaling in liver of juvenile turbot |
摄食后大菱鲆肌肉中TOR信号应答通路相关蛋白的表达量变化呈现与肝脏类似模式(见图 3)。摄食2 h后LP组大菱鲆肌肉mTOR被有效激活,持续至6 h时开始减弱,之后逐渐恢复基础水平。6 h内LP+L组大菱鲆肌肉中mTOR激活程度均显著高于LP组,且在摄食后12 h饲料添加亮氨酸(LP+L组)能够维持大菱鲆肌肉mTOR激活状态。大菱鲆肌肉S6蛋白的磷酸化在摄食后2 h开始激活并在6 h达到顶峰,LP处理组在摄食后1 2h激活程度逐渐下降。与LP组相比,饲料添加1%亮氨酸(LP+L组)能够有效提高S6激活峰值,且持续激活至12 h。同S6相似,大菱鲆摄食后肌肉中4E-BP1也在LP+L组显示出较强的状态。
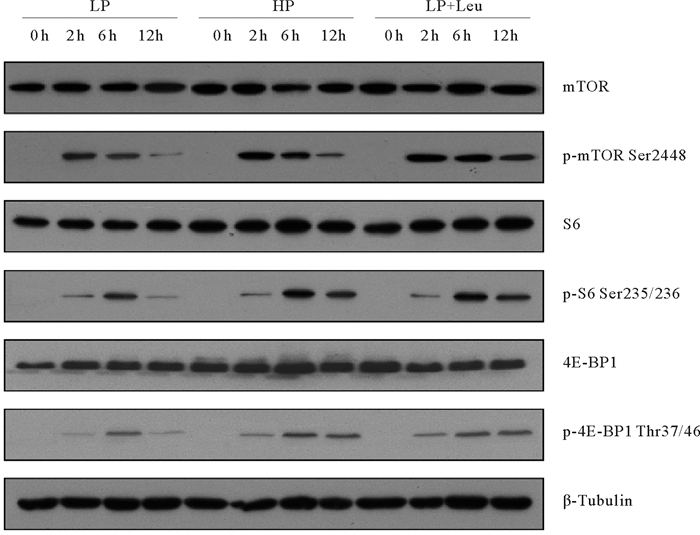
|
( 通过蛋白质印迹检测大菱鲆摄食后后不同时间点肌肉中mTOR、S6和4E-BP1的总水平和磷酸化形式的水平。LP:低蛋白水平饲料;HP:高蛋白水平饲料;LP+Leu:低蛋白水平饲料添加亮氨酸补充剂;mTOR:雷帕霉素靶蛋白;S6:核糖体蛋白S6;4E-BP1:真核起始因子4E结合蛋白1。The levels of total and the phosphorylated forms of mTOR, S6 and 4E-BP1 in muscle at different time points after feeding were examined by western blots. LP: Low protein diet; HP: High protein diet; LP+Leu: Low protein diet with leucine supplement; mTOR: Mechanistic target of rapamycin; S6: Ribosomal protein S6; 4E-BP1: 4E-binding protein 1. ) 图 3 饲喂Leu补充剂对大菱鲆幼鱼肌肉中mTOR信号通路的影响 Fig. 3 Effects of Leu supplementation on mTOR signaling in muscle of juvenile turbot |
实验显示(见图 4),精氨酸在肌肉中也起到了激活TOR信号通路的作用。与LP组相比,饲料添加1%精氨酸(LP+Arg)能够有效提高磷酸化mTOR的激活峰值。大菱鲆肌肉S6和4E-BP1蛋白的磷酸化在摄食后2 h开始激活,LP+Arg组显示出比LP组更高的激活水平。
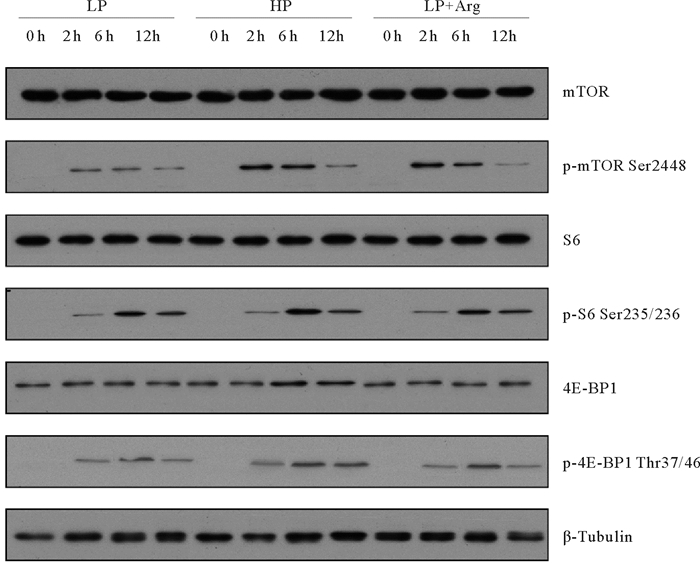
|
( 蛋白质印迹检测大菱鲆摄食后后不同时间点肌肉中mTOR、S6和4E-BP1的总水平和磷酸化形式的水平。LP:低蛋白水平饲料;HP:高蛋白水平饲料;LP+Arg:低蛋白水平饲料添加精氨酸补充剂;mTOR:雷帕霉素靶蛋白;S6:核糖体蛋白S6;4E-BP1:真核起始因子4E结合蛋白1。The levels of total and the phosphorylated forms of mTOR, S6 and 4E-BP1 in muscle at different time points after feeding were examined by western blots. LP: Low protein diet; HP: High protein diet; LP+Arg: Low protein diet with arginine supplement; mTOR: Mechanistic target of rapamycin; S6: Ribosomal protein S6; 4E-BP1: 4E-binding protein 1. ) 图 4 饲喂Arg补充剂对大菱鲆幼鱼肌肉中mTOR信号通路的影响 Fig. 4 Effects of Arg supplementation on mTOR signaling in muscle of juvenile turbot |
足够的饲料蛋白水平是维持大菱鲆正常生长的必备条件,饲料蛋白不足将导致其生长水平低下。亮氨酸和精氨酸都是鱼类的必需氨基酸,对多种鱼类在各生长阶段生长起着重要作用。饲料中补充适宜的亮氨酸可以提高鱼类的生长性能,这在大菱鲆[13]、银鲫(Carassius auratus gibelio var. CAS Ⅲ)[20]、牙鲆(Paralichthys olivaceus)[21]、石斑鱼(Epinephelus coioides)[22]等硬骨鱼中都已经被证实。饲料中添加适量精氨酸能够提升卵形鲳鲹(Trachinotus ovatus)[23]和团头鲂(Megalobrama amblycephala)[24]等多种水产动物的生长效果。在本实验中,LP饲料抑制了大菱鲆幼鱼的正常生长,而LP饲料添加1%亮氨酸或1%精氨酸显著提高了大菱鲆的特定生长率、饲料效率、蛋白质效率和增重率,从而挽救因饲料蛋白不足带来的不利生长情况。此外,饲料氨基酸水平未对肥满度、肝体比和脏体比产生影响。本研究表明,饲料中添加适量功能性氨基酸可以提高大菱鲆幼鱼饲料利用率,同时提高蛋白质效率,这与在杂交鲶鱼(Pelteobagrus vachelli× Leiocassis longirostris)[25]和银鲫[20]中的研究结果一致。不过,对军曹鱼(Rachycentron canadum)[26]和卵形鲳鲹[23]的研究表明,饲料中过量的精氨酸水平抑制了它们的生长。大菱鲆幼鱼对精氨酸需求量为饲料干物质的3.17%,本实验中LP+R组精氨酸水平接近需求量,并未造成负面影响。过量亮氨酸水平也不利于牙鲆[21]和鲢鱼(Mylopharyngodon piceus)的生长[10]。
在幼鱼时期,鱼类消化系统尚未完全发育,消化酶活性常被用作衡量鱼消化系统消化能力的指标。适量添加精氨酸能够促进鱼类肠道发育和提高消化能力。基于本研究结果,饲料添加1%精氨酸能够有效地提高大菱鲆幼鱼的淀粉酶活性和脂肪酶活性,这与在大黄鱼(Larimichthys crocea)[27]和黑鲷(Acanthopagrus schlegelii)[28]中的研究结果一致。然而,并非所有消化酶在该组中都表现出最佳活性。例如,胰蛋白酶活性并未明显高于其他各处理组。而在大黄鱼中胰蛋白酶水平随着饲料精氨酸水平同步提高,这种不同可能是因生长阶段和物种差异造成的。
精氨酸在调节高等脊椎动物的免疫应答和抗病能力效果方面尤为突出,在鱼类中精氨酸作为免疫调节剂受到了极大的关注。溶菌酶是鱼类先天免疫系统的重要组成部分,血浆溶菌酶波动能够反映出大菱鲆对应激源的反应。过氧化氢酶普遍存在于生物体内,酶促活性为机体提供了抗氧化防御机理。在本研究中发现,饲料添加1%精氨酸能够提高大菱鲆血浆总抗氧化能力和溶菌酶、过氧化氢酶活性,这意味着精氨酸能够提高大菱鲆的免疫应答和抗病能力,这与之前在斑鲈(Lateolabrax maculatus) [29]和斑点叉尾鮰(Ictalurus punctatus)[30]中得到的结论一致。先前的研究表明,精氨酸缺乏会在不同鱼类中造成一系列免疫问题,包括白细胞数量减少,溶菌酶和补体活性降低,刺激超氧阴离子、一氧化氮和免疫球蛋白生成,以及造成血凝反应,对病原体的抵抗力也因此下降。然而,饮食中过量的精氨酸似乎适得其反,降低了一些硬骨鱼类的免疫功能和抗病能力,例如鲤鱼(Cyprinus carpio)[31]。
mTOR信号通路能够整合多种信号刺激合成代谢(如蛋白质、脂质和核苷酸合成),进而促进细胞生长,同时抑制自噬等分解代谢过程,亮氨酸和精氨酸已经被证明是激活mTORC1的最重要氨基酸之一[12, 32]。在本研究中,与LP组相比,投喂晶体亮氨酸、精氨酸饲料的大菱鲆拥有更高的体蛋白和体脂肪水平,与HP组相当。这与在许多硬骨鱼中的研究结果一致[33-34]。添加亮氨酸后,LP+L组大菱鲆显示出高的饲料蛋白质利用率和mTOR信号通路蛋白激活情况,与HP组相当。本研究结果表明,日粮中添加亮氨酸可提高肌肉和肝脏中mTOR、4E-BP1和S6的磷酸化水平。在哺乳动物中,亮氨酸被证明直接通过mTOR或间接通过PI3K-AKT-mTOR信号通路调节蛋白质合成。给限制饮食的成年大鼠口服亮氨酸可通过激活mTOR信号通路来刺激骨骼肌中蛋白质合成[35]。低蛋白配方食物中添加亮氨酸可显著增加新生猪骨骼肌和内脏组织中的蛋白质合成,达到与高蛋白膳食相似的速率[36]。此外,Lang等[37]报道称亮氨酸诱导的TOR磷酸化可能不依赖于PI3K-AKT信号通路。这些发现表明,与哺乳动物一样,亮氨酸可以激活硬骨鱼细胞中TOR或PI3K-AKT-TOR信号通路,且有助于鱼类肌肉蛋白质的合成。然而,凡纳滨对虾(Litopenaeus vannamei)[38]幼虾的肌肉蛋白质含量不随亮氨酸水平的增加而变化。在银鲫[20]的研究中发现,饲料亮氨酸水平对肌肉中4E-BP2和S6K1的mRNA水平没有差异。这一点在大菱鲆幼鱼中也被证实,张凯凯等[5]认为大菱鲆幼鱼肌肉中4E-BP1-2和TOR的转录水平不受饲料亮氨酸的影响。因此,还需要更多的研究来阐明亮氨酸促进鱼类肌肉蛋白质合成的更详细的机制。与亮氨酸类似的,低蛋白饲料中添加精氨酸能够激活大菱鲆肌肉和肝脏中mTOR信号通路。这与在哺乳动物研究中得到的结论一致,Yao等[39]发现日粮补充精氨酸可增加新生猪骨骼肌中的mTOR信号传导活性。相应的,在鱼类研究中发现适当的精氨酸还能显著提高草鱼(Ctenopharyngodon idella)肌肉中tor和s6k1基因的表达水平[34]。从以上研究可以发现,亮氨酸和精氨酸都是能够激活大菱鲆mTOR信号通路的功能性氨基酸,此外,精氨酸还能够提高大菱鲆消化酶活性,这是在LP+L组没有观察到的。
4 结语低蛋白饲料中添加1%亮氨酸或1%精氨酸能够有效提高大菱鲆幼鱼生长性能,亮氨酸和精氨酸作为化学信使能够有效激活mTOR信号途径,进而影响大菱鲆肝脏和肌肉蛋白合成,提高低蛋白水平饲料喂养下大菱鲆的饲料蛋白效率和蛋白质沉积,最终促进了大菱鲆的生长。精氨酸作为有代表性的功能性氨基酸,能够影响大菱鲆生长、体组成、肠道消化吸收能力和特异性免疫。这些结果为进一步揭示功能性氨基酸调控鱼类生长的内在机制提供了参考。
| [1] |
Wilson R P. Amino Acids and Proteins[M]. 3rd Edition. Netherlands: Elsevier, 2002.
(  0) 0) |
| [2] |
Wu G Y. Amino acids: Metabolism, functions, and nutrition[J]. Amino Acids, 2009, 37(1): 1-17. DOI:10.1007/s00726-009-0269-0 (  0) 0) |
| [3] |
Wu G Y. Functional amino acids in growth, reproduction, and health[J]. Advances in Nutrition, 2010, 1(1): 31-37. DOI:10.3945/an.110.1008 (  0) 0) |
| [4] |
Costas B, Conceicao L E C, Dias J, et al. Dietary arginine and repeated handling increase disease resistance and modulate innate immune mechanisms of Senegalese sole (Solea senegalensis Kaup, 1858)[J]. Fish & Shellfish Immunology, 2011, 31(6): 838-847. (  0) 0) |
| [5] |
Zhang K K, Mai K S, Xu W, et al. Effects of dietary arginine and glutamine on growth performance, nonspecific immunity, and disease resistance in relation to arginine catabolism in juvenile turbot (Scophthalmus maximus L.)[J]. Aquaculture, 2017, 468: 246-254. DOI:10.1016/j.aquaculture.2016.10.021 (  0) 0) |
| [6] |
Kadowaki M, Kanazawa T. Amino acids as regulators of proteolysis[J]. Journal of Nutrition, 2003, 133(6): 2052-2056. DOI:10.1093/jn/133.6.2052S (  0) 0) |
| [7] |
Lin Y, Dengu J M, Miao L H, et al. Effects of dietary supplementary leucine in a wheat meal-rich diet on the growth performance and immunity of juvenile gibel carp (Carassius auratus gibelio var. CAS Ⅲ)[J]. Aquaculture Research, 2021, 52(4): 1501-1512. DOI:10.1111/are.15003 (  0) 0) |
| [8] |
Stipanuk M H. Leucine and protein synthesis: mTOR and beyond[J]. Nutrition Reviews, 2007, 65(3): 122-129. DOI:10.1111/j.1753-4887.2007.tb00289.x (  0) 0) |
| [9] |
Sakkas P, Jones L A, Houdijk J G, et al. Leucine and methionine deficiency impairs immunity to gastrointestinal parasites during lactation[J]. British Journal of Nutrition, 2013, 109(2): 273-282. DOI:10.1017/S0007114512000931 (  0) 0) |
| [10] |
McAllan L, Cotter P D, Roche H M, et al. Impact of leucine on energy balance[J]. Journal of Physiology and Biochemistry, 2013, 69: 155-163. DOI:10.1007/s13105-012-0170-2 (  0) 0) |
| [11] |
Garlick P J. The role of leucine in the regulation of protein metabolism[J]. Journal of Nutrition, 2005, 135(6): 1553-1556. DOI:10.1093/jn/135.6.1553S (  0) 0) |
| [12] |
Li F N, Yin Y L, Tan B, et al. Leucine nutrition in animals and humans: mTOR signaling and beyond[J]. Amino Acids, 2011, 41(5): 1185-1193. DOI:10.1007/s00726-011-0983-2 (  0) 0) |
| [13] |
Wang N, Zhang X, Liu C, et al. Fine-tuning of postprandial responses via feeding frequency and leucine supplementation affects dietary performance in turbot (Scophthalmus maximus L.)[J]. Journal of Nutrition, 2021, 151(10): 2957-2966. DOI:10.1093/jn/nxab221 (  0) 0) |
| [14] |
Ham D J, Caldow M K, Lynch G S, et al. Arginine protects muscle cells from wasting in vitro in an mTORC1-dependent and NO-independent manner[J]. Amino Acids, 2014, 46(12): 2643-2652. DOI:10.1007/s00726-014-1815-y (  0) 0) |
| [15] |
Ma X, Han M, Li D, et al. L-Arginine promotes protein synthesis and cell growth in brown adipocyte precursor cells via the mTOR signal pathway[J]. Amino Acids, 2017, 49(5): 957-964. DOI:10.1007/s00726-017-2399-0 (  0) 0) |
| [16] |
Jobgen W S, Fried S K, Fu W J, et al. Regulatory role for the arginine-nitric oxide pathway in metabolism of energy substrates[J]. The Journal of Nutritional Biochemistry, 2006, 17(9): 571-588. DOI:10.1016/j.jnutbio.2005.12.001 (  0) 0) |
| [17] |
Andersen R F, Kamperis K, Winding L, et al. Inappropriate arginine vasopressin secretion in childhood idiopathic nephrotic syndrome[J]. Pediatric Nephrology, 2014, 29(9): 1742-1742. (  0) 0) |
| [18] |
魏玉婷. 大菱鲆(Scophthalmus maximus)幼鱼对饲料中蛋氨酸、精氨酸、维生素A及维生素E需求量的研究[D]. 青岛: 中国海洋大学, 2010. Wei Y T. Studies on Requirements of Dietary Methionine, Arginine, Vitamin A, Vitamin E for Turbot (Scophthalmus maximus) Jureniles[D]. Qingdao: Ocean University of China, 2010. (  0) 0) |
| [19] |
Xu D, He G, Mai K, et al. Effect of fish meal replacement by plant protein blend on amino acid concentration, transportation and metabolism in juvenile turbot (Scophthalmus maximus L.)[J]. Aquaculture Nutrition, 2017, 23(5): 1169-1178. DOI:10.1111/anu.12486 (  0) 0) |
| [20] |
Zou T, Cao S P, Xu W J, et al. Effects of dietary leucine levels on growth, tissue protein content and relative expression of genes related to protein synthesis in juvenile gibel carp (Carassius auratus gibelio var. CAS Ⅲ)[J]. Aquaculture Research, 2018, 49(6): 2240-2248. DOI:10.1111/are.13682 (  0) 0) |
| [21] |
Wang L P, Han Y Z, Jiang Z Q, et al. Interactive effects of dietary leucine and isoleucine on growth, blood parameters, and amino acid profile of Japanese flounder Paralichthys olivaceus[J]. Fish Physiology and Biochemistry, 2017, 43(5): 1265-1278. DOI:10.1007/s10695-017-0370-3 (  0) 0) |
| [22] |
Niu X J, Qian X L, Feng H M, et al. Growth and metabolic responses of grouper juveniles (Epinephelus coioides) fed diets containing varying levels of leucine[J]. Aquaculture, 2021, 534: 736281. DOI:10.1016/j.aquaculture.2020.736281 (  0) 0) |
| [23] |
Lin H Z, Tan X H, Zhou C P, et al. Effect of dietary arginine levels on the growth performance, feed utilization, non-specific immune response and disease resistance of juvenile golden pompano Trachinotus ovatus[J]. Aquaculture, 2015, 437: 382-389. DOI:10.1016/j.aquaculture.2014.12.025 (  0) 0) |
| [24] |
Liang H L, Ren M C, Habte-Tsion H M, et al. Dietary arginine affects growth performance, plasma amino acid contents and gene expressions of the TOR signaling pathway in juvenile blunt snout bream, Megalobrama amblycephala[J]. Aquaculture, 2016, 461: 1-8. DOI:10.1016/j.aquaculture.2016.04.009 (  0) 0) |
| [25] |
Zhao Y, Li J Y, Jiang Q, et al. Leucine improved growth performance, muscle growth, and muscle protein deposition through AKT-TOR and AKT-FOXO3a signaling pathways in hybrid catfish Pelteobagrus vachelli×Leiocassis longirostris[J]. Cells, 2020, 9(2): 327. DOI:10.3390/cells9020327 (  0) 0) |
| [26] |
Ren M C, Ai Q H, Mai K S. Dietary arginine requirement of juvenile cobia (Rachycentron canadum)[J]. Aquaculture Research, 2014, 45(2): 225-233. DOI:10.1111/j.1365-2109.2012.03218.x (  0) 0) |
| [27] |
Miao Y Q, Liu Y T, Cui K, et al. Effects of dietary arginine on growth, activity of digestive enzymes, GCN2-ATF4 signalling pathway and nutritional metabolism-related gene expression of large yellow croaker (Larimichthys crocea) larvae[J]. Aquaculture Nutrition, 2021, 27(6): 2333-2343. DOI:10.1111/anu.13366 (  0) 0) |
| [28] |
Zhou F, Zhou J, Shao Q J, et al. Effects of arginine-deficient and replete diets on growth performance, digestive enzyme activities and genes expression of black sea bream, Acanthopagrus schlegelii, Juveniles[J]. Journal of the World Aquaculture Society, 2012, 43(6): 828-839. DOI:10.1111/j.1749-7345.2012.00606.x (  0) 0) |
| [29] |
Cheng Y W, Li X S, Wang L, et al. Effects of dietary arginine levels on growth, immune function of physical barriers and serum parameters of spotted seabass (Lateolabrax maculatus) reared at different water temperatures[J]. Aquaculture, 2021, 541: 736812. DOI:10.1016/j.aquaculture.2021.736812 (  0) 0) |
| [30] |
Pohlenz C, Buentello A, le J Helland S, et al. Effects of dietary arginine supplementation on growth, protein optimization and innate immune response of channel catfish Ictalurus punctatus (Rafinesque, 1818)[J]. Aquaculture Research, 2014, 45(3): 491-500. DOI:10.1111/j.1365-2109.2012.03252.x (  0) 0) |
| [31] |
Hoseini S M, Yousefi M, Hoseinifar S H, et al. Effects of dietary arginine supplementation on growth, biochemical, and immunological responses of common carp (Cyprinus carpio L.): Stressed by stocking density[J]. Aquaculture, 2019, 503: 452-459. DOI:10.1016/j.aquaculture.2019.01.031 (  0) 0) |
| [32] |
Duan Y H, Li F N, Li Y H, et al. The role of leucine and its metabolites in protein and energy metabolism[J]. Amino Acids, 2016, 48(1): 41-51. DOI:10.1007/s00726-015-2067-1 (  0) 0) |
| [33] |
Wu C L, Chen L, Lu Z B, et al. The effects of dietary leucine on the growth performances, body composition, metabolic abilities and innate immune responses in black carp Mylopharyngodon piceus[J]. Fish & Shellfish Immunology, 2017, 67: 419-428. (  0) 0) |
| [34] |
Wang B, Liu Y, Feng L, et al. Effects of dietary arginine supplementation on growth performance, flesh quality, muscle antioxidant capacity and antioxidant-related signalling molecule expression in young grass carp (Ctenopharyngodon idella)[J]. Food Chemistry, 2015, 167: 91-99. DOI:10.1016/j.foodchem.2014.06.091 (  0) 0) |
| [35] |
Anthony J C, Yoshizawa F, Anthony T G, et al. Leucine stimulates translation initiation in skeletal muscle of postabsorptive rats via a rapamycin-sensitive pathway[J]. Journal of Nutrition, 2000, 130(10): 2413-2419. DOI:10.1093/jn/130.10.2413 (  0) 0) |
| [36] |
Yin Y L, Yao K, Liu Z J, et al. Supplementing L-leucine to a low-protein diet increases tissue protein synthesis in weanling pigs[J]. Amino Acids, 2010, 39(5): 1477-1486. DOI:10.1007/s00726-010-0612-5 (  0) 0) |
| [37] |
Lang C H, Frost R A. Endotoxin disrupts the leucine-signaling pathway involving phosphorylation of mTOR, 4E-BP1, and S6K1 in skeletal muscle[J]. Journal of Cellular Physiology, 2005, 203(1): 144-155. DOI:10.1002/jcp.20207 (  0) 0) |
| [38] |
Liu F J, Liu Y J, Tian L X, et al. Quatitative dietary leucine requirement of juvenile Pacific white shrimp, Litopenaeus vannamei (Boone) reared in low-salinity water[J]. Aquaculture Nutrition, 2014, 20(3): 332-340. DOI:10.1111/anu.12082 (  0) 0) |
| [39] |
Yao K, Yin Y L, Chu W, et al. Dietary arginine supplementation increases mTOR signaling activity in skeletal muscle of neonatal pigs[J]. The Journal of Nutrition, 2008, 138(5): 867-872. DOI:10.1093/jn/138.5.867 (  0) 0) |
 2024, Vol. 54
2024, Vol. 54


