2. 烟台海益苗业有限公司,山东 烟台 264000
三倍体贝类具有生长快、风味好、育性差、夏季死亡率低等优势[1-3],自Stanley[4]利用细胞松弛素B(Cytochalasin B, CB)成功诱导美洲牡蛎(Crassostrea virginica)三倍体以来,三倍体育种已相继在三十余种贝类中开展了研究。目前采用的诱导方法主要有物理法(静水压[5]、冷/热休克[6])、化学法(CB,6-二甲基氨基嘌呤[7],咖啡因[8])和生物法(二倍体和四倍体亲本配合[9])。近年来,王昭萍等[10]研究显示,低盐作为一种新的三倍体诱导方式,具有诱导效果好,成本低、操作便捷、安全无毒等优点,具有广阔的推广前景。
之前对于低盐诱导三倍体的研究中,于瑞海[11]、孔静[12]、陈宏发[13]等相继给出了不同盐度诱导条件下太平洋牡蛎(Crassostrea gigas)受精卵的卵裂率、孵化率和三倍体率,同时应用“孵化率×三倍体率”的值作为综合评价指标,判断三倍体的诱导效果,从而得出最佳的诱导条件。然而,为了给生产实践提供更好的理论依据,有必要对卵裂率和孵化率随诱导盐度的变化趋势进行进一步分析,同时探索一种更为科学合理的综合评价方法。
利用已有数据建立模型估测不同卵裂率、孵化率对应的诱导盐度,其原理与半数效量的估测类似。半数效量广泛应用于评测外界胁迫的致死率[14]、致畸率[15]、致突变率[16](半数致死剂量,LD50),及评断药物的有效剂量[17](半数有效剂量,ED50),在贝类中也被用来探究细菌感染、金属沉积物等的危害[18-20]。统计学中可以通过概率单位加权回归,得到胁迫程度(药物剂量、细菌感染量等)和胁迫效果(有效率、死亡率等)之间的回归曲线,从而反映不同胁迫条件下的致死效应[21],该回归可利用Probit回归分析实现[15]。
主成分分析(Principal Component Analysis,PCA)是研究如何通过少数几个主成分来解释多个变量的分析方法。其通过正交变换将原变量进行线性组合得到一组新变量(主成分),使它们尽可能多地保留原始变量的信息,且彼此不相关,并选取少数几个在变差总信息量中比例较大的主成分来进行分析,从而达到减少变量的目的[22-23]。该方法十分适用于综合分析多个因素,以探讨三倍体的诱导效果。
本研究利用概率单位加权回归法,分别得到了盐度与卵裂率及盐度与孵化率的回归拟合,为估测特定卵裂率和孵化率对应的诱导盐度提供了模型,并应用配对样本T检验对该模型的可信性进行了验证;同时利用主成分分析法,对不同诱导盐度下的卵裂率、孵化率和三倍体率进行了降维,抽取了两个分别代表卵裂、孵化率和三倍体率的主成分,分别计算了主成分的得分和不同诱导盐度的综合得分,为探究三倍体最佳诱导条件提供了一种更加全面科学的评价方法。
1 材料和方法 1.1 材料实验用2龄种贝(壳长8~14 cm)取自烟台海益苗业有限公司,经升温促熟培育后待用。
1.2 方法 1.2.1 精卵获取及受精实验所用海水均为过滤自然海水,盐度为30,水温为23~25 ℃,器械每次操作前均使用淡水杀死精子,避免精子污染。挑选性腺发育程度较好的亲贝,洗刷干净后开壳,解剖针挑取适量性腺镜检,区分雌雄。雌性亲贝取卵,卵液先用300目筛绢过滤去除组织碎屑,后用1 000目筛绢以过滤海水冲洗2~3遍去除混入的组织液消化液等,不同亲贝的卵液置于不同的100 mL烧杯内,浸泡50 min促熟,镜检,选取卵子形状近圆、卵内物质致密的卵液混合,浓缩卵液至700~800 mL,调整卵子密度为7 000~8 000个/mL[24]。受精前10 min解剖取精子,挑选精子活力高的精液,用300目筛绢过滤去除组织碎屑,以卵子:精子=1:5~1:6的比例进行受精[13]。
1.2.2 低盐诱导处理及幼虫培养40%~50%受精卵出现第一极体(PB1)时将受精卵液加入500 mL烧杯中,使得终盐度分别为4,6,8,10,12,14,16和30,低盐诱导15 min。后迅速转入20 L桶中进行培养。统计卵裂率、孵化率,24 h后收集D型幼虫,利用流式细胞术测定三倍体率,染色剂为DAPI,流式细胞仪型号为FC500 MPL(Beckman Coulter, USA)。实验重复3次。
1.2.3 指标测定卵裂率=卵裂卵数/受精卵总数×100%。
孵化率= D形幼虫数/受精卵总数×100%。
三倍体率=三倍体D形幼虫数/(三倍体D形幼虫数+二倍体D形幼虫数)×100%。
数据表示方法:平均值±标准误(Mean±SE)。
1.3 概率单位加权回归及模型验证 1.3.1 概率单位加权回归采用SPSS 19.0中的Probit回归对数据进行概率单位加权回归,模型选择概率模型,对回归得到的结果进行标准化残差分析,去除不适合进行回归直线拟合的数据,对剩下的数据进行第二次Probit回归,得到最终模型。
1.3.2 模型验证根据Probit回归得到的模型选择若干合适的盐度,按照1.2中的方法测定这些盐度处理条件下的卵裂率及孵化率,采用SPSS 19.0中配对样本T检验的方法与模型拟合的卵裂率和孵化率进行比较。
1.4 主成分分析采用SPSS 19.0对卵裂率、孵化率和三倍体率进行主成分分析,参照王芳[22]、李艳双[23]等的方法,以累计方差贡献率≥85%作为主成分的选取标准,根据以下公式计算综合得分:
综合评价指数=主成分1得分×主成分2的方差贡献率+主成分2得分×主成分1的方差贡献率。
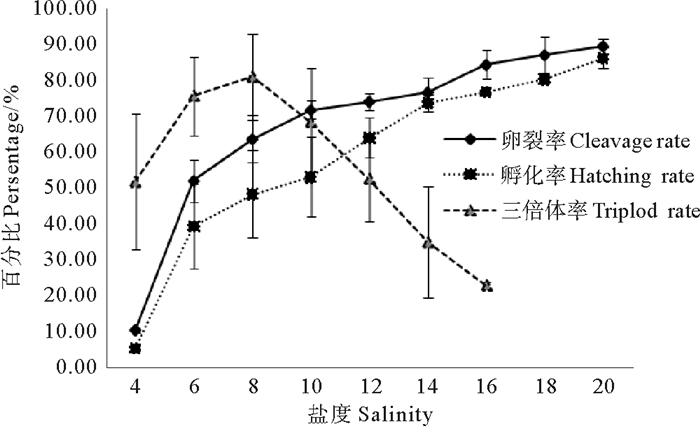
2 结果与讨论 2.1 不同盐度诱导条件下的卵裂率、孵化率和三倍体率由图 1可知,随着诱导盐度的增加,受精卵的卵裂率、孵化率也随之增加,而三倍体率呈现先升后降的趋势,且盐度8时三倍体率最高,这与于瑞海、孔静[11-12]等的结果一致。
|
图 1 不同盐度诱导条件下的卵裂率、孵化率及三倍体率 Fig. 1 Cleavage rates, hatching rates and triploid rates of different inducing salinities |
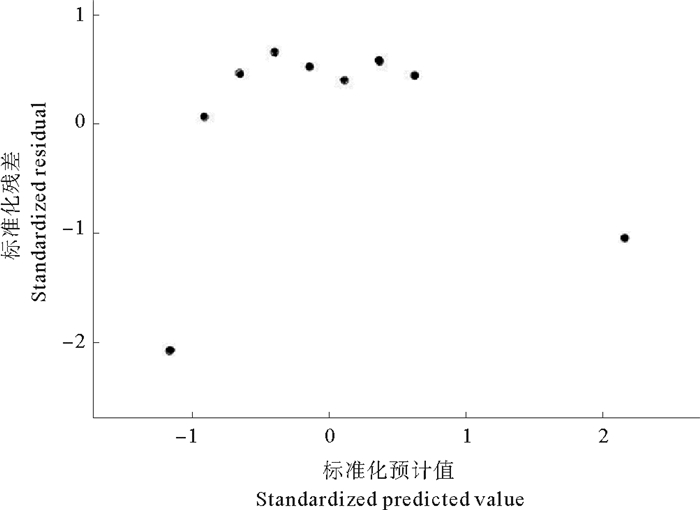
Pearson拟合度检验可用来判断曲线的拟合效果,其卡方值越小,R2值越接近1,拟合效果越好,由表 1可知,该拟合的R2接近0,远小于1,说明有显著偏离曲线的点对数据的回归拟合造成了干扰,因此对所有数据进行标准化残差分析,结果见图 2。其中,调整的R2值越接近1,P值越小,说明残差回归效果越好,数据的残差越接近正态分布,拟合效果越好。
|
|
表 1 卵裂率及孵化率的Pearson拟合度检验 Table 1 Pearson chi-square test of cleavage rates and hatching rates |
|
图 2 卵裂率数据的标准化残差回归分析 Fig. 2 Standard residual regression analysis of cleavage rate data |
图 2中显示,盐度4的试验点,其标准化残差小于-2,落在正态分布区间外,因此应将其判定为异常试验点,不参与回归拟合。同时,表 2中显示,将盐度4及30的数据依次删除之后,标准化残差回归的R2值增加至接近1,P值降低,表现为极显著,说明除盐度4外,盐度30亦为异常试验点,将这两组数据删除后,数据的残差符合正态分布,拟合出的曲线可信性较高。
|
|
表 2 卵裂率和孵化率的标准化残差回归 Table 2 Standard Residual regression analysis of cleavage rates and hatching rates |
将卵裂率和孵化率中盐度4、30组数据均删除之后,对剩余数据进行第二次Probit回归分析,协变量(盐度)选择不进行转换、进行以10为底的对数转换或自然对数转换,进行比较,结果如表 1所示。由表 1可知,对于卵裂率来说,对盐度进行以10为底的对数转换和进行自然对数转换得到的结果相同(卡方=1.135,R2=0.951),且均优于不对盐度进行转换得到的结果(卡方=1.586,R2=0.903),因此随机采用对盐度进行以10为底的对数转换;对于孵化率来说,不对盐度进行转换得到的结果优于对盐度进行以10为底的对数转换或自然对数转换的结果,因此本次回归未对盐度进行对数转换。概率回归结果见表 3、4和5。其中卵裂率为50%的诱导盐度估计值为5.648,孵化率为50%的诱导盐度估计值为8.644。
|
|
表 3 卵裂率及孵化率与诱导盐度的PROBIT模型构建 Table 3 Probit model of cleavage rates/hatching rates and inducing salinities |
|
|
表 4 卵裂率与诱导盐度的PROBIT回归 Table 4 Weighted probit regression analysis of cleavage rates and inducing salinities |
|
|
表 5 孵化率与诱导盐度的PROBIT回归 Table 5 Weighted probit regression analysis of hatching rates and inducing salinities |
由于Probit回归分析采用的盐度范围是6~18,因此验证盐度的选择范围也应为6~18,因此,根据表 4和5的结果,卵裂率选择的验证盐度及其对应估计百分比分别为:7.5/60%,10.0/70%,14.2/80%;孵化率选择的验证盐度及其对应估计百分比分别为:6.1/40%,8.6/50%,11.2/60%,14.0/70%,17.2/80%。验证结果如表 6所示。
|
|
表 6 不同诱导盐度下观测值与回归模型估计值的比较 Table 6 Pared-samples T testof the observed values and the predicted values |
由表 6可得,所有组别的P值均大于0.05,说明估计值和观测值之间不存在显著差异,即该模型对不同诱导盐度下卵裂率和孵化率的估计较为可信。因此,生产实践中可参考表 4和5的结果,根据盐度与卵裂率、孵化率的关系选择更为合适的诱导盐度。
2.4 综合评价指标计算前人的研究往往采用将孵化率与三倍体率的乘积作为综合指标来评价诱导效果,然而生产实践中需考虑的评价因素不仅只有孵化率与三倍体率,卵裂率、附着变态率、生长速度、抗逆性等因素都应当列入最优诱导条件评价体系中,主成分分析作为一种能同时考虑多种影响因素的评价方法,对于诱导条件的选择是很有意义的。
2.4.1 卵裂率、孵化率与盐度的主成分分析由于本实验数据不存在量纲及数量级的区别,因此卵裂率、孵化率和三倍体率的数据无需进行标准化,可直接进行主成分分析。
主成分分析共抽取了三个主成分,其方差贡献率分别是73.62%,26.16%和0.22%,为了能够尽可能多地保留原始变量的信息,主成分的选取通常遵循“累计方差贡献率≥85%”的标准。按照该标准,我们选取了前两个主成分用于综合指数的计算,其累计方差贡献率为99.78% (见表 7)。对于主成分1,它在卵裂率与孵化率上的特征向量分别为0.936/0.986,而在三倍体率上的特征向量为负值(-0.600),说明主成分1主要反映了卵裂率和孵化率这两个原始变量;而主成分2在三倍体率上的特征向量(0.800)则显著高于在卵裂、孵化率上的特征向量(0.348、0.157),说明主成分2主要反映的是三倍体率这个原始变量,也就是说主成分1和主成分2很好的反映了所有的原始变量,成功地达到了减少变量的目的。
|
|
表 7 提取主成分的负荷及其方差贡献率 Table 7 Factor loading and variance contribution rate of the extracted principal components |
根据这两个主成分的特征值、特征向量及方差贡献率得出的综合评价指数见表 8。结果显示,随着盐度的增加,诱导的综合评价指数先升后降,在盐度为8时达到最大值(0.67),这与之前的研究结果一致,说明盐度8的确为适宜的诱导盐度。然而通过该表格还可以看出,盐度10的综合评价指数也较高(0.54),与盐度8相比,表现出更高的卵裂、孵化率(PC1: 0.04>-0.53)和较低的诱导效果(PC2: 0.72<1.09)。因此,生产实践中可以根据实际需要选择诱导盐度为8(更高的诱导率)或10(更高的存活率)。当然,仅根据卵裂率、孵化率和三倍体率得出的综合评价指数是不全面的,需要进一步实验提供不同诱导盐度条件下幼虫的存活、附着及后续的生长数据,以期得到更为完善的评价体系,为生产实践提供科学的指导。
|
|
表 8 不同诱导盐度条件下的综合评价指数 Table 8 Comprehensive evaluation index of different inducing salinities |
本研究通过对卵裂率、孵化率与盐度进行概率加权回归拟合和主成分分析,为低盐诱导太平洋牡蛎三倍体提供了可参考模型与更科学的综合评价方法。Probit模型提供了不同诱导盐度下卵裂率与孵化率的估计值,要达到50%卵裂率和50%孵化率的诱导盐度应分别大于5.648和8.644。主成分分析得出了各诱导盐度的综合评价指数,其中盐度8,10评价指数最高,盐度8诱导率最高但存活率相对较低,盐度10诱导率稍低但存活率较高,在生产实践中根据具体需要,选择更好的诱导效果或更高的存活率。
| [1] |
Nell REHJA, Thompson P A. Studies on triploid oysters in Australia: XIII. Performance of diploid and triploid Sydney rock oyster, Saccostrea glomerata (Gould, 1850), progeny from a third generation breeding line[J]. Aquaculture, 2009, 233: 93-107.
(  0) 0) |
| [2] |
Normand J, Ernande B, Haure J, et al. Reproductive effort and growth in Crassostrea gigas: Comparison of young diploid and triploid oysters issued from natural crosses or chemical induction[J]. Aquatic Biology, 2009, 7: 229-241. DOI:10.3354/ab00190
(  0) 0) |
| [3] |
Jeung H D, Keshavmurthy S, Lim H J, et al. Quantification of reproductive effort of the triploid Pacific oyster, Crassostrea gigas raised in intertidal rack and bag oyster culture system off the west coast of Korea during spawning season[J]. Aquaculture, 2016, 464: 374-380. DOI:10.1016/j.aquaculture.2016.07.010
(  0) 0) |
| [4] |
Stanley J G, Allen S K, Hidu H. Ployploidy induced in the American oyster Crassostrea virginica with cytochalasin B[J]. Aquaculture, 1981, 23: 1-10. DOI:10.1016/0044-8486(81)90002-8
(  0) 0) |
| [5] |
Shen Y, Zhang X, He H, et al. Triploidy induction by hydrostatic pressure in the pearl oyster, Pinctada martensii Dunker[J]. Aquaculture, 1993, 110(3-4): 221-227. DOI:10.1016/0044-8486(93)90370-E
(  0) 0) |
| [6] |
田传远, 王如才, 梁英, 等. 低温诱导太平洋牡蛎产生三倍体[J]. 海洋科学, 1999(1): 53-55. Tian C, Wang R, Liang Y, et al. Triplod Pacific oyster, Crassostrea gigas, as induced by cold shock[J]. Marine Sciences, 1999(1): 53-55. DOI:10.3969/j.issn.1000-3096.1999.01.021 (  0) 0) |
| [7] |
Gerard A, Ledu C, Phelipot P, et al. The induction of MI and MII triploids in the Pacific oyster Crassostrea gigas with 6-DMAP or CB[J]. Aquaculture, 1999, 174(3-4): 229-242. DOI:10.1016/S0044-8486(99)00032-0
(  0) 0) |
| [8] |
Patrick D, Katsuhiko T W, Akira K. Triploidy induction by caffeine-heat shock treatments in the japanese pearl oyster Pinctada fucata martensii[J]. Nihon Suisan Gakkai Shi, 1990, 56: 1423. DOI:10.2331/suisan.56.1423
(  0) 0) |
| [9] |
Wang Y, Guo X, DeBrosse G, et al. Superior growth in natural triploid eastern oyster produced by diploid×tetraploid crosses[J]. Journal of Shellfish Research, 2004, 24: 1274.
(  0) 0) |
| [10] |
王昭萍, 赵婷, 于瑞海, 等. 一种新方法——低渗诱导虾夷扇贝三倍体的研究[J]. 中国海洋大学学报(自然科学版), 2009, 39(2): 193-196. Wang Z, Zhao T, Yu R, et al. A new method for triploid induction by hypotonic treatment in scallop Patinopecten yessoensis[J]. Periodical of Ocean University of China, 2009, 39(2): 193-196. (  0) 0) |
| [11] |
于瑞海, 王昭萍, 孔静, 等. 利用不同盐度诱导长牡蛎三倍体的研究[J]. 中国海洋大学学报(自然科学版), 2015, 45(1): 26-29. Yu R, Wang Z, Kong J, et al. A methodological study on the induction of triploidy oyster with different salinites[J]. Periodical of Ocean University of China, 2015, 45(1): 26-29. (  0) 0) |
| [12] |
孔静, 王昭萍, 于瑞海, 等. 低渗诱导太平洋牡蛎三倍体以及与其他诱导方法的比较[J]. 中国水产科学, 2011, 18(3): 581-587. Kong J, Wang Z, Yu R, et al. Triploid induction in Pacific oyster (Crassostrea gigas) by hypotonic treatment and comparison with other induction methods[J]. Journal of Fishery Sciences of China, 2011, 18(3): 581-587. (  0) 0) |
| [13] |
陈洪发, 王昭萍, 于瑞海, 等. 不同盐度海水对低盐诱导长牡蛎三倍体的影响[J]. 中国海洋大学学报(自然科学版), 2016, 46(9): 24-28. Chen H, Wang Z, Yu R, et al. Effect of salinty on the induction of triploid oyster (Crassostrea gigas)[J]. Periodical of Ocean University of China, 2016, 46(9): 24-28. (  0) 0) |
| [14] |
George D Floros, Anastasia I Kokkari, Nikolaos A Kouloussis, et al. Evaluation of the natural zeolite lethal effects on adults of the bean weevil under different temperatures and relative humidity regimes[J]. Journal of Economic Entomology, 2018, 111(1): 482-490. DOI:10.1093/jee/tox305
(  0) 0) |
| [15] |
Amal Abdel Aziz Eisa, Gamal El-Sayed Aboelghar, Ibrahim Mahmoud Ammar, et al. Teratogenic effects induced by chitosan oligosaccharide in Wistar female rat Rattus norvegicus[J]. Environmental Science and Pollution Research, 2018, 25(10): 9371-9379. DOI:10.1007/s11356-018-1199-8
(  0) 0) |
| [16] |
Tabti D M, Laouar K, Rajendran S, et al. Identification of desirable mutants in quantitative traits of lentil at early (M2) generation[J]. Journal of Environmental Biology, 2018, 39: 137-142. DOI:10.22438/jeb/39/2/MRN-476
(  0) 0) |
| [17] |
王惠霞, 徐礼鲜, 马加海, 等. 口服异丙酚对小鼠镇静和麻醉作用[J]. 第四军医大学学报, 2005, 21: 1957-1959. Wang H, Xu L, Ma J, et al. Effect of orally taken propofolon sedation and anesthesia in mice[J]. Journal of Forth Military Medical University, 2005, 21: 1957-1959. DOI:10.3321/j.issn:1000-2790.2005.21.013 (  0) 0) |
| [18] |
Marie-Agnès Travers, Delphine Tourbiez, Leïla Parizadeh, et al. Several strains, one disease: Experimental investigation of Vibrio aestuarianus infection parameters in the Pacific oyster, Crassostrea gigas[J]. Veterinary Research, 2017, 48: 32. DOI:10.1186/s13567-017-0438-1
(  0) 0) |
| [19] |
Robyn M Estes, Carolyn S Friedman, Ralph A Elston, et al. Pathogenicity testing of shellfish hatchery bacterial isolates on Pacific oyster Crassostrea gigas larvae[J]. Diseases of Aquatic Organisms, 2004, 58: 223-230. DOI:10.3354/dao058223
(  0) 0) |
| [20] |
Phelps H L, Warner K A. Estuarine sediment bioassay with oyster pediveliger larvae (Crassostrea gigas)[J]. Bulletin of Environmental Contamination and Toxicology, 1990, 44(2): 197-204. DOI:10.1007/BF01700136
(  0) 0) |
| [21] |
Lingling Deng, Jiayin Dai, Hong Cao, et al. Effects of an organophosphorous insecticide on survival, fecundity, and development of Hylyphantes graminicola (Sundevall) (Araneae: Linyphiidae)[J]. Environmental Toxicology and Chemistry, 2006, 25(11): 3073-3077. DOI:10.1897/06-194R.1
(  0) 0) |
| [22] |
王芳. 主成分分析与因子分析的异同比较及应用[J]. 统计教育, 2003, 56(5): 14-17. Wang F. Comparison and application of principal component analysis & factor analysis[J]. Statistical Education, 2003, 56(5): 14-17. (  0) 0) |
| [23] |
李艳双, 曾珍香, 张闽, 等. 主成分分析法在多指标综合评价方法中的应用[J]. 河北工业大学学报, 1999, 28(1): 94-97. Li Y, Zeng Z, Zhang M, et al. Application of primary component analysis in the methods of comprehensive evaluation formany indexes[J]. Journal of Hebei University of Technology, 1999, 28(1): 94-97. DOI:10.3969/j.issn.1007-2373.1999.01.022 (  0) 0) |
| [24] |
Guo-fan Z, Ya-qing C, Jian S, et al. Triploidy induction in Pacific oyster Crassostrea gigas by caffeine with thermal shock[J]. Chinese Journal of Oceanology and Limnology, 1998, 16: 249-255. DOI:10.1007/BF02848731
(  0) 0) |
2. Haiyi Marine Seeds Co. Ltd, Yantai 264000, China
 2020, Vol. 50
2020, Vol. 50


