脂肪是由甘油和脂肪酸组成的三酰甘油酯,脂肪的性质和特点主要由脂肪酸决定。脂肪酸是一端含有一个羧基的脂肪族碳氢链,它包括一条长的烃链(“尾”)和一个末端羧基(“头”)。依据双键的数目、位置及碳氢链饱和程度,脂肪酸可分为饱和脂肪酸(Saturated fatty acid,SFA)、单不饱和脂肪酸(Monounsaturated fatty acids,MUFA)和多不饱和脂肪酸(Polyunsaturated fatty acid,PUFA)。其中PUFA又可分为:n-3 PUFAs和n-6 PUFAs。n-3 PUFAs主要包括亚麻酸(α-linolenic acid,ALA)、二十碳五烯酸(Eicosapentaenoic acid,EPA)和二十二碳六烯酸(Docosahexaenoic acid,DHA);n-6 PUFAs主要包括亚油酸(Linoleic acid,LA)和二十碳四烯酸(Arachidonic acid,AA)[1]。
脂肪酸作为膜中磷脂的主要构成成分参与了组织构建,并在结合转运胆固醇中发挥着重要作用;另外,在脊椎动物下丘脑不同区域的长链脂肪酸(Long-chain fatty acids,LCFA)能够作为能量的传感器,在调节能量动态平衡中扮演着非常重要的角色[2];研究还证明,游离状态的PUFA代谢生成的调节物质对于炎症有重要的调节作用,可以调控炎症的启动、发展和消退[2-3];作为一系列高活性激素类物质的前体,脂肪酸也能调控凝血和应急反应等重要生理过程[4]。因此,脂肪酸在维持机体的正常机能、促进生长发育、调控动物免疫力等方面发挥着非常重要的作用[5]。除此之外,脂肪酸在动物性腺形成、配子发生和胚胎发育中的作用也逐渐得到了揭示并引起了重视。为了进一步全面认识脂肪酸在机体发挥的作用,本文对该领域的研究进展进行了综述。
1 脂肪酸在性腺形成、配子发生和胚胎发育中的作用大多数脂肪酸可以由动物机体本身合成;少量机体自身不能合成、或合成速度慢无法满足需要,必须通过食物供给的多不饱和脂肪酸,主要包括n-3 PUFAs、n-6 PUFAs,称为必需脂肪酸(Essential fatty acids,EFA)。例如,亚油酸和亚麻酸是成人的必需脂肪酸,亚油酸、花生四烯酸等n-6PUFAs,和亚麻酸、二十碳五烯酸及二十二碳六烯酸等n-3PUFAs都是鱼虾的必需脂肪酸。由于不同物种对脂肪酸的利用存在差异,本文对脂肪酸分别在哺乳动物、鱼类和无脊椎动物中的作用进行综述。
1.1 脂肪酸在哺乳动物性腺形成、配子发生和胚胎发育中的作用脂肪酸通常以三酰基甘油(TG)的形式储存在细胞质中。不带电的甘油酯通常以中性脂滴的形式排列,是代谢能量高度集中的存储体[6]。在成年哺乳动物中,脂滴储存的主要位置是脂肪细胞。脂肪细胞的细胞质几乎完全由一个大的TG球组成。值得注意的是,哺乳动物卵母细胞和胚胎的细胞质中也含有大量的脂质[7-9]。那么,脂肪酸在这些组织或细胞中起什么作用呢?
卵母细胞的发育是一个多阶段的过程。在原始卵泡向成熟卵母细胞发展的过程中,卵母细胞积累脂质有数个发育阶段,而其成熟的最后阶段最容易受到细胞质脂质含量变化的影响。Aardema等的研究表明,牛卵母细胞的脂质分布是动态的,很大程度上取决于其发育的环境[10]。比如,牛卵母细胞在减数分裂成熟之前和过程中保留了非酯化脂肪酸(Non esterified fatty acids,NEFA)。n-3和n-6 PUFAs物质代谢产生的前列腺素和与免疫相关的花生酸类物质是在卵巢中生成的,它们作为激素以调节卵巢功能,其随着排卵过程周期性变化[11]。本文从以下3个方面来描述脂肪酸在调控生殖发育中的功能。
1.1.1 脂肪酸与哺乳动物卵泡发育与生育能力哺乳动物的生育能力与卵泡中脂肪酸的改变密切相关。研究发现,优质卵母细胞往往含有更多的亚油酸和花生四烯酸[12]。孕妇超重和女性肥胖会对滤泡液的成分产生影响,并导致生育能力不佳[13-14]。最近的一项研究中,使用一个Δ6脂肪酸去饱和酶(FADS2)缺失的小鼠突变体(该突变体缺乏生物合成n-3和n-6 PUFAs的关键酶活性),研究了PUFA在雌性和雄性生殖中的分子作用[15]。研究发现,PUFA合成缺乏导致雌性小鼠卵泡发育停止、卵母细胞闭锁和不育,滤泡颗粒细胞间隙连接网络的解体。在Fads2突变体的睾丸中,睾丸屏障被破坏,精子发生受阻,导致不孕。而持续的AA和DHA联合供应重塑了PUFA缺陷的卵巢和睾丸膜脂质体,促进了功能间隙连接网络的重新组装,并在支持细胞中重建睾丸屏障,不仅在发育中的子代中重建了生育能力,在成年不育的Fads2突变小鼠中也是如此。这些发现证实了n-3和n-6 PUFAs与性腺膜结构及女性和男性生育能力之间的分子联系,并可能促进对PUFA在人类生育能力中关键作用的研究[15]。而在奶牛饲粮中添加EFA或共轭亚油酸(CLA)均不能提高体外胚胎产量,但添加ALA和9-顺式CLA、11-反式CLA可影响卵泡颗粒细胞(GC)的形态和功能,进而可能会导致奶牛卵泡发育和卵巢周期受损[16]。
脂肪酸种类较多,不同的脂肪酸的作用并不相同。饱和游离脂肪酸,如棕榈酸(PA)和硬脂酸(SA),以时间和剂量依赖的方式显著抑制人颗粒细胞的生存。饱和游离脂肪酸对细胞存活的抑制作用是由细胞凋亡引起的。软脂酸诱导颗粒细胞凋亡时,颗粒细胞凋亡抑制因子Bcl-2表达下调,凋亡效应因子Bax表达上调。饱和脂肪酸对颗粒细胞存活的影响可能是生殖异常的一种可能机制,如在肥胖妇女中经常观察到的闭经[17]。高脂饮食(High fat diet,HFD)的肥胖小鼠睾丸支持细胞(Sertoli cell)凋亡率增加,活性氧的水平也有所提高[18]。而多不饱和脂肪酸,如花生四烯酸,并不影响细胞存活。而且,花生四烯酸对棕榈酸和硬脂酸诱导的细胞凋亡还具有保护作用。与饱和脂肪酸相比,n-3 PUFAs可归为保护性游离脂肪酸。n-3 PUFAs在生理相关水平上可保护支持细胞免受棕榈酸诱导的脂毒性[18]。油酸在化学上被归为不饱和的n-9脂肪酸。一些相关的研究表明,油酸在抵消饱和脂肪酸的有害影响和支持卵母细胞的发育方面发挥着关键作用。油酸可以通过脂肪酸代谢分配、膜结构组织改变、氧化应激衰减和细胞内信号传导调节等机制促进正常卵母细胞和着床前胚胎的发育[19]。另外,有研究发现,油酸可特异性地影响颗粒细胞的形态、生理特征和基因表达水平,从而改变颗粒细胞的功能。在奶牛的负能量平衡(NEB)或饥饿期间增加油酸浓度: (1)可诱导对培养的牛颗粒细胞内脂滴积聚,形成泡沫状细胞形态;(2)显著降低促性腺激素激素受体FSHR和LHCGR、甾体生成基因STAR、CYP11A1、HSD3B1和CYP19A1、细胞周期调节因子CCND2的转录丰度[20];(3)减少奶牛17-β-雌二醇(E2)的产生,增加脂肪酸转运体CD36的表达,促进血管生成和组织重塑,从而提早启动奶牛的卵泡-黄体过渡(Folliculo-luteal transition)[21]。而棕榈酸和硬脂酸的作用则相反,均显著上调牛颗粒细胞FSHR、LHCGR、CYP19A1、HSD3B1、CCND2的表达,增加17β-雌二醇(E2)的分泌[22]。
非酯化脂肪酸是卵泡液的主要脂质成分之一,NEFA水平升高会损害卵母细胞品质和发育潜力,抑制猪颗粒细胞转变为黄体细胞,进而影响子代的代谢和生殖能力[23]。将牛卵母细胞暴露于较高浓度的NEFA中,在其随后发育的胚胎中,与脂肪酸合成相关的基因表达上调,同时促进氧化代谢的中断;抑制脂肪酸β-氧化可以恢复发育能力[24]。同样,在未处于负能量平衡状态的奶牛中,增加滤泡内NEFA浓度对其卵泡发育有不利影响[25]。可见不同浓度的NEFA对生殖发育的影响有所不同。
多囊卵巢综合征(PCOS)是一种以高雄激素为特征的复杂而常见的内分泌紊乱,常伴有小窦期卵泡生长停滞,颗粒细胞增殖极少,慢性无排卵。研究表明,PUFA抑制细胞凋亡,增加细胞增殖。PUFAs (n-3/n-6=1/15)显著增加PCOS大鼠卵巢品质,改善卵巢结构,显著提高血清激素(FSH和E2)水平。研究发现,PUFA通过增加与激素分泌和卵巢功能相关的甾体生成酶的表达,提高PCOS的生殖性能[26]。进一步研究显示,n-3 PUFAs通过激活PI3K/Akt通路上调PCOS中的CYP51表达,进而增强细胞发育和类固醇生物合成[27]。
1.1.2 脂肪酸与哺乳动物胚胎发育脂肪酸在动物胚胎发育中也发挥着重要作用。Menezo等的数据表明牛胚胎总脂肪酸含量在第11~13天之间急剧上升,花生四烯酸在第14天进一步增加[28]。Wonnacott等发现,在绵羊饲粮中无论添加n-3 PUFAs还是n-6 PUFAs,所有的胚泡都有较高的不饱和脂肪酸组成,尤其是亚油酸[29]。研究还发现,50 μmol/L的亚麻酸能提高山羊体外培养的卵母细胞减数分裂成熟速率,降低胚泡凋亡,促进胚胎发育[30]。在猪中,油酸提高了囊胚率,而硬脂酸则没有影响[31]。在某些代谢环境中观察到较高水平的饱和脂肪酸(尤其是棕榈酸和硬脂酸)对人卵母细胞成熟和着床有不利影响,但这种影响可以被油酸和二十碳五烯酸等不饱和脂肪酸的存在抵消[32]。Wakefield等在小鼠模型中研究发现,喂养富含n-3 PUFAs的食物,然后在体内受精后评估胚胎品质,发现囊胚数量和整体胚胎品质降低,伴随着线粒体受损和ROS水平升高,同时该研究表明,孕期高剂量的n-3 PUFAs会降低小鼠正常胚胎发育,因而提出了在孕期补充n-3 PUFAs是否适当的问题[33]。脂肪酸对胚胎发育的影响是如何产生的还不清楚,但食物中脂肪酸的比例对胚胎发育是明显重要的。Van Hoeck等证明,将牛卵母细胞暴露于生理相关的高水平棕榈酸、油酸和硬脂酸中会引起胚泡中代谢和基因表达的显著失调,而当这些脂肪酸单独补充时,这种影响并不明显,这说明脂肪酸比例对胚胎成功发育的重要性[34]。
瘦素(Leptin)是一种由脂肪组织分泌的蛋白质类激素。有研究发现,Leptin和Leptin受体基因突变的小鼠均表现为饮食过多、能耗减少、严重肥胖和不孕不育[35]。当重新注射Leptin后,体质量和饮食恢复正常,生育能力也有明显的改善,表现为雌性子宫和卵巢增加品质、雄性睾丸增加品质、精子数量增多[35]。同时有研究发现,瘦素与子宫内膜异位和不孕密切相关[36],但Leptin是通过直接调控肥胖而影响性腺发育,还是通过调控性激素的分泌而影响肥胖,进而影响性腺发育,还有待于进一步研究。
1.1.3 脂肪酸与雄性哺乳动物生育能力PUFA的组成和形态对男性生育能力产生影响[37]。脂肪酸广泛参与精子发育、成熟和受精过程。Lenzi等对正常精子和红细胞的不饱和脂肪酸含量进行了总结和比较,发现精子中最具代表性的PUFA(C22∶6, n-3)所占比例更高。这表明精子具有活跃的脂肪酸代谢能力,在精子发生和成熟过程中处于去饱和状态[38]。DHA是精子发生和成熟所必需的,且DHA含量与精子受精能力呈正相关[39]。花生四烯酸对人类精子活力存在着抑制作用,该抑制作用具有浓度依赖性[40]。另外,PUFA可以作为精子生育和病理的标志。Safarinejad等[41]比较了可生育和不育男性的精子PUFA组成,发现可生育组的n-3 PUFAs更高,但不育组的花生四烯酸水平更高。Am-In等研究了正常和低活力公猪精子的脂质分布[42]。二十二碳六烯酸和n-3 PUFAs与精子活力、存活率、正常形态和正常质膜正相关,亚麻油对公羊睾丸发育和精子发生有促进作用,而饱和脂肪酸和n-6/n-3 PUFAs与正常精子参数呈负相关[42]。
饮食中的脂肪酸能够对精子品质和功能产生明显的影响。精子脂肪酸在饮食中n-3多不饱和脂肪酸最为敏感[43]。橄榄油通过增加大鼠配子活力、减少氧化应激和略微提高线粒体呼吸效率,在一定程度上抵消高脂肪饮食对精子品质的负面影响,磷虾油可增加精子浓度和活力,提高乳酸脱氢酶、克雷布斯循环酶(Krebs cycle enzymes)和呼吸链复合物的活性,同时增加细胞ATP水平,减少氧化损伤[44]。饲料中脂肪酸的摄入对配子组成和雄性生殖能力有显著影响。通过调节n-3 PUFAs摄入量,使n-3/n-6 PUFAs比值保持在一个最佳范围内尤为重要[45]。外源性补充反式脂肪酸的小鼠会导致生殖损伤,表现为血清睾酮浓度下降、精子数量减少,在高浓度下还会抑制精子发生,使睾丸退化[46]。n-3 PUFAs、n-6 PUFAs和反式脂肪酸的摄入也会影响男性睾丸的功能[47],反式脂肪酸摄入高的人精子数量减少了37%,同样这些人睾酮浓度减少15%,睾丸直径减少4%[48]。过量的饮食胆固醇对雄性小鼠和大鼠的生殖功能有非常负面的影响。大量的实验动物研究也证明了饲料脂肪酸对基因表达的影响,尤其是PPAR、去饱和酶和延长酶基因[49]。反式脂肪酸的负作用可能通过下调精子中PPAR核受体来发挥[50]。
1.2 脂肪酸在鱼类性腺发育与配子发生中的作用鱼类中存在中性脂肪和极性脂肪[51],其中极性脂肪主要作为结构脂类,中性脂肪的主要生物学功能是能量存贮。中性脂肪与极性脂肪的含量存在组织和时间差异性,这主要与其功能有关。某些鱼类在发育过程中对脂肪酸的利用存在一定的选择性。有研究表明,银鲳亲鱼性腺发育过程中,包含DHA在内的多种必需脂肪酸在总脂肪酸中的比例随卵巢的发育而增加[52]。鱼类的精巢中以极性脂肪为主,因为精巢中含有大量精细胞[53]。精子发育过程中需要极性脂肪作为构成其细胞膜的成分,因此精巢中高含量的DHA或许与保持精子的活力有关,以保证受精作用的顺利进行[37]。
鱼卵中的脂类和脂肪酸含量对胚胎发育和仔鱼存活有重要作用[20],在卵发育过程中,卵黄物质在肝脏中合成,然后转移至卵中[54]。研究发现在卵巢发育的后期,为了保障卵巢发育需要的营养和能量,银鲳肌肉中的中性脂肪与总脂肪向卵巢中进行转移;虽然在精巢的发育过程中,精巢总脂肪、极性脂肪和中性脂肪没有显著的增加,但是雄鱼肝脏和肌肉中的极性脂肪减少,表明雄鱼肌肉中的极性脂肪有向精巢转移的趋势或被优先消耗的特点[52]。与银鲳类似,在牙鲆亲鱼的性腺发育过程中,可能优先动用肝脏中储存的某些脂肪酸,并在卵中选择性的积累[55]。有研究证实,卵巢中积累的PUFA能够影响卵黄蛋白原的合成、促进卵母细胞发育成熟、提高产卵数量和品质、提高受精率及孵化率[56]。在斑马鱼和剑尾鱼中,均发现使用混合油(鱼油∶亚麻=1∶1)可以获得最高的产卵量和孵化率,证实了n-3和n-6 PUFAs在动物繁殖过程中的重要作用[57]。在斑马鱼中,饲料中添加高不饱和脂肪酸及中链脂肪酸均可促进雌鱼的繁殖性能,并提高仔鱼的成活率[28];饲喂橄榄油的斑马鱼具有较高的精子密度和活力,生育率也较高[58]。在大菱鲆中,饲料中添加一定量的花生四烯酸则可抑制发育前期的亲鱼雌二醇和睾酮的合成[59]。在大西洋鳕鱼中,饲粮中添加花生四烯酸影响了与内分泌调节相关的E2和T的血浆谱以及cyp19a1a转录本水平[60]。有研究表明,本质上对卵子和仔鱼的品质产生影响的是n-3和n-6 PUFAs比例的平衡,并不是n-3 PUFAs的含量[61-62]。适宜的n-6/n-3 PUFAs比值对黄鳝的生长和繁殖是必要的[63]。欧洲鳗鱼体内,不同的脂肪酸与激素相互作用可以诱导卵巢的发育。增加日粮中n-3 PUFAs水平能促进欧洲鳗鲡的卵母细胞生长,从而促进激素处理下欧洲鳗鲡卵巢发育[64]。在中华鲟中,18%脂肪水平饲料可促进花生四烯酸代谢、胆固醇生物合成和卵黄形成,利于卵母细胞中脂滴沉积,促进中华鲟雌鱼性腺发育成熟[65]。
李娟[66]研究发现,bmp8a基因敲除后,斑马鱼在表现为肥胖、脂肪肝等特征的同时出现生育能力的减弱,在突变体的精巢中发现编码某些脂肪分解相关的酶(BSSL、LIPC、Pgc-1a、PPARα、UCP1、UCP2等)以及雄激素合成途径中的关键酶基因(cyp17a、cyp11a1、StAR等)的表达明显下降,推测肥胖斑马鱼精巢中类固醇合成能力下降,雄性激素合成减少导致精细胞的正常发育受影响。
1.3 脂肪酸在无脊椎动物性腺发育与配子发生中的作用在海胆配子发育过程中,生殖腺中脂肪酸组成的动态变化已有详细描述。研究发现,在配子发育过程中,在喂食含有脂肪酸饵料的条件下,二十碳五稀酸和二十二碳六烯酸是主要的被富集的长链多不饱和脂肪酸。相比之下,花生四烯酸的含量在整个配子发育过程中似乎变化不大,不太受摄食的影响[12]。海胆在变态发育过程中似乎有2个关键时期需要使用脂质,为其发育提供能量[67]。分析苏格兰西海岸2种海胆种群的性体指数(Gonadal somatic indices,GSI)和脂肪酸特征表明,不同种群海胆之间的GSI差异是由于摄食富含脂肪酸不同的食物引起的[68]。综上所述,脂肪酸在海胆的性腺发育中发挥作用。
在甲壳类中,高度不饱和脂肪酸在性腺成熟过程中不仅作为一种能量来源,而且是卵黄合成和胚胎发育必需的营养成分。有研究显示,在中华绒螯蟹中,育肥饲料中HUFA组成和含量对其雌体卵巢发育可造成一定的影响[69-70]。长期食用不含PUFA饲料的凡纳滨对虾亲虾性腺发育会终止[71]。虽然高含量的PUFA没有表现出对凡纳滨对虾性腺发育的促进作用,但是性腺中PUFA的含量会随着饲料中PUFA含量的升高而升高[72]。据此,Palacios等推断,凡纳滨对虾在饥饿状态下,没有外来能源为亲虾提供能量,饥饿的亲虾为了维持基本的生命活动,或许对性腺中的营养物质进行了重吸收[73]。另有研究表明,在性腺成熟的亲虾卵巢中具有较高含量的胆固醇,体现胆固醇对亲虾性腺发育和产卵孵化的调节作用[74]。饲料中适宜的DHA/EPA比例可提高凡纳滨对虾亲虾的性类固醇激素含量,促进其繁殖产卵[75]。对扇贝幼虫发育过程中的脂类动态与变态成功的关系研究表明,在变态前时期甘油三酯的积累是扇贝发育到脱螺阶段的一个很好的预测指标[76]。
在线虫中发现,使用多不饱和脂肪酸喂养线虫时,会引起其性腺细胞的过度凋亡从而导致绝育[77];另外,卵细胞中存在的多不饱和脂肪酸能吸引精子往储精囊的方向运动,表明多不饱和脂肪酸能够影响精子向卵细胞移动的能力[78]。
海洋无脊椎动物已被证明是独特脂肪酸结构的主要来源,这种结构源于不寻常的生物合成途径。其中,非甲基脂肪酸(Non-methyle-interrupted,NMI)存在于各种软体动物体、棘皮动物、海绵动物和许多其他无脊椎动物中,但其确切的生物学意义目前尚不清楚[79]。
2 脂肪酸调控性腺发育或配子发生的分子机制本文从脂肪酸如何影响代谢、活性氧、内质网应激、细胞信号事件和基因表达等几个方面进行描述。
2.1 脂肪酸β-氧化脂肪酸被广泛认为是卵母细胞和早期胚胎的潜在代谢底物[80]。对棕榈酸进行放射性标记,发现其可进入小鼠胚胎,特别是存在于代谢活跃的8细胞和囊胚晚期阶段[81]。脂肪酸最主要的氧化代谢方式为β-氧化。进入线粒体的脂肪酸经过β-氧化为卵母细胞提供能量。实验证实,体外成熟的卵母细胞与体内成熟的卵母细胞相比,脂肪酸β-氧化能力明显降低,同时脂肪酸β-氧化通路相关基因表达异常[82-83],说明脂肪酸β-氧化在卵母细胞成熟过程中发挥了重要作用。在猪和牛的卵母细胞成熟过程中,抑制β-氧化会导致随后的胚胎活力下降[84-85]。脂肪酸β-氧化的速率限制步骤是肉碱氨基糖酰基转移酶1(CPT1B)的催化,该酶在小鼠囊胚中可检测到表达。CPT1的抑制剂Etomoxir或丙二酰辅酶A(Malonyl CoA)可抑制卵母细胞的成熟,降低受精卵和2细胞胚胎的存活率;通过补充棕榈酸或L-肉碱可对其进行拯救[86-87]。CPT1的活性受到AMPK的调节。AMPK通过磷酸化抑制乙酰辅酶A羧化酶(ACC),降低丙二酰辅酶A(CPT1的有效抑制剂)的含量,导致脂质合成减少,增加脂肪酸氧化。
2.2 脂肪酸与活性氧(ROS)ROS的产生是有氧呼吸的一个特征,会对包括DNA、蛋白质和脂类在内的细胞大分子造成损害[88-89]。活性氧的类型包括超氧化物、过氧化物和羟基自由基。脂肪酸β-氧化产生ROS,可破坏线粒体DNA和蛋白质,导致线粒体功能受损[90]。实验证明,高水平的ROS会降低牛卵母细胞核的成熟率。LA能够诱导改变线粒体的分布、增加ROS水平, 在某种程度上对卵母细胞成熟起抑制作用[91]。脂质与活性氧(ROS)反应被称为脂质过氧化。ROS和脂质含量之间的关系具有物种差异性,在低脂肪酸组成的小鼠卵母细胞和早期胚胎中,脂肪酸β-氧化使其免受ROS诱导的脂质过氧化,但在其他物种没有发现这种特点[12]。
张志岐等[92]发现,脂肪酸可通过调控活性氧(ROS)的水平对精子的生理功能产生影响(见图 1)。细胞内的长链脂肪酸(LCFA)在酰基辅酶A合成酶(ACS)的催化下,可以迅速酯化为长链脂酰辅酶A(LCFA-CoAs),合成的LCFA-Co As被转运至线粒体进行β-氧化,进而产生高水平的活性氧(ROS),使脂质过氧化,进而影响精子功能,包括精子膜结构损伤、精子无法获能、难以与卵细胞结合及失去活性等[93-94]。
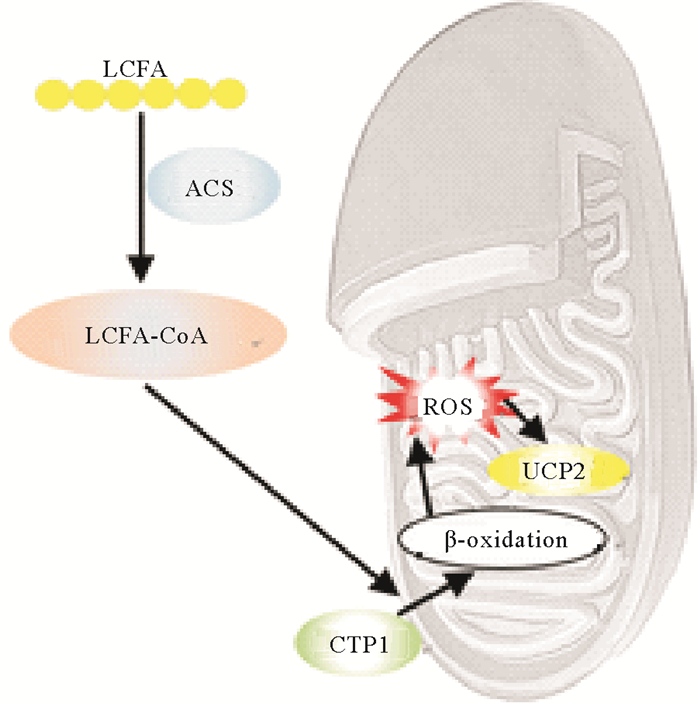
|
(LCFA:长链脂肪酸;ACS:酰基辅酶A合成酶;LCFA-CoAs:长链脂酰辅酶A;β-Oxidation:β-氧化;ROS:活性氧;UCP2:解偶联蛋白Ⅱ;CPT1:肉毒碱棕榈酰转移酶Ⅰ。LCFA: Long-chain fatty acids; ACS: Acyl-CoA synthetase; LCFA-CoAs: Long chain acyl coenzyme A; β-Oxidation; ROS: Reactive oxygen species; UCP2:Uncoupling protein Ⅱ; CPT1: Carnitine palmitoyl transferase Ⅰ. ) 图 1 脂肪酸参与精子活力的调控(改自文献[92]) Fig. 1 Fatty acids participate in the regulation of sperm motility (Modified by reference [92]) |
当过量折叠或错误折叠的蛋白质聚集在内质网腔内时,就会发生内质网应激,从而触发未折叠蛋白反应(Unfolded protein response, UPR)以适应这种应激条件。卵巢颗粒细胞通过产生性类固醇(主要是雌二醇和黄体酮)和各种生长因子,在维持卵母细胞发育过程中发挥重要作用。Hua等[95]以小鼠原代颗粒细胞为细胞模型,探讨了脂肪酸对颗粒细胞内质网应激的影响。研究发现,高脂饲料喂养显著提高了小鼠颗粒细胞中葡萄糖调节蛋白78 kDa (GRP78)蛋白的表达水平,睾酮诱导的雌二醇生成受到相应的抑制。另外,采用棕榈酸酯处理小鼠原代颗粒细胞,发现脂毒性显著增加了内质膜应激,损害了颗粒细胞功能相关标志物(雄激素受体(Ar)、Cyp19a1、Hsd17b1和胰岛素受体底物1(IRS1))的mRNA表达。胰岛素可增强睾酮通过激活AKT通路诱导雌二醇的生成。然而,通过棕榈酸处理来刺激内质网应激消除了胰岛素促进的雌二醇生成。过表达IRS1可显著改善棕榈酸或衣霉素诱导的芳香化酶表达和雌二醇生成障碍。因此,脂肪毒性可通过激活内质网应激和抑制IRS1通路来减弱胰岛素刺激的雌二醇生成[95]。
2.4 脂肪酸作为细胞信号调控基因表达细胞信号传递所需要的许多分子都有脂肪酸前体。例如,花生四烯酸最初是作为质膜磷脂双分子层的一部分以酯化形式储存的。激活的G蛋白偶联受体可刺激磷脂酶作用于磷脂,使其水解释放花生四烯酸或含有花生四烯酸的产物。花生四烯酸进一步代谢可产生前列腺素等信号分子[96]。这些分子在细胞、组织和整个生物水平上都有一系列的影响。
脂肪酸也会结合核受体,包括过氧化物酶体增殖物激活受体(PPAR)以及甾醇调节元件结合蛋白(SREBP)和NF-кB等转录因子,从而对这些受体的活性以及基因表达起到重要的调控作用[97-98]。
3 总结和展望本文综述了脂肪酸如EPA、DPA和DHA等在动物性腺发育与配子发生过程中的重要作用。这是一个越来越受关注的领域。不同的生殖器官和细胞有不同比例的主要饱和脂肪酸、单不饱和脂肪酸和多不饱和脂肪酸,保持这些比例对正常发育至关重要。已知膳食脂肪可以影响配子的脂质组成,对动物生育能力产生有害或有益的影响,但仍需要更多的研究来了解饮食如何影响配子参数和生育能力,揭示脂肪酸比例对发育的微妙影响,破译脂肪酸调控性腺发育与配子发生的机制。脂质修饰对细胞生理和代谢调节的影响非常复杂,还需要进一步探索[99]。另外,饮食脂肪是否可通过表观遗传修饰对后代健康产生潜在影响也是值得关注的一个问题。下一步,借助于小鼠、斑马鱼和线虫等模式动物,结合基因敲除、转基因及单细胞测序等研究功能基因的方法,探索脂肪酸如何影响代谢、氧化应激、膜组成、细胞信号事件和相关基因表达,进而揭示脂肪酸在生殖细胞和早期胚胎发育中的调控作用,这将为动物的科学繁育乃至人类的生育健康提供理论支撑。人类饮食的变化可能对生育能力和后代健康有长期影响, 因而相关研究成为了生育研究的一个新前沿。
| [1] |
左然涛, 康森, 徐玮, 等. 脂肪酸对鱼类免疫系统的影响及调控机制研究进展[J]. 水产学报, 2015, 39(7): 1079-1087. Zuo R T, Mai K S, Xu W, et al. Advance of studies on the effects of fatty acids on immune responses and nutritional regulation mechanism in fish species[J]. Journal of Fisheries of China, 2015, 39(7): 1079-1087. (  0) 0) |
| [2] |
Calder P C. Polyunsaturated fatty acids and inflammation[J]. Prostaglandins, Leukotrienes and Essential Fatty Acids, 2006, 75(3): 197-202. DOI:10.1016/j.plefa.2006.05.012 (  0) 0) |
| [3] |
Poulsen R S, Gorlinger K H, Serhan C N, et al. Identification of inflammatory and proresolving lipid mediators in bone marrow and their lipidomic profiles with ovariectomy and omega-3 intake[J]. American Journal of Hematology, 2008, 83(6): 437-445. DOI:10.1002/ajh.21170 (  0) 0) |
| [4] |
Sargent J, Bell G, Mcevor L. Recent developments in the essential fatty acid nutrition of fish[J]. Aquaculture, 1999, 177(2): 191-199. (  0) 0) |
| [5] |
许友卿, 张海柱, 丁兆坤. 二十二碳六烯酸和二十碳五烯酸的代谢研究[J]. 水产科学, 2007, 26(10): 580-583. Xu Y Q, Zhang H Z, Ding Z K. A Review: Metabolism of docosahexaenoic acid and eicosapentaenoic acid[J]. Fisheries Science, 2007, 26(10): 580-583. DOI:10.3969/j.issn.1003-1111.2007.10.014 (  0) 0) |
| [6] |
Mckeegan P J, Sturmey R G. The role of fatty acids in oocyte and early embryo development[J]. Reproduction Fertility and Development, 2012, 24(1): 59-67. DOI:10.1071/RD11907 (  0) 0) |
| [7] |
Coull G D, Speake B K, Staines M E, et al. Lipid and fatty acid composition of zona-intact sheep oocytes[J]. Theriogenology, 1998, 49(1): 179-179. DOI:10.1016/S0093-691X(98)90532-5 (  0) 0) |
| [8] |
Ferguson E M, Leese H J. Triglyceride content of bovine oocytes and early embryos[J]. Journal of Reproduction and Fertility, 1999, 116(2): 373-378. DOI:10.1530/jrf.0.1160373 (  0) 0) |
| [9] |
Mcevoy T, Coull G, Broadbent P, et al. Fatty acid composition of lipids in immature cattle, pig and sheep oocytes with intact zona pellucida[J]. Journal of Reproduction and Fertility, 2000, 118(1): 163-70. DOI:10.1530/reprod/118.1.163 (  0) 0) |
| [10] |
Aardema H, Vos P, Lolicato F, et al. Oleic acid prevents detrimental effects of saturated fatty acids on bovine oocyte developmental competence[J]. Biology of Reproduction, 2011, 85(1): 62-69. DOI:10.1095/biolreprod.110.088815 (  0) 0) |
| [11] |
Tsafriri A. Ovulation as a tissue remodelling process. Proteolysis and cumulus expansion[M]//Mukhopadhyay A K, Raizada M K. Tissue Renin-Angiotensin Systems, 1995, 377(377): 121-140.
(  0) 0) |
| [12] |
Carboni S, Hughes A D, Atack T, et al. Fatty acid profiles during gametogenesis in sea urchin (Paracentrotus lividus): Effects of dietary inputs on gonad, egg and embryo profiles[J]. Comparative Biochemistry and Physiology, Part A, 2013, 164: 376-382. DOI:10.1016/j.cbpa.2012.11.010 (  0) 0) |
| [13] |
Dunning K R, Cashman K, Russell D L, et al. Beta-oxidation is essential for mouse oocyte developmental competence and early embryo development[J]. Biology of Reproduction, 2010, 83(6): 909-918. DOI:10.1095/biolreprod.110.084145 (  0) 0) |
| [14] |
Jungheim E S, Louden E D, Chi M Y, et al. Preimplantation exposure of mouse embryos to palmitic acid results in fetal growth restriction followed by catch-up growth in the offspring[J]. Biology of Reproduction, 2011, 85(4): 678-683. DOI:10.1095/biolreprod.111.092148 (  0) 0) |
| [15] |
Stoffel W, Schmidt-Soltau I, Binczek E, et al. Dietary ω3 and ω6-polyunsaturated fatty acids reconstitute fertility of juvenile and adult Fads2—Deficient mice[J]. Molecular Metabolism, 2020, 36: 100974. DOI:10.1016/j.molmet.2020.100974 (  0) 0) |
| [16] |
Sharma A, Baddela V S, Roettgen V, et al. Effects of dietary fatty acids on bovine oocyte competence and granulosa cells[J]. Front Endocrinol (Lausanne), 2020, 11: 87. DOI:10.3389/fendo.2020.00087 (  0) 0) |
| [17] |
Mu Y M. Saturated FFAs, Palmitic acid and stearic acid, induce apoptosis in human granulosa cells[J]. Endocrinology, 2001, 142(8): 3590-3597. DOI:10.1210/endo.142.8.8293 (  0) 0) |
| [18] |
Hu X, Ge X, Wei L, et al. Effects of saturated palmitic acid and omega-3 polyunsaturated fatty acids on sertoli cell apoptosis[J]. Systems Biology in Reproductive Medicine, 2018, 64: 1-13. DOI:10.1080/19396368.2017.1411728 (  0) 0) |
| [19] |
Fayezi S, Leroy J, Novin M G, et al. Oleic acid in the modulation of oocyte and preimplantation embryo development[J]. Zygote, 2018, 26(1): 1-13. DOI:10.1017/S0967199417000582 (  0) 0) |
| [20] |
Yenuganti V R, Viergutz T, Vanselow J. Oleic acid induces specific alterations in the morphology, gene expression and steroid hormone production of cultured bovine granulosa cells[J]. General and Comparative Endocrinology, 2016, 232: 134-144. DOI:10.1016/j.ygcen.2016.04.020 (  0) 0) |
| [21] |
Yenuganti V R, Koczan D, Vanselow J. Correction to: Genome wide effects of oleic acid on cultured bovine granulosa cells: Evidence for the activation of pathways favoring folliculo-luteal transition[J]. BMC Genomics, 2021, 22(1): 486. DOI:10.1186/s12864-021-07817-6 (  0) 0) |
| [22] |
Markovich M L, Rizzuto N V, Brown P B. Diet affects spawning in zebrafish[J]. Zebrafish, 2007, 4(1): 69-74. DOI:10.1089/zeb.2006.9993 (  0) 0) |
| [23] |
Shi M, Sirard M A. Cocultured porcine granulosa cells respond to excess non-esterified fatty acids during in vitro maturation[J]. Journal of Ovarian Research, 2021, 14(1): 142. DOI:10.1186/s13048-021-00904-y (  0) 0) |
| [24] |
Hoeck V V, Leroy J L, Arias-Lvarez M, et al. Oocyte developmental failure in response to elevated nonesterified fatty acid concentrations: Mechanistic insights[J]. Reproduction, 2013, 145(1): 33-44. DOI:10.1530/REP-12-0174 (  0) 0) |
| [25] |
Ferst J G, Missio D, Bertolin K, et al. Intrafollicular injection of nonesterified fatty acids impaired dominant follicle growth in cattle[J]. Animal Reproduction Science, 2020, 219: 106536. DOI:10.1016/j.anireprosci.2020.106536 (  0) 0) |
| [26] |
Ma X, Weng X, Hu X, et al. Roles of different n-3/n-6 PUFAs ratio on ovarian cell development and steroidogenesis in PCOS rat[J]. Food & Function, 2019, 10(11): 7397-7406. (  0) 0) |
| [27] |
Hu X S, Weng X C, Tian Y, et al. Effects of omega-3 polyunsaturated fatty acids on steroidogenesis and cellular development in PCOS rats[J]. Food & Function, 2019, 10(5): 2504-2514. (  0) 0) |
| [28] |
Yves M, Jean-Paul R, Bernard D, et al. Kinetic study of fatty acid composition of day 7 to day 14 cow embryos[J]. Biology of Reproduction, 1982(5): 787-790. (  0) 0) |
| [29] |
Wonnacott K E, Kwong W Y, Hughes J, et al. Dietary omega-3 and -6 polyunsaturated fatty acids affect the composition and development of sheep granulosa cells, oocytes and embryos[J]. Reproduction, 2010, 139(1): 57-69. DOI:10.1530/REP-09-0219 (  0) 0) |
| [30] |
Veshkini A, Khadem A A, Mohammadi-Sangcheshmeh A, et al. Linolenic acid improves oocyte developmental competence and decreases apoptosis of in vitro—produced blastocysts in goat[J]. Zygote, 2016, 24(4): 537-548. DOI:10.1017/S0967199415000507 (  0) 0) |
| [31] |
Piotr P, Natalia M, Izabela S, et al. Fatty acid induced lipolysis influence embryo development, gene expression and lipid droplet formation in the porcine cumulus cells[J]. Biology of Reproduction, 2020, 103(1): 36-48. DOI:10.1093/biolre/ioaa045 (  0) 0) |
| [32] |
Mirabi P, Chaichi M J, Esmaeilzadeh S, et al. The role of fatty acids on ICSI outcomes: A prospective cohort study[J]. Lipids in Health and Disease, 2017, 16(1): 18. DOI:10.1186/s12944-016-0396-z (  0) 0) |
| [33] |
Wakefield S L, Lane M, Schulz S J, et al. Maternal supply of omega-3 polyunsaturated fatty acids alter mechanisms involved in oocyte and early embryo development in the mouse[J]. American Journal of Physiolgy Endocrinology and Metabolisrn, 2008, 294(2): 425-434. DOI:10.1152/ajpendo.00409.2007 (  0) 0) |
| [34] |
Hoeck V V, Sturmey R G, Bermejo-Alvarez P, et al. Elevated non-esterified fatty acid concentrations during bovine oocyte maturation compromise early embryo physiology[J]. PLoS One, 2011, 6(8): e23183. DOI:10.1371/journal.pone.0023183 (  0) 0) |
| [35] |
杨春. Leptin调节下丘脑神经肽Y分泌的研究[D]. 石家庄: 河北医科大学, 2005. Yang C. The Studies of Leptin Regulating Secretion of Neuropeptide Y in Hypothalamus[D]. Shijiazhuang: Hebei Medical University, 2005. (  0) 0) |
| [36] |
Wunder D M, Kretschmer R, Bersinger N A. Concentrations of leptin and C-reactive protein in serum and follicular fluid during assisted reproductive cycles[J]. Human Reproduction, 2005(5): 1266-1271. (  0) 0) |
| [37] |
Nissen H P, Kreysel H W. Polyunsaturated fatty acids in relation to sperm motility[J]. Andrologia, 1983, 15(3): 264-269. (  0) 0) |
| [38] |
Lenzi A, Picardo M, Gandini L, et al. Lipids of the sperm plasma membrane: From polyunsaturated fatty acids considered as markers of sperm function to possible scavenger therapy[J]. Hum Reprod Update, 1996, 2(3): 246-256. DOI:10.1093/humupd/2.3.246 (  0) 0) |
| [39] |
Furimsky A, Vuong N, Xu H B, et al. Percoll gradient-centrifuged capacitated mouse sperm have increased fertilizing ability and higher contents of sulfogalactosylglycerolipid and docosahexaenoic acid-containing phosphatidylcholine compared to washed capacitated mouse sperm[J]. Biology of Reproduction, 2005, 72(3): 574-583. DOI:10.1095/biolreprod.104.036095 (  0) 0) |
| [40] |
Aksoy Y, Aksoy H, Altınkaynak K, et al. Sperm fatty acid composition in subfertile men[J]. Prostaglandins, Leukotrienes and Essential Fatty Acids, 2006, 75: 75-79. DOI:10.1016/j.plefa.2006.06.002 (  0) 0) |
| [41] |
Safarinejad M R, Hosseini S Y, Dadkhah F, et al. Relationship of omega-3 and omega-6 fatty acids with semen characteristics, and anti-oxidant status of seminal plasma: A comparison between fertile and infertile men[J]. Clinical Nutrition, 2010, 29(1): 100-105. DOI:10.1016/j.clnu.2009.07.008 (  0) 0) |
| [42] |
Am-in N, Kirkwood R N, Techakumphu M, et al. Lipid profiles of sperm and seminal plasma from boars having normal or low sperm motility[J]. Theriogenology, 2011, 75(5): 897-903. DOI:10.1016/j.theriogenology.2010.10.032 (  0) 0) |
| [43] |
Esmaeili V, Shahverdi A H, Moghadasian M H, et al. Dietary fatty acids affect semen quality: A review[J]. Andrology, 2015, 3(3): 450-461. DOI:10.1111/andr.12024 (  0) 0) |
| [44] |
Ferramosca A., Moscatelli N, di Giacomo M., et al. Dietary fatty acids influence sperm quality and function[J]. Andrology, 2017, 5(3): 423-430. DOI:10.1111/andr.12348 (  0) 0) |
| [45] |
Saez F, Drevet J R. Dietary cholesterol and lipid overload: Impact on male fertility[J]. Oxidative Medicine and Cellulav Longevity, 2019, 2019: 4521786. (  0) 0) |
| [46] |
Veaute C, Andreoli M F, Racca A, et al. Effects of isomeric fatty acids on reproductive parameters in mice[J]. American Journal of Reproductive Immunology, 2007, 58: 487-496. DOI:10.1111/j.1600-0897.2007.00530.x (  0) 0) |
| [47] |
Mínguez-Alarcón L, Chavarro J E, Mendiola J, et al. Fatty acid intake in relation to reproductive hormones and testicular volume among young healthy men[J]. Asian Journal of Andrology, 2017, 19(2): 184-190. DOI:10.4103/1008-682X.190323 (  0) 0) |
| [48] |
Chavarro J E, Furtado J, Toth T L, et al. Trans-fatty acid levels in sperm are associated with sperm concentration among men from an infertility clinic[J]. Fertility & Sterility, 2011, 95(5): 1794-1797. (  0) 0) |
| [49] |
Saether T, Tran T N, Rootwelt H, et al. Essential fatty acid deficiency induces fatty acid desaturase expression in rat epididymis, but not in testis[J]. Reproduction, 2007, 133(2): 467-477. DOI:10.1530/REP-06-00294 (  0) 0) |
| [50] |
Chavarro J E, Lidia M A, Jaime M, et al. Trans fatty acid intake is inversely related to total sperm count in young healthy men[J]. Human Reproduction, 2014(3): 429-440. (  0) 0) |
| [51] |
Sargent J R. Origins and Functions of Egg Lipids: Nutritional Implications[M]. Oxford: Blackwell Sciences Ltd, 1995: 353-372.
(  0) 0) |
| [52] |
Huang X, Yin Y, Shi Z, et al. Lipid content and fatty acid composition in wild-caught silver pomfret (Pampus argenteus) broodstocks: Effects on gonad development[J]. Aquaculture, 2010, 310(1-2): 192-199. DOI:10.1016/j.aquaculture.2010.10.015 (  0) 0) |
| [53] |
黄旭雄, 温文, 危立坤, 等. 闽东海域银鲳亲鱼性腺发育后期脂类及脂肪酸蓄积特点[J]. 水产学报, 2014, 38(1): 100-107. Huang Q Q, Wen W, Wei L K, et al. Characteristics of lipid and fatty acid accumulation in wild-caught broodstocks of Pampus argenteus from Mindong seazone[J]. Journal of Fisheries of China, 2014, 38(1): 100-107. (  0) 0) |
| [54] |
张士璀, 孙旭彤, 李红岩. 卵黄蛋白原研究及其进展[J]. 海洋科学, 2002, 26(7): 32-35. Zhang S C, Sun X T, Li H Y. Review on vitelloginin[J]. Marine Sciences, 2002, 26(7): 32-35. (  0) 0) |
| [55] |
王际英, 苗淑彦, 李宝山, 等. 野生褐牙鲆亲鱼不同卵巢发育期脂肪和脂肪酸组成的分析与比较[J]. 上海海洋大学学报, 2011, 20(2): 238-243. Wang J Y, Miao S Y, Li B S, et al. A comparative study on lipid and fatty acid compositions of wild Paralichthys olivaceus broodstocks during different ovary development stages[J]. Journal of Shanghai Ocean University, 2011, 20(2): 238-243. (  0) 0) |
| [56] |
王际英, 苗淑彦, 张利民, 等. 野生与人工养殖牙鲆亲鱼不同组织脂肪酸的比较[J]. 水产学报, 2012, 36(5): 748-755. Wang J Y, Miao S Y, Zhang L M, et al. A comparative study on fatty acid composition in different tissues of the wild and cultured Paralichthys olivaceus broodstocks[J]. Journal of Fisheries of China, 2012, 36(5): 748-755. (  0) 0) |
| [57] |
Jaya-Ram A, Kuah M K, Lim P S, et al. Influence of dietary HUFA levels on reproductive performance, tissue fatty acid profile and desaturase and elongase mRNAs expression in female zebrafish Danio rerio[J]. Aquaculture, 2008, 277(3): 275-281. (  0) 0) |
| [58] |
Samaee S M, Manteghi N, Estevez A. Zebrafish as a model to screen the potential of fatty acids in reproduction[J]. Zebrafish, 2019, 16(1): 47-64. DOI:10.1089/zeb.2018.1641 (  0) 0) |
| [59] |
张圆琴, 徐后国, 曹林, 等. 饲料中花生四烯酸对发育前期大菱鲆亲鱼性类固醇激素合成的影响[J]. 水产学报, 2017, 41(4): 588-601. Zhang Y Q, Xu H G, Cao L, et al. Effects of dietary arachidonic acid on the sex steroid hormone synthesis in turbot broodstock before maturation[J]. Journal of Fisheries of China, 2017, 41(4): 588-601. (  0) 0) |
| [60] |
Norberg B, Kleppe L, Andersson E, et al. Effects of dietary arachidonic acid on the reproductive physiology of female Atlantic cod (Gadus morhua L.)[J]. General and Comparative Endocrinology, 2017, 250(Sup1): 21-35. (  0) 0) |
| [61] |
Bell G, Sargent J R. Arachidonic acid in aquaculture feeds: Current status and future opportunities[J]. Aquaculture, 2003, 218: 494-499. (  0) 0) |
| [62] |
Simopoulos A P. The importance of the ratio of omega6/omega3 essential fatty acids[J]. Biomed Pharmacother, 2002, 56: 365-379. DOI:10.1016/S0753-3322(02)00253-6 (  0) 0) |
| [63] |
Zhou Q B, Wu H D, Zhu C S, et al. Effects of dietary lipids on tissue fatty acids profile, growth and reproductive performance of female rice field eel (Monopterus albus)[J]. Fish Physiology and Biochemistry, 2011, 37(3): 433-445. DOI:10.1007/s10695-010-9444-1 (  0) 0) |
| [64] |
da Silva Filipa F G, Støttrup Josianne G, Elin Kjørsvik, et al. Interactive effects of dietary composition and hormonal treatment on reproductive development of cultured female European eel, Anguilla anguilla[J]. Animal Reproduction Science, 2016, 171: 17-26. DOI:10.1016/j.anireprosci.2016.05.007 (  0) 0) |
| [65] |
Leng X, Zhou H, Tan Q, et al. Integrated metabolomic and transcriptomic analyses suggest that high dietary lipid levels facilitate ovary development throughthe enhanced arachidonic acid metabolism, cholesterol biosynthesis and steroid hormone synthesis in Chinese sturgeon (Acipenser sinensis)[J]. British Journal of Nutrition, 2019, 122(11): 1230-1241. DOI:10.1017/S0007114519002010 (  0) 0) |
| [66] |
李娟. Bmp8a在调控雄性斑马鱼生殖能力中的作用研究[D]. 青岛: 中国海洋大学, 2018: 30-33. Li J. The Function of Bone Morphogenetic Protein-8a(Bmp8a) in the Regulation of Male Zebrafish Fertility[D]. Qingdao: Ocean University of China, 2018: 30-33. (  0) 0) |
| [67] |
Sewell M A. Utilization of lipids during early development of the sea urchin Evechinus chloroticus[J]. Marine Ecology Progress Series, 2005, 304: 133-142. DOI:10.3354/meps304133 (  0) 0) |
| [68] |
Hughes A D, Catarino A I, Kelly M S, et al. Gonad fatty acids and trophic interactions of the echinoid Psammechinus miliaris[J]. Marine Ecology Progress Series, 2005, 305(1): 101-111. (  0) 0) |
| [69] |
Wu X G, Cheng Y X, Sui L Y, et al. Effect of dietary supplementation of phospholipids and highly unsaturated fatty acids on reproductive performance and offspring quality of the Chinese mitten crab Eriocheir sinensis (H. Milne-Edwards), female broodstock[J]. Aquaculture, 2007, 273(4): 602-613. DOI:10.1016/j.aquaculture.2007.09.030 (  0) 0) |
| [70] |
Sui L Y, Sun H X, Wu X G, et al. Effect of dietary HUFA on tissue fatty acid composition and reproductive performance of Chinese mitten crab Eriocheir sinensis(H. Milne-Edwards)brood stock[J]. Aquaculture International, 2011, 19(2): 269-282. DOI:10.1007/s10499-010-9379-7 (  0) 0) |
| [71] |
Wouters R, Gómez L, Lavens P, et al. Feeding enriched Artemia biomass to Penaeus vannamei broodstock: Its effect on reproductive performance and larval quality[J]. Journal of Shellfish Research, 1999, 18(2): 651-656. (  0) 0) |
| [72] |
Wouters R, Piguave X, Bastidas L, et al. Ovarian maturation and haemolymphatic vitellogenin concentration of Pacific white shrimp Litopenaeus vannamei (Boone) fed increasing levels of total dietary lipids and HUFA[J]. Aquaculture Research, 2001, 32(7): 573-582. DOI:10.1046/j.1365-2109.2001.00580.x (  0) 0) |
| [73] |
Palacios E, Ibarra A M, Racotta I S. Tissue biochemical composition in relation to multiple spawning in wild and pond-reared Penaeus vannamei brookstock[J]. Aquaculture, 2000, 1859(3-4): 353-371. (  0) 0) |
| [74] |
Teshima S, Kanazawa A. Variation in lipid composition during the ovarian maturation of the prawn[J]. Bull Jpn Soc Sci Fish, 1983, 49(6): 957-962. DOI:10.2331/suisan.49.957 (  0) 0) |
| [75] |
汪春玲. 不同投喂频率和饲料中DHA/EPA比例对凡纳滨对虾亲虾繁殖性能及后代质量的影响[D]. 上海: 上海海洋大学, 2018. Wang C L. Effects of Different Feeding Frequency and Dietary DHA/EPA Ratio on the Reproductive Performance and Offspring Quality of Litopenaeus vanamei Broodstock[D]. Shanghai: Shanghai Ocean University, 2018. (  0) 0) |
| [76] |
Pernet F, Bricelj V M, Cartier S. Lipid class dynamics during larval ontogeny of sea scallops, Placopecten magellanicus, in relation to metamorphic success and response to antibiotics[J]. Journal of Experimental Marine Biology & Ecology, 2006, 329(2): 265-280. (  0) 0) |
| [77] |
唐鸿云. 线虫脂肪酸代谢与性别决定研究[D]. 杭州: 浙江大学, 2014. Tang H Y. Fatty Acid Metabolism and Sex Determination in C. elegans[D]. Hangzhou: Zhejiang University, 2014. (  0) 0) |
| [78] |
Kubagawa H M, Watts J L, Corrigan C, et al. Oocyte signals derived from polyunsaturated fatty acids control sperm recruitment in vivo[J]. Nature Cell Biology, 2006, 8(10): 1143-1148. DOI:10.1038/ncb1476 (  0) 0) |
| [79] |
Barnathan G. Non-methylene-interrupted fatty acids from marine invertebrates: Occurrence, characterization and biological properties[J]. Biochimie, 2009, 91(6): 671-678. DOI:10.1016/j.biochi.2009.03.020 (  0) 0) |
| [80] |
Sturmey R G, Reis A, Leese H J, et al. Role of fatty acids in energy provision during oocyte maturation and early embryo development. Reprod[J]. Reproduction in Domestic Animals, 2010, 44(s3): 50-58. (  0) 0) |
| [81] |
Hillman N, Flynn T J. The metabolism of exogenous fatty acids by preimplantation mouse embryos developing in vitro[J]. Journal of Embryology and Experimental Morphology, 1980, 56(4): 157-168. (  0) 0) |
| [82] |
Yuan Y, Ida J M, Paczkowski M, et al. Identification of developmental competence-related genes in mature porcine oocytes[J]. Molecular Reproduction & Development, 2011, 78(8): 565-575. (  0) 0) |
| [83] |
Dunning K R, Anastasi M R, Zhang V J, et al. Regulation of fatty acid oxidation in mouse cumulus-oocyte complexes during maturation and modulation by PPAR agonists[J]. PLoS One, 2014, 9(2): e87327. DOI:10.1371/journal.pone.0087327 (  0) 0) |
| [84] |
Sturmey R. Energy metabolism in pig oocytes and early embryos[J]. Reproduction, 2003, 126(2): 197. DOI:10.1530/rep.0.1260197 (  0) 0) |
| [85] |
Ferguson E M, Leese H J. A potential role for triglyceride as an energy source during bovine oocyte maturation and early embryo development[J]. Molecular Reproduction & Development, 2006, 73(9): 1195-1201. (  0) 0) |
| [86] |
Downs S M, Mosey J L, Klinger J. Fatty acid oxidation and meiotic resumption in mouse oocytes[J]. Molecular Reproduction & Development, 2010, 76(9): 844-853. (  0) 0) |
| [87] |
Downs S M. Regulation of the G2/M transition in rodent oocytes[J]. Molecular Reproduction & Development, 2010, 77(7): 566-585. (  0) 0) |
| [88] |
Stadtman E R, Levine R L. Protein oxidation[J]. Ann N Y Acad Sci, 2000, 899: 191-208. (  0) 0) |
| [89] |
Takahashi M, Keicho K, Takahashi H, et al. Effect of oxidative stress on development and DNA damage in in vitro cultured bovine embryos by comet assay[J]. Theriogenology, 2000, 54(1): 137-145. DOI:10.1016/S0093-691X(00)00332-0 (  0) 0) |
| [90] |
Duvnjak M, Leroti I, Bar N, et al. Pathogenesis and management issues for non-alcoholic fatty liver disease[J]. World Journal of Gastroenterology, 2007, 13(34): 4539-4550. DOI:10.3748/wjg.v13.i34.4539 (  0) 0) |
| [91] |
Marei W F, Wathes D C, Fouladi-Nashta A A. Differential effects of linoleic and alpha-linolenic fatty acids on spatial and temporal mitochondrial distribution and activity in bovine oocytes[J]. Fertility and Development, 2012, 24: 679-690. DOI:10.1071/RD11204 (  0) 0) |
| [92] |
张志岐, 束刚, 江青艳. 下丘脑对脂类的营养感应及其参与食欲调控的机制[J]. 动物营养学报, 2013, 25(7): 1395-1405. Zhang Z Q, Shu G, Jiang Q Y. Hypothalamus lipid nutritional sensing and mechanisms in appetite regulation[J]. Chinese Journal of Animal Nutrition, 2013, 25(7): 1395-1405. (  0) 0) |
| [93] |
Jonge C D, Barratt C. The Sperm Cell (Production, Maturation, Fertilization, Regeneration) || Reactive Oxygen Species: Friend or Foe[M]. Cambridge: Cambidge Books Online, 2006: 170-193.
(  0) 0) |
| [94] |
Costantini D, Rowe M, Butler M W, et al. From molecules to living systems: Historical and contemporary issues in oxidative stress and antioxidant ecology[J]. Functional Ecology, 2010, 24(5): 950-959. DOI:10.1111/j.1365-2435.2010.01746.x (  0) 0) |
| [95] |
Hua D, Zhou Y, Lu Y, et al. Lipotoxicity impairs granulosa cell function through activated endoplasmic reticulum stress pathway[J]. Reproductive Sciences (Thousand Oaks, Calif), 2020, 27(1): 119-131. DOI:10.1007/s43032-019-00014-7 (  0) 0) |
| [96] |
Daniele P. Arachidonic acid in cell signaling[J]. Current Opinion in Cell Biology, 1993, 5(2): 274-280. DOI:10.1016/0955-0674(93)90116-8 (  0) 0) |
| [97] |
Sampath H, Ntambi J. Polyunsaturated fatty acid regulation of genes of lipid metabolism[J]. Annual Review of Nutrition, 2005, 25(1): 317-340. DOI:10.1146/annurev.nutr.25.051804.101917 (  0) 0) |
| [98] |
Bordoni A, Nunzio M D, Danesi F, et al. Polyunsaturated fatty acids: From diet to binding to PPARs and other nuclear receptors[J]. Genes & Nutrition, 2006, 1(2): 95-106. (  0) 0) |
| [99] |
Diez C, Heyman Y, Bourhis D L, et al. Delipidating in vitro—produced bovine zygotes: Effect on further development and consequences for freezability[J]. Theriogenology, 2001, 55(4): 923-936. DOI:10.1016/S0093-691X(01)00454-X (  0) 0) |
 2023, Vol. 53
2023, Vol. 53

