2. 青岛海洋科学与技术国家实验室,海洋渔业科学与食物产出过程功能实验室,山东 青岛 266072
金乌贼(Sepia esculenta),俗称乌鱼、墨鱼,隶属软体动物门(Mollusca)头足纲(Cephalopoda)乌贼目(Sepioidea)乌贼科(Sepiidae)乌贼属(Sepia),广泛分布于中国黄渤海、东海、南海,日本北海道以南,朝鲜西南海域及菲律宾群岛海域,是重要的经济种[1]。繁殖期的雌性金乌贼常发生多次交配行为,雄性金乌贼为提高自身繁殖成功率,在交配前会机械性移除雌性口颊膜处先交配雄性的精荚,从而使自己的精荚完整地粘附于雌性口膜处。目前关于金乌贼精荚的研究多集中于精子超微结构和低温损伤的电镜观察、精荚器的结构以及精荚的形成等。金乌贼精子为鞭毛型精子,分为头部、中部和尾部三部分,外部附有光滑呈裙边状的被膜。精子由输精管进入黏液腺后,输精管壶腹收缩,使得每次进入的批量精子恰好形成一个精荚。精荚为长椭圆型,外部包有被膜,被膜内部包裹着三部分:弹射装置、接合部和精团。当头中部包裹的质膜破损,含有大量精子的精团则被释放[2-3]。研究发现,中华绒螯蟹(Eriocheir sinensis)的精荚在进入纳精囊后立即破裂,以游离精子的形式存在,副性腺自溶物蛋白中的小泡蛋白能够促进精荚破裂[4]。但迄今关于影响金乌贼精子储存、释放的主导因素尚未见报道。
青岛近海金乌贼繁殖期在每年5—7月,成体在沿岸产卵场结群并繁衍后代。观察发现,5—7月随着繁殖期的推移,海水温度逐渐升高,雌性金乌贼产卵量减少,受精率逐渐降低[5]。因此推测,温度亦可能是影响金乌贼精子活力和精荚中精子释放的重要因素,其具体影响机制仍有待进一步研究。
针对上述问题,本文分别研究了促进金乌贼精子释放的影响因素以及温度对精子活力的影响,以期解释金乌贼精子储存与释放机制,明确不同存放条件下精子的寿命与活力,为丰富金乌贼繁殖生物学研究内容,优化人工繁育技术提供参考资料和理论基础。
1 实验方法 1.1 金乌贼精子释放的影响因素选取状态良好(色泽鲜亮、活力强、胴背部无伤)的亲本10尾(5♀,5♂),解剖雌雄亲本,将精荚从精荚囊中剥离出来,暂置于冰上干净的培养皿中。取精荚囊、副性腺、精巢、卵巢、缠卵腺组织块各0.7~1 g,在液氮中研磨后,与海水1:1混合。10 000 r/s冷冻离心15 min,取上清液即各组织的蛋白提取液。利用考马斯亮蓝法测定并统一蛋白浓度,将各组织蛋白提取液浓度统一调至3.87 g/L。各取2 mL人工海水、精荚囊蛋白液,副性腺蛋白液,精巢蛋白液、卵巢蛋白液、缠卵腺蛋白液于培养皿中,并在每个培养皿中分别放入10个刚摘取的新鲜精荚,其中人工海水为对照组,每组设置3个重复。实验温度维持在19 ℃,每隔30 min观察并记录完整精荚数量。
19和4℃条件下,另取30个新鲜精荚分别置于海水、副性腺蛋白液、精荚囊蛋白液、精巢蛋白液及缠卵腺蛋白液培养皿中,每7天更换一次上述液体,每天19:00记录各组培养皿中精荚的完整情况,并随机刺破1个完整精荚以检测精子活力。
1.2 温度对精子活力的影响青岛近海金乌贼繁殖初期的海水温度约为19 ℃,此时繁殖状态良好,随着繁殖期的推移,水温逐渐升高,后期繁殖力明显下降。因此本实验设置对照组19 ℃,5个温度处理组20、21、22、23和24 ℃,比较分析不同温度下金乌贼精子活力的差异,每个温度设置3次重复。主要测定指标为精子激烈运动、慢速运动及原地颤动的持续时间,以镜检视野中70%左右精子由前一运动阶段转入后一运动阶段时,认为该批精子已进入下一运动阶段。统计精子寿命,即从精液与激活液混合开始,到镜检视野中约90%的精子停止活动为止的时间,即停止原地颤动。统计分析不同温度条件下精子活力的差异,并对1个精荚中精子的数量进行计数。
2 结果 2.1 精子释放速度与精子活性各实验组完整精荚的保持数量如表 1所示。精荚离体1 h后,所有实验组均保持完整形态。在卵巢蛋白组,完整精荚的数量随时间的延长急剧下降。添加卵巢蛋白液后第5小时精荚头部的质膜破损,精子开始释放,第8小时,完整精荚剩余(8.00±0.00)个,第8.5小时,完整精荚仅剩余(4.00±0.58)个,第9小时,减至(3.33±0.33)个,第9.5小时,无完整精荚,精子全部释放。由此说明卵巢蛋白提取液对金乌贼精荚中精子释放具有明显的促进作用。
|
|
表 1 各实验组完整精荚的保持数量 Table 1 The total number of spermatophore in each experimental groups |
在1.5和4 h时,精巢蛋白组的完整精荚分别为(9.00±0.00)和(8.00±0.58)个。第6小时,副性腺蛋白组的精荚剩余(9.33±0.33)个。由此可知,与卵巢蛋白提取液相比,副性腺蛋白、精荚囊蛋白、精巢蛋白和缠卵腺蛋白提取液对精子释放的促进作用均较弱。
持续观察发现,当水温维持在19~20 ℃,海水中保存的精荚可连续4 d维持完整形态,而副性腺与精荚囊蛋白液中的精荚仅完整保存2 d,缠卵腺蛋白液中的精荚仅完整保存1 d,期间如使用针刺破精荚,则精子团立即释放。但观察发现,精荚在上述各蛋白液及海水中储存到第2天时,针刺释放出的精子已全部死亡(见表 2)。
|
|
表 2 不同温度下各实验组完整精荚及精子活性的保持时间 Table 2 Life span of spermatophore and sperm in experimental groups at two different temperature |
水温4 ℃条件下,海水中的精荚可保持完整形态25 d,针刺后镜检发现,4 ℃存放3 d后,精荚形态虽完好,但仅有部分精子具活力,且精子处于运动状态的时间为30 min~1 h,存放22 d后,精荚形态虽完整,但精荚内的精子全部失去活力。副性腺与精荚囊蛋白液中的精荚可维持完整形态3 d,精子仅在第1天具活性。而精荚在精巢与缠卵腺蛋白液中可保持完整形态2 d,精荚内的精子在第2天全部死亡(见表 2)。综上所述,较低温度下,海水中保存的精荚,其完整形态和部分精子活力可维持较长时间。
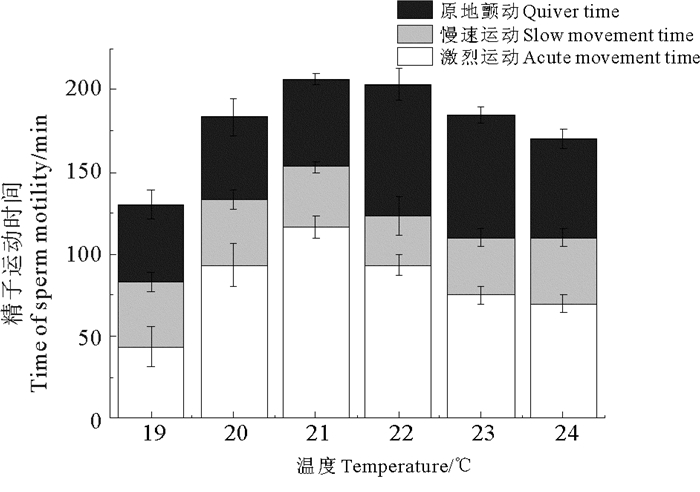
2.2 精子最适温度范围一个精荚中精子数量约1.99×107个。随着水温升高,不同温度下精子激烈运动时间呈先升高后降低的趋势。当精子处于20、21和22 ℃的海水中时,其激烈运动时间分别为(93.33±13.33)、(116.67±6.67)和(93.33±6.67)min,差异不显著(P>0.05),但显著高于19℃组的(43.33±12.02)min(P<0.05)。21 ℃组精子激烈运动时间显著高于23 ℃组的(75.00±5.00)min和24 ℃组的(70.00±5.77)min(P<0.05)。不同温度组中精子慢速运动时间差异不显著(P>0.05)。随水温升高,精子原地颤动时间同样呈现先升高后降低的趋势。22℃组((80.00±10.00)min)精子原地颤动时间达到最大值,且显著高于19 ℃组(46.67±8.82)min、20 ℃组的(50.00±11.55)min和21 ℃组的(53.33±3.33)min(P<0.05),并高于23℃组的(75.00±5.00) min和24 ℃组的(60.00±5.77) min,但差异不显著(P>0.05)。精子寿命在21℃时达到最大值(206.67±6.67) min,随温度升高又逐渐降低(见图 1)。
|
图 1 温度对金乌贼精子活力的影响 Fig. 1 Effects of temperature on sperm motility of S. esculenta |
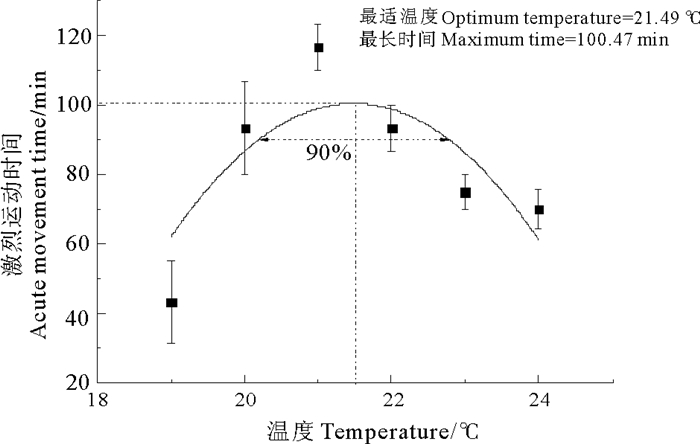
温度对精子激烈运动时间的影响如图 2所示,通过拟合精子激烈运动时间y和温度x的关系曲线,得出y=-6.225 14x2+267.507 05x-2 773.362, r2=0.370 89。当x=21.49℃时,ymax21.49=100.47 min。90%置信区间内,精子最长激烈运动时间的温度范围为20.22~22.76 ℃。因此判断,水温20.22~22.76 ℃时精子活力最高。
|
图 2 不同温度对精子激烈运动时间的影响 Fig. 2 Effects of temperature on acute movement time |
温度是影响生物生长和繁殖的重要因素。温度过高或过低会影响生物体内生化反应相关酶的活性,进而影响机体健康状态。温度胁迫是物种进化的动力之一,长期的温度变化可引起物种的分化甚至新物种的形成[6]。生物在对高温的适应过程中,逐渐改变机体代谢水平和生理状态,这更是一种积极的适应和调节过程[7]。本研究发现,4和19 ℃时,海水中精荚维持完整形态的时间(25和4 d)远大于其他实验组(2~3 d,1~2 d)。但用针刺破精荚,镜检发现,4 ℃海水保存3 d后,仍有部分精子具活性,精荚持续保存22 d后,精子才完全失去活性,而其他实验组的精子活性仅维持1 d。由此推断,低温海水环境能明显抑制精荚头部破损速度,对精荚外膜的损伤较小,同时低温也抑制了精子的能量代谢,延长了精子寿命。有研究表明,当精子由常温快速降至0 ℃时,由于冷休克,精子将发生不可逆的损伤,进而活力降低,而该温度对精子的损伤要低于冷冻[8-9]。将金乌贼精子置于超低温(-80 ℃)保存后,经透射电镜观察,发现精子顶体肿胀甚至脱落,细胞核与核膜分离,线粒体双层膜被破坏,精子鞭毛呈不规则缠绕、断裂甚至脱落[3]。而4℃海水中保存的精荚,其中的精子是否受冷休克影响而发生不可逆损伤,或海水渗透压能否改变精子的活力等尚有待进一步探究。
本研究结果显示,卵巢蛋白提取液可明显促进精荚中精子释放(9.5 h),而副性腺蛋白液、精荚囊蛋白液、精巢蛋白液和缠卵腺蛋白液对精子释放无显著影响。持续观察发现,与海水相比,精荚在副性腺蛋白液、精荚囊蛋白液、精巢蛋白液和缠卵腺蛋白液中保持完整形态的时间较短,这些蛋白液亦对精子释放产生影响,但影响较弱。蛋白质是生命活动的主要承担者,并参与能量供给。Cowey[10]研究发现不同质量和含量的蛋白质对虹鳟(Salmo gairdneri)肝脏组织内某些酶的活力产生影响。由此推断,本实验中特定的组织蛋白液可能为金乌贼精荚中某些酶提供能量,促进了精子释放,其中卵巢蛋白液的作用较为明显。迄今,国内外学者针对精荚中精子释放的影响因素开展了大量研究。曲迪[2]在对中华绒螯蟹的精荚破裂机制的研究中发现,精液、卵巢蛋白和纳精囊蛋白均对精荚破裂无影响,而雄性副性腺蛋白在精荚破裂过程中发挥促进作用。Wang[11]通过硫酸铵沉淀、Sephacryl S-200凝胶层析柱和DEAE-Sephacel离子层析柱等实验,从副性腺发育后期内容物蛋白中分离纯化出一种约50 kDa的蛋白,这种蛋白可促进精荚破裂,并经过HPLC-ESI-MS/MS shotgun分析鉴定为组织蛋白酶A。颜跃弟[12]利用胰蛋白酶使日本沼虾(Macrobrachium nipponense)精荚破裂进而获得存活率较高的游离精子。Takami[13]认为土鳖虫(Carabus insulicola)纳精囊开口部位和输卵管处的腺体或细胞可分泌某些蛋白酶使精荚破裂。还有学者认为,精荚在进入纳精囊后,纳精囊中的某些低分子量的化学物质可渗透进入精荚中,导致精荚破裂[14]。
本研究发现,金乌贼一个精荚中精子数量约为1.99×107个。在水温30℃时,凡纳滨对虾(Litopenaeus vannamei)精荚第一次再生后精子总数最高达1.49×107个[15]。只有处于激烈运动状态时精子才能有效进入卵子,因此精子激烈运动时间是衡量精子活力的主要指标。金乌贼精子活力随温度的升高呈现先上升后降低的趋势,精子活力最适温度范围为20.22~22.76℃,在21℃时精子活力最强,精子激烈运动时间和寿命分别为(116.67±6.67)和(206.67±6.67) min,这与胶州湾内金乌贼繁殖期海水温度11~25 ℃相一致[5]。斜带石斑鱼(Epinephelus coioides)精子的活力随着温度升高而逐步升高,当到达临界温度时又会下降,且精子活力的最适范围为25~31 ℃[16]。长鳍篮子鱼(Siganus canaliculatus)和点篮子鱼(Siganus guttatus)精子最适温度范围为20~25 ℃和25~30 ℃[17]。由此可见,鱼类的适温性不同,其精子活力的最高适温范围也随之变化。暖温性并具有精荚的金乌贼,其精子寿命和受精能力远大于上述暖水性鱼种,这也是对其特殊繁殖习性的一种适应。
某些体外受精的物种,其精子激烈运动时间和精子寿命较短,如斜带石斑鱼在29 ℃时精子活力达到最高,此时精子快速运动时间和精子寿命分别为27和37 min[16],23.5 ℃时瓣结鱼(Folifer brevifilis)精子在0.45%~ 0.55%的NaCl溶液中剧烈运动时间和精子寿命最长,分别为33.5和172.5 s[18],而一定剂量紫外线辐射下西伯利亚鲟(Acipenser baerii)精子寿命和激烈运动时间最高可达467和40 s[19],远低于金乌贼。有研究表明,海月水母(Aurelia sp.)[20]和玛丽鱼(Poecilia latipinna)[21]等体内受精的物种,其精子寿命和激烈运动时间较长,水温22 ℃时,海月水母精子快速运动时间和寿命分别为4 h 30 min和10 h。25 ℃时,玛丽鱼精子寿命长达3~5 h。21 ℃时金乌贼精子激烈运动时间和精子寿命较长,分别为(116.67±6.67)和(206.67±6.67) min,精子较长的激烈运动时间和寿命有助于体内受精,因此推测金乌贼的生殖方式应为体内受精,但粘附于口膜处的精荚,其精子释放、入卵方式和精卵结合的场所等仍有待进一步探究。
4 结语金乌贼卵巢蛋白提取液可明显促进精荚中精子释放,但具体是何种化学物质发挥作用仍需进一步探究。同时本研究明确了精子活力最高的适宜温度为20.22~22.76 ℃。研究结果丰富了金乌贼繁殖生物学的内容,为有效开展头足类人工繁育提供了科学依据。
| [1] |
董正之. 世界大洋经济头足类生物学[M]. 济南: 山东科学技术出版社, 1991: 197-207. Dong Z Z. Economic Cephalopods Biology in the World Ocean[M]. Jinan: Shandong Technology Press, 1991: 197-207. (  0) 0) |
| [2] |
韩松, 郑小东, 李琪, 等. 金乌贼(Sepia esculenta)精子超微结构和低温损伤电镜观察[J]. 海洋与湖沼, 2010(4): 483-488. Han S, Zheng X D, Li Q, et al. Ultrastructure of Sepia esculenta (Cephalopoda: Sepiida) spermatozoa and its damage by low temperature[J]. Oceanologia et Limnologia Sinica, 2010(4): 483-488. (  0) 0) |
| [3] |
宋训民. 金乌贼(Sepia ecsulenta Hoyle)精荚器的结构和精荚的生成[J]. 山东大学学报, 1963(3): 78-91. Song X M. The structure of spermatheca and generation of spermatophore in Sepia ecsulenta Hoyle[J]. Journal of Shandong University, 1963(3): 78-91. (  0) 0) |
| [4] |
曲迪.中华绒螯蟹精荚破裂以及精子顶体酶活力研究[D].上海: 华东师范大学, 2007: 1-38. Qu D. Studies on Spermathophore Dissolution and Sperm Acrosin Activity of Eriocheir sinensis[D]. Shanghai: East China Normal University, 2007: 1-38. http://cdmd.cnki.com.cn/article/cdmd-10269-2007082068.htm (  0) 0) |
| [5] |
李嘉泳. 金乌贼(Sepia esculenta Hoyle)在黄渤海的结群生殖和洄游[J]. 山东海洋学院学报, 1963, 5(2): 69-108. Li J Y. Breeding and migration in the Bohai Sea and the Yellow Sea of Sepia esculenta Hoyle[J]. Journal of Shandong College of Oceanography, 1963, 5(2): 69-108. (  0) 0) |
| [6] |
何璐, 虞泓, 袁理春, 等. 生物温度适应的分子生态学研究进展[J]. 亚热带农业研究, 2014, 10(3): 205-211. He L, Yu H, Yuan L C, et al. Advances in molecular ecology of biological temperature adaptation[J]. Subtropical Agriculture Research, 2014, 10(3): 205-211. (  0) 0) |
| [7] |
刘石林, 茹小尚, 徐勤增, 等. 高温胁迫对刺参耐高温群体和普通群体主要免疫酶活力的影响[J]. 中国水产科学, 2016(2): 344-351. Liu S L, Ru X S, Xu Q Z, et al. Effects of high-temperature stress on several immune enzyme activities of Apostichopus japonicus thermotolerant and normal species[J]. Journal of Fishery Sciences of China, 2016(2): 344-351. (  0) 0) |
| [8] |
Drobnis E Z, Crowe L M, Berger T, et al. Cold shock damage is due to lipid phase transitions in cell membranes: A demonstration using sperm as a model[J]. Journal of Experimental Zoology Part A: Ecological Genetics and Physiology, 1993, 265(4): 432-437.
(  0) 0) |
| [9] |
孟祥黔, 张德福. 猪精液超低温保存技术及其对养猪业未来的重要作用[J]. 国外畜牧学:猪与禽, 2009(3): 42-44. Meng X Q, Zhang D F. The important role of cryopreservation of pig sperm in pig industry[J]. Foreign Animal Husbandry: Pigs and Poultry, 2009(3): 42-44. (  0) 0) |
| [10] |
Cowey C B, Cooke D J, Matty A J, et al. Effects of quantity and quality of dietary protein on certain enzyme activities in rainbow trout[J]. The Journal of Nutrition, 1981, 111(2): 336-345. DOI:10.1093/jn/111.2.336
(  0) 0) |
| [11] |
Wang J, Fang D A, Wang Y, et al. Cathepsin A protein from the accessory sex gland of the Chinese mitten crab (Eriocheir sinensis) plays a key role in spermatophore digestion[J]. Journal of Insect Physiology, 2013, 59(9): 953-960. DOI:10.1016/j.jinsphys.2013.07.003
(  0) 0) |
| [12] |
颜跃弟, 傅洪拓, 乔慧, 等. 酶解制备日本沼虾游离精子方法的研究[J]. 中国农学通报, 2015, 31(2): 107-111. Yan YD, Fu HT, Qi H, et al. Trypsinase digestion in acquiring free sperms from Macrobrachium nipponensis[J]. Chinese Agricultural Science Bulletin, 2015, 31(2): 107-111. (  0) 0) |
| [13] |
Takami Y. Mating behavior, insemination and sperm transfer in the ground beetle Carabus insulicola[J]. Zoological Science, 2002, 19(9): 1067-1073. DOI:10.2108/zsj.19.1067
(  0) 0) |
| [14] |
Uma K, Subramoniam T. Histochemical characteristics of spermatophore layers of Scylla serrata (Forskal)(Decapoda: Portunidae)[J]. International Journal of Invertebrate Reproduction, 1979, 1(1): 31-40. DOI:10.1080/01651269.1979.10553297
(  0) 0) |
| [15] |
袁路, 蔡生力. 温度, 盐度对凡纳滨对虾精荚再生和精子质量的影响[J]. 水产学报, 2006, 30(1): 63-68. Yuan L, Cai S L. Effect of temperature and salinity on spermatophore regeneration and sperm quality in Litopenaeus vannamei[J]. Journal of Fisheries of China, 2006, 30(1): 63-68. (  0) 0) |
| [16] |
赵会宏, 刘晓春, 林浩然, 等. 斜带石斑鱼精子超微结构及盐度, 温度, pH对精子活力及寿命的影响[J]. 中国水产科学, 2003, 10(4): 286-292. Zhao H H, Liu X C, Lin H R, et al. Ultrastructure of spermatozoa and effects of salinity, temperature and pH on spermatozoa motility in Epiniphelus coioides[J]. Journal of Fishery Sciences of China, 2003, 10(4): 286-292. DOI:10.3321/j.issn:1005-8737.2003.04.005 (  0) 0) |
| [17] |
刘鉴毅, 黄晓荣, 章龙珍. 盐度, 温度和pH对2种篮子鱼精子活性的影响[J]. 海洋渔业, 2014, 36(6): 523. Liu J Y, Huang X R, Zhang L Z. Effects of salinity, temperature and pH on spermatozoa motility in two kinds of rabbitfish[J]. Marine Fisheries, 2014, 36(6): 523. DOI:10.3969/j.issn.1004-2490.2014.06.007 (  0) 0) |
| [18] |
谢恩义, 何学福. 瓣结鱼的繁殖习性以及精子的活力与寿命[J]. 动物学杂志, 1999, 34(2): 5-8. Xie E Y, He X F. Reproductive habit in Folifer brevifilis and sperm motility[J]. Chinese Journal of Zoology, 1999, 34(2): 5-8. DOI:10.3969/j.issn.0250-3263.1999.02.002 (  0) 0) |
| [19] |
张涛, 颜世伟, 章龙珍, 等. 紫外线辐射对西伯利亚鲟精子活力和寿命的影响[J]. 应用生态学报, 2011, 22(8): 2179-2183. Zhang T, Yan S W, Zhang L Z, et al. Impacts of ultraviolet irradiation on the sperm motility and longevity of Acipenser baerii[J]. Chinese Journal of Applied Ecology, 2011, 22(8): 2179-2183. (  0) 0) |
| [20] |
陈昭廷, 李琪, 陈四清, 等. 海月水母精巢发育及排精过程的观察[J]. 动物学杂志, 2015, 50(1): 131-140. Chen Z T, Li Q, Chen S Q, et al. The testis development and spermiation process in moon jellyfish[J]. Chinese Journal of Zoology, 2015, 50(1): 131-140. (  0) 0) |
| [21] |
苏新有.玛丽鱼(Poecilia latipinna)精子的超低温冷冻保存[D].汕头: 汕头大学, 2007. Su XY. Cryopreservation of Molly Fish (Poecilia latipinna) Sperm[D]. Shantou: Shantou University, 2007. http://cdmd.cnki.com.cn/article/cdmd-10560-2007134631.htm (  0) 0) |
2. Laboratory for Marine Fisheries Science and Food Production Process, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266072, China
 2019, Vol. 49
2019, Vol. 49


