工业革命以来,随着全球经济的飞速发展,化石燃料的大量使用、森林的大肆砍伐以及土地的不合理开发利用等人类活动导致CO2大量排放,到2013年大气CO2浓度已由工业革命前的180×10-6~280×10-6上升到近400×10-6,并以每年约0.5%的速率继续增加,据估计到21世纪末,大气CO2浓度将达到700×10-6~800×10-6[1-3]。大气CO2浓度的大幅升高,导致全球性的温室效应,引发了全球变暖、干旱频发、海平面升高等一系列环境变化。同时,人类排放的约1/3的CO2被海洋吸收使得全球海洋出现了严重酸化。相对于工业革命前,2007年海水pH已下降0.1个pH单位,预计到21世纪末海水pH还会下降0.3~0.4个单位,到2300年将降低0.7~0.8个单位[4-8]。海洋酸化及伴随的海水碳酸盐化学体系的变化对海洋生物产生深远的影响,特别是对海洋钙化生物造成严重损害,如贝类和棘皮动物在钙化早期对海洋酸化尤其敏感,其幼体存活率受到海洋酸化的严重制约[9-10]。此外,海洋酸化可以促进固氮和脱氮过程同时削弱硝化作用,改变溶氧浓度分布和金属的生物可利用性,从而对海洋生物产生间接影响[6]。
在一定范围内,大气CO2浓度的增加可以促进海洋植物的光合作用和生长,增加初级生产力。如CO2浓度增加不仅增加依赖CO2的浮游植物的初级生产力和丰度,还提高其利用的碳氮比[11-13]。对大型海藻而言,则取决于大气CO2浓度升高带来的正面效应和pH下降带来的负面作用的平衡[14]。已有研究发现,高CO2浓度促进坛紫菜(Porphyra haitanensis)、龙须菜(Gracilaria lemaneiformis)、蛎菜(Ulva conglobata)、缘管浒苔(U. linza)、条斑紫菜(P. yezoensis)、两种江蓠属海藻G. sp.和G. chilensis以及酵母状节荚藻(Lomentaira articulata)的生长[15-16]。CO2浓度升高对红藻和褐藻等钙化藻的光合作用具有促进作用,但这些藻类的钙化作用和营养代谢等生理过程因CO32-浓度和碳酸钙饱和度降低而表现为抑制[17-19]。大气CO2浓度升高对红树的影响因种类不同而存在差异,如CO2浓度上升促进桐花树(Aegiceras corniculatum)、白骨壤(Avicennia marina)的生长发育,而木榄(Bruguiera-gymnorrhiza)和正红树(Rhizophora apiculata)的光合作用并不因CO2浓度上升而加强[20]。总体上,海草基本处于碳限制状态,CO2浓度的增加促进海草叶片光合效率,并伴随着对光的需求降低[21-24]。大气CO2浓度升高对海草生长影响的研究主要集中于热带海草种类,且存在明显的种间差异。如CO2浓度的增加可以显著促进齿叶丝粉草(Cymodocea serrulata)、圆叶丝粉草(C. rotundata)和单脉二药草(Halodule unine-rvis)的生长,但对卵叶喜盐草(Halophila ovalis)、泰来草(Thalassia hemprichii)、针叶草(Syringodium isoetifolium)、小丝粉草(C. nodosa)和龟裂泰来草(T. testudinum)的生长无明显影响[25-27]。
鳗草(Zostera marina L.)是北半球温带海域海草的优势种,属鳗草科(Zostreraceae)鳗草属(Zostera),通常在沿海潮间带和潮下带较浅的水域形成繁茂群落,从而为鱼类和贝类等海洋动物提供多样的饵料场、栖息场和育幼场,具有极高的生态服务价值[28-29]。为探明大气CO2浓度增加对鳗草植株存活和生长的影响及其生理适应过程,实验室条件下模拟大气CO2浓度的升高幅度和升高过程,监测植株的存活、生长状况以及气道面积,测定植株叶片的光合色素含量、过氧化物酶(POD)活性、可溶性糖含量,明确鳗草植株应对大气CO2浓度升高的响应过程。研究结果不仅可以进一步查明全球气候变化对海洋生物的影响,还可为丰富鳗草生理生态学理论提供资料。
1 材料与方法 1.1 实验材料实验于2017年4月在中国海洋大学增殖生态学实验室进行。实验用鳗草植株采自山东省青岛市汇泉湾鳗草草床。采集时,用手从鳗草植株底部连根挖取,确保植株完整。植株经海水充分浸洗,去除杂质、贝类及叶片附生生物,放入盛有海水的泡沫箱运回实验室,置于室外大型水槽暂养7 d。
1.2 CO2浓度控制与实验系统实验用培养箱为55 cm×40 cm×50 cm的玻璃水槽。实验时,水槽上表面用耐高温透光塑料膜密封,其中对照组(CO2浓度380×10-6)水槽上表面不密封;水槽1个侧面距离上表面10 cm开有一个直径为1.7 cm的圆孔,并用玻璃胶固定一根长10 cm的玻璃管于开孔处,玻璃管内侧与水槽气体相联通外侧连接橡胶管,供CO2气体通入。橡胶管连接多头可控气体阀、微调阀和计泡器,最后接入CO2气瓶。
实验时,气体的少量泄漏及植物光合作用等,会造成实验组培养箱CO2浓度下降。为确保各实验组的CO2浓度变化幅度不超过设置值的5%,实验过程中使用CO2浓度检测仪(衡欣,VZ7788BZ)对各实验组CO2浓度进行实时监测,并通过调节可控气体阀、微调阀和计泡器实现对CO2浓度的有效控制。具体调节过程如下:逐个调节接入培养箱的可控气体阀和微调阀,观察计泡器中每两个气泡出现的时间间隔以及培养箱中CO2浓度,使单位时间内培养箱的进气量保持恒定,CO2得到及时补充,以维持恒定的CO2浓度。由于一天中不同时间段植物的光合速率和呼吸速率不同,导致CO2浓度在不同时间段呈现不同程度下降。因此于实验期间的每天07:00、12:00、17:00和22:00采用上述调节方法,分别对各实验组的CO2补充量进行调整。
1.3 实验设计与过程实验设置4个CO2浓度,分别为380×10-6(对照组,当前大气CO2浓度)、750×10-6 (对应21世纪末大气CO2浓度)、1 900×10-6(对应23世纪末大气CO2浓度)以及变化组(实验期间,按照约50×10-6/d的速率逐步由380×10-6升高至1 900×10-6)。通过前期预实验,得出不同浓度实验组鳗草昼夜消耗CO2的速率以及微调阀控制的补气速率,以计泡器为辅,每日调节微调阀使各组补充CO2的速率等于CO2的消耗速率。
每个实验组设置8个重复,每个重复使用6株植株,每4个重复放置于1个玻璃水槽,全部实验共种植192株植株,使用8个玻璃水槽。实验时,选取长势良好的植株进行实验。为标准化实验,选取具有相似形态学特征的植株进行实验,即株高12~18 cm、叶片3~4片、根状茎4 cm,并对其进行标记。标记时,在各植株维管束顶端即分生组织上方1 cm处用细针扎孔。
实验于室外进行30 d。实验期间,光照强度、水温、光照周期均与自然变化相同,海水为自然海水,玻璃水槽底部铺设砂泥混合底质,厚度5 cm,每5 d换水一次。
1.4 样品采集与测定实验期间,每天测定各实验组的CO2浓度(CO2浓度检测仪;衡欣VZ7788BZ),使用CO2SYS软件计算二氧化碳分压(pCO2);利用YSI 6600多参数水质仪(美国YSI公司)测定水体的水温、盐度和pH,利用AS-ALK2总碱度分析仪(美国APOLLO公司)测定实验海水总碱度(TA)。
实验结束后,观察并记录鳗草植株的存活情况,计算各实验组的存活率。每实验组随机选取10株植株进行叶片光合色素含量测定,另随机选取5株植株进行酶活力和可溶性糖含量测定,随机选取5株进行气道面积的测定,余下植株进行生长指标测定。
1.4.1 植株生长指标鳗草植株清水洗净后,用吸水纸拭去水分,保证根、茎、叶完整,然后根据针孔标记的情况测量植株新生组织的叶长、叶宽、茎节长、茎节直径。根据叶长和叶宽计算单株叶片面积,即实验期间单株全部新生叶片的叶长与叶宽乘积之和(cm2·shoot-1);根据单株新生叶片总长计算叶片延伸率,即单株新叶总长除以实验天数(cm·shoot-1·d-1);根据新生茎节总长计算茎节延伸率,即单株新生茎长除以实验天数(mm·shoot-1·d-1)。植株生产力测定时,根据标记结果,分别将植株地上组织的新生叶片和地下组织的新生茎节用剪刀剪下,去离子水清洗后置于60 ℃烘箱中烘干48 h至恒重,测量各组织干重,计算公式参照文献[30-31]。
1.4.2 叶片光合色素含量鳗草植株叶片光合色素含量的测定采用二甲基甲酰胺法,即取每株植株第二片新鲜叶片2 cm2,置于10 mL离心管中,加入5 mL二甲基甲酰胺(DMFO),避光保存3 d,然后用分光光度计进行测定。以DMFO为空白,分别于665、652、649和470 nm测定吸光度值(OD),计算公式为:
叶绿素a含量=(13.95D665-6.88D649)V/S;
叶绿素总含量=(1 000/34.5×D652)V/S;
类胡萝卜素含量=(4.08D470-11.56D649+3.29D665)V/S。
式中:D为吸光度值(mg·mL-1);V为提取液体积(mL);S为叶片鲜重面积(cm2),各色素含量单位为mg·cm-2。
1.4.3 叶片POD活力和可溶性糖含量实验结束后,将植株叶片用海水清洗干净,干纱布拭去多余水分,迅速于-80 ℃保存。过氧化物酶(POD, U·mg-1)活力的测定采用比色法,使用南京建成生物工程研究所POD测试盒(A084-3)进行。可溶性糖含量(%)的测定使用蒽酮法,即将植株取出清洗干净后,将其放入烘箱中烘干至恒重,磨碎称取10 mg,加入8 mL乙醇提取100 min,3 500 r·min-1离心5 min,取提取液1 mL,加入5 mL蒽酮试剂,摇匀,沸水浴中显色10 min,取出冷却,在波长625 nm处比色测定吸光值。计算公式如下:
| $ Y = C \times V/\left( {M \times {{10}^6}} \right) \times 100\% \circ $ |
式中:Y为样品中可溶性糖含量(%);C为提取液的葡萄糖含量(μg/mL);V为样品稀释后的体积(mL); M为样品质量(g)。
1.4.4 叶片及茎节横切面气道面积将待测的鳗草植株清洗干净后放入盛有海水的培养皿中,每个待测植株取第二片新鲜叶片及第二个新生茎节进行切片,切片厚度为1 mm左右,然后在变焦体视显微镜(Nikon,SMZ1000)下进行观察并拍照,然后使用Image Pro软件对所拍摄的照片进行气道面积的计算。
1.5 数据分析各实验组数据以平均值±标准误表示,首先进行单因素方差分析(ANOVA),差异显著时使用Tukey多重比较分析组间差异。数据分析使用SPSS20.0进行,以P < 0.05作为差异显著水平,以P < 0.01作为差异极显著水平。分析结果使用Origin Pro 2015软件绘图。
2 结果 2.1 环境因子实验期间,各实验组环境因子的变化如表 1所示。水温和盐度保持稳定,平均值分别为17.9 ℃和32。海水pH随CO2浓度的增加逐渐下降,而pCO2则逐步升高(P < 0.05)。总碱度(TA)的变化不明显(P>0.05)。
|
|
表 1 实验期间各实验组环境因子的变化(平均值±标准差) Table 1 Changes in environmental factors under different CO2 levels during the experiment (mean±SD) |
实验期间,除750×10-6浓度组有1株植株死亡外,其余3个浓度组的鳗草植株均生长良好,未出现死亡情况。
2.3 生长指标植株叶片延伸率的变化如图 1(a)所示。随CO2气体浓度增加,叶片延伸率呈逐渐上升趋势,在1 900×10-6时达到最大值,显著高于对照组(P < 0.05),是对照组的1.41倍,其它各实验组之间无显著差异(P>0.05)。各实验组的单株叶面积和茎节延伸率均无明显变化,平均值分别为19.2~25.3 cm2·shoot-1和1.03~1.11 mm·shoot-1·d-1(见图 1(b)~(c))。各实验组植株茎节直径的变化与叶片延伸率一致,随CO2气体浓度增加,茎节直径呈逐渐上升趋势,在1 900×10-6时达到最大值(3.0 mm),显著高于对照组(P < 0.05)(见图 1(d))。
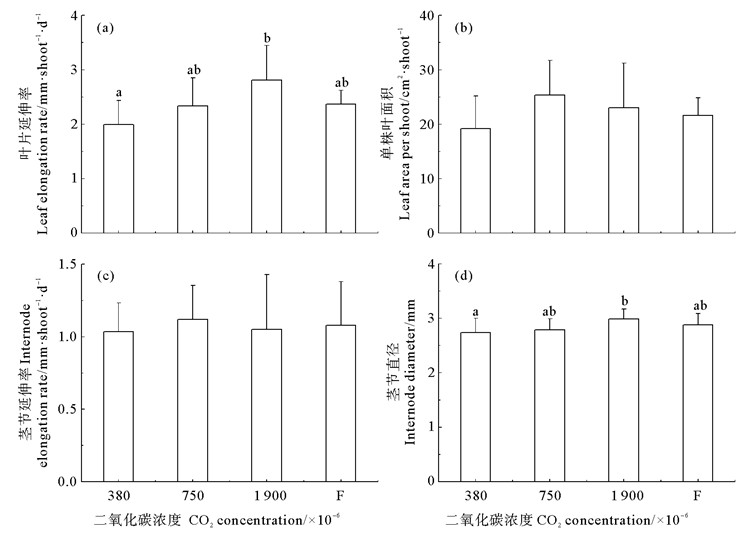
|
(数据为平均值±标准差,误差线上的不同字母表示组间差异显著(P < 0.05);F表示CO2气体浓度变化实验组,即CO2气体浓度随实验时间变化逐步由380×10-6升高至1 900×10-6。下同。Data are means ±S.D. of means. Different letters above error bars indicate significant differences among the treatments (P < 0.05). F represents the fluctuating group of which the CO2 concentration changes over time from 380×10-6 to 1 900×10-6. The same below. ) 图 1 不同CO2浓度鳗草植株叶片延伸率(a)、单株叶面积(b)、茎节延伸率(c)、茎节直径(d)的变化 Fig. 1 Changes in (a) leaf elongation rate, (b) leaf area per shoot, (c) internode elongation rate and (d) internode diameter of Z. marina plants under different CO2 concentrations |
鳗草植株生产力的变化如表 2所示。单因素方差分析显示,各实验组之间地上生产力、地下生产力及总生产力均无显著差异(P>0.05),其平均值分别为3.6,2.3和5.4 mg DW·shoot-1·d-1。
|
|
表 2 不同CO2浓度鳗草植株生产力的变化(平均值±标准差) Table 2 Changes in productivities of Z. marina plants under different CO2 levels during the experiment (Mean±SD) |
鳗草叶片光合色素含量的变化如表 3所示。结果显示,不同CO2浓度对植株叶片的叶绿素a、叶绿素b、总叶绿素和类胡萝卜素含量均无明显影响(P>0.05)。但不同CO2浓度对植株叶片的叶绿素a含量与叶绿素b含量之比具有显著影响,其比值随CO2浓度升高而逐渐增大,并于1 900×10-6时达到最大值,显著高于380×10-6和750×10-6实验组(P < 0.05)(见图 2)。
|
|
表 3 不同CO2浓度鳗草植株光合色素含量的变化(平均值±标准差) Table 3 Changes in photosynthetic pigment contents of Z. marina plants under different CO2 levels during the experiment (Mean±SD) |
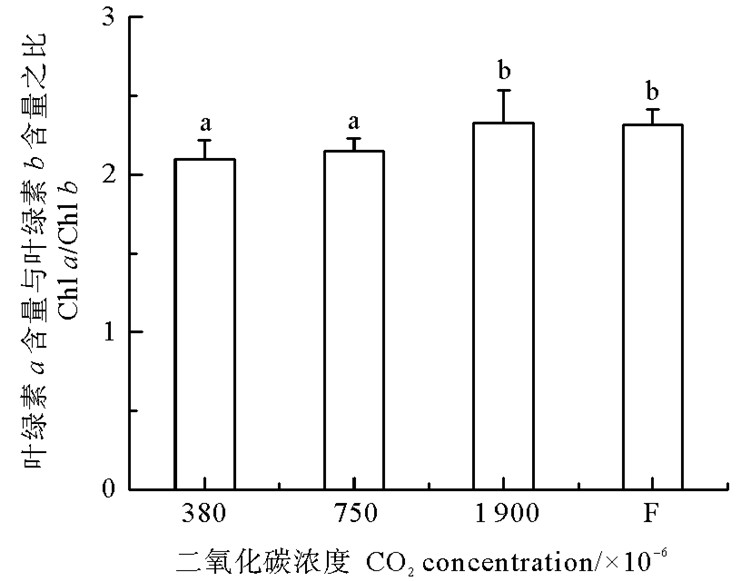
|
图 2 不同CO2浓度鳗草植株叶绿素a含量与叶绿素b含量之比的变化 Fig. 2 Change in the ratio of chlorophyll a and chlorophyll b content of Z. marina plants under different CO2 concentrations |
鳗草植株POD活力的变化如图 3所示。随CO2气体浓度增加,植株POD活力呈现先增加后减少的趋势,并于750×10-6时达到最大值(25.9 U/mL),显著高于对照组和浓度变化实验组(P < 0.05),分别是这两个实验组的2.4和2.2倍。鳗草植株可溶性糖含量的变化如图 4所示。随CO2气体浓度增加,植株可溶性糖含量呈现逐渐上升的趋势,并于1 900×10-6时达到最大值(35.3%),显著高于对照组和浓度变化实验组(P < 0.05),是这两个实验组的1.6倍。
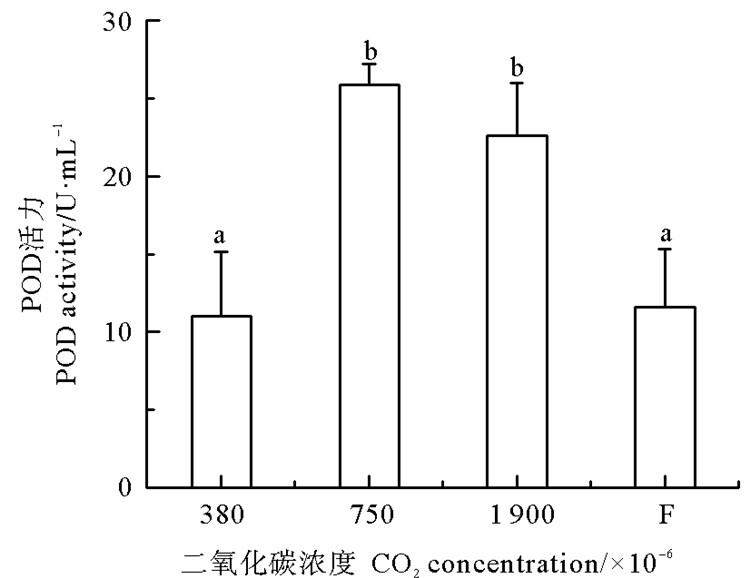
|
图 3 不同CO2浓度鳗草植株过氧化物酶活力的变化 Fig. 3 Change in POD activity of Z. marina plants under different CO2 concentrations |
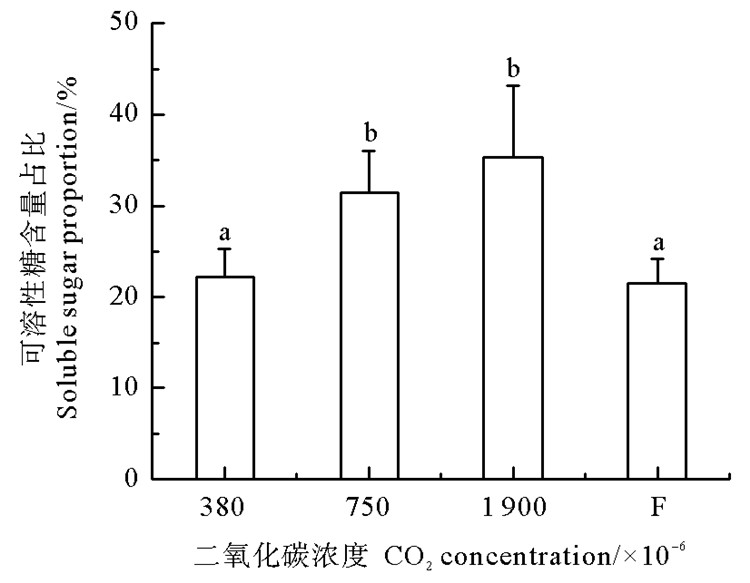
|
图 4 不同CO2浓度鳗草植株可溶性糖含量的变化 Fig. 4 Change in soluble sugar proportion of Z. marina plants under different CO2 concentrations |
鳗草植株叶片和茎节的结构尽管相对简单,但是气道非常发达,从而能够更好地适应沉水生活(见图 5)。随着CO2气体浓度增加,植株茎节横切面气道面积呈现逐渐增大的趋势,于1 900×10-6时达到最大值(0.54 mm2),显著高于对照组和浓度变化实验组(P < 0.05),分别是这两个实验组的1.7和1.5倍(见图 6(a))。随CO2气体浓度增加,植株叶片横切面气道面积也呈现逐渐增大的趋势,于1 900×10-6时达到最大值(0.53 mm2),显著高于对照组(P < 0.05),是对照组的2.1倍(见图 6(b))。
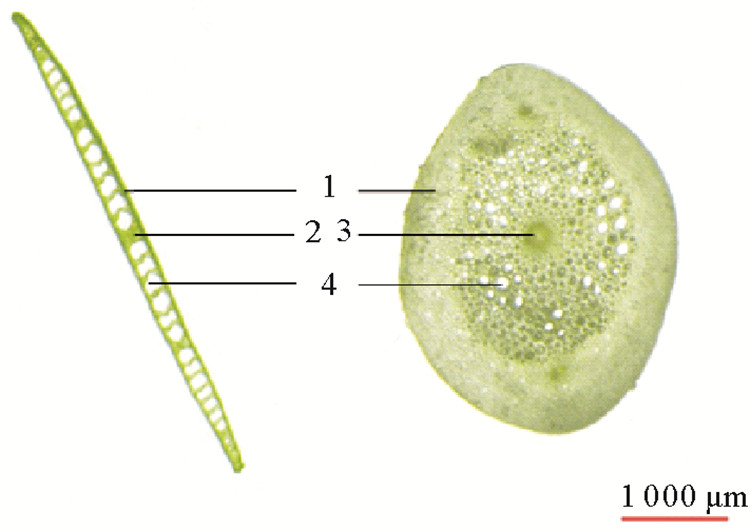
|
( 1 薄壁组织;2 叶脉;3 中央维管束;4 气道。1 Parenchyma; 2 Leaf vein; 3 Central vascular bundle; 4 Airway. ) 图 5 鳗草叶片横切面(左)和茎节横切面(右)示意图 Fig. 5 The pictures of leaf transverse airway (left) and internode transverse airway (right) of Z. marina plants |
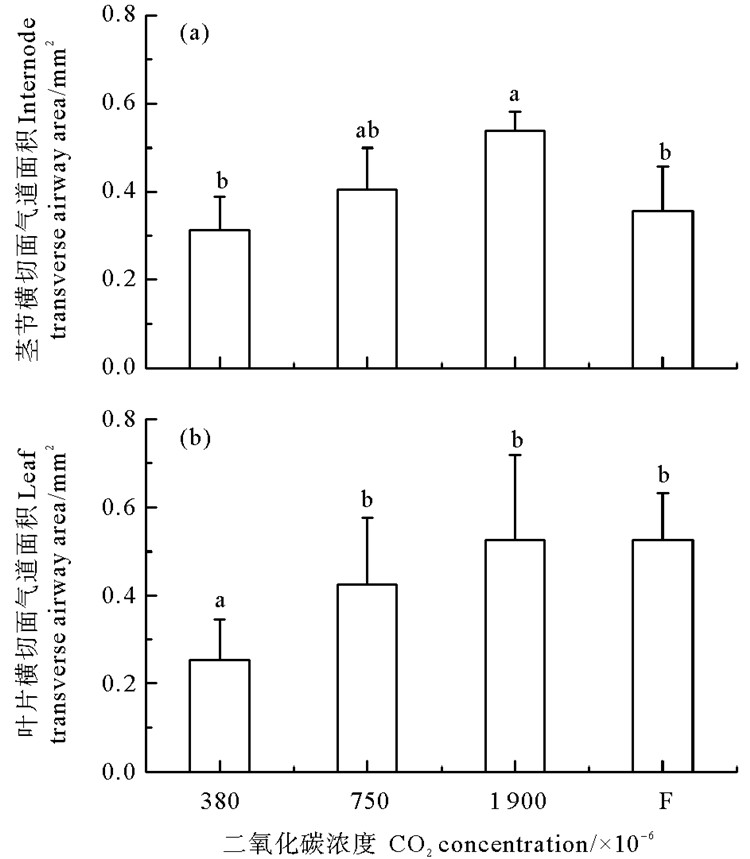
|
图 6 不同CO2浓度鳗草植株茎节横切面气道面积(a)和叶片横切面气道面积(b)的变化 Fig. 6 Changes in (a) internode transverse airway area and (b) leaf transverse airway area of Z. marina plants under different CO2 concentrations |
随着全球人类活动的不断加剧,大气CO2浓度的持续增加而引发的一系列环境变化是人类目前面临的一个严重挑战。不同于海洋钙化生物,陆地植物通常因大气CO2浓度上升而受益。大量研究已经显示,短期内大气CO2浓度升高有利于陆地植物的光合固碳作用,从而促进植物的生长发育,且对C3植物的促进作用更明显[6]。大气CO2浓度升高对海洋植物存活和生长的影响与植物种类有关,这可能是因为尽管多数海洋植物具有碳浓缩机制(CCMs),但是不同植物种类对碳的利用存在CO2依赖型、HCO3-依赖型和同时利用HCO3-和CO2型的差异[6]。大气pCO2加倍情况下,表层海水溶解的CO2浓度加倍,但HCO3-浓度仅增加6%,因此,CO2依赖型的海洋植物一般是大气CO2浓度升高的主要受益者,而HCO3-依赖型的海洋植物所受促进作用不明显[6, 16]。对颗石藻、红藻、绿藻和褐藻等钙化藻而言,大气CO2浓升高的影响则取决于正、负效应的平衡,即CO2和HCO3-浓度增加对光合作用的促进以及CO32-浓度和碳酸钙饱和度降低对钙化作用的抑制[6, 14, 19]。海草作为C3植物,通常处于碳限制状态,因此尽管CO2浓度增加对不同海草种类的促生长作用存在差异,但单纯的CO2浓度增加对海草床的自我维持均有利[21-22]。本研究结果显示,大气CO2浓度升高对鳗草植株的生长具有较明显的促进作用,特别是植株叶片延伸率显著提高,在1 900×10-6时达到最大值,是对照组的1.4倍。研究结果与齿叶丝粉草、圆叶丝粉草等海草种类的研究结论相一致[24]。这可能是因为与其它C3植物相同,CO2浓度升高打破了这些海草种类的碳限制,其可以通过改变对CO2的需求来调节自身生长对CO2浓度升高的响应[21]。
3.2 海草对大气CO2浓度升高的生理响应本研究结果显示,随大气CO2浓度升高,鳗草植株的叶绿素a/b、可溶性糖含量和气道面积等指标均呈现逐渐升高的变化趋势,并在1 900×10-6时达到最大值。叶绿素a是海草植株的主要光合色素,其随大气CO2浓度的升高而增加,表明大气CO2浓度的升高对鳗草植株叶片的光合能力具有明显的促进作用[32]。可溶性糖作为呼吸底物为植物的生长发育提供能量,从而有效促进植株茎蔓伸长和叶片生长[33-34]。植物可借助通气组织为叶片和根系提供呼吸代谢所需的O2,且O2的释放量与通气组织的发达程度呈正相关关系,因此气道截面积的增加有利于植株气体交换能力的提升,进而提高光合效率[35-37]。此外,通气组织还是CO2的储存库,植株夜间吸收的CO2除部分同化为羧酸供白天光合作用时使用外,其余则储存于通气组织中备用[36]。本研究结果发现,大气CO2浓度升高,鳗草植株的POD活性随之升高,其中750×10-6浓度组和1 900×10-6浓度组鳗草植株的POD活性显著高于对照组和浓度变化组。这可能是因为CO2浓度升高后,消除了植株光合作用的碳限制,光合固碳量增加,从而导致活性氧产量增加,这时作为抗氧化防御系统的主要成分POD酶的含量相应增加,清除体内多余的活性氧,以减少对植株的伤害[38-40]。
4 结语本研究发现,大气CO2浓度升高对鳗草的存活无明显影响,但对其叶片生长具有显著的促进作用。当大气CO2浓度升高至1 900×10-6时,鳗草的叶片延伸率达到最大值,促生作用最明显。本研究明确了大气CO2浓度升高对鳗草存活和生长的影响,初步查明了鳗草植株应对大气CO2浓度升高的生理响应过程,为了解海草床生态系统的自我维持能力及其科学保护提供了理论依据和科学基础。然而,大气CO2浓度升高还伴随着温室效应引起的全球气温升高以及海水pCO2升高引起的海洋酸化,因此在大气CO2浓度升高引起的综合效应下,天然海草床生态系统的响应过程仍需进一步研究。
| [1] |
Feely R A, Sabine C L, Lee K, et al. Impact of anthropogenic CO2 on the CaCO3 system in the oceans[J]. Science, 2004, 305(5682): 362. DOI:10.1126/science.1097329
(  0) 0) |
| [2] |
Garrard S L, Beaumont N J. The effect of ocean acidification on carbon storage and sequestration in seagrass beds:A global and UK context[J]. Marine Pollution Bulletin, 2014, 86(1-2): 138-146. DOI:10.1016/j.marpolbul.2014.07.032
(  0) 0) |
| [3] |
Qu C F, Liu F M, Zheng Z, et al. Effects of ocean acidification on the physiological performance and carbon production of the Antarctic sea ice diatom Nitzschia, sp. ICE-H[J]. Marine Pollution Bulletin, 2017, 120: 184-191. DOI:10.1016/j.marpolbul.2017.05.018
(  0) 0) |
| [4] |
Caldeira K, Wickett M E. Oceanography:Anthropogenic carbon and ocean pH[J]. Nature, 2003, 425(6956): 365-365. DOI:10.1038/425365a
(  0) 0) |
| [5] |
Orr J C, Fabry V J, Aumont O, et al. Anthropogenic ocean acidification over the twenty-first century and its impact on calcifying organisms[J]. Nature, 2005, 437(7059): 681-686. DOI:10.1038/nature04095
(  0) 0) |
| [6] |
汪思茹, 殷克东, 蔡卫君, 等. 海洋酸化生态学研究进展[J]. 生态学报, 2012, 32(18): 5859-5869. Wang S R, Yin K D, Cai W Q, et al. Advances in studies of ecological effects of ocean acidification[J]. Acta Ecologica Sinica, 2012, 32(18): 5859-5869. (  0) 0) |
| [7] |
Rodríguez A, Hernández J C, Brito A, et al. Effects of ocean acidification on juvenile sea urchins:Predator-prey interactions[J]. Journal of Experimental Marine Biology and Ecology, 2017, 493: 31-40. DOI:10.1016/j.jembe.2017.04.005
(  0) 0) |
| [8] |
Liu W, Yu Z, Huang X, et al. Effect of ocean acidification on growth, calcification, and gene expression in the pearl oyster, Pinctada fucata[J]. Marine Environmental Research, 2017, 130: 174-180. DOI:10.1016/j.marenvres.2017.07.013
(  0) 0) |
| [9] |
Gazeau F, Quiblier C, Jansen J M, et al. Impact of elevated CO2 on shellfish calcification[J]. Geophysical Research Letters, 2007, 34(7): 07603. DOI:10.1029/2006GL028554
(  0) 0) |
| [10] |
王有基, 李丽莎, 李琼珍, 等. 海洋酸化和全球变暖对贝类生理生态的影响研究进展[J]. 生态学报, 2014, 34(13): 3499-3508. Wang Y J, Li L S, Li Q Z, et al. Research progress on eco-physiological responses of shellfish under ocean acidification and global warming[J]. Acta Ecologica Sinica, 2014, 34(13): 3499-3508. (  0) 0) |
| [11] |
Tortell P D, Morel F M M. Sources of inorganic carbon for phytoplankton in the eastern Subtropical and Equatorial Pacific Ocean[J]. Limnology and Oceanography, 2002, 47(4): 1012-1022. DOI:10.4319/lo.2002.47.4.1012
(  0) 0) |
| [12] |
Riebesell U, Schulz K G, Bellerby R G J, et al. Enhanced biological carbon consumption in a high CO2 ocean[J]. Nature, 2007, 450(7169): 545-548. DOI:10.1038/nature06267
(  0) 0) |
| [13] |
王为民, 刘光兴, 陈洪举, 等. 短期海洋酸化对黄海近岸浮游植物群落结构的影响[J]. 海洋环境科学, 2016, 35(3): 392-397. Wang W M, Liu G X, Chen H J, et al. Short-term effects of ocean acidification on phytoplankton community structure in nearshore area of Yellow Sea[J]. Marine Environmental Science, 2016, 35(3): 392-397. (  0) 0) |
| [14] |
高坤山. 海洋酸化正负效应:藻类的生理学响应[J]. 厦门大学学报(自然版), 2011, 50(2): 411-417. Gao K S. Positive and negative effects of ocean acidification:Physiological responses of algae[J]. Journal of Xiamen University, 2011, 50(2): 411-417. (  0) 0) |
| [15] |
Zou D H, Gao K S. Effects of elevated CO2concentration on the photosynthesis and related physiological processes in marine macroalgae[J]. Acta Ecologica Sinica, 2002, 22(10): 1750-1757.
(  0) 0) |
| [16] |
刘雅萌, 汤镇铭, 李信书, 等. 在海洋酸化背景下温度变化对大型绿藻缘管浒苔光合生理特性的影响[J]. 生态学杂志, 2014, 33(9): 2402-2407. Liu Y M, Tang Z M, Li X S, et al. The responses of photosynthetic physiology in macroalga Ulva linza to temperature variation under ocean acidification[J]. Chinese Journal of Ecology, 2014, 33(9): 2402-2407. (  0) 0) |
| [17] |
Engel A, Zondervan I, Aerts K, et al. Testing the direct effect of CO2 concentration on a bloom of the coccolithophorid Emiliania huxleyi in mesocosm experiments[J]. Limnology and Oceanography, 2005, 50(2): 493-507. DOI:10.4319/lo.2005.50.2.0493
(  0) 0) |
| [18] |
Semesi I S, Kangwe J, Björk M. Alterations in seawater pH and CO2, affect calcification and photosynthesis in the tropical coralline alga, Hydrolithon, sp. (Rhodophyta)[J]. Estuarine Coastal & Shelf Science, 2009, 84(3): 337-341.
(  0) 0) |
| [19] |
郑伟, 钟志海, 杨梓, 等. 大气CO2增加对不同生长光强下龙须菜光合生理特性的影响[J]. 生态学报, 2014, 34(24): 7293-7299. Zheng W, Zhong Z H, Yang Z, et al. Effects of elevated CO2 concentration on the photosynthetic physiological characteristics of Gracilaria lemaneiformis grown under different light levels[J]. Acta Ecologica Sinica, 2014, 34(24): 7293-7299. (  0) 0) |
| [20] |
Zhang Q M. Responses of tropical biological coasts to global change[J]. Quaternary Sciences, 2007, 27(5): 834-844.
(  0) 0) |
| [21] |
Zimmerman R C, Kohrs D G, Steller D L, et al. Impacts of CO2 enrichment on productivity and light requirements of eelgrass[J]. Plant Physiology, 1997, 115(2): 599-607. DOI:10.1104/pp.115.2.599
(  0) 0) |
| [22] |
Jiang Z J, Huang X P, Zhang J P. Effects of CO2 enrichment on photosynthesis, growth, and biochemical composition of seagrass Thalassia hemprichii (Ehrenb.) Aschers[J]. Journal of Integrative Plant Biology, 2010, 52(10): 904-913.
(  0) 0) |
| [23] |
Alexandre A, Silva J, Buapet P, et al. Effects of CO2 enrichment on photosynthesis, growth, and nitrogen metabolism of the seagrass Zostera noltii[J]. Ecology & Evolution, 2012, 2(10): 2625-2635.
(  0) 0) |
| [24] |
Ow Y X, Collier C J, Uthicke S. Responses of three tropical seagrass species to CO2 enrichment[J]. Marine Biology, 2015, 162(5): 1005-1017. DOI:10.1007/s00227-015-2644-6
(  0) 0) |
| [25] |
Campbell J E, Fourqurean J W. Effects of in situ CO2 enrichment on the structural and chemical characteristics of the seagrass Thalassia testudinum[J]. Marine Biology, 2013, 160(6): 1465-1475. DOI:10.1007/s00227-013-2199-3
(  0) 0) |
| [26] |
Takahashi M, Noonan S H C, Fabricius K E, et al. The effects of long-term in situ CO2enrichment on tropical seagrass communities at volcanic vents[J]. ICES Journal of Marine Science, 2015(3): 1-11.
(  0) 0) |
| [27] |
Apostolaki E T, Vizzini S, Hendriks I E, et al. Seagrass ecosystem response to long-term high CO2 in a Mediterranean volcanic vent[J]. Marine Environmental Research, 2014, 99(4): 9-15.
(  0) 0) |
| [28] |
Niu S N, Zhang P D, Liu J, et al. The effect of temperature on the survival, growth, photosynthesis, and respiration of young seedlings of eelgrass Zostera marina L[J]. Aquaculture, 2012, 350-353: 98-108. DOI:10.1016/j.aquaculture.2012.04.010
(  0) 0) |
| [29] |
黄小平, 江志坚, 范航清, 等. 中国海草的"藻"名更改[J]. 海洋与湖沼, 2016, 47(1): 290-294. Huang X P, Jiang Z J, Fan H Q, et al. The nomenclature of the "Algae" name of seagrasses in China[J]. Oceanologia Et Limnologia Sinica, 2016, 47(1): 290-294. (  0) 0) |
| [30] |
Zhao J S, Zhang Q, Liu J, et al. Effects of copper enrichment on survival, growth and photosynthetic pigment of seedlings and young plants of the eelgrass[J]. Marine Biology Research, 2016(7): 1-11.
(  0) 0) |
| [31] |
张沛东, 吴晓晓, 徐强, 等. 外源植物生长素对鳗草植株促生长作用的研究[J]. 中国海洋大学学报(自然科学版), 2016, 46(11): 99-107. Zhang P D, Wu X X, Xu Q, et al. Studies on promotion of exogenous auxin to Zostera marina growth[J]. Periodical of Ocean University of China, 2016, 46(11): 99-107. (  0) 0) |
| [32] |
潘瑞炽, 王小菁, 李娘辉. 植物生理学[M]. 北京: 高等教育出版社, 2008. PAN Rui-Chi, WANG Xiao-Jing, LI Niang-Hui. Plant Physiology[M]. Beijing: Higher Education Press, 2008. (  0) 0) |
| [33] |
Koch K E. Carbohydrate-modulated gene expression in plants[J]. Annual Review of Plant Physiology & Plant Molecular Biology, 1996, 47(1): 509-540.
(  0) 0) |
| [34] |
龙雯虹, 郭华春, 高星, 等. 3种薯蓣属植物珠芽糖类含量变化与茎叶生长的关系[J]. 西北植物学报, 2009, 29(6): 1187-1192. Long W H, Guo H C, Gao X, et al. Relationship between variation of Carbohydrate in bulbils and vine elongating, leaf expansion about Dioscorea[J]. Acta Botanica Boreali-Occidentalia Sinica, 2009, 29(6): 1187-1192. (  0) 0) |
| [35] |
Kludze H K, De Laune R D, Patrick W H. Aerenchyma formation and methane and oxygen exchange in rice[J]. Soil Science Society of America Journal, 1993, 57(2): 386-391. DOI:10.2136/sssaj1993.03615995005700020017x
(  0) 0) |
| [36] |
樊明寿, 张福锁. 植物通气组织的形成过程和生理生态学意义[J]. 植物生理学通讯, 2002, 38(6): 615-618. Fan M S, Zhang F S. Aerenchyma formation in plant and its physiological and ecological significance[J]. Plant Physiology Communications, 2002, 38(6): 615-618. (  0) 0) |
| [37] |
单提波, 赵明辉, 武静莲, 等. 不同气孔密度水稻的光合特征及Rubisco酶活性研究[J]. 核农学报, 2015, 29(6): 1142-1148. Shan T B, Zhao M H, Wu J L, et al. Study on photosynthetic characteristics and rubisco activity of rice leaves with different stomatal densities[J]. Journal of Nuclear Agricultural Sciences, 2015, 29(6): 1142-1148. (  0) 0) |
| [38] |
Zhou R, Zhao H. Protecting enzyme system of herbage and its functions in the cold growing process in alpine and cold region[J]. Acta Botanica Boreali-occidentalia Sinica, 2002, 22(3): 566-573.
(  0) 0) |
| [39] |
吴学明, 苏旭, 刘玉萍. 青海湖畔两种植物叶片中超氧化物歧化酶(SOD)和过氧化物酶(POD)活性的研究[J]. 青海草业, 2005, 14(2): 7-11. Wu X M, Su X, Liu Y P. Study on activity of SOD and POD in the leaves of two plants near the Qinghai Lake[J]. Qinghai Prataculture, 2005, 14(2): 7-11. (  0) 0) |
| [40] |
刘春香.大气CO2浓度升高背景下大型海藻光合功能响应的研究[D].广州: 华南理工大学, 2016. Liu C X. Study on The Photosynthetic Functions of Marine Macroalgae in Response to Elevated Atmospheric CO2[D]. Guangzhou: South China University of Technology, 2016. (  0) 0) |
 2020, Vol. 50
2020, Vol. 50


