2. 青岛海洋生物医药研究院, 山东 青岛 266075
近年来,各种各样的水凝胶材料作为药物载体、组织支架或伤口敷料被广泛应用于生物体,为医学领域的研究提供新的思路和方向[1]。其中水凝胶敷料因具有可以保持湿润的伤口环境、吸收组织渗出物、允许氧气通透和促进伤口愈合等优点[2-3]而备受关注。但是目前研究的传统水凝胶敷料在受到外力刺激后,其网络结构的完整性会受到损害,影响水凝胶的使用和寿命[4],若水凝胶本身具有自愈能力便可以解决这一问题。同时,传统水凝胶的抑菌活性低,因此往往会引起作用部位的微生物感染,而且尽管不少研究者额外装载了抗菌成份,如抗生素[5]或金属银颗粒[6],但随着多种耐药菌株的出现,细菌的耐药性问题日益突出[7]。此外在抗菌成分被完全释出后,水凝胶就会失去抗菌活性。因此,研发具有抗菌可注射的自愈性水凝胶备受期待。换句话说,在生物医学材料领域中,设计能够解决当前水凝胶使用完整性和抑菌性问题的新型抗菌性自愈合水凝胶迫在眉睫。
海洋生物医用材料是生物医用材料中的重要分支,因其具有资源丰富、功能独特、生物安全、成本低廉的优点而备受生物材料界的广泛关注[8]。其中,壳聚糖(Chitosan, CS)作为地球上第二大可再生资源,主要通过广泛存在于昆虫、甲壳类硬壳和真菌细胞壁的甲壳质脱乙酰而获得。CS具有抑菌、止血、愈创、减少疤痕增生、吸附等生物学功能并可被降解,经过物理化学修饰的CS衍生物,已被广泛应用于生物医学领域。CS只可溶于部分稀酸溶液(乙酸、盐酸、硝酸和甲酸等),而不溶于碱液、强酸和水,致使其应用受到很大限制[9]。CS分子链上存在大量游离氨基、羧基和羟基等活泼基团,可作为反应位点对其进行化学改性,从而获得溶解性和生物性能更好的CS衍生物。根据先前的研究,对CS的改性主要有羧基化反应[10]、季氨化反应[11]、烷基化反应[12]、酰化反应[13]、硫醇化反应[14]以及其他化学修饰[15]。
本研究通过取代反应和酰胺反应,首次分别对甘油三甲基氯化铵(GTMAC)和N-乙酰半胱氨酸(N-Acetyl-L-Cysteine, NAC)进行CS的氨基接枝,以制备溶解性和生物性能更好的N-乙酰半胱氨酸季铵盐壳聚糖(NAC-QCS)。具有无毒性和良好生物相容性的普鲁兰多糖(Pullulan)经过高碘酸钠氧化后,生成含醛基的氧化普鲁兰多糖(OP)。以OP作为交联剂:与NAC-QCS上的氨基发生席夫碱反应生成亚胺键;与己二酸二酰肼上的酰肼基团发生缩合反应生成酰腙键。NAC-QCS上的巯基经氧化作用生成二硫键。在上述3种动态共价键的作用下,成功制备出NQC-OP-ADH水凝胶。随后,研究了NQC-OP-ADH水凝胶的化学结构、形态、溶胀率、胶凝时间、可注射性、自愈性、抑菌性和生物相容性。
1 试剂、材料和仪器试剂:CS(分子量为410 kDa, 脱乙酰度(DD) 为95.88%)产自青岛百成海洋生物资源有限公司;甘油三甲基氯化铵(GTMAC)产自国药集团;N-乙酰半胱胺酸(NAC)产自国药集团;OP产自国药集团;己二酸二酰肼(ADH)产自国药集团;其他试剂均为分析纯。
材料:L929细胞由中国海洋大学海洋生命学院生物化学实验室捐赠;大肠杆菌(Escherichia coli)和金黄色葡萄球菌(Staphylococcus aureus)由青岛大学附属医院馈赠;动物实验程序是根据1986年英国动物(科学程序)法案和相关指南进行的,并获得海洋生命学院伦理委员会批准(SMXY No. 20190909S0208)。
仪器:傅里叶红外扫描仪(AVATAR-360,美国,Nicolet);冷冻干燥机(FD-1D-50,北京博医康实验仪器有限公司);扫描电子显微镜(S-3400N,日本日立有限公司);荧光共聚焦显微镜(Nikon A1R,日本尼康公司)。
2 实验方法 2.1 NQC-OP-ADH水凝胶的制备根据先前的制备方法[16],经纯化得到季铵盐壳聚糖(QCS)。取1 g QCS溶于80 mL蒸馏水中备用。将4 g N-Cys溶于20 mL蒸馏水中,并依次加入4.73 g EDC和2.84 g NHS,用1 mol/L HCl溶液调pH = 5.0,活化1 h,结束后将其慢慢滴加到QCS溶液内,调节最终反应液pH = 5.0。室温下避光搅拌反应6 h,再在4 ℃下避光透析5 d,冷冻干燥后获得NAC-QCS样品。
将1 g普鲁兰多糖溶于100 mL蒸馏水中,加入0.53 g NaIO4,在室温下避光搅拌反应16 h后,再加入0.67 g甘露醇反应2 h,使未参加反应的NaIO4失活。反应结束后,用透析袋透析5 d,冷冻干燥后得到氧化普鲁兰多糖(OP)[17]。
将一定量的NAC-QCS、OP和ADH分别溶于pH = 7.4的磷酸缓冲盐溶液(Ahosphate buffer saline, PBS)中,将OP溶液加入NAC-QCS与ADH混合的溶液中并立即搅拌均匀,一定时间后形成透明的NQC-OP-ADH水凝胶。
2.2 NQC-OP-ADH水凝胶的性质表征 2.2.1 FT-IR和SEM表征本文利用FT-IR(傅立叶变换红外光谱)对CS、NAC-QCS、OP和NQC-OP-ADH水凝胶进行表征,通过官能团的改变,证明产物的成功制备。然后利用SEM(扫描电子显微镜)观察NQC-OP-ADH水凝胶的微结构和形态。
2.2.2 成胶时间、可注射性和宏观自愈性研究本文通过管倒置法检测水凝胶的胶凝时间[18]。将NAC-QCS、ADH和OP溶液迅速混合均匀,在室温下,每隔10 s将试管倒置,若混合物在倒置后60 s内不再流动则判定溶液已成胶,记录此时的时间为成胶时间。
将NAC-QCS溶于混有甲基蓝(0.002%, wt/vol)的PBS中,随后加入ADH和OP溶液混合均匀,迅速将溶液转移至注射器,待其完全成胶后,推动注射器,观察水凝胶是否可以通过针头挤出而不堵塞,并在室温下放置4 h,观察其通过注射器后能否再愈合为完整水凝胶[1]。
这里选用宏观自愈实验来评价NQC-OP-ADH水凝胶的自愈性能。制备3个水凝胶圆盘(直径20 mm, 厚度3 mm),其中一个为未染色的透明水凝胶,另2个分别用中性红和甲基蓝染色,每个水凝胶圆盘等分成3片,3种颜色的水凝胶各取一片,组合成含有不同颜色的水凝胶圆盘。在室温下放置4 h,观察此组合水凝胶圆盘是否会自愈合为一个整体,然后将其用镊子提起并保持在空中,观察其是否有损坏,以检验其自愈合能力。
2.2.3 溶胀动力学研究本文研究NQC-OP-ADH水凝胶在0.01 mol/L PBS (pH=7.4)溶液中的溶胀行为,评估其吸收渗出液的能力。将冷冻干燥后的水凝胶进行称量后,完全浸入盛有5 mL PBS的烧杯内,并置于37 ℃培养箱中,每隔一定时间t将胶取出,用吸水纸除去其表面多余水分,并记录其质量。待水凝胶质量达到最大且不再变化时,记录此时的质量。干态下水凝胶在t时刻的溶胀率(Swelling ratio, SR)RS和平衡溶胀率(Equilibrium swelling ratio, ESR)RES的结算式分别为
| $ R_{\mathrm{S}}=\frac{M_t-M_0}{M_0}, $ | (1) |
| $ R_{\mathrm{ES}}=\frac{M_{\mathrm{s}}-M_0}{M_0}。$ | (2) |
式中:Mt表示t时刻水凝胶的质量;M0表示初始干燥时水凝胶的质量;Ms表示水凝胶的最大稳定质量。
2.3 水凝胶的抑菌活性将E. coli和S. aureus用无菌PBS稀释为单位体积(单位:mL)的细菌群落总数(CFU)为1 × 105的细菌悬浮液。在48孔板的每个孔中依次加200 μL NQC-OP-ADH的前体溶液,待其成胶后,在每个水凝胶上滴加10 μL细菌悬浮液,37 ℃培养2 h后,每孔中加入1 mL无菌PBS,然后悬浮剩余存活细菌,再从中取15 μL细菌悬浮液涂布在琼脂平板上,37 ℃培养24 h,对琼脂平板上的菌落进行计数。将直接悬浮在1 mL PBS中的10 μL细菌悬浮液用作阴性对照。抑菌率R的计算式为
| $ R=\frac{Q_{\mathrm{c}}-Q_{\mathrm{h}}}{Q_{\mathrm{c}}} \text { 。} $ | (3) |
式中:Qh表示用水凝胶培养的细菌数量;Qc表示用PBS培养的对照组细菌数量。
2.4 水凝胶的生物相容性 2.4.1 溶血实验取预先冻干的NQC-OP-ADH水凝胶研磨成粉末并悬浮于1 mL生理盐水中,37 ℃温浴1 h。将新鲜抽取的4 mL小鼠血液在含有0.2 mL肝素钠抗凝血剂的抗凝管内混匀,并加入5 mL生理盐水稀释血液。然后在含有样品的离心管内加入60 μL稀释血液,轻轻混匀,置于37 ℃孵育1 h。用离心机1 200 r/min离心5 min后取上清液,并将上清液加入96孔板中,用酶标仪测波长在545 nm处的吸光度值。实验以蒸馏水作为阳性对照,生理盐水作为阴性对照。溶血率(Hemolysis rate, HR)RH的计算式为
| $ R_{\mathrm{H}}=\frac{\left(V_{\mathrm{OD}, \mathrm{s}}-V_{\mathrm{OD}, \mathrm{ne}}\right)}{\left(V_{\mathrm{OD}, \mathrm{pc}}-V_{\mathrm{OD}, \mathrm{nc}}\right)} \times 100 \% 。$ | (4) |
式中:VOD, s为实验组样品的吸光度值;VOD, nc为阴性对照组(生理盐水)的吸光度值;VOD, pc为阳性对照组(蒸馏水)的吸光度值。
2.4.2 细胞毒性实验用噻唑蓝(MTT)比色法检验NQC-OP-ADH水凝胶的细胞毒性。NQC-OP-ADH水凝胶在细胞培养液中分别浸提1、6、12和24 h,浸提液用孔径0.22 μm的滤膜过滤除菌备用。向96孔板依次加入200 μL L929细胞悬浮液(8×103个/mL),37 ℃孵育12 h,吸出每孔内的细胞培养液,并向每两行孔内分别加入一种浸提时间的浸提液(200 μL),四个时间点的浸提液依次加入96孔板内。该实验中,共培养了3板96孔板的细胞,这三板细胞需在37 ℃下分别培养24、48和72。结束后,向每孔加入各20 μL MTT培养4 h。取出96孔板,去除每孔内的溶液,加入200 μL二甲基亚砜(DMSO),放入37 ℃恒温摇床继续培养15 min,用酶标仪测波长在490 nm处的吸光度值。细胞存活率(Cell viability)Rcv的计算式为
| $ R_{\mathrm{cv}}=\frac{V_{\mathrm{OD}, \mathrm{s}}}{V_{\mathrm{OD}, \mathrm{c}}} \times 100 \% 。$ | (5) |
式中:VOD, s为实验组样品的吸光度值;VOD, c为空白对照组的吸光度值。
2.4.3 水凝胶的细胞表面培养在24孔板的每孔中加入500 μL NQC-OP-ADH前体溶液,待成胶后,在每个水凝胶上加入500 μL L929细胞悬液,在37 ℃下分别培养1、3和5 d(每隔1 d换一次培养液)。相应培养时间结束后,吸出孔内的细胞培养液,并用PBS轻轻荡洗3次,加入4 μmoL/mL钙黄绿素乙酰氧基甲酯(Calcein-AM)200 μL,37 ℃培养15 min,吸出Calcein-AM溶液,用PBS小心清洗3次,确保水凝胶上的Calcein-AM清洗干净。最后将24孔板避光放置在激光共聚焦显微镜下观察,将激发波长调节为490 nm,将发射波长调节为515 nm。在490 nm波长激发下,活细胞为黄绿色,然后进行表面拍摄和3 D拍摄,并收集图像。
2.4.4 水凝胶的细胞包埋培养将离心得到的L929细胞悬浮在OP溶液中,加入NAC-QCS和ADH溶液迅速混匀,以制备包埋有细胞的NQC-OP-ADH水凝胶,在每份水凝胶上加入500 μL细胞培养液,然后在37 ℃下分别培养1、3和5 d(每隔1 d换一次培养液)。用Calcein-AM溶液对活细胞进行染色,以评估细胞活力,然后在激光共聚焦显微镜下进行3 D拍摄,并收集图像。
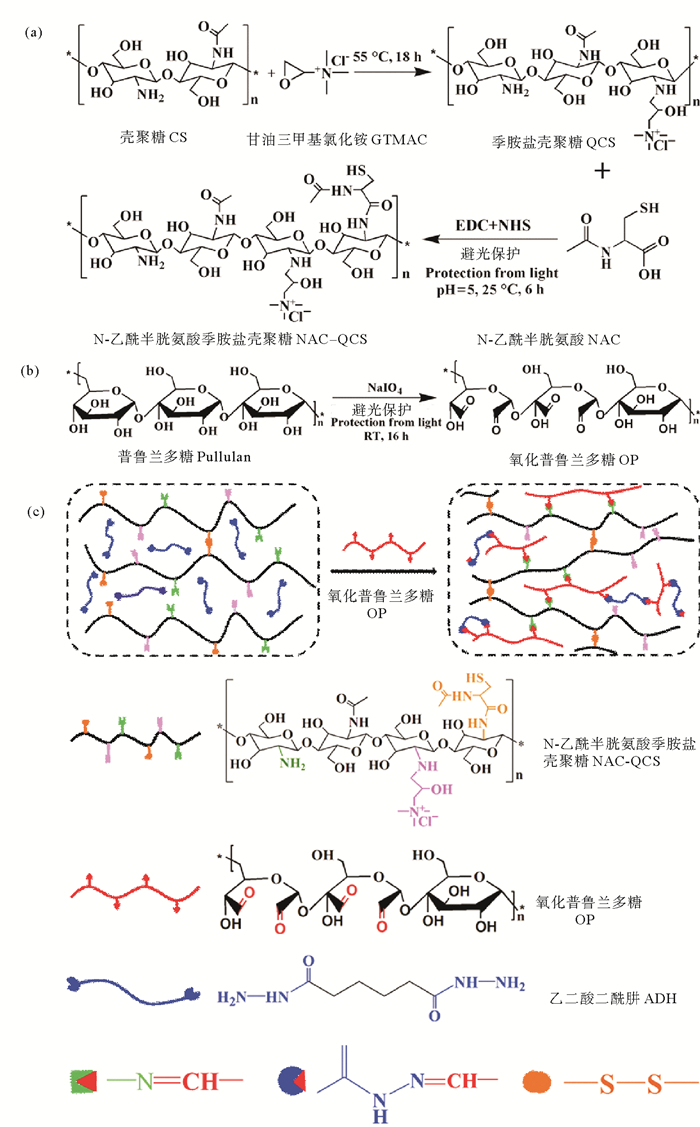
3 结果与讨论 3.1 NQC-OP-ADH水凝胶的制备和性质表征 3.1.1 NQC-OP-ADH水凝胶的合成路线、FT-IR和SEM表征NQC-OP-ADH水凝胶的合成路线如图 1所示,红外光谱如图 2所示。同CS相比,NAC-QCS光谱中在1 481 cm-1处出现一个新的强峰,此峰对应于GTMAC的甲基带特征峰[19]。由于NAC上的—COOH与CS主链上—NH2发生酰胺化反应,生成新的酰胺基团,所以在NAC-QCS光谱中1 649 cm-1处的酰胺Ⅰ谱带和1 303 cm-1处的酰胺Ⅲ谱带强度增强,而1 610 cm-1处的酰胺Ⅱ谱带减弱。NAC-QCS在2 516和524 cm-1处出现微弱的新峰分别是NAC中—SH和—S—S—特征峰[20-21]。以上发现说明GTMAC和NAC均成功接枝在CS的—NH2上,生成新的产物NAC-QCS。
|
图 1 NAC-QCS (a)、OP (b) 和NQC-OP-ADH水凝胶(c) 的合成路线 Fig. 1 The synthetic route of NAC-QCS (a), OP (b), and NQC-OP-ADH hydrogel (c) |
|
图 2 CS、NAC-QCS、OP和NQC-OP-ADH水凝胶的红外光谱 Fig. 2 FTIR spectra of CS, NAC-QCS, OP, and NQC-OP-ADH hydrogel |
在OP光谱中1 733 cm-1处出现的醛基伸缩振动峰表明—CHO成功引入OP中。但在NQC-OP-ADH水凝胶的光谱中,此醛基峰和NAC-QCS主链上—NH2在1 610 cm-1处的—N—H弯曲振动峰消失,说明醛基和氨基发生席夫碱(Schiff base)反应, 从而生成亚胺键[22]。据[23-24]文献报道,OP的醛基和ADH的酰肼基团反应生成的酰腙键本应该在1 639 cm-1处有—C=O吸收峰,但在水凝胶光谱中此峰没有出现,而是在1 655 cm-1处形成一个大峰,此峰的形成可能是由于酰腙键的—C=O吸收峰同NAC-QCS中的酰胺Ⅰ谱带和—N=C—吸收峰发生了叠加[25]。在NQC-OP-ADH水凝胶的光谱中,523 cm-1处存在—S—S—微弱的吸收峰,2 516 cm-1处的—SH特征峰消失,归因于水凝胶中—SH含量太少,并且在成胶过程中一部分被氧化为—S—S—[20]。以上结果证实NQC-OP-ADH水凝胶是通过动态席夫碱、酰腙键和二硫键交联形成的。
图 3是液氮快速冻干的NQC-OP-ADH水凝胶的扫描电镜图。水凝胶内部有清晰的多孔状结构,孔径大多为40 μm左右,使水凝胶具有同外界交换气体和液体的能力,孔的大小也适合细胞迁移到水凝胶中,并在基质内均匀分布,进行营养物和代谢产物的交换[26]。

|
((a)500 ×; (b)1 000 ×.) 图 3 NQC-OP-ADH水凝胶的SEM电镜照片 Fig. 3 SEM images of NQC-OP-ADH hydrogels |
NQC-OP-ADH水凝胶的成胶时间约为(82±8) s, 适宜的成胶时间可满足水凝胶作为注射性水凝胶应用于医学领域。
同传统水凝胶相比,自愈合水凝胶能够在受到损伤后恢复其结构和功能,从而拥有更长的使用时间。具有可注射性的自愈合水凝胶可以通过微创方式进行体内药物递送,从而减轻患者疼痛,并能使微小创面得到更快恢复[27]。在本研究中,观察到NQC-OP-ADH水凝胶从注射器的针头内挤出,没有堵塞针孔(见图 4(a)),为给水凝胶向生物体的注射提供可能性,并且在4 h后又自愈合为完整的水凝胶形态(见图 4(b)),这主要归因于水凝胶的黏度会随着剪切应力的增加而降低,即剪切稀化特性[28]。

|
图 4 NQC-OP-ADH水凝胶的注射过程(a)和4 h后自愈的水凝胶(b) Fig. 4 Injection process of NQC-OP-ADH hydrogel (a) and self-healing hydrogel after 4 h (b) |
NQC-OP-ADH水凝胶的自愈过程照片如图 5所示。水凝胶在室温下放置4 h,不施加任何外力的情况下,愈合为一个完整的水凝胶圆盘(见图 5(c)),2种颜色水凝胶之间的界限变得模糊,当用镊子将其夹住并在空中保持静止时,水凝胶圆盘也能在自身重力作用下完好无损(见图 5(d)),这表明愈合水凝胶的交界处并不是简单的粘合而是动态共价键的动态反应,在中性条件下实现了良好愈合,主要归功于水凝胶中—NH2和—CHO之间形成的动态亚胺键。动态共价键既有共价键的稳定性又有非共价键的可逆性,它可以在水凝胶网络中建立键生成和解离的内在动态平衡,从而赋予水凝胶自我修复的能力[29]。

|
((a)水凝胶圆盘;(b)刚组合的水凝胶圆盘;(c)愈合4 h的自愈合水凝胶;(d)基于自身重力下的愈合水凝胶。(a)Hydrogel disks; (b)Hydrogel disks just combined; (c)Self-healed hydrogel disks after healing for 4 h; (d)Self-healed hydrogel disks based on its own gravity.) 图 5 NQC-OP-ADH水凝胶的自愈过程照片 Fig. 5 Photographs of self-healing process of NQC-OP-ADH hydrogel |
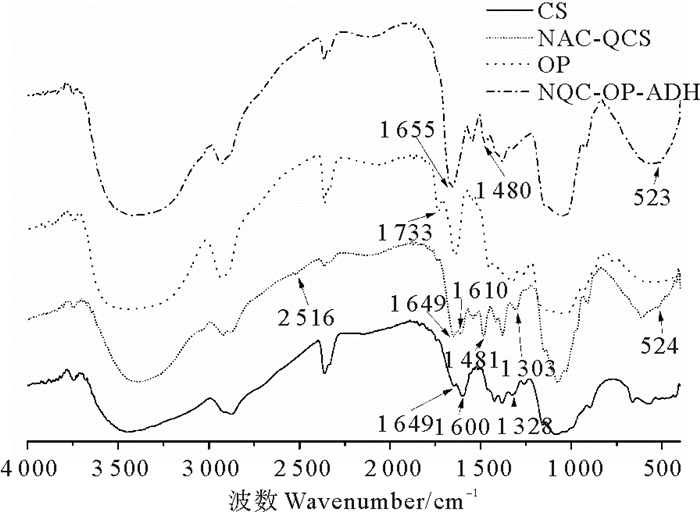
NQC-OP-ADH水凝胶的溶胀动力学曲线如图 6所示。
|
图 6 NQC-OP-ADH水凝胶在PBS(pH=7.4)的溶胀动力学 Fig. 6 Swelling kinetics of NQC-OP-ADH hydrogels in PBS (pH=7.4) |
在开始的60 min内,水凝胶表现出快速吸水的能力,溶胀率达到了(14.84±0.71) g/g,这主要是由于NQC-OP-ADH水凝胶为多孔网状结构,这些孔之间相互连通,形成通道,水分子或溶剂分子通过对流方式快速进入到水凝胶内部,使水凝胶的体积随溶剂分子的进入而不断膨大,产生溶胀现象[30]。60 min时,水凝胶内部已含有大量的溶剂分子,随着时间的延长,溶剂分子进入水凝胶的速度减慢,致使水凝胶的溶胀率缓慢增加,最后达到溶胀平衡,最终的平衡溶胀率为(16.86 ± 0.25) g/g。NQC-OP-ADH水凝胶具有良好的溶胀性能,因此有助于吸收大量的渗出液,减少伤口浸润,为其在组织工程中的应用提供支持。
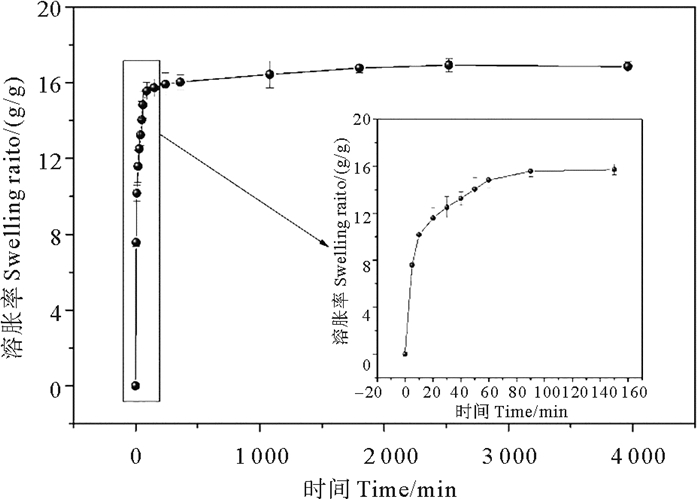
3.2 水凝胶的抑菌实验NQC-OP-ADH水凝胶对Escherichia coli和Staphlococcu aureus的抑制率如图 7所示。由式(3)计算出NQC-OP-ADH水凝胶对E. coli的抑制率为84%,对S. aureus的抑制率为99%。可以看出,NQC-OP-ADH水凝胶对2种菌都显示出良好的抗菌能力,但是对S. aureus(革兰氏阳性菌)的抑制作用优于对E. coli(革兰氏阴性菌)的抑制作用,可能是由于细菌细胞壁成分和结构的不同而导致的。革兰氏阳性菌的细胞壁由一层厚而致密的肽聚糖和磷壁酸组成,带负电荷的磷壁酸与NQC-OP-ADH水凝胶中带正电荷的季铵基团发生静电相互作用,破坏细菌细胞膜,致使细菌死亡。而革兰氏阴性菌的细胞壁由薄的肽聚糖层、外部脂多糖层和脂蛋白层等多层潜在屏障组成,不含有磷壁酸,依靠带有少量负电荷的脂多糖、蛋白质或磷脂同带正电荷的季铵基团发生静电相互作用,因此其作用强度较弱[31]。故NQC-OP-ADH水凝胶对革兰氏阳性菌的表面接触抑制率更高。
|
( (a)和(b)分别展示当用pH=7.4的PBS作为对照培养时E. coli和S. aureus的生长情况;(c)和(d)分别展示水凝胶接触培养后E. coli和S. aureus的生长情况;(e)水凝胶对细菌的抑制率。(a) and (b) show the growth of E. coli and S. aureus when pH = 7.4 PBS was used as control, respectively; (c) and (d) show the growth of E. coli and S. aureus after hydrogel contact culture, respectively; (e)Inhibition rate of bacteria by hydrogel. ) 图 7 NQC-OP-ADH水凝胶对E. coli和S. aureus的表面抗菌活性 Fig. 7 Surface antibacterial activity against E. coli and S. aureus of NQC-OP-ADH hydrogels |
NQC-OP-ADH水凝胶的溶血率如表 1所示。实验结果表明,稀释的血液经过NQC-OP-ADH水凝胶作用后,其溶血率为(1.168±0.055)%(小于2%),说明水凝胶不溶血,暗示着NQC-OP-ADH水凝胶有良好的血液相容性,可作为生物材料应用于组织工程。
|
|
表 1 NQC-OP-ADH水凝胶的溶血率 Table 1 Hemolysis rate of NQC-OP-ADH hydrogel |
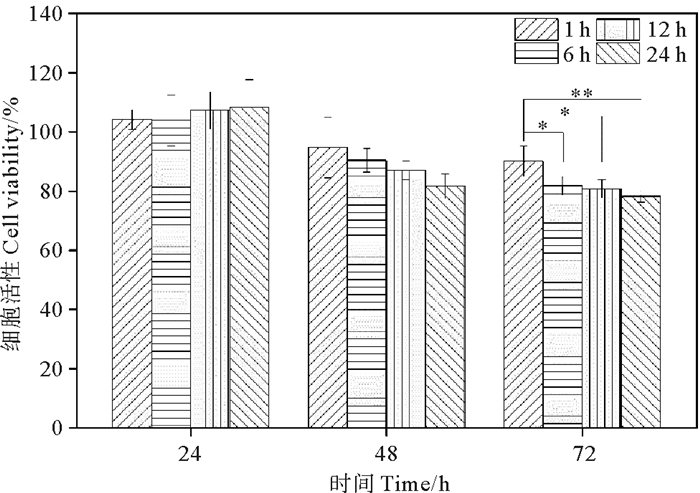
不同浸提时间的NQC-OP-ADH水凝胶浸提液的细胞毒性如图 8所示。实验结果显示,在培养L929达24 h时,4个时间段的NQC-OP-ADH水凝胶浸提液均表现出促进细胞生长的趋势,细胞存活率均大于100%,这可能归因于水凝胶在细胞培养液中被浸提出的成分利于细胞生长,此成分被细胞作为营养物所利用,从而促进细胞生长;也有可能是在早期的培养过程中,NQC-OP-ADH水凝胶中带正电荷的季铵基团与细胞膜上带负电荷的磷酸基团发生相互作用,更好地促进细胞黏附。通过对24、48和72 h的细胞培养结果进行统计学分析发现,相同浸提时间的数据间并无显著性差异。随着培养时间延长至48和72 h,细胞存活率没有明显的增长,除了同细胞培养液的营养成分不足和代谢物的积累有关之外,还可能由于培养一段时间后细胞铺满底部而导致生长空间有限,细胞间发生接触抑制,不利于细胞的生长。另一方面,NQC-OP-ADH水凝胶中含有季铵基团,在与细胞的长时间接触过程中,可能会对细胞膜产生作用,影响细胞的生长。但在整个培养过程中细胞存活率始终大于80%,符合一级细胞毒性评级,表明NQC-OP-ADH水凝胶具有良好的细胞相容性,故具有作为生物医学材料的应用潜力。
|
(p < 0.05;p < 0.01.) 图 8 不同浸提时间的NQC-OP-ADH水凝胶浸提液对L929细胞培养不同时间后的细胞活性 Fig. 8 Cellular activity of different extraction times of NQC-OP-ADH hydrogels extract on the viability of L929 cells at different cultivation time |
应用于生物医学领域的材料必须具有良好的细胞相容性[27],故对NQC-OP-ADH进行细胞培养并检测细胞相容性是必不可少的。图 9为NQC-OP-ADH水凝胶对L929细胞表面培养1、3和5 d的荧光拍摄图片。实验结果显示,从第1天到第5天,水凝胶中绿色荧光强度逐渐变强,有大量的活细胞生长,且细胞增殖有明显增长的趋势(见图 9(a))。从3D图片(见图 9(b))可明显观察出,水凝胶内部也有大量细胞生长,且随时间的推移,细胞有向水凝胶深处迁移的趋势。主要归因于细胞接种在水凝胶表面后,由于水凝胶内部的孔状网络结构为细胞提供了迁移黏附空间,使细胞从表面迁移到水凝胶内部。实验结果初步表明NQC-OP-ADH水凝胶有良好的细胞相容性。

|
图 9 NQC-OP-ADH水凝胶表面培养L929细胞荧光照片的平面图(a)和3D图(b) Fig. 9 Plan view (a) and 3D view (b) of fluorescent photos of L929 cells cultured on NQC-OP-ADH hydrogel surface |
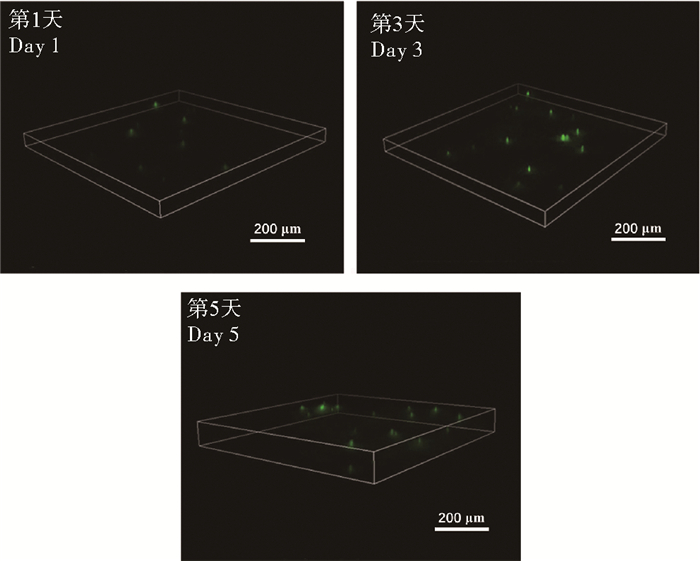
将L929细胞包埋在NQC-OP-ADH水凝胶内部,观察细胞生长情况,如图 10所示。观察到包埋在水凝胶内部的细胞有良好的生长状态,且随着培养时间的增加,细胞数量增多,表明细胞在水凝胶内部有增殖行为。通过细胞表面培养和包埋培养,都显示出NQC-OP-ADH水凝胶有良好的细胞相容性,能为细胞提供良好的生长环境,为进一步应用于生物医学领域提供支持。
|
图 10 NQC-OP-ADH水凝胶包埋培养L929细胞的3 D荧光照片 Fig. 10 Fluorescence photographs of L929 cells cultured inside NQC-OP-ADH hydrogel |
(1) 以海洋生物材料CS为基础材料,通过3种动态共价键的作用制备出新型NQC-OP-ADH水凝胶,该水凝胶具有孔径约为40 μm的三维网络孔状结构,且具有快速吸水的能力和良好的溶胀性能,有助于吸收伤口部位大量的渗出液,减少伤口浸润,为其在组织工程中的应用提供支持。NQC-OP-ADH能快速成胶,且成胶后仍有可注射性;被分割的水凝胶圆盘重新靠近组合时,可通过动态共价键自我愈合。
(2) NQC-OP-ADH水凝胶对E. coli和S. aureus的抑菌率分别为84%和99%,表现出良好的抑菌活性。
(3) NQC-OP-ADH水凝胶其溶血率小于2%,可判定为不溶血材料;其在培养L929细胞24、48和72 h过程中,细胞存活率始终大于80%,且L929细胞在水凝胶表面和内部培养时具有良好的生长状态,表现出低细胞毒性和良好的细胞相容性。
| [1] |
Wei Z, Yang J H, Liu Z Q, et al. Novel biocompatible polysaccharide-based self-healing hydrogel[J]. Advanced Functional Materials, 2015, 25(9): 1352-1359. DOI:10.1002/adfm.201401502 (  0) 0) |
| [2] |
Fan Z J, Liu B, Wang J Q, et al. A novel wound dressing based on Ag/graphene polymer hydrogel: Effectively kill bacteria and accelerate wound healing[J]. Advanced Functional Materials, 2014, 24: 3933-3943. DOI:10.1002/adfm.201304202 (  0) 0) |
| [3] |
Tran N Q, Joung Y K, Lih E, et al. In situ forming and rutin-releasing chitosan hydrogels as injectable dressings for dermal wound healing[J]. Biomacromolecules, 2011, 12(8): 2872. DOI:10.1021/bm200326g (  0) 0) |
| [4] |
Li L, Yan B, Yang J Q, et al. Novel mussel-inspired injectable self-healing hydrogel with anti-biofouling property[J]. Advanced Materials, 2015, 27: 1294-1299. DOI:10.1002/adma.201405166 (  0) 0) |
| [5] |
Kim K, Luu Y K, Chang C, et al. Incorporation and controlled release of a hydrophilic antibiotic using poly(lactide-co-glycolide)-based electrospun nanofibrous scaffolds[J]. Journal of Controlled Release, 2004, 98(1): 47-56. DOI:10.1016/j.jconrel.2004.04.009 (  0) 0) |
| [6] |
Xing Z C, Chae W P, Baek J Y, et al. In vitro assessment of antibacterial activity and cytocompatibility of silver-containing PHBV nanofibrous scaffolds for tissue engineering[J]. Biomacromolecules, 2010, 11(5): 1248-1253. DOI:10.1021/bm1000372 (  0) 0) |
| [7] |
Fischbach M A, Walsh C T. Antibiotics for emerging pathogens[J]. Science, 2009, 325(5944): 1089-1093. DOI:10.1126/science.1176667 (  0) 0) |
| [8] |
顾其胜, 位晓娟. 我国海洋生物医用材料研究现状和发展趋势[J]. 中国材料进展, 2011, 30(4): 6. Gu Q S, Wei X J. Current situation and development trend of marine biomedical materials[J]. Materials China, 2011, 30(4): 6. (  0) 0) |
| [9] |
Kumar M. A review of chitin and chitosan applications[J]. Reactive and Functional Polymers, 2000, 46(1): 1-27. DOI:10.1016/S1381-5148(00)00038-9 (  0) 0) |
| [10] |
Zhang H, Omer A M, Hu Z, et al. Fabrication of magnetic bentonite/carboxymethyl chitosan/sodium alginate hydrogel beads for Cu (Ⅱ) adsorption[J]. International Journal of Biological Macromolecules, 2019, 135: 490-500. DOI:10.1016/j.ijbiomac.2019.05.185 (  0) 0) |
| [11] |
Mourya V K, Inamdar N N. Trimethyl chitosan and its applications in drug delivery[J]. Journal of Materials Science: Materials in Medicine, 2009, 20(5): 1057-1079. DOI:10.1007/s10856-008-3659-z (  0) 0) |
| [12] |
郑化, 杜予民. N-醚基壳聚糖的合成及膜的结构与性能[J]. 武汉大学学报, 2002(2): 197-200. Zheng H, Du Y M. Preparation of N-acylchitosan and structure, properties of their films[J]. Journal of Wuhan University, 2002(2): 197-200. (  0) 0) |
| [13] |
Bernkop-Schnürch A, Hornof M, Guggi D. Thiolated chitosans[J]. European Journal of Pharmaceutics & Biopharmaceutics, 2004, 57(1): 9-17. (  0) 0) |
| [14] |
赵旭升, 刘光华, 干建群. 壳聚糖的化学改性(Ⅰ)[J]. 纤维素科学与技术, 2009, 17(2): 50-59. Zhao X S, Liu G H, Gan J Q. Chemical modification of chitosan (Ⅰ)[J]. Journal of Cellulose Science and Technology, 2009, 17(2): 50-59. (  0) 0) |
| [15] |
冯小强. 壳聚糖降解、抑菌性能及其应用研究[D]. 兰州: 兰州大学, 2007. Feng X Q. Study on the Degradation, Inhibition Activity and Application of Chitosan[D]. Lanzhou: Lanzhou University, 2007. (  0) 0) |
| [16] |
Miles K B, Ball R L, Matthew H W T. Chitosan films with improved tensile strength and toughness from N-acetyl-cysteine mediated disulfide bonds[J]. Carbohydrate Polymers, 2016, 139: 1-9. DOI:10.1016/j.carbpol.2015.11.052 (  0) 0) |
| [17] |
Bruneel D, Schacht E. Chemical modification of pullulan: Periodate oxidation[J]. Polymer, 1993, 34(12): 2628-2632. DOI:10.1016/0032-3861(93)90600-F (  0) 0) |
| [18] |
Qu J, Zhao X, Ma P X, et al. pH-responsive self-healing injectable hydrogel based on N-carboxyethyl chitosan for hepatocellular carcinoma therapy[J]. Acta Biomaterialia, 2017, 58: 168-180. DOI:10.1016/j.actbio.2017.06.001 (  0) 0) |
| [19] |
Medeiros Borsagli F G L, Carvalho I C, Mansur H S. Amino acid-grafted and N-acylated chitosan thiomers: Construction of 3D bio-scaffolds for potential cartilage repair applications[J]. International Journal of Biological Macromolecules, 2018, 114: 270-282. DOI:10.1016/j.ijbiomac.2018.03.133 (  0) 0) |
| [20] |
Rajawat G S, Shinde U A, Nair H A. Chitosan-N-acetyl cysteine microspheres for ocular delivery of acyclovir: Synthesis and in vitro/in vivo evaluation[J]. Journal of Drug Delivery Science and Technology, 2016, 35: 333-342. DOI:10.1016/j.jddst.2016.08.006 (  0) 0) |
| [21] |
Sun L, Du Y, Fan L, et al. Preparation, characterization and antimicrobial activity of quaternized carboxymethyl chitosan and application as pulp-cap[J]. Polymer, 2006, 47(6): 1796-1804. DOI:10.1016/j.polymer.2006.01.073 (  0) 0) |
| [22] |
Vo T S, Vo T T B C, Suk J W, et al. Recycling performance of graphene oxide-chitosan hybrid hydrogels for removal of cationic and anionic dyes[J]. Nano Convergence, 2020, 7(1): 1-11. DOI:10.1186/s40580-019-0212-3 (  0) 0) |
| [23] |
张倩倩. 新型可注射癸酸化壳聚糖/甲基纤维素水凝胶的制备表征及作为皮肤修复敷料的可行性评估[D]. 青岛: 中国海洋大学, 2019. Zhang Q Q. Preparation and Characterization of Novel Injectable Decanoic Acid Modified Chitosan/Methylcellulose Hydrogel and Feasibility Evaluation as Skin Repair Dressing[D]. Qingdao: Ocean University of China, 2019. (  0) 0) |
| [24] |
Zhao X, Wu H, Guo B, et al. Antibacterial anti-oxidant electroactive injectable hydrogel as self-healing wound dressing with hemostasis and adhesiveness for cutaneous wound healing[J]. Biomaterials, 2017, 122: 34-47. DOI:10.1016/j.biomaterials.2017.01.011 (  0) 0) |
| [25] |
Roberts M C, Hanson M C, Massey A P, et al. Dynamically restructuring hydrogel networks formed with reversible covalent crosslinks[J]. Advanced Materials, 2007, 19(18): 2503-2507. DOI:10.1002/adma.200602649 (  0) 0) |
| [26] |
Dang Q F, Yan J Q, Li J J, et al. Controlled gelation temperature, pore diameter and degradation of a highly porous chitosan-based hydrogel[J]. Carbohydrate Polymers, 2011, 83(1): 171-178. DOI:10.1016/j.carbpol.2010.07.038 (  0) 0) |
| [27] |
Hou S, Wang X, Park S, et al. Rapid self-integrating, injectable hydrogel for tissue complex regeneration[J]. Advanced Healthcare Materials, 2015, 4(10): 1491-1495. DOI:10.1002/adhm.201500093 (  0) 0) |
| [28] |
Deng G, Tang C, Li F, et al. Covalent cross-linked polymer gels with reversible solgel transition and self-healing properties[J]. Macromolecules, 2010, 43(3): 1191-1194. DOI:10.1021/ma9022197 (  0) 0) |
| [29] |
Wu Y, Wang L, Guo B, et al. Electroactive biodegradable polyurethane significantly enhanced Schwann cells myelin gene expression and neurotrophin secretion for peripheral nerve tissue engineering[J]. Biomaterials, 2016, 87: 18-31. DOI:10.1016/j.biomaterials.2016.02.010 (  0) 0) |
| [30] |
Li Y, Rodrigues J, Tomás H. Injectable and biodegradable hydrogels: Gelation, biodegradation and biomedical applications[J]. Chemical Society Reviews, 2012, 41(6): 2193-2221. (  0) 0) |
| [31] |
Liang S N, Dang Q F, Liu C S, et al. Characterization and antibacterial mechanism of poly(aminoethyl) modified chitin synthesized via a facile one-step pathway[J]. Carbohydrate Polymers, 2018, 195: 275-287. DOI:10.1016/j.carbpol.2018.04.109 (  0) 0) |
2. Marine Biomedical Research Institute of Qingdao, Qingdao 266075, China
 2024, Vol. 54
2024, Vol. 54


