2. 国家海洋局秦皇岛海洋环境监测中心站,河北 秦皇岛 066002;
3. 海洋活性物质与现代分析技术国家海洋局重点实验室(国家海洋局第一海洋研究所),山东 青岛 266061
在所有生物能源中,微藻已经获得了相当大的关注[1]。与其他生物燃料原料相比,微藻能够生长在不同水质中[2],解决了对可耕土地的竞争问题。微藻生命周期短并具高生长率[3-4]、高生物量和高光合效率[5],除油脂外,能产生一些有价值的副产物,被认为是维生素、矿物质、抗氧化剂和其他药物化合物的丰富来源[6]。微藻也可作为动物饲料或厌氧发酵产生甲烷。但是目前微藻高培养成本和低脂含量限制了微藻生物柴油工业化的发展,若解决了生产成本及生产环节的瓶颈,微藻生物柴油必能广泛代替陆生植物生物柴油,成为更可持续生物柴油的主要原料来源[7-9]。
柠檬酸是脂肪酸合成的原料,可在细胞溶质中合成乙酰辅酶A,乙酰辅酶A含量增加有利于脂肪酸的合成[10-11]。柠檬酸亦能促进乙酰辅酶A羧化酶的活性,后者催化乙酰辅酶A进入脂肪酸合成过程从而促进脂肪酸合成[12]。此外,柠檬酸参与三大物质氧化分解过程,是构成呼吸链的重要物质之一,能够为机体提供大量能量[13-14],从而促进细胞生长。近年来,已有学者进行了柠檬酸对微藻生长及总脂含量影响方面的研究[15-17],但研究结果有所差异。丁彦聪等[15]对小球藻(Chlorella sp.)的研究结果表明,添加柠檬酸能够促进小球藻生长,但对小球藻总脂含量无显著影响。Li等[16]的研究结果表明,适当浓度的柠檬酸可促进小球藻(Chlorella vulgaris)的生长和总脂合成。杨凯[17]的实验结果显示,添加适量的外源柠檬酸能促进克里藻(Klebsormidium sp.)、枝鞘藻(Oedocladium sp.)和真枝藻(Stigonema sp.)生长并提高它们的总脂含量。
绿藻生长快,易培养,生物量和总脂含量高,有成为生物柴油优质原料的潜力。海绿球藻(Halochloro-coccum sarcotum)属绿藻门(Chlorophyta)绿球藻目(Chlorococcales)海绿球藻属(Halochlorococcum)[18],微绿球藻(Nannochloris oculata)属绿藻门(Chlorophyta)四胞藻目(Tetrasporales)微绿球藻属(Nannochloris)[19]。研究表明,海绿球藻和微绿球藻的总脂含量能分别达到干重的35.80%和33.56%[20]。目前,仅见石伟杰有关柠檬酸对海绿球藻和微绿球藻总脂含量及脂肪酸组成影响的报道[20]。本文以海绿球藻和微绿球藻为实验材料,研究了不同浓度柠檬酸对2株绿藻的生长、叶绿素荧光参数、总脂含量和脂肪酸组成的影响,以期为2株绿藻的开发利用提供重要的参考依据。
1 材料与方法 1.1 藻种实验所用藻种取自中国海洋大学微藻种质库,分别为海绿球藻(Halochlorococcum sarcotum)和微绿球藻(Nannochloris oculata)。
1.2 实验设计实验所用容器为1 000 mL的三角烧瓶,所用培养基为f培养基,即f/2培养基[21]营养盐浓度的2倍。根据预实验结果,培养基中柠檬酸浓度分别设为0(对照组)、0.05、0.1、0.2和0.4 g/L,每个柠檬酸浓度设3个平行。将处于指数生长末期的实验藻种(400 mL)接种到含不同柠檬酸浓度的培养液(400 mL)中。培养温度(25±1)℃,光照强度5 000 lx,盐度31,连续充气培养。培养时间为4 d,每天定时定量取样,测定细胞密度和叶绿素荧光参数,培养结束后测定叶绿素含量、干重、总脂含量以及脂肪酸组成。
1.3 各项参数测定用血球计数板测定细胞密度,按梁英等[22]的方法测定叶绿素荧光参数(PSⅡ最大光能转化效率Fv/Fm、光化学淬灭qP、非光化学淬灭NPQ、最大光合作用效率Pm、快速光曲线的初始斜率α、最小饱和光照强度Ik),按戴荣继等[23]的方法测定叶绿素含量,按李植峰等[24]的方法测定总脂含量。总脂产率=总脂含量×干重/培养天数,单位为g/(L·d)。按照改进的Lepage和Roy[25]方法对干燥的微藻样品进行甲酯化,按照梁英等[26]的方法采用美国Agilent 6890N型气相色谱仪、5973型质谱仪测定脂肪酸组成。
1.4 数据处理采用SPSS11.5软件对数据进行单因子方差分析、多重比较及相关性分析(P<0.05表示差异显著)。
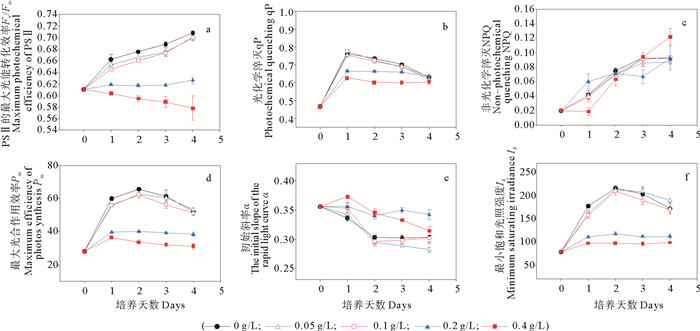
2 结果与分析 2.1 不同浓度柠檬酸对海绿球藻和微绿球藻叶绿素荧光参数的影响图 1a~f显示了海绿球藻在不同浓度柠檬酸培养条件下其荧光参数的变化情况。从图 1可以看出,在整个培养周期中,对照及低浓度处理组(0~0.1 g/L)的Fv/Fm值均随培养时间的增加而升高,且显著高于高浓度处理组(0.2~0.4 g/L)。0.2 g/L处理组的Fv/Fm值随培养时间变化不显著,0.4 g/L处理组的该参数随培养时间的增加而逐步下降。第1~4天,对照及各处理组的qP值都先升高后降低,第1~3天,0.4 g/L处理组的qP值最低,其次是0.2 g/L处理组,对照及低浓度处理组(0~0.1 g/L)间无显著差异(P>0.05)。Pm和Ik值随培养时间和不同浓度柠檬酸的变化规律相似:对照及低浓度处理组(0~0.1 g/L)的Pm和Ik值随着培养时间的增加而升高,均在第2天达到最大值,之后随培养时间的增加而下降,在整个实验过程中,对照及低浓度处理组(0~0.1 g/L)的Pm和Ik值均显著高于高浓度处理组(0.2~0.4 g/L)。对照及各处理组的NPQ值都随培养时间的增加而升高,在第4天,0.4 g/L处理组的NPQ值显著高于对照及其他处理组。对照及各处理组的α值随培养时间增加总体呈下降趋势,在第4天,0.2 g/L处理组的α值最大,0.05 g/L处理组最小。
|
图 1 不同浓度柠檬酸对海绿球藻叶绿素荧光各参数(Fv/Fm、qP、NPQ、Pm、α、Ik)的影响 Fig. 1 Effects of different citric acid concentrations on the chlorophyll fluorescence parameters (Fv/Fm, qP, NPQ, Pm, α, Ik) of Halochlorococcum sarcotum |
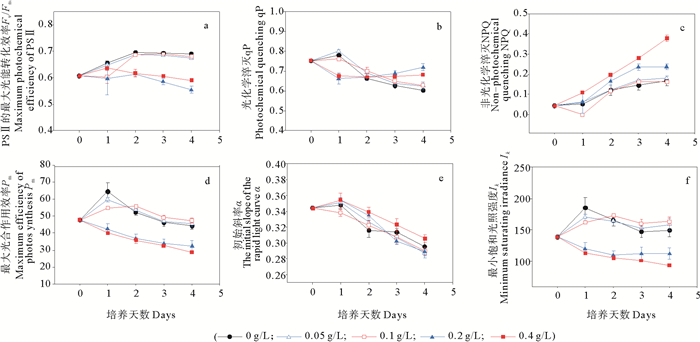
图 2a~f表示的是不同浓度柠檬酸对微绿球藻叶绿素荧光特性的影响。图 2显示,第2~4天,对照及低浓度处理组(0~0.1 g/L)的Fv/Fm值显著高于高浓度处理组(0.2~0.4 g/L)。实验前期(1~2 d)对照及低浓度处理组(0~0.1 g/L)的qP值显著高于高浓度处理组(0.2~0.4 g/L),实验结束时,对照及低浓度处理组(0~0.1 g/L)的qP值显著低于高浓度处理组(0.2~0.4 g/L)。在整个培养周期中,对照及低浓度处理组(0~0.1 g/L)的Pm和Ik值均随培养时间的增加先升高后降低且组间差异不显著(P>0.05),而高浓度处理组(0.2~0.4 g/L)的上述参数则随培养时间的增加而降低,均显著低于对照及低浓度处理组(0~0.1 g/L)。第1~4天,对照及各处理组的NPQ值均随培养时间的延长而增加,实验结束时,0.4 g/L处理组的NPQ值最大,显著高于对照及其他处理组。第1~4天,对照及各处理组的α值与NPQ的变化趋势相反,均随培养时间的延长而降低,实验结束时,0.4 g/L处理组的α值最低。
|
图 2 不同浓度柠檬酸对微绿球藻叶绿素荧光各参数(Fv/Fm、qP、NPQ、Pm、α、Ik)的影响 Fig. 2 Effects of different citric acid concentrations on the chlorophyll fluorescence parameters (Fv/Fm, qP, NPQ, Pm, α、Ik) of Nannochloris oculata |
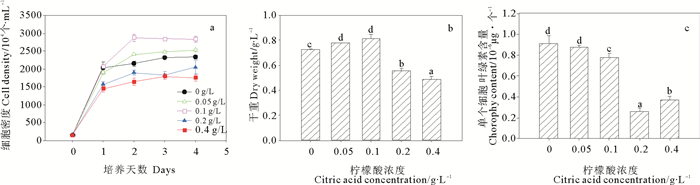
不同浓度柠檬酸对海绿球藻细胞密度、干重和叶绿素含量的影响见图 3a~c。实验前期(0~2 d)对照及各处理组细胞密度呈上升趋势,2 d后趋于稳定,实验结束时,细胞密度由大到小为0.1 g/L处理组>0.05 g/L处理组>对照组>0.2 g/L处理组>0.4 g/L处理组,0.1 g/L处理组的细胞密度最大,比对照组增加了21.26%,显著高于对照及其他处理组,而高浓度柠檬酸(0.2~0.4 g/L)显著抑制细胞密度的增加。柠檬酸浓度对海绿球藻的细胞干重和叶绿素含量也有显著影响,与对照组相比,低浓度柠檬酸(0.05~0.1 g/L)对细胞干重有显著的促进作用,柠檬酸浓度为0.1 g/L时细胞干重最大,但与0.05 g/L处理组差异不显著。高浓度处理组(0.2~0.4 g/L)的细胞干重和叶绿素含量均显著小于对照及低浓度处理组(0~0.1 g/L),说明柠檬酸浓度为0.2~0.4 g/L时抑制海绿球藻干重的增加和叶绿素的合成。
|
图 3 不同浓度柠檬酸对海绿球藻细胞密度、干重和叶绿素含量的影响 Fig. 3 Effects of different citric acid concentrations on the cell density, dry weight and chlorophyll content of Halochlorococcum sarcotum |
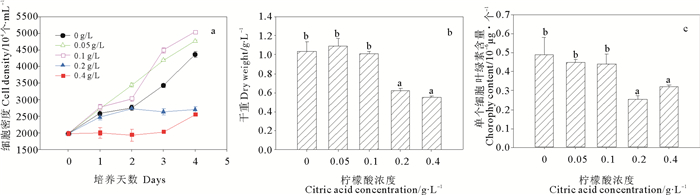
图 4a~c反映了不同浓度柠檬酸下,微绿球藻生长及叶绿素含量的变化情况。从图 4可以看出,第2天到实验结束时,低浓度处理组(0.05~0.1 g/L)的细胞密度显著高于对照组,而高浓度处理组(0.2~0.4 g/L)的细胞密度显著低于对照组,说明低浓度柠檬酸可促进该藻的生长,而高浓度则抑制其生长。其中0.1 g/L的柠檬酸浓度对该藻生长的促进作用最显著,培养结束时0.1 g/L处理组的细胞密度比对照组增加了15.34%。柠檬酸浓度对细胞干重和叶绿素含量也有显著影响且两者趋势相同,高浓度处理组(0.2~0.4 g/L)的干重和叶绿素含量显著低于对照组及低浓度处理组(0~0.1 g/L),0.05 g/L处理组的干重最大,但与对照组及0.1 g/L处理组之间差异不显著(P>0.05)。0~0.1 g/L处理组的叶绿素含量之间也没有显著差异(P>0.05)。
|
图 4 不同浓度柠檬酸对微绿球藻细胞密度、干重和叶绿素含量的影响 Fig. 4 Effects of different citric acid concentrations on the cell density, dry weight and chlorophyll content of Nannochloris oculata |
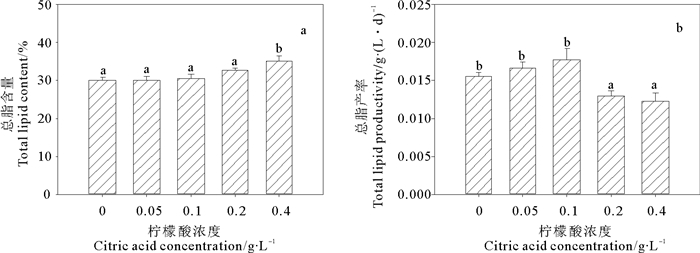
图 5a~b给出了不同浓度柠檬酸对海绿球藻总脂含量和总脂产率的影响。结果表明,与对照组相比,0.05~0.2 g/L的柠檬酸浓度对该藻的总脂含量无显著影响,0.4 g/L的柠檬酸浓度显著促进了该藻的总脂合成,该浓度下的总脂含量(35.20%)比对照组增加了17.77%。柠檬酸浓度为0.1 g/L时总脂产率最大(0.018 g/(L·d)),显著高于对照及其他处理组。
|
图 5 不同浓度柠檬酸对海绿球藻总脂含量和总脂产率的影响 Fig. 5 Effects of different citric acid concentrations on the total lipid contents and total lipid productivity of Halochlorococcum sarcotum |
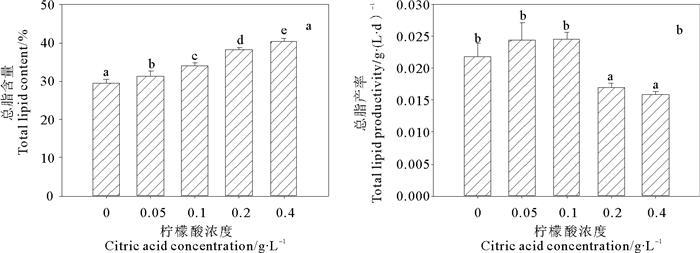
不同浓度柠檬酸对微绿球藻总脂含量和总脂产率的影响见图 6a~b。从图 6可以看出,总脂含量随柠檬酸浓度的增加而增大,在0.4 g/L时达到最大值(40.42%),比对照组增加了36.97%;总脂产率在柠檬酸浓度为0.1 g/L时达到最大值(0.025 g/(L·d)),比对照组增加了13.84%。高浓度处理组(0.2~0.4 g/L)的总脂产率显著低于对照及低浓度处理组(0~0.1 g/L)。
|
图 6 不同浓度柠檬酸对微绿球藻总脂含量和总脂产率的影响 Fig. 6 Effects of different citric acid concentrations on the total lipid contents and total lipid productivity of Nannochloris oculata |
不同浓度柠檬酸对海绿球藻脂肪酸组成的影响见表 1。从表 1中可以看出,该藻的主要脂肪酸是16:0(21.03%~22.47%)、18:0(3.39%~7.01%)、20:0(1.85%~3.50%)、18:1n-9(28.05%~42.47%)、16:3n-3(7.01%~11.98%)和18:2n-6(13.20%~14.91%)。多重比较结果显示,柠檬酸浓度对18:0、20:0、18:1n-9及16:3n-3含量的影响差异显著(P<0.05),对18:2n-6含量的影响差异不显著(P>0.05)。其中,0.1~0.2 g/L处理组的16:0显著高于对照及其他处理组;随柠檬酸浓度增加,18:0、18:1n-9和MUFA(单不饱和脂肪酸总和)的含量均呈增加趋势,都在柠檬酸浓度为0.4 g/L时达到最大值,与对照组相比,分别增加了94.72%、51.40%和51.40%;20:0、16:3n-3和PUFA(多不饱和脂肪酸总和)含量均随柠檬酸浓度增加而降低,对照及低浓度处理组(0~0.1 g/L)的上述脂肪酸含量显著高于高浓度处理组(0.2~0.4 g/L)。柠檬酸浓度对SFA(饱和脂肪酸总和)的影响差异不显著(P>0.05)。
|
|
表 1 不同浓度柠檬酸对海绿球藻脂肪酸组成的影响(占总脂肪酸的百分比) Table 1 Effects of different citric acid concentrations on the fatty acid compositions of Halochlorococcum sarcotum(Expressed in perrentage of total fatty acids) |
表 2给出了微绿球藻脂肪酸组成随不同浓度柠檬酸的变化情况。表 2显示,该藻的主要脂肪酸是16:0(23.63%~28.00%)、18:0(3.69%~5.83%)、20:0(1.72%~3.35%)、18:1n-9(33.45%~46.54%)、16:3n-3(4.45%~7.65%)和18:2n-6(11.73%~18.42%)。多重比较结果表明,柠檬酸浓度对16:0、18:1n-9、16:3n-3和18:2n-6含量的影响差异显著(P<0.05),对18:0和20:0含量的影响差异不显著(P>0.05)。柠檬酸浓度为0.2 g/L时16:0含量达到最大值,比对照组增加了18.50%。18:1n-9和MUFA含量均随柠檬酸浓度的增加而升高,在柠檬酸浓度为0.4 g/L时达到最大值,分别比对照组增加了39.13%和39.13%。16:3n-3、18:2n-6和PUFA含量均随柠檬酸浓度增加而降低,高浓度处理组(0.2~0.4 g/L)的上述脂肪酸含量显著低于对照及低浓度处理组(0~0.1 g/L)。柠檬酸浓度对SFA的影响差异显著(P<0.05),柠檬酸浓度为0.2 g/L时SFA含量最高,但与0.4 g/L处理组差异不显著。
|
|
表 2 不同浓度柠檬酸对微绿球藻脂肪酸组成的影响(占总脂肪酸的百分比) Table 2 Effects of different citric acid concentrations on the fatty acid compositions of Nannochloris oculata(Expressed in perrentage of total fatty acids) |
叶绿素荧光技术能够利用植物活体发出的叶绿素荧光,快速、有效检测出植物细胞光合功能的受损情况。Fv/Fm表示PSⅡ最大光能转换效率,能够反映环境变化对微藻光合作用产生的影响,Fv/Fm值在不良环境下会明显降低[27]。在整个培养周期中,海绿球藻和微绿球藻高浓度处理组(0.2~0.4 g/L)的Fv/Fm值始终显著低于对照及低浓度处理组(0~0.1 g/L),该结果表明,高浓度柠檬酸(0.2~0.4 g/L)胁迫下,2株绿藻的PSⅡ最大光能转换效率降低,PSⅡ反应中心受损,原初反应被抑制。qP表示光化学淬灭,反映了PS Ⅱ处于光适应状态下进行光化学反应的能力。Pm表示最大光合作用效率[28],Ik表示最小饱和光照强度。海绿球藻和微绿球藻对照及低浓度处理组(0~0.1 g/L)的qP、Pm和Ik值均显著高于高浓度处理组(0.2~0.4 g/L),上述结果说明0.2~0.4 g/L的柠檬酸浓度不利于2株绿藻的光合作用,进行光化学反应的能力受到抑制,最大光合作用效率降低。NPQ为非光化学淬灭,海绿球藻和微绿球藻高浓度处理组(0.2~0.4 g/L)的该参数显著高于其他处理组,原因可能是微藻在高浓度柠檬酸(0.2~0.4 g/L)胁迫下,通过提高NPQ来散失光合色素吸收的过多光能[29],从而保证光合系统稳态,降低对细胞的伤害。丙酮酸羧化酶存在于所有光合生物中,是光合作用过程中的关键酶,参与光合碳同化等重要代谢途径[30-31]。有机酸是常用的丙酮酸羧化酶的抑制剂[32]。柠檬酸是经过发酵制取的一种有机酸[33]。由此可以看出,高浓度柠檬酸通过抑制海绿球藻和微绿球藻的丙酮酸羧化酶活性,破坏藻细胞PSⅡ反应中心,且柠檬酸浓度越大破坏程度越大,从而阻碍电子传递,降低电子传递活性和光合作用效率。
研究表明,添加外源柠檬酸对微藻生长有一定的影响[15-17]。丁彦聪等[15]对小球藻的研究结果表明,到达收获期时,在添加了浓度为0.78 mmol/L(0.15 g/L)柠檬酸的培养液中小球藻的细胞密度最大,为对照组的2.5倍。杨凯[17]的实验结果表明,柠檬酸浓度为100 mg/L(0.1 g/L)时,克里藻、枝鞘藻的生长最佳,而真枝藻则在柠檬酸浓度为120 mg/L(0.12 g/L)下生长效果最好。本实验结果表明,适合海绿球藻和微绿球藻生长的柠檬酸浓度均为0.1 g/L,与杨凯对克里藻、枝鞘藻的研究结果一致。此外,丁彦聪等[15]研究发现,在培养的最初几天,小球藻在0.26~0.52 mmol/L(0.05~0.1 g/L)的较低浓度柠檬酸培养液中生长较快,随着培养时间的延长,小球藻在0.78 mmol/L(0.15 g/L)的较高浓度柠檬酸培养液中生长速度加快。而我们的结果表明,在整个培养周期中,低浓度柠檬酸(0.05~0.1 g/L)促进海绿球藻和微绿球藻的生长,而高浓度柠檬酸(0.2~0.4 g/L)则抑制2株绿藻的生长。这种差异主要与实验所用藻种、柠檬酸浓度范围以及培养条件有关,丁彦聪等[15]在L1海水培养基中培养小球藻,柠檬酸浓度为0~0.78 mmol/L(0~0.15 g/L),培养时间为14 d;而本实验是在f培养基中培养海绿球藻和微绿球藻,柠檬酸浓度为0.05~0.4 g/L,培养时间为4 d。一方面,本实验未进行0.15 g/L柠檬酸浓度对海绿球藻和微绿球藻生长的研究,因此无从得知此柠檬酸浓度下2株绿藻的生长状况。另一方面,丁彦聪等[15]实验的柠檬酸浓度最高设定为0.78 mmol/L(0.15 g/L),因此也无从得知0.2~0.4 g/L的柠檬酸对小球藻生长的影响。
乙酰辅酶A羧化酶是所有生物中脂肪酸从头合成的关键酶,催化的反应是脂肪酸合成第一个限速步骤[34-36]。柠檬酸能增加乙酰辅酶A羧化酶的多聚体比例,是一种乙酰辅酶A羧化酶活性的变构激活剂[37-38]。因此,添加外源柠檬酸能够促进脂肪酸合成速率[39],促进油脂积累。杨凯[17]实验结果表明,添加100 mg/L(0.1 g/L)的柠檬酸时克里藻和枝鞘藻的总脂含量最高,添加120 mg/L(0.12 g/L)的柠檬酸时,真枝藻的总脂含量最高。本实验结果显示,0.4 g/L的柠檬酸培养条件下,2株绿藻总脂含量均达到最大值,与以上结果有所差异,差异的原因主要与微藻种类、培养条件以及柠檬酸浓度有关。杨凯[17]是在BG11培养基中培养淡水绿藻(克里藻、枝鞘藻)和淡水蓝藻(真枝藻),柠檬酸浓度为30~150 mg/L(0.03~0.15 g/L),培养时间33 d;而本实验是在f培养基中培养海水的海绿球藻和微绿球藻,柠檬酸浓度为0.05~0.4 g/L,培养时间为4 d。丁彦聪等[15]对小球藻的研究则表明,0~0.78 mmol/L(0~0.15 g/L)的外源柠檬酸对小球藻总脂含量无显著影响,与本实验对海绿球藻的部分研究结果相似,即0~0.2 g/L的柠檬酸浓度对海绿球藻的总脂合成无显著促进效果。综上所述,柠檬酸浓度对某些微藻的油脂合成有一定的促进作用,但对另一些微藻的总脂含量没有显著影响,添加外源柠檬酸对微藻总脂含量是否有影响以及影响程度随着微藻种类、柠檬酸浓度以及培养条件的不同而变化。研究表明,总脂产率能够反映藻细胞油脂积累速率,弥补了仅利用生物量或总脂含量作为产油藻株评价标准的不足[40],因此本实验用总脂含量和总脂产率相结合的方法来综合评价外源柠檬酸对2株绿藻油脂积累的影响。
在微藻脂肪酸合成过程中,经乙酰辅酶A羧化酶催化合成的丙二酸单酰辅酶A与乙酰辅酶A共同作为引物合成16碳和18碳的饱和脂肪酸,然后经过碳链延长酶及去饱和酶作用逐步形成不饱和脂肪酸[41-42]。柠檬酸既是乙酰辅酶A羧化酶的变构激活剂[37-38],也是合成乙酰辅酶A的原料之一[10-11],因此,柠檬酸在决定细胞内代谢燃料走向分解利用或以脂肪酸形式贮存方面有重要作用[43]。国内外有关不同浓度柠檬酸对微藻脂肪酸的研究一般集中在脂肪酸含量方面,对脂肪酸组成的研究很少[15-17]。本实验中,2株绿藻的18:1n-9和MUFA均随柠檬酸浓度增大而增加,16:3n-3和PUFA均随柠檬酸浓度增大而降低,SFA随柠檬酸浓度的变化趋势则与微藻种类有关,说明高浓度柠檬酸对2株绿藻的18:1n-9和MUFA的合成有促进作用,而对16:3n-3和PUFA的合成有抑制作用,柠檬酸浓度对海绿球藻SFA的合成影响不显著,对微绿球藻的SFA合成有一定的促进作用。因此柠檬酸浓度对不同藻种脂肪酸组成的影响存在差异,目前关于柠檬酸对微藻脂肪酸组成的相关文献还未见报道,具体作用机理还需进一步研究。
4 结语本研究得出,不同浓度柠檬酸对海绿球藻和微绿球藻的生长、叶绿素荧光参数、总脂含量和脂肪酸组成均有显著影响。柠檬酸浓度为0.1 g/L时,2株绿藻的生长状况和叶绿素荧光参数达到较为理想状态,且它们的总脂产率达到最高。因此,适合2株绿藻生长及产脂的最佳柠檬酸浓度是0.1 g/L。本研究探索了不同藻种的最佳柠檬酸浓度,在保证微藻生物量的前提下提高总脂含量, 为海绿球藻和微绿球藻的开发利用提供理论依据。
| [1] |
Mehrabadi A, Craggs R, Farid M M. Waste water treatment high rate algal ponds (WWT HRAP) for low-cost biofuel production[J]. Bioresource Technology, 2015, 184: 202-214. DOI:10.1016/j.biortech.2014.11.004
(  0) 0) |
| [2] |
Saadaoui I, Ghazal G A, Bounnit T, et al. Evidence of thermo and halotolerant Nannochloris isolate suitable for biodiesel production in qatar culture collection of cyanobacteria and microalgae[J]. Algal Research, 2016, 14: 39-47. DOI:10.1016/j.algal.2015.12.019
(  0) 0) |
| [3] |
Chung Y S, Lee J W, Chung C H. Molecular challenges in microalgae towards cost-effective production of quality biodiesel[J]. Renewable & Sustainable Energy Reviews, 2017, 74: 139-144.
(  0) 0) |
| [4] |
Chia S R, Ong H C, Chew K W, et al. Sus Lble approaches for algae utilisation in bioenergy production[J/OL]. Renewable Energy.http://doi.org/10.1016/j.renene.2017.04.001.
(  0) 0) |
| [5] |
Chisti Y. Biodiesel from microalgae[J]. Biotechnology Advances, 2007, 25(3): 294-306. DOI:10.1016/j.biotechadv.2007.02.001
(  0) 0) |
| [6] |
Converti A, Casazza A A, Ortiz E Y, et al. Effect of temperature and nitrogen concentration on the growth and lipid content of Nannochloropsis oculata and Chlorella vulgaris for biodiesel production[J]. Chemical Engineering and Processing: Process Intensification, 2009, 48(6): 1146-1151. DOI:10.1016/j.cep.2009.03.006
(  0) 0) |
| [7] |
李华, 王伟波, 刘永定, 等. 微藻生物柴油发展与产油微藻资源利用[J]. 可再生能源, 2011, 29(4): 84-89. Li H, Wang W B, Liu Y D, et al. The development of microalgae biodiesel and the utilization of oleaginous microalgae[J]. Renewable Energy Resources, 2011, 29(4): 84-89. DOI:10.3969/j.issn.1671-5292.2011.04.019 (  0) 0) |
| [8] |
Concas A, Steriti A, Pisu M, et al. Comprehensive modeling and investigation of the effect of iron on the growth rate and lipid accumulation of Chlorella vulgaris cultured in batch photobioreactors[J]. Bioresource Technology, 2014, 153(2): 340-350.
(  0) 0) |
| [9] |
Doan T T Y, Sivaloganathan B, Obbard J P. Screening of marine microalgae for biodiesel feedstock[J]. Biomass and Bioenergy, 2011, 35(7): 2534-2544. DOI:10.1016/j.biombioe.2011.02.021
(  0) 0) |
| [10] |
Liang M H, Jiang J G. Characterization and nitrogen deficiency response of ATP-citrate lyase from unicellular alga Dunaliella tertiolecta[J]. Algal Research, 2016, 20: 77-86. DOI:10.1016/j.algal.2016.09.025
(  0) 0) |
| [11] |
Marudhupandi T, Gunasundari V, Tissera K R A. Influence of citrate on Chlorella vulgaris for biodiesel production[J]. Biocatalysis and Agricultural Biotechnology, 2014, 3(4): 386-389. DOI:10.1016/j.bcab.2014.03.008
(  0) 0) |
| [12] |
Watson J A, Lowenstein J M. Citrate and the conversion of carbohydrate into fat. Fatty acid synthesis by a combination of cytoplasm and mitochondria[J]. Journal of Biological Chemistry, 1970, 245(22): 5993-6002.
(  0) 0) |
| [13] |
李振. 绿色饲料添加剂柠檬酸在水产养殖中的应用[J]. 农业经济与管理, 2005(5): 33-35. Li Z. Application of green feeding additives citric acid in aquaculture[J]. Agricultural Economics and Management, 2005(5): 33-35. (  0) 0) |
| [14] |
黄金华, 宁国信. 柠檬酸的生物学特性及其在水产养殖中的应用综述[J]. 广西农学报, 2016, 31(3): 59-62. Hang J H, Ning G X. The study on the biological characteristics of citric acid and application in aquaculture[J]. Journal of Guangxi Agriculture, 2016, 31(3): 59-62. DOI:10.3969/j.issn.1003-4374.2016.03.016 (  0) 0) |
| [15] |
丁彦聪, 高群, 刘家尧, 等. 环境因子对小球藻生长的影响及高产油培养条件的优化[J]. 生态学报, 2011, 31(18): 5307-5315. Ding Y C, Gao Q, Liu J Y, et al. Effect of environmental factors on growth of Chlorella sp. and optimization of culture conditions for high oil production[J]. Acta Ecologica Sinica, 2011, 31(18): 5307-5315. (  0) 0) |
| [16] |
Li C L, Yang H L, Xia X L, et al. High efficient treatment of citric acid effluent by Chlorella vulgaris and potential biomass utilization[J]. Bioresource Technology, 2013, 127: 248-255. DOI:10.1016/j.biortech.2012.08.074
(  0) 0) |
| [17] |
杨凯.高油脂微藻筛选及不同培养条件对其脂肪酸含量及组分的影响[D].苏州: 苏州大学, 2009. Yang K. Selection of High-Level Lipid Microalgae and Effect of Different Culture Conditions on the Fatty Acid Contents and Components[D]. Suzhou: Soochow University, 2009. http://cdmd.cnki.com.cn/Article/CDMD-10285-2009118921.htm (  0) 0) |
| [18] |
Kornmann P, Sahling P H. Meeresalgen von helgoland: Ergänzung[J]. Helgoländer Meeresuntersuchungen, 1983, 36(1): 1-65. DOI:10.1007/BF01995795
(  0) 0) |
| [19] |
陈明耀. 生物饵料培养[M]. 北京: 中国农业出版社, 1995. Chen M Y. Live Food Cultivatology[M]. Beijing: China Agriculture Press, 1995. (  0) 0) |
| [20] |
石伟杰.高脂绿藻的选育以及油脂积累条件的初步研究[D].青岛, 中国海洋大学, 2012. Shi W J. Preliminary Study on Breeding of High-Lipid Marine Green Algae and Condition for Lipid Accumulation[D]. Qingdao: Ocean University of China, 2012. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2212549 (  0) 0) |
| [21] |
Guillard R R L, Ryther J H. Studies of marine planktonic diatoms: Ⅰ. Cyclotella nana (Hustedt) and Detonula confervacea (Cleve) Gran[J]. Canadian Journal of Microbiology, 1962, 8(2): 229-239. DOI:10.1139/m62-029
(  0) 0) |
| [22] |
Liang Y, Sun M H, Tian C Y, et al. Effects of salinity stress on the growth and chlorophyll fluorescence of Phaeodactylum tricornutum and Chaetoceros gracilis (Bacillariophyceae)[J]. Botanica Marina, 2014, 57(6): 469-476.
(  0) 0) |
| [23] |
戴荣继, 黄春, 佟斌, 等. 藻类叶绿素及其降解产物的测定方法[J]. 中央民族大学学报(自然科学版), 2004, 13(1): 75-80. Dai R J, Huang C, Tong B, et al. Determination of algal chlorophyll and their degradation products[J]. Journal of the Central University for Nationalities, 2004, 13(1): 75-80. DOI:10.3969/j.issn.1005-8036.2004.01.013 (  0) 0) |
| [24] |
李植峰, 张玲, 沈晓京, 等. 四种真菌油脂提取方法的比较研究[J]. 微生物学通报, 2001, 8(6): 72-75. Li Z F, Zhang L, Shen X J, et al. A comparative study on four method of fungi lipid extraction[J]. Microbiology, 2001, 8(6): 72-75. DOI:10.3969/j.issn.0253-2654.2001.06.018 (  0) 0) |
| [25] |
Lepage G, Roy C C. Improved recovery of fatty acid through direct transesterification without prior extraction or purification[J]. Journal of Lipid Research, 1984, 25(12): 1391-1397.
(  0) 0) |
| [26] |
梁英, 刁永芳, 田传远, 等. 硅浓度对筒柱藻B169生长、叶绿素荧光参数、总脂含量及脂肪酸组成的影响[J]. 海洋湖沼通报, 2014, 1(1): 18-25. Liang Y, Diao Y F, Tian C Y, et al. Effects of silicon concentrations on the growth, chlorophyll fluorescence parameters, total lipid content and fatty acid compositions of Cylindrotheca sp. B169[J]. Transactions of Oceanology & Limnology, 2014, 1: 18-25. (  0) 0) |
| [27] |
Parkhill J, Maillet G, Cullen J J. Fluorescence-based maximal quantum yield for PSⅡ as a diagnostic of nutrient stress[J]. Journal of Phycology, 2001, 37(4): 517-529. DOI:10.1046/j.1529-8817.2001.037004517.x
(  0) 0) |
| [28] |
孙明辉.筒柱藻生长、总脂含量和脂肪酸组成的初步研究[D].青岛, 中国海洋大学, 2015. Sun M H. A Preliminary Study on the Growth, Total Lipid Content and Fatty Acid Composition of Cylindrotheca sp.[D]. Qingdao: Ocean University of China, 2015. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2900261 (  0) 0) |
| [29] |
莫亿伟, 郭振飞, 谢江辉. 温度胁迫对柱花草叶绿素荧光参数和光合速率的影响[J]. 草业学报, 2011, 20(1): 96-101. Mo Y W, Guo Z F, Xie J H. Effects of temperature stress on chlorophyll fluorescence parameter and photosynthetic rates of Stylosanthes guianensis[J]. Acta Prataculture Sinica, 2011, 20(1): 96-101. (  0) 0) |
| [30] |
宋东辉, 侯李君, 施定基. 生物柴油原料资源高油脂微藻的开发利用[J]. 生物工程学报, 2008, 24(3): 341-348. Song D H, Hou L J, Shi D J. Exploitation and utilization of rich lipids-microalgae, as new lipids feedstock for biodiesel production-a review[J]. Chinese Journal of Biotechnology, 2008, 24(3): 341-348. DOI:10.3321/j.issn:1000-3061.2008.03.001 (  0) 0) |
| [31] |
魏绍巍, 黎茵. 植物磷酸烯醇式丙酮酸羧化酶的功能及其在基因工程中的应用[J]. 生物工程学报, 2011, 27(12): 1702-1710. Wei S W, Li Y. Functions of plant phosphoenolpyruvate carboxylase and its applications for genetic engineering[J]. Chinese Journal of Biotechnology, 2011, 27(12): 1702-1710. (  0) 0) |
| [32] |
Rajagopalan A V, Devi M T, Raghavendra A S. Molecular biology of C4 phosphoenolpyruvate carboxylase: Structure, regulation and genetic engineering[J]. Photosynthesis Research, 1994, 39(2): 115-135. DOI:10.1007/BF00029380
(  0) 0) |
| [33] |
粟雄高.柠檬酸和微生态制剂对凡纳滨对虾生长、消化酶活性和免疫性能的影响[D].上海: 上海海洋大学, 2012. Su X G. Effects of Citric Acid and Microecologics on Growth Performance, Digestive Enzyme Activity and Immunity of White Whrimp, Litopenaeus vannamei [D]. Shanghai: Shanghai Ocean University, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10264-1013000326.htm (  0) 0) |
| [34] |
Salie M J, Thelen J J. Regulation and structure of the heteromeric acetyl-CoA carboxylase[J]. Biochimica Et Biophysica Acta, 2016, 1861(9): 1207-1213. DOI:10.1016/j.bbalip.2016.04.004
(  0) 0) |
| [35] |
龚莹, 彭少丹, 汪骞, 等. 乙酰辅酶A羧化酶的结构功能及基因的研究进展[J]. 安徽农业科学, 2010, 38(35): 19893-19896. Gong Y, Peng S D, Wang Q, et al. Research progress on the structure function of acetyl-CoA carboxylase and its genes[J]. Journal of Anhui Agricultural Sciences, 2010, 38(35): 19893-19896. DOI:10.3969/j.issn.0517-6611.2010.35.006 (  0) 0) |
| [36] |
Hunt D W, Winters G C, Brownsey R W, et al. Inhibition of sebum production with the acetyl-CoA carboxylase inhibitor olumacostat glasaretil[J]. Journal of Investigative Dermatology, 2017, 137(7): 1415-1423. DOI:10.1016/j.jid.2016.12.031
(  0) 0) |
| [37] |
韩春春, 王继文.乙酰辅酶A羧化酶在脂肪代谢过程中的调控研究[C]. //杨宁.中国家禽业—机遇与挑战—第十三次全国家禽学术讨论会论文集.北京: 中国农业科学技术出版社, 2007: 720-723. Han C C, Wang J W. Study on acetyl-CoA carboxylase in regulating metabolism of fatty acid[C]. // Yang N. Memoir of China poultry-opportunities and challenges-the 13th colloquium of poultry. Beijing: China Agricultural Science and Technology Press, 2007: 720-723. http://www.wanfangdata.com.cn/details/detail.do?_type=conference&id=6502449 (  0) 0) |
| [38] |
Munday M R, Hemingway C J. The regulation of acetyl-CoA carboxylase-a potential target for the action of hypolipidemic agents[J]. Advances in Enzyme Regulation, 1999, 39(1): 205-234. DOI:10.1016/S0065-2571(98)00016-8
(  0) 0) |
| [39] |
王立柱, 温皓程, 邹渝, 等. 产油微藻的分离、筛选及自养培养氮源、碳源的优化[J]. 微生物学通报, 2010, 37(3): 336-341. Wang L Z, Wen H C, Zou Y, et al. Isolation, selection of microalgae for lipid production and optimization of its nitrogen resource and carbon resource in autotrophic culture[J]. Microbiology China, 2010, 37(3): 336-341. (  0) 0) |
| [40] |
李涛, 李爱芬, 桑敏, 等. 富油能源微藻的筛选及产油性能评价[J]. 中国生物工程杂志, 2011, 31(4): 98-105. Li T, Li A F, Sang M, et al. Screening oleaginous microalgae and evaluation of the oil-producing characteristic[J]. China Biotechnology, 2011, 31(4): 98-105. (  0) 0) |
| [41] |
廖灵旋, 于昊, 黄建忠. 多不饱和脂肪酸合成途径研究进展[J]. 微生物学杂志, 2014, 34(3): 80-85. Liao L X, Yu H, Huang J Z. Advanced in polyunsaturated fatty acids synthesis pathway[J]. Journal of Microbiology, 2014, 34(3): 80-85. DOI:10.3969/j.issn.1005-7021.2014.03.016 (  0) 0) |
| [42] |
刘婉君.微拟球藻多不饱和脂肪酸合成途径及去饱和酶功能的研究[D].广州: 暨南大学, 2016. Liu W J. Research in Polyunsaturated Fatty acid Synthesis Pathway and Desaturase in Nannochloropsis oceanica [D]. Guangzhou: Jinan University, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10559-1016790977.htm (  0) 0) |
| [43] |
王镜岩. 生物化学教程[M]. 北京: 高等教育出版社, 2008: 401-427. Wang J Y. Essential Biochemistry[M]. Beijing: Higher Education Press, 2008: 401-427. (  0) 0) |
2. Marine Environment Monitoring Central Station of Qinhuangdao, State Oceanic Administration, Qinhuangdao 066002, China;
3. Key Laboratory for Marine Bioactive Substances and Modern Analytical Technology, The First Institute of Oceanography, State Oceanic Administration, Qingdao 266061, China
 2018, Vol. 48
2018, Vol. 48

