几丁质酶可降解几丁质中N-乙酰葡萄糖胺C1和C4间的糖苷键,是属于糖基水解酶类。Broadway等[1]根据几丁质酶作用机理不同,认为其至少包含有内切几丁质酶、外切几丁质酶和N-乙酰-β-D-氨基葡萄糖苷酶(EC3.2.1.52,NAGase)等3种不同组分,其中NAGase主要是通过对几丁质外切生成β-N-乙酰葡萄糖胺单体和寡聚糖,并将外切几丁质酶酶解几丁质产生的几丁二糖继续降解为单体。几丁质酶在动植物、微生物体内普遍存在,在不同生物体中也发挥着不同的生理作用[2];其中节肢动物几丁质酶除了起到对含几丁质的食物进行酶解消化外,还与节肢动物周期性蜕皮蜕壳的生理现象密切相关[3]。为了阐明几丁质酶在昆虫、虾蟹、鲎等这些节肢动物周期性蜕皮过程的生理作用,几丁质酶的组成结构及其催化机理成为了研究热点[4]。
目前,对几丁质酶功能基团的研究方法主要有蛋白质化学修饰法和定点突变技术。Fan等[5]用酶的定点突变技术研究了舞毒蛾(Lymantria dispar)几丁质酶的功能基团,发现Asp143、Asp145和Trp146三个具有高度保守性的氨基酸残基与酶催化活性密切相关;Lu等[6]也用该技术研究表明:烟草天蛾(Manduca sexta)几丁质酶Trp142、Asp144和Glu146是酶活性部位的必需基团,Glu146在几丁质降解中主要起酸碱催化作用。Jin等[7]则采用蛋白质化学修饰法研究了锯缘青蟹(Scylla serrata)NAGase的功能基团,证明了色氨酸是酶活性的必需基团,而酶中二硫键和精氨酸的胍基不是酶活性所必需的;Xie等[8]也对凡纳滨对虾(Litopenaeus vannamei)NAGase进行化学修饰,结果证明色氨酸是对虾NAGase的必需基团,酶反应动力学研究还发现对虾NAGase酶分子催化活性只需一个色氨酸残基参与。课题组已从中国鲎(Tachypleus tridentatus)分离纯化到NAGase[9],在研究其酶学性质的基础上,本研究进一步通过化学修饰法探讨了中国鲎NAGase的功能基团,为揭示中国鲎在生活周期中蜕皮与几丁质酶活性之间的相关性奠定理论基础。
1 材料与方法 1.1 材料参照文献[9]所述方法分离纯化中国鲎NAGase,分别通过抽提、30%和80%的饱和硫酸铵分级分离、Sephadex G-200凝胶层析以及DEAE-32离子交换层析分离,纯化后获得聚丙烯酰胺凝胶电泳(PAGE)单一纯的酶制剂,比活力为505.21 U/mg,酶制剂在4 ℃下经过双蒸馏水透析后,用于酶化学修饰的研究。
NAGase催化的底物对硝基苯-N-乙酰-β-D-氨基葡萄糖苷(pNP-β-D-GlcNAc),由上海医药工业研究院生化室合成;Sephadex G-200出自Pharmacia;纤维素DEAE-32是Whatman产品;对氯汞苯甲酸(p-chloromercuribenzoate,pCMB)是Sigma产品;苯甲基磺酰氟(Phenylmethanesulfonyl fluoride,PMSF)为Merk公司产品;甲醛、乙酸酐、三硝基苯磺酸(Trinitrobenzene sulfonic acid,TNBS)、二巯基苏糖醇(Dithiothreitol,DTT)、乙酰丙酮(Acetylacetone,AA)、溴代乙酸(Bromoacetic acid,BrAc)、碘代乙酸(Iodoacetic acid,IAc)、N-溴代琥珀酰亚胺(N-bromosuccinimide,NBS),以及其它试剂均为国产分析纯。
1.2 方法 1.2.1 中国鲎内脏NAGase活力测定中国鲎内脏NAGase活力的测定方法参考文献[9]。在2 mL的酶测活体系中,包含1 mL 75 mmol/L HAC-NaAC缓冲液(pH=5.4),0.2 mL 5 mmol/L的底物pNP-β-D-GlcNAc,0.78 mL的双蒸馏水,20 μL酶液。在37 ℃下反应10 min,以2 mL 0.5 mol/L NaOH终止反应,测定A405 nm,以未加入酶制剂的为空白对照组。
1.2.2 中国鲎内脏NAGase功能基团的化学修饰选择TNBS等10种化学修饰剂,分别在不同修饰体系中对中国鲎NAGase进行化学修饰。TNBS、乙酸酐和DTT等3种修饰剂对酶的修饰在0.01 mol/L Tris-HCl(pH=8.0)缓冲体系37 ℃下进行,PMSF对酶的修饰采用同样的缓冲体系,但是在25 ℃下进行;甲醛和NBS均在37 ℃下0.20 mol/L NaAc-HAc(pH=5.4)的缓冲体系中对酶进行修饰;乙酰丙酮则是在37 ℃下,0.01 mol/L Tris-HCl(pH=9.0)的缓冲体系中对酶进行修饰;在0.10 mol/L NaAc-HAc(pH=6.0)缓冲体系中,溴代乙酸在25 ℃下,碘代乙酸在37 ℃下分别对酶进行修饰;而pCMB是在0.05 mol/L NaAc-HAc(pH=5.8)缓冲体系中,37 ℃下对酶进行修饰。
修饰酶活力的测定:在NAGase酶液中按一定比例(V酶: V修饰剂=1:3)分别加入不同的修饰剂,于各自的修饰体系中修饰30 min,然后取出50 μL的修饰酶,在NAGase测活体系中测定酶的剩余活力,设立了对照组,在化学修饰试验中,为了排除修饰剂本身对试验的干扰,在对照组设置中,则是在加入2 mL 0.5 mol/L NaOH后再加入50 μL修饰酶制剂。以测得的未修饰酶活力为100%,而修饰酶活力以相对酶活力(%)表示。
1.2.3 NBS对NAGase紫外吸收光谱和内源荧光发射光谱的影响NAGase经0、2、3、5、10 μmol/L浓度NBS化学修饰后,分别用日本岛津UV-2550型紫外分光光度计扫描,测定NAGase经修饰后的紫外吸收峰。此外,NAGase经0、2、5、10、15、20 μmol/L浓度NBS化学修饰后,分别用美国Cary Eclipse荧光分光光度计扫描,在酶内源荧光激发光谱波长为230.9 nm下,测定NAGase经修饰后的内源荧光发射光谱峰。
2 结果与分析 2.1 中国鲎内脏NAGase的分离纯化中国鲎内脏NAGase通过抽提、硫酸铵沉淀分级分离、凝胶层析以及离子交换层析后,获得NAGase酶制剂,透析后经PAGE和SDS-PAGE检定,电泳图谱均显示一谱带(见图 1),说明经分离纯化后NAGase已达到电泳纯,用此纯酶制剂进行酶的化学修饰试验。
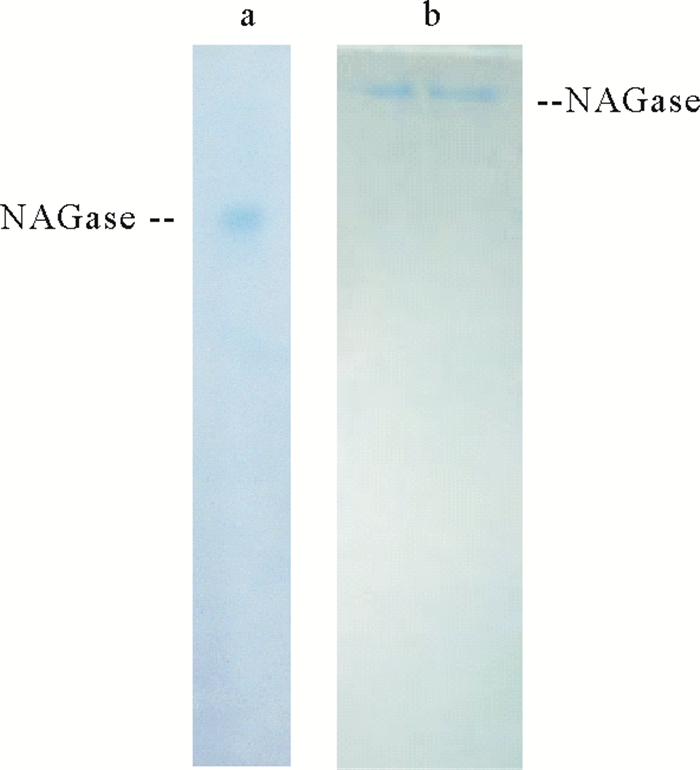
|
图 1 中国鲎NAGase的PAGE(a)及SDS-PAGE(b)图谱 Fig. 1 PAGE(lane a) and SDS-PAGE (lane b) of the purified NAGase from Tachypleus tridentatus |
采用甲醛和乙酸酐两种氨基修饰剂[10],分别对中国鲎NAGase进行化学修饰,发现NAGase经8 mmol/L甲醛修饰后,酶活力仅剩4.1%(见图 2);而乙酸酐在0~200 mmol/L浓度范围内,对NAGase化学修饰的结果表明:随乙酸酐修饰剂浓度的增加,NAGase活力逐渐下降,呈浓度效应,当乙酸酐修饰剂浓度达到200 mmol/L时,NAGase活力丧失了97.8%(见图 3)。有许多化合物可以修饰酶蛋白中赖氨酸ε-氨基,TNBS也是其中非常有效的一种[11]。研究发现,随着化学修饰剂TNBS浓度的增大,NAGase活力逐渐下降,20 mmol/L TNBS可使中国鲎NAGase活力丧失94.7%(见图 4)。这些结果表明了:NAGase的赖氨酸ε-氨基被化学修饰后,酶的活性变化大,赖氨酸ε-氨基是中国鲎NAGase活性的必需基团。
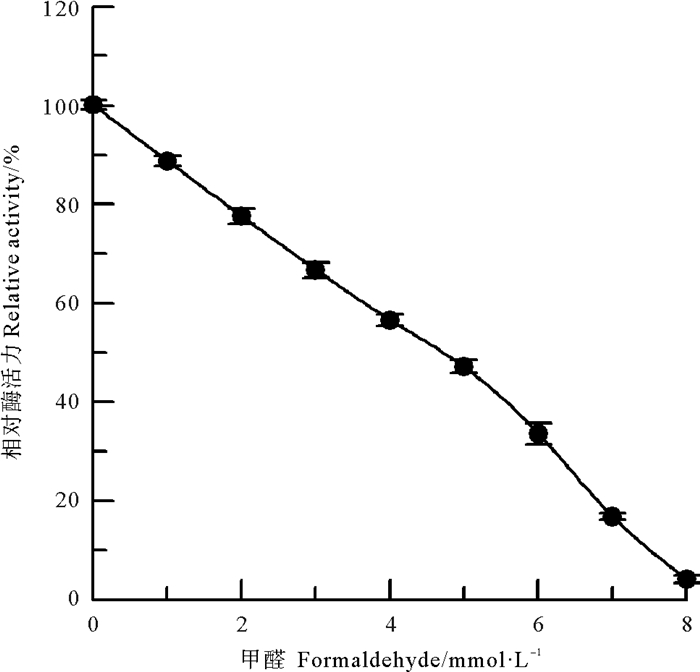
|
图 2 甲醛对中国鲎NAGase的修饰作用 Fig. 2 Modification of NAGase from T. tridentatus by formaldehyde |
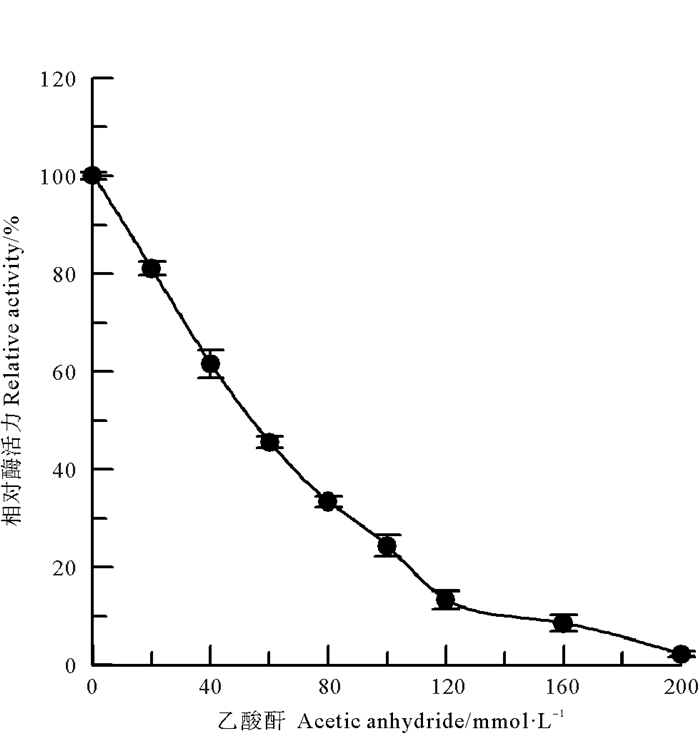
|
图 3 乙酸酐对中国鲎NAGase的修饰作用 Fig. 3 Modification of NAGase from T. tridentatus by Acetic anhydride |
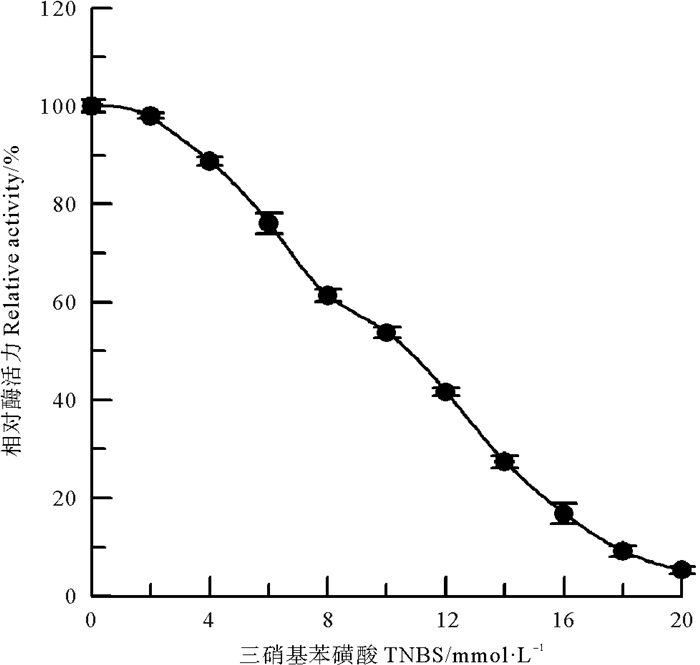
|
图 4 TNBS对中国鲎NAGase的修饰作用 Fig. 4 Modification of NAGase from T. tridentatus by TNBS |
PMSF是蛋白质中丝氨酸羟基的专一化学修饰剂[11]。在偏碱性条件下,采用PMSF对中国鲎NAGase酶蛋白中丝氨酸羟基进行专一的化学修饰。结果见图 5,随着修饰剂PMSF浓度的升高,修饰后酶的活力逐渐降低,当修饰剂PMSF浓度达到200 mmol/L时,NAGase活力几乎丧失,结果表明:中国鲎NAGase酶蛋白中丝氨酸的羟基对酶活力是必需的,是酶的必需基团。
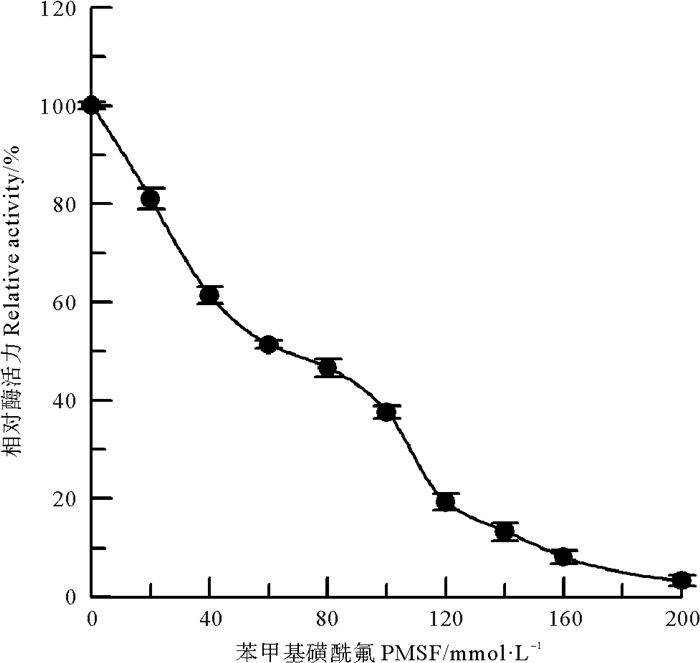
|
图 5 PMSF对中国鲎NAGase的修饰作用 Fig. 5 Modification of NAGase from T. tridentatus by PMSF |
巯基基团是蛋白质分子中极易发生反应的侧链基团,其中有机汞试剂是最早使用的巯基修饰试剂,其中pCMB能专一修饰酶蛋白中半胱氨酸巯基[12]。选用有机汞试剂pCMB对中国鲎NAGase进行化学修饰,结果(见图 6)表明,NAGase经pCMB化学修饰后,酶活力发生较大变化,当修饰剂pCMB浓度达到0.5 mmol/L时,NAGase活力已丧失83.4%,NAGase活力下降应该是由于半胱氨酸巯基被修饰后酶蛋白的空间构象发生变化所致,说明半胱氨酸巯基是中国鲎NAGase活性的必需基团。
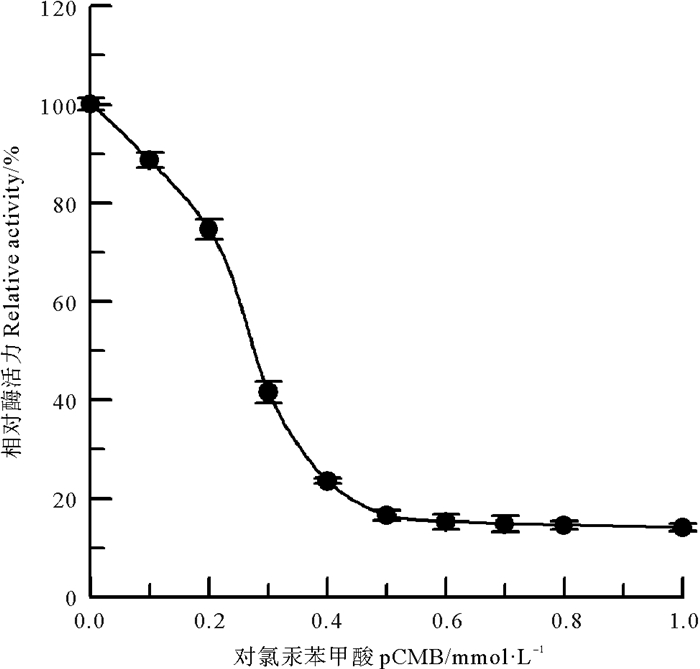
|
图 6 pCMB对中国鲎NAGase的修饰作用 Fig. 6 Modification of NAGase from T. tridentatus by pCMB |
在偏碱性条件下,常用DTT将蛋白质中的二硫键还原成游离巯基,对其进行特异性的化学修饰[12]。DTT对中国鲎NAGase酶蛋白的化学修饰结果如图 7所示,可见随着修饰剂DTT浓度的提高,NAGase活力呈不断下降趋势,当DTT浓度达120 mmol/L时,酶活力则丧失了81.3%。DTT还原了NAGase酶蛋白中的二硫键,而二硫键的还原导致酶蛋白的空间构象发生改变,从而使酶催化活力发生改变。说明中国鲎NAGase酶蛋白中的二硫键与酶活力密切相关,其二硫键在维系酶蛋白的三维空间构象中起重要作用。
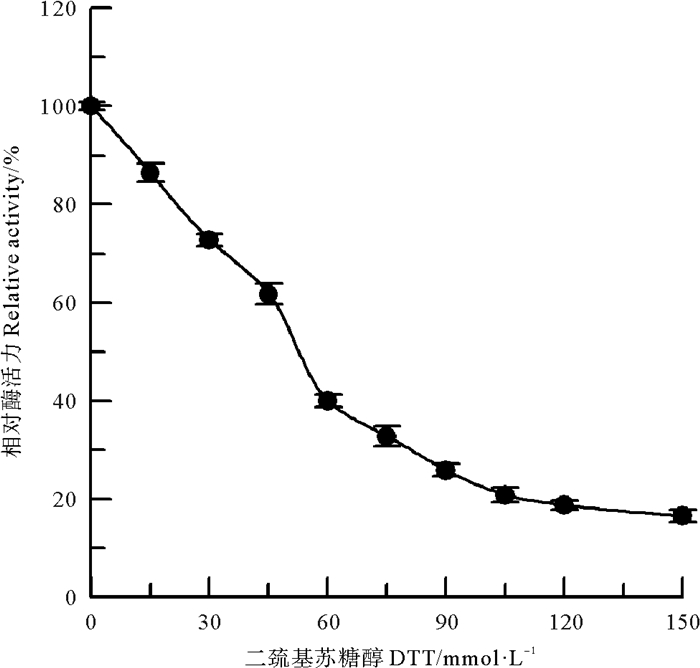
|
图 7 DTT对中国鲎NAGase的修饰作用 Fig. 7 Modification of NAGase from T. tridentatus by DTT |
精氨酸残基含有一个呈碱性的胍基,酶活性部位的胍基能结合带有阴离子的底物,乙酰丙酮则能专一地修饰酶蛋白精氨酸残基中胍基[13],在偏碱性条件下,乙酰丙酮与胍基相互作用后改变了精氨酸侧链基团的结构,从而影响酶蛋白的性质,导致与底物的亲和力发生变化。在本试验中,发现乙酰丙酮在0~140 mmol/L浓度范围内,中国鲎NAGase经乙酰丙酮修饰后酶活力基本没有变化,说明精氨酸胍基与NAGase活性无关,精氨酸胍基不是中国鲎NAGase活性的必需基团。
2.7 咪唑基的化学修饰组氨酸咪唑基是许多酶活性部位的组成部分,在偏酸性的条件下,BrAc对酶蛋白中组氨酸残基进行取代反应,生成羧甲基衍生物,可以特异性修饰蛋白质中的组氨酸咪唑基[11]。BrAc对中国鲎NAGase的化学修饰结果(见图 8)表明,当BrAc浓度达到150 mmol/L时,NAGase活力只剩5.4%,几乎丧失酶活力。进一步采用IAc作为中国鲎NAGase组氨酸咪唑基的化学修饰剂[10],结果如图 9所示,120 mmol/L IAc可使酶活力丧失93.5%。说明组氨酸咪唑基与中国鲎NAGase活力密切相关,组氨酸咪唑基是中国鲎NAGase活性所必需的。

|
图 8 BrAc对中国鲎NAGase活力的影响 Fig. 8 Modification of NAGase from T. tridentatus by BrAc |
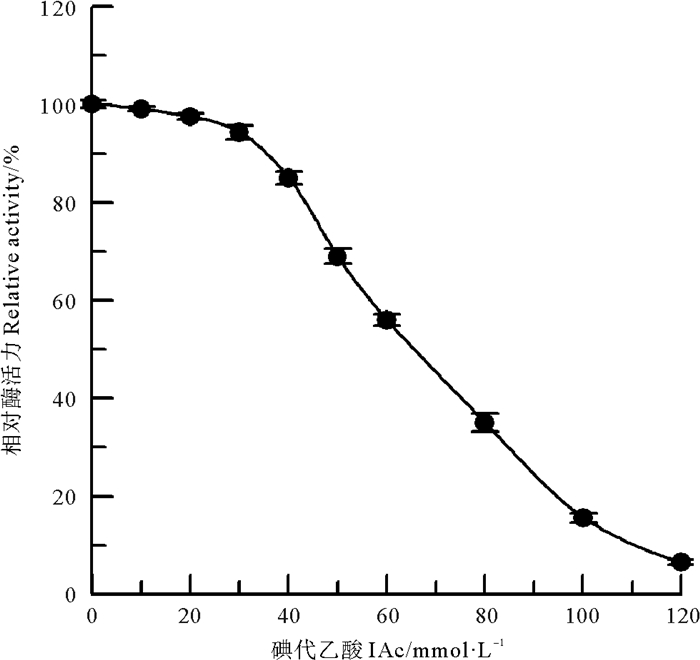
|
图 9 IAc对中国鲎NAGase活力的影响 Fig. 9 Modification of NAGase from T. tridentatus by IAc |
NBS是蛋白质中色氨酸的特异性修饰试剂,可使吲哚基团氧化成羟吲哚衍生物,导致蛋白质性质发生变化[7]。NBS化学修饰中国鲎NAGase的结果(见图 10)表明:经低浓度的NBS修饰后NAGase活力则迅速下降,25 μmol/L NBS修饰酶后,NAGase活力几近丧失,说明中国鲎NAGase色氨酸吲哚基被氧化后酶催化活力发生较大变化。

|
图 10 NBS对中国鲎NAGase的修饰作用 Fig. 10 Modification of NAGase from T. tridentatus by NBS |
此外,中国鲎NAGase经NBS修饰后,酶蛋白的紫外吸收光谱和荧光发射光谱强度也发生相应变化。在0~5 μmol/L浓度范围内,随着修饰剂NBS浓度的增大,NAGase酶蛋白在273 nm波长处的紫外吸收峰值逐渐降低,10 μmol/L NBS下紫外吸收峰消失(见图 11)。而NAGase酶蛋白内源荧光发射光谱峰在330.9 nm波长处,但NBS修饰后NAGase酶蛋白的荧光强度发生变化(见图 12),随修饰剂NBS浓度增大,酶蛋白荧光强度呈不断下降趋势,荧光发射光谱峰出现向短波长移动(“蓝移”)现象,20 μmol/L NBS使NAGase酶蛋白的荧光发射几近焠灭,说明NBS对NAGase的生色基团——色氨酸的苯环修饰后,酶蛋白的空间构象发生较大变化,导致酶活力丧失;由于苯环共轭体系破坏,加上Trp残基经NBS修饰后其疏水性可能有所增强,导致荧光发射光谱峰发生“蓝移”现象,随着NBS浓度增大,“蓝移”越多[14-15]。上述结果表明:色氨酸是中国鲎NAGase活性的必需基团。
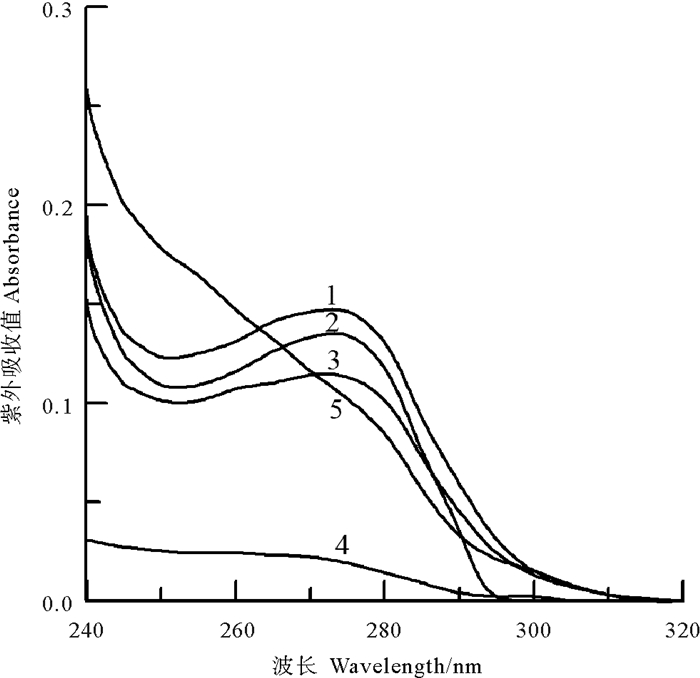
|
(曲线1~5:NBS浓度分别为0、2、3、5、10 μmol·L-1。The final concentrations of NBS were 0, 2, 3, 5 and 10 μmol·L-1 for curves 1~5, respectively.) 图 11 中国鲎NAGase在NBS中的紫外吸收光谱 Fig. 11 UV absorption spectra of NAGase from T. tridentatus modified by NBS |
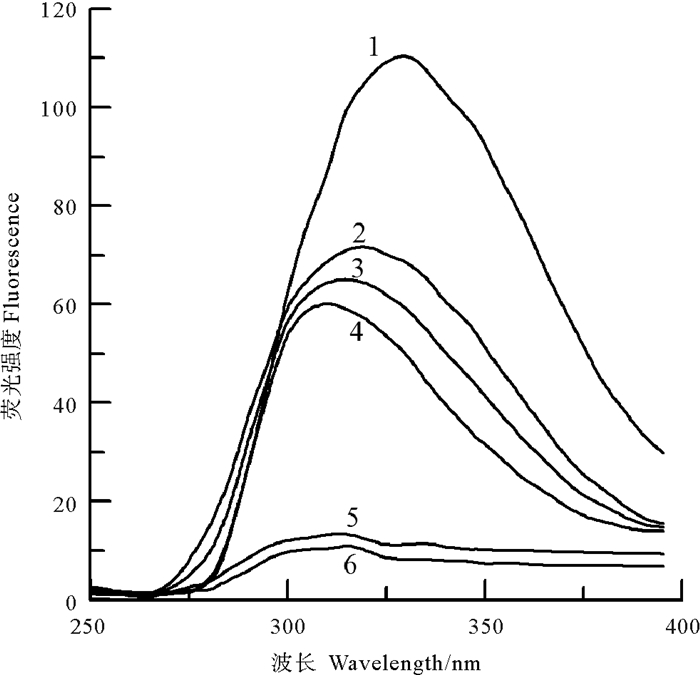
|
(曲线1~6, NBS浓度分别为0、2、5、10、15、20 μmol·L-1。The final concentrations of NBS were 0, 2, 5, 10, 15 and 20 μmol·L-1 for curves 1~6, respectively.) 图 12 中国鲎NAGase在NBS中的内源荧光发射光谱 Fig. 12 Fluorescence emission spectra of NAGase from T. tridentatus modified by NBS |
蛋白质化学修饰法已广泛应用在酶蛋白活性基团的研究中。石艳等[12]采用化学修饰法研究了菜青虫(Pieris brassicae)表皮NAGase活性的必需基团,结果表明:半胱氨酸(Cys)的巯基、色氨酸(Trp)的吲哚基、组氨酸(His)的咪唑基是NAGase的必需基团;精氨酸(Arg)残基及赖氨酸(Lys)的ε-氨基不是菜青虫NAGase的必需基团。Jin等[7]也研究了锯缘青蟹(Scylla serrata)内脏NAGase的必需基团,结果显示Trp的吲哚基、His的咪唑基、Lys的ε-氨基是NAGase活性所必需的,Arg胍基和二硫键则不是锯缘青蟹NAGase的必需基团。Xie等[8]对凡纳滨对虾(Litopenaeus vannamei)NAGase的必需基团研究表明:Trp的吲哚基、His的咪唑基、Lys的ε-氨基是NAGase活性所必需的,而Arg胍基和二硫键不是凡纳滨对虾NAGase活性所必需的。此外,林心宇等[16]研究了槐猪精液中NAGase的功能基团,研究判断Cys的巯基、Trp的吲哚基、His的咪唑基以及Lys的ε-氨基是NAGase活性中心的功能基团,二硫键也是槐猪精液NAGase活性所必需的,但Arg的胍基不是酶活性所必需的基团。前已研究的蝾螺(Turbo cornutus Solander)[11]内脏NAGase的必需基团,发现Cys巯基和丝氨酸(Ser)羟基不是酶活性的必需基团,而Trp的吲哚基、Lys的ε-氨基是蝾螺NAGase活性部位的必需基团,而His的咪唑基是酶催化活性所必需的,但可能不处于酶的活性部位。
本研究结果表明:中国鲎NAGase中Lys ε-氨基、His咪唑基、Trp吲哚基和Ser羟基经化学修饰后,酶活力几近丧失,这些氨基酸基团判断为中国鲎NAGase活性的必需基团,且可能处于酶的活性部位;Cys巯基经修饰后酶活力下降,但不完全失活,说明Cys巯基是中国鲎NAGase催化活性所必需的,但可能不处于酶的活性部位;DTT修饰NAGase中的二硫键后,酶活力明显下降,证明二硫键在维系中国鲎NAGase酶蛋白三维空间构象中起重要作用;而Arg胍基经修饰后NAGase活性基本不变,说明Arg胍基不是中国鲎NAGase的必需基团。
总之,从不同生物来源NAGase酶蛋白的必需基团分析,Trp的吲哚基、His的咪唑基是大多数生物NAGase活性的必需基团,Arg胍基、Lys的ε-氨基、Cys巯基和二硫键在不同生物来源的NAGase中发挥着不同作用。
| [1] |
Broadway R M, Williams D L, Kain W C, et al. Partial characterization of chitinolytic enzymes from Streptomyces albidoflavus[J]. Letters in Applied Microbiology, 1995, 20(5): 271-276. DOI:10.1111/j.1472-765X.1995.tb00444.x
(  0) 0) |
| [2] |
糜艳霞, 任慧, 张常, 等. 几丁质酶的研究进展[J]. 生命科学研究, 2015, 19(5): 437-443. Mi Y X, Ren H, Zhang C, et al. Advances in study and application on chitinase[J]. Life Science Research, 2015, 19(5): 437-443. (  0) 0) |
| [3] |
吕黎, 宁黔冀. 甲壳动物几丁质酶基因结构与功能的研究进展[J]. 生理科学进展, 2011, 42(6): 457-459. Lü L, Ning Q J. Advances in crustaceans chitinase gene structure and function research[J]. Progress in Physiological Sciences, 2011, 42(6): 457-459. (  0) 0) |
| [4] |
黄乾生, 陈超琪, 谢晓兰, 等. 凡纳滨对虾内脏几丁质酶基因的克隆、序列分析与结构预测[J]. 台湾海峡, 2009, 28(3): 355-359. Huang Q S, Chen C Q, Xie X L, et al. Cloning, sequence and structure analysis for the chitinase gene in the viscera of Litopenaeus vannamei[J]. Journal of Oceanography in Taiwan Strait, 2009, 28(3): 355-359. (  0) 0) |
| [5] |
Fan X J, Yang C, Zhang C, et al. Cloning, site-directed mutagenesis, and functional analysis of active residues in Lymantria dispar chitinase[J]. Applied Biochemistry & Biotechnology, 2017, 184(1): 12-24.
(  0) 0) |
| [6] |
Lu Y M, Zen K C, Muthukrishnan S, et al. Site-directed mutagenesis and functional analysis of active site acidic amino acid residues D142, D144 and E146 in Manduca sexta(Tobacco hornworm) chitinase[J]. Insect Biochemistry and Molecular Biology, 2003, 32(11): 1369-1382.
(  0) 0) |
| [7] |
Jin Z X, Zhang J P, Yan Y W, et al. Studies on the chemical modification of the essential groups of N-acetyl-β-d-glucosaminidase from viscera of green crab(Scylla serrata)[J]. Applied Biochemistry & Biotechnology, 2008, 149(2): 119-127.
(  0) 0) |
| [8] |
Xie X L, Huang Q S, Wang Y, et al. Modification and modificatory kinetics of the active center of prawn β-N-acetyl-D-glucosaminidase[J]. Journal of Biomolecular Structure & Dynamics, 2009, 26(6): 781-786.
(  0) 0) |
| [9] |
林建城, 许恒棋, 罗新明. 中国鲎N-乙酰-β-D-氨基葡萄糖苷酶的分离纯化及酶学性质研究[J]. 中国海洋大学学报(自然科学版), 2017, 47(9): 62-69. Lin J C, Xu H Q, Luo X M. Study on purification and enzymatic characteristics of β-N-acetyl-D-glucosaminidase from the viscera of horseshoe crab(Tachypleus tridentatus)[J]. Periodical of Ocean University of China, 2017, 47(9): 62-69. (  0) 0) |
| [10] |
周海梦, 王洪睿. 蛋白质化学修饰[M]. 北京: 清华大学出版社, 1998: 26-32. Zhou H M, Wang H R. Protein Chemical Modification[M]. Beijing: Tsinghua University Press, 1998: 26-32. (  0) 0) |
| [11] |
Lin J C, Chen Q X, Shi Y, et al. The chemical modification of the essential groups of β-N-acetyl-D-glucosaminidase from Turbo cornutus Solander[J]. IUBMB Life, 2003, 55(9): 547-552. DOI:10.1080/15216540310001626601
(  0) 0) |
| [12] |
石艳, 刘炜风, 陈清西. 菜青虫N-乙酰-β-D-氨基葡萄糖苷酶活性必需基团的研究[J]. 厦门大学学报(自然科学版), 2006, 45(6): 851-854. Shi Y, Liu W F, Chen Q X. Studies on the essential groups of the β-N-acetyl-D-glucosaminidase from the cabbage butterfly(Pieris brassicae)[J]. Journal of Xiamen University(Natural Science), 2006, 45(6): 851-854. (  0) 0) |
| [13] |
张龙翔, 张庭芳, 李令援. 生化实验方法和技术[M]. 第二版. 北京: 高等教育出版社, 1997: 138-140. Zhang L X, Zhang T F, Li L Y. Method and Technology of Biochemistry[M]. 2nd edition. Beijing: Higher Education Press, 1997: 138-140. (  0) 0) |
| [14] |
初志战, 陈纪鹏, 刘小林, 等. 醇类有机溶剂对木瓜蛋白酶催化活性的影响机理[J]. 食品与生物技术学报, 2014, 33(10): 1112-1115. Chu Z Z, Chen J P, Liu X L, et al. Effect on catalytic activity and conformation of papain with four kinds of organic solvent[J]. Journal of Food Science and Biotechnology, 2014, 33(10): 1112-1115. (  0) 0) |
| [15] |
王静, 金征宇, 江波, 等. Aspergillus ficuum菊粉酶的荧光光谱研究[J]. 食品科学, 2009, 30(23): 237-241. Wang J, Jin Z Y, Jiang B, et al. Intrinsic fluorescence of Aspergillus ficuum inulinases[J]. Food Science, 2009, 30(23): 237-241. (  0) 0) |
| [16] |
林心宇, 章文, 沈林松, 等. 槐猪精液中N-乙酰-β-D-氨基葡萄糖苷酶功能基团的研究[J]. 黑龙江畜牧兽医, 2015(9): 85-88. Lin X Y, Zhang W, Shen L S, et al. Studies on the functional groups of the β-N-acetyl-D-glucosaminidase from semen of Huai pig[J]. Heilongjiang Animal Science and Veterinary Medicine, 2015(9): 85-88. (  0) 0) |
 2020, Vol. 50
2020, Vol. 50

