2. 东营市海盈水产品开发有限责任公司,山东 东营 257503
小刀蛏(Cultellus attenuatus)隶属软体动物门(Mollusca)双壳纲(Bivalvia)帘蛤目(Veneroida)刀蛏科(Cultellidae),在我国南北方沿海均有分布[1],是我国名贵贝类品种之一,小刀蛏作为新兴的贝类养殖品种,具有生长速度快、营养丰富、价格昂贵等特点,具有较高的经济价值和产业开发前景。目前我国小刀蛏人工育苗总体上还处于试验阶段,关于小刀蛏的研究也比较少,主要集中在营养分析、遗传多样性、繁殖发育等方面。徐加涛等[2]对小刀蛏软体的营养成分进行了分析,发现其软体部具有较高的食用价值和保健作用;曾国权等[3]对小刀蛏群体内同工酶的生化遗传进行了分析,发现其多态座位比例为52.38%,说明小刀蛏具有较强的遗传变异能力;王亚等[4]对小刀蛏的性腺、胚胎以及幼体发育进行了较系统研究,姜绪等[5]对莱州湾小刀蛏繁殖生物学进行了系统研究,顾忠旗等[6]对小刀蛏进行室内人工育苗研究,但出苗量极低。迄今为止,对于小刀蛏人工育苗的研究未见更多报道,育苗技术上存在亲贝蓄养困难、难培养的问题,针对这一问题,作者对小刀蛏室内育苗技术进行了改进和创新。2017年在莱州长渔水产有限公司进行了小刀蛏的人工育苗技术试验,取得了人工育苗的成功, 为其增殖放流及人工养殖工作的开展奠定了技术基础。
1 材料与方法 1.1 材料 1.1.1 育苗设施实验在莱州市长渔水产有限公司进行,育苗池规格为5.0 m×4.0 m×1.2 m,共20个。
1.1.2 亲贝来源小刀蛏采自山东省东营黄河三角洲自然海区, 从中挑选壳面完整、无机械损伤、软体部饱满的个体作亲贝。育苗时使用亲贝100 kg, 平均壳长7.5 cm。
1.1.3 育苗水质要求自然海水经沉淀、曝气后,再通过2次砂滤后方可使用。培育期间水温为自然海水温度, pH 8.0~8.2, 亲贝蓄养期间盐度26~30, 幼虫培育期间盐度为26~30,稚贝培育期间定期投喂微生态制剂调节水质。
1.1.4 育苗期投喂的饵料种类培育期间投喂的单胞藻有金藻(球等鞭金藻(Jsochrysis galbana)3011、叉鞭金藻(Dirateria inornate))、小硅藻(Nitzschia closterium)、角毛藻(Chaetoceros muelleri)、扁藻(Platymonas subcordiformis)和小球藻(Chlorella vulgaris)等。
1.1.5 附着基选择及处理亲贝蓄养期间的海泥和细沙均取自莱州市无污染海区,细沙经150目筛绢过滤,海泥是经200筛绢过滤,粒经在50~100 μm,使用时经10×10-6 mol/L浓度的高锰酸钾溶液消毒处理30 min后,冲洗2~3遍即可使用,而稚贝培育期间的海泥需用水煮沸消毒后再使用。
1.1.6 数据计算肥满度是按软体部湿重与体重比值百分比;成活率是统计结束时成活个体数与统计开始时数量的百分比;产卵率是产卵排精亲贝个数与育苗用总亲贝数百分比。
1.2 方法 1.2.1 亲贝培育将上述处理好的小刀蛏亲贝均匀放在池底铺10 cm厚的海泥育苗池内暂养,每天及时挑出不潜泥沙的亲贝。培育密度80个/m2, 培育水深80 cm, 连续充气。每日换水2次,每次换水量为总水体量的1/3~1/2;每日投喂6~8次,投喂种类为小硅藻和扁藻, 日投饵量为小硅藻(2~3)×105 cell/mL、扁藻(2~4)×104 cell/mL。并进行了小刀蛏亲贝不同运输方法及干露时间成活率以及亲贝在铺泥、铺沙和半泥半沙3种底质中培育情况的比较试验。
1.2.2 亲贝催产及孵化采用阴干+升温, 阴干+氨海水浸泡法催产及阴干+复合维生素浸泡3种方法诱导产卵、排精, 即将亲贝从培育池内捞起放入网箱里, 冲洗其排泄物和污垢, 阴干3 h, 放入氨水浓度为0.005%海水中以及复合维生素浓度为0.005%海水浸泡2 h后, 放入升温3~4 ℃加满过滤海水的育苗池里, 微量充气, 0.5~1.0 h后即能产卵、排精。当受精卵达一定数量后, 立即移到其他培育池中继续产卵, 然后进行1~2次的洗卵和分池孵化培育。
1.2.3 幼虫培育当受精卵发育到D形幼虫时, 立即用300目筛绢网选出进行培育, 培育水温为23~28 ℃, 密度5~6个/mL。日换水2次, 每次换水1/3~1/2培育水体, 换水后投饵, 壳顶幼虫前期投喂金藻(2~3)×104cell/mL;壳顶幼虫中后期混合投喂金藻(3~5)×104cell/mL和扁藻(0.5~1)×104 cell/mL。镜检观察幼虫胃肠饱满情况, 并及时调整饵料投喂量。每日检测幼虫生长情况。
1.2.4 采苗与附着基的投放当幼虫培育到壳顶后期, 此时幼虫出现眼点, 需要立即投附着基采苗,采苗时调整幼虫密度1~2个/mL。采用2种方法采苗:有底质采苗法, 附着基底质选择当地自然海区滩涂上无污染的海泥(经200目的筛绢过滤, 粒径50~100 μm), 经淘洗暴晒干燥后备用。使用时, 将海泥用海水煮沸, 冷却后投入育苗池中, 充气均匀后停气, 充分沉淀待用,厚度为2~3 mm;并进行与无底质采苗法和半泥半沙式采苗实验。
1.2.5 稚贝培育管理刚附着稚贝培育密度为(80~100)×104个/m2, 1.0 mm稚贝培育密度为(30~40)×104个/m2。稚贝培育期间投喂单胞藻以扁藻、小球藻、角毛藻为主, 金藻为辅,刚附着时日投喂量按金藻密度为(10~15)×104 cell/mL, 1~3 mm的稚贝日投喂量为度为(15~20)×104 cell/mL, 扁藻、小球藻和角毛藻按其大小换算。每日换水3次, 每次换水量1/3培育水体, 培育期间水温22~30 ℃。
附着后每7~10 d进行一次移池疏养, 第一次和第二次分池的附着基为200目筛绢筛的海泥, 厚度2~3 mm;从第三次分池开始, 附着基改为100目筛绢筛的粒径100~300 μm的海泥, 厚度3~5 mm。并根据池底残饵、污物多少, 对海泥底质进行更换并适时疏苗进行分池移养。期间开展无底质上升流培育稚贝试验和不同盐度(15,20,25,30和35)下培育稚贝试验。
2 结果与分析 2.1 亲贝培育情况经过30 d的蓄养培育, 小刀蛏亲贝培育的成活率为70%, 其死亡主要原因是采捕时和运输时造成的伤害, 因小刀蛏壳薄脆,运输和起捕时很易受伤。不同运输方法小刀蛏成活率分析见表 1。
|
|
表 1 小刀蛏亲贝不同运输方式成活率情况比较 Table 1 omparison on survival rate of Cultellus attenuatus in different transportation modes |
小刀蛏亲贝在亲贝蓄养期间,在0.2 m3的塑料水槽桶里各放了60个小刀蛏进行了不铺沙和泥,铺海泥,铺半沙半泥,铺细沙四类底质培养30 d效果比较。不同底质蓄养小刀蛏成熟效果比较如表 2,其中培育初期肥满度为40%。
|
|
表 2 小刀蛏亲贝不同底质培养效果比较 Table 2 Comparison on different sediments for Cultellus attenuatus parents |
从表 1看出, 不铺沙运输的小刀蛏死亡率明显高于铺沙死亡率(P < 0.05), 这主要是小刀蛏壳薄, 长途运输中相互之间磨擦导致贝壳易碎, 因此, 小刀蛏亲贝长途运输必须铺沙加冰, 且冰不能直接加在亲贝上。
从表 2可以看出,经过30 d不同底质的培养条件下,小刀蛏亲贝的肥满度之间具有显著差异(P < 0.05),其中铺海泥底质小刀蛏肥满度增加值最大;铺海泥和半泥半沙组的成活率显著高于不铺沙和泥组及铺细沙组(P < 0.05),4种底质培养条件下的产卵率均差异较大(P < 0.05)。
2.2 催产与孵化采用阴干+升温法,阴干+氨海水浸泡+升温法以及阴干+复合维生素浸泡+升温法3种方法诱导小刀蛏亲贝排精、产卵。受精卵卵径为55~60 μm, 属沉性卵。在海水盐度26的条件下, 当水温为23 ℃时, 受精卵经24 h发育到D形幼虫。不同催产方法催产效果比较见表 3。
|
|
表 3 不同催产条件催产效果比较 Table 3 Comparison on different spawning inductions |
由表 3可见, 3种诱导方法中,阴干+氨海水浸泡+升温法的小刀蛏诱导产卵的效果最好,其次是阴干+复合维生素浸泡+升温法,最差是阴干+升温法,孵化率是阴干+升温法和阴干+复合维生素浸泡+升温法最好,阴干+氨海水浸泡+升温法孵化率差些,但也较高。从生产角度考虑,阴干+氨海水浸泡+升温法诱导最佳。
2.3 幼虫培育在盐度30、投喂金藻的条件下, D形幼虫生长发育速度随水温不同而变化,在26 ℃幼虫生长发育进程如图 1所示。
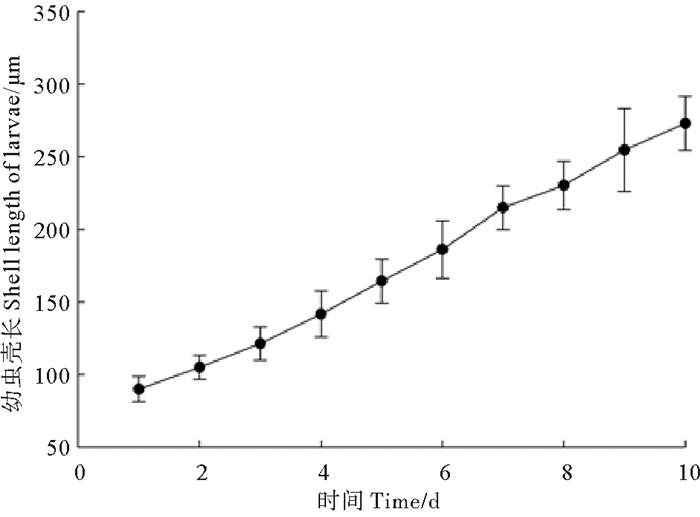
|
图 1 小刀蛏幼虫壳长生长情况 Fig. 1 Growth of Cultellus attenuatus larvae |
从图 1可以看出, D形幼虫经10 d生长发育到眼点幼虫, 此时幼虫壳长在265~270 μm,D形幼虫平均壳长日增长为20 μm左右。
2.4 附着采苗当幼虫发育至265 μm时,60%幼虫出现眼点, 进入附着变态前期, 立即将幼虫投放到已投放海泥附着基的培育池中, 观察到部分面盘萎缩; 壳长生长至320~350 μm时, 面盘脱落, 变态后营匍匐生活;在水温25~28 ℃条件下, 再经15~20 d的培育, 幼苗可生长到1 000 μm左右, 此阶段稚贝壳长日生长量为50~60 μm。无底质和有底质附苗效果比较如表 4所示。
|
|
表 4 小刀蛏眼点幼虫附着变态情况表 Table 4 Collection and metamorphism of Cultellus attenuatus eyespot larvae in different sediments |
从表 4可以看出, 无底质采苗在变态率和采苗数量与纯海泥底质采苗没有差异,比半沙半泥以及纯海沙高;但在采苗后生长速度方面无底质生长速度大大慢于海泥底质培育的生长速度,因此无底质采苗适合培育壳长小于500 μm前的培育,海泥底质在后期培育方面,在生长速度和成活率方面适合大规格苗种的培育。
2.5 稚贝培育 2.5.1 小刀蛏稚贝上升流培育模式试验在小刀蛏稚贝培育过程中, 进行了无底质上升流培育15 d后稚贝生长、成活效果与有底质培育效果的比较实验, 其结果见图 2、3。
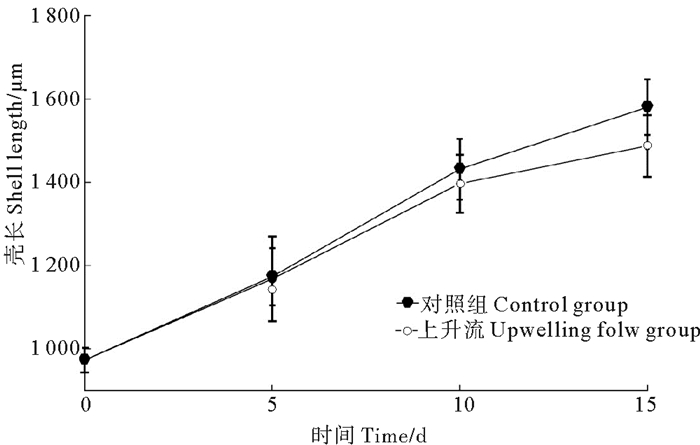
|
图 2 小刀蛏稚贝壳长在上升流培育过程中生长情况(P < 0.05) Fig. 2 Growth of Cultellus attenuatus juveniles in upwelling flow (P < 0.05) |
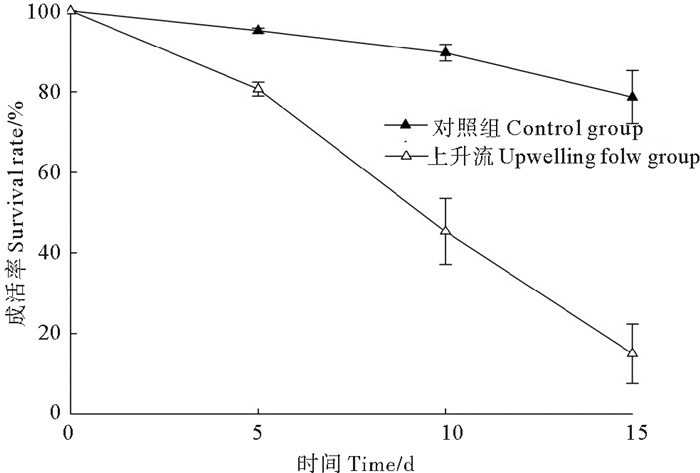
|
图 3 小刀蛏稚贝在上升流培育过程中成活情况(P < 0.05) Fig. 3 Survival rate of Cultellus attenuatus juveniles in upwelling flow (P < 0.05) |
从图 2和3可以看出, 小刀蛏稚贝在15 d上升流培育过程中, 壳长生长速度稍慢于对照组稚贝的生长速度, 但差异不明显;而无底质上升流成活率明显低于有底泥培养的对照组, 差异明显, 因此, 1 000 μm以上的小刀蛏稚贝不适宜上升流培育模式, 小刀蛏稚贝的培育需有一定厚度的底泥附着基培育。
从图 3可以看出, 小刀称稚贝在15 d上升流培育过程中, 前5 d的成活率可维持在80%以上, 但第10天的成活率大幅下降, 仅为45%, 15 d的成活率仅为15%。因此, 小刀蛏稚贝(壳长大于1.0 mm以上)培育不适合无底质上升流培育模式, 必须在有泥沙质底质中培育。
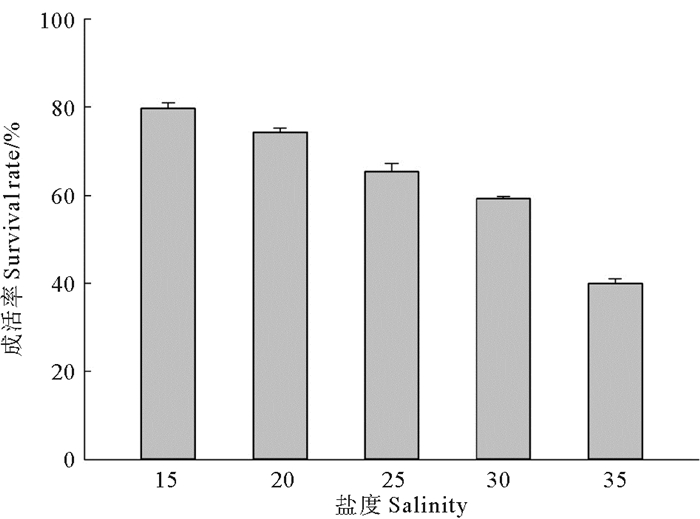
2.5.2 小刀蛏在不同盐度下培育条件下生长比较小刀蛏稚贝在泥底和不同盐度15, 20, 25, 30, 35, 培育15 d稚贝生长情况比较试验, 其结果见图 4、5。
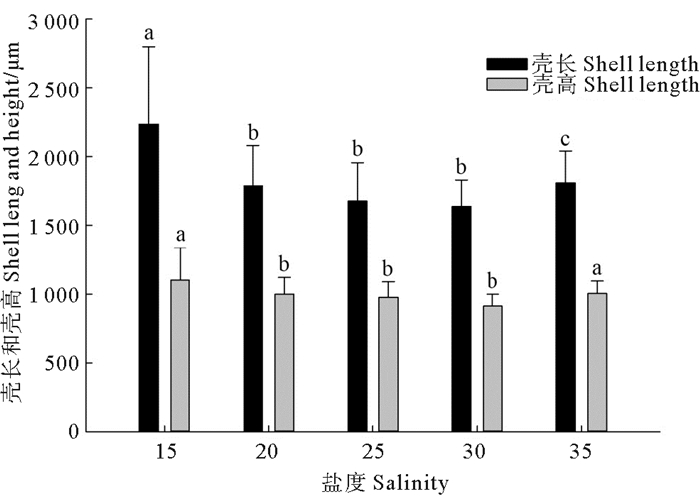
|
图 4 小刀蛏稚贝在不同盐度下生长比较 Fig. 4 Comparison on the growth of Cultellus attenuatus juveniles in different salinities |
|
图 5 小刀蛏稚贝不同盐度下成活率比较 Fig. 5 Comparison on the survival rate of Cultellus attenuatus juveniles in different salinities |
从图 4可看出, 小刀蛏稚贝适宜培育的盐度为15, 其次是20和30, 最差是35, 盐度15与其它盐度差异显著, 其它盐度之间差异不显著, 盐度35生长较好, 主要是死亡率高,培育密度大幅下降造成的。
从图 5可看出, 盐度15的成活率最好, 20次之, 35最低, 而且它们之间差异显著(P < 0.05)。
综上所述, 小刀蛏稚贝适宜盐度15~20,生长速度最快, 成活率最高。
2.5.3 小刀蛏育苗情况经过30 d的培育,将1 mm的稚贝培育至2~3 mm,每天换水2次, 每次1/2个水体, 投饵8次, 日投喂量(15~20)×104cell·mL·d-1, 8~12 d移池1次, 按照此培育过程, 稚贝成活率可达60%以上, 培育出3 mm以上的商品苗2 000万粒,取得比较好的育苗效果。
3 讨论 3.1 亲贝运输及室内蓄养培育的问题小刀蛏在运输过程中,由于小刀蛏外壳较薄脆,受到冲击和挤压易断裂或壳碎,从而造成小刀蛏伤害和死亡,是引起死亡的主要原因,因此,我们尝试小刀蛏亲贝在运输前和细沙混在一起,可以大大降低亲贝之间挤压或摩擦造成的伤害,运输成活率大大提高。这与薄片镜蛤(Dosinia laminata)[7]、四角蛤蜊(Mactra veneriformis)[8]、中国仙女蛤(Callista chinensis Holten)[9]、库页岛蛤蜊(Pseudocardium sachalinense)[10]等生活环境为泥沙底的贝类亲贝运输成活率高明显不同,主要是与这些贝类壳较硬,耐积压有关系, 而与大竹蛏(Solen grandis)[11]因生活底质为沙质底, 壳大比较硬, 也比较耐积压有关。
亲贝培育是育苗的关键,通过多年取样调查和解剖性腺观察发现, 山东黄河三角洲沿海小刀蛏自然繁殖季节为6月,根据本研究也可以在繁殖季节前,提早入池通过室内升温促熟培育产卵,小刀蛏适宜做亲贝的规格为壳长6~8 cm, 个体活力好且排卵量大, 能获得大批优质受精卵。
小刀蛏亲贝蓄养发育慢、死亡率较高, 除了与运输有关外,另一原因是亲贝蓄养必须在有纯海泥底质中和有少量细沙的泥沙质底泥中培育,纯沙底质成活率较低的原因是小刀蛏壳薄,潜沙后对壳和软体部及足的伤害较大,引起死亡,这也是小刀蛏为何必须用海泥做附着基、与大竹蛏亲贝蓄养底质不同的主要原因[11-12]。而小刀蛏用海泥做附着基,海泥极易引起水质变化,所以,在海泥中加小量的细沙、加大换水和勤更换底泥是保证其亲贝蓄养成活率的关键。
3.2 适宜诱导小刀蛏产卵适宜方法的问题目前诱导扇贝、牡蛎产卵、排精的方法主要是阴干、升温法,在生产中小刀蛏采用此法效果较差,我们按照中国仙女蛤、库页岛蛤蜊、菲律宾蛤仔(Ruditapes philippinarum)和缢蛏(Sinonovaculla constricta)育苗[9-10, 13-14]中使用阴干、升降温及氨海水浸泡的方法,和我们改进的阴干、复合维生素浸泡法,诱导效果明显比阴干、升温刺激及氨海水浸泡法好,基本解决了小刀蛏产卵的问题,而且对亲贝刺激较少,受精卵孵化率高, 这主要是因维生素和氨海水能促进卵细胞成熟, 经阴干和升温刺激就可以大批产卵、排精, 这与王昭萍[15]和邸伟鹏[16]在牡蛎和扇贝体外促熟培育中使用的维生素和氨海水的原理相一致。在诱导产卵方法选择上,首先要保证产出更多质量好的卵子,孵化率高,其次对种贝伤害少,诱导后种贝活力可迅速恢复。不管哪种方法诱导催产,都要根据亲贝性腺的成熟程度来掌握,要因种和发育程度而定,发育程度好易催产,发育程度差,即使使用多种方法催产也不成功,甚至把不成熟卵子催出,受精率、孵化率也较低,不利于幼虫培养,因此,催产要根据种贝性腺的发育情况而定。
3.3 不同附着基采苗效果探讨采苗时机和如何采苗是提高附着变态率的关键。本育苗过程中,主要采用4种采苗方法。第一种是无底质采苗,池中和池底部不放任何附着基, 优点是水质好、眼点幼虫变态率高,但附着变态后10 d内,需转入铺海泥的育苗池中,这样才能保证稚贝生长快和成活率高,与孔宁对库页岛蛤蜊[9]研究的结果一致;第二种是池底铺海泥采苗,池底铺有2~3 mm厚的海泥,海泥必须经过200目筛绢过滤并水煮后方可使用,虽然附着变态率较无底质稍差,但生长速度较快,并一直可以培育到商品规格,但不易长时间培养使用,需要经常更换海泥底质;第三种是半沙半泥底质采苗,采苗效果也比较好,但移池、筛苗由于沙的存在,易造成稚贝壳碎,引起死亡,稚贝培育死亡率较高;第四种是采用纯沙采苗培育,虽然稚贝干净,但不宜移池和分苗,死亡率也很高,从采苗效果、生长速度、生产操作和不伤害稚贝等方面考虑,纯海泥底质采苗效果和培育效果最好,这一结果与闫喜武在薄片镜蛤[7]、赵玉明[17]在青蛤(Cyclina sinensis)育苗采用海泥附着基采苗效果一致,而与李长松[18]在青蛤、陈志在双线血蛤(Sanguinolvia diphos)[19]研究的底质对稚贝生长影响结果相似。
3.4 小刀蛏稚贝不同培育模式和盐度试验探讨小刀蛏稚贝培养时需在育苗池底部加入一定量的海泥底质进行培养。在实际生产过程中,海泥底质容易腐败,易造成小刀蛏稚贝的死亡,因此要不断的更新底质。又因小刀蛏稚贝壳薄,在更换底质时容易造成小刀蛏稚贝的损伤,增加死亡率。因此,本实验进行了无底质上升流培育实验。根据我们的试验,小刀蛏稚贝在1 mm以上, 采用无底质的上升流培育模式, 死亡率特别高, 因此, 此法不适合小刀蛏稚贝培育, 应探讨新的培育模式方法。
根据我们的盐度试验, 小刀蛏稚贝在低盐生活条件下, 生长速度和成活率高, 这和其亲贝生活环境和习性有关, 也和顾忠旗[6]的实验结果一致, 而盐度35生长速度快于20,25和30, 主要是因为其死亡率高, 剩下的培育密度低于其它盐度组, 造成生长速度快于其它组, 而低于15盐度组,这一结果与曹伏军[20]在文蛤稚贝培育、桑士田[21]在菲律宾蛤仔稚贝培育的盐度实验相似,主要这二种贝类与小刀蛏的生活环境相似有关。
因此,针对小刀蛏稚贝的特点,探讨一种新的稚贝培育模式和方法是下一步研究的重点之一。
4 结语本研究通过对小刀蛏的亲贝运输、室内促熟培育、人工诱导产卵、幼虫培育、采苗和稚贝培育的研究,初步解决了小刀蛏室内人工育苗的技术问题。按照此培育方法操作, 小刀蛏亲贝的成活率可达70%,稚贝培育成活率可达60%以上, 本研究成功培育出3 mm以上商品苗2 000万粒,为小刀蛏规模化人工育苗和增养殖奠定了基础。
| [1] |
徐凤山. 中国海双壳类软体动物[M]. 北京: 科学出版社, 1997: 188. Xu F S. The Bivalvia Mollusca in China Seas[M]. Beijing: Science Press, 1997: 188. (  0) 0) |
| [2] |
徐加涛, 徐国成, 许星鸿, 等. 小刀蛏软体部营养成分分析及评价[J]. 食品科学, 2013, 17: 263-267. Xu J T, Xu G C, Xu X H, et al. Analysis of nutritional composition of edible parts of Cultellus attenuatus Dunker [J]. Food Science, 2013, 17: 263-267. (  0) 0) |
| [3] |
曾国权, 方军, 贾守菊, 等. 小刀蛏群体内同工酶的生化遗传分析[J]. 水产科学, 2010, 11: 669-673. Zeng G Q, Fang J, Jia S J, et al. Biochemical genetic analysis of eight isozymes in intra-populations of razor clam Cultellus attenuatus[J]. Fisheries Science, 2010, 11: 669-673. DOI:10.3969/j.issn.1003-1111.2010.11.010 (  0) 0) |
| [4] |
王亚.小刀蛏性腺、胚胎及幼体发育研究[D].宁波: 宁波大学, 2012. Wang Y. Studies on Development of Gonads, Embryos and Youngs of Phaxas attenuatus(Bivalvia, Mollusca)[D]. Ningbo: Ningbo University, 2012. http://cdmd.cnki.com.cn/Article/CDMD-11646-1012051090.htm (  0) 0) |
| [5] |
姜绪, 韦秀梅, 冯艳微, 等. 莱州湾海域小刀蛏(Cultellus attenuatus)繁殖生物学研究[J]. 渔业科学进展, 2017, 38(6): 107-111. Jiang X, Wei X M, Feng Y W, et al. The reproductive biology of Cultellus attenuatus in the Laizhou Bay[J]. Progress Fishery Sciences, 2017, 38(6): 107-111. (  0) 0) |
| [6] |
顾忠旗, 倪梦麟, 周民栋, 等. 小刀蛏室内人工育苗技术研究[J]. 科学养鱼, 2017(6): 46-48. Gu Z Q, Ni M L, Zhou M D, et al. Research on indoor artificial breeding techniques of Cultellus attenuatus[J]. Scientific Fish Farming, 2017(6): 46-48. (  0) 0) |
| [7] |
闫喜武, 左江鹏, 张跃环, 等. 薄片镜蛤人工育苗技术的初步研究[J]. 大连海洋学院学报, 2008, 23(4): 268-272. Yan X W, Zuo J P, Zhang Y H, et al. Indoor artificial breeding of clam Dosinia laminata[J]. Journal of Dalian Fisheries University, 2008, 23(4): 268-272. (  0) 0) |
| [8] |
闫喜武, 张跃环, 霍忠明, 等. 北方沿海四角蛤蜊人工育苗技术的初步研究[J]. 大连海洋学院学报, 2008, 23(5): 348-252. Yan X W, Zhang Y H, Huo Z M, et al. Artificial breeding technique of clam Mactra veneriformis in Northern coast in China[J]. Journal of Dalian Fisheries University, 2008, 23(5): 348-252. (  0) 0) |
| [9] |
李碧全, 周小文, 陈明达, 等. 中国仙女蛤人工育苗试验[J]. 海洋渔业, 2011, 33(1): 53-58. Li B Q, Zhou X W, Chen M D, et al. The artificial breeding of Callista chinensis(Holten)[J]. Marine Fisheries, 2011, 33(1): 53-58. DOI:10.3969/j.issn.1004-2490.2011.01.009 (  0) 0) |
| [10] |
孔宁, 李琪, 丛日浩, 等. 库页岛厚蛤蜊的人工繁殖和胚胎发育[J]. 海洋科学, 2011, 35(10): 6-10. Kong N, Li Q, Cong R H, et al. Artificial reproduction and embryonic development of surf clam Pseudocardium sachalinense[J]. Marine Sciences, 2011, 35(10): 6-10. (  0) 0) |
| [11] |
王雪梅, 路宜华, 丰爱秀, 等. 大竹蛏健康苗种培育新模式的研究[J]. 水产养殖, 2012(8): 14-16. Wang X M, Lu Y H, Feng A X, et al. Study on the new model of healthy seedling breeding of Solen grandis[J]. Journal of Aquaculture, 2012(8): 14-16. DOI:10.3969/j.issn.1004-2091.2012.08.007 (  0) 0) |
| [12] |
宋贤亭, 于瑞海, 马培振, 等. 大竹蛏室内人工育苗技术研究[J]. 海洋湖沼通报, 2015(4): 56-60. Song X T, Yu R H, Ma P Z, et al. A study on the artificial indoor seeding raising of Solen grandis[J]. Transactions of Oceanology and Limnology, 2015(4): 56-60. (  0) 0) |
| [13] |
刘慧, 方建光, 朱建新, 等. 菲律宾蛤仔高密度育苗技术[J]. 海洋水产研究, 2005, 26(6): 28-33. Li H, Fang J G, Zhu J X, et al. Technique for high density artificial reproduction of Manila clam, Ruditapes philippinarum[J]. Marine Fisheries Research, 2005, 26(6): 28-33. (  0) 0) |
| [14] |
王如才, 王昭萍. 海水贝类养殖学[M]. 青岛: 中国海洋大学出版社, 2008. Wang R C, Wang Z P. Science of Marine Shellfish Culture[M]. Qingdao: Ocean University of China Press, 2008. (  0) 0) |
| [15] |
王昭萍, 王如才, 李洪刚, 等. 维生素及海水浸泡对牡蛎卵子的体外促熟作用[J]. 海洋湖沼通报, 1997(2): 70-75. Wang Z P, Wang R C, Li H G, et al. Improving maturation of eggs stripped form oyster, Crassostrea gigas[J]. Transactions of Oceanology and Limnology, 1997(2): 70-75. (  0) 0) |
| [16] |
邸炜鹏, 王昭萍, 于瑞海, 等. 氨海水与5-羟色胺对栉孔扇贝解剖卵的体外促熟作用[J]. 中国海洋大学学报(自然科学版), 2011, 41(4): 46-50. Di W P, Wang Z P, Yu R H, et al. Effect of ammonia seawater and 5-HT on maturation of oocyte stripped from scallop, Chlamys farreri[J]. Periodical of Ocean University of China, 2011, 41(4): 46-50. (  0) 0) |
| [17] |
赵玉明, 顾润润, 于业绍. 海泥附着基的青蛤工厂化育苗试验[J]. 南方水产, 2005(1): 54-56. Zhao Y M, Gu R R, Yu S Y. Experiment in industrial artificial breeding of Cyclina sinensis used sea mud as adherings substance[J]. South China Fisheries Science, 2005(1): 54-56. DOI:10.3969/j.issn.2095-0780.2005.01.009 (  0) 0) |
| [18] |
李长松, 房斌, 王慧, 等. 青蛤稚贝放养密度与底质中硫化物相关性研究[J]. 水产学报, 2006, 30(6): 796-800. Sun C S, Fang B, Wang H, et al. Correlativity study on aquiculture density of juvenile clam Cyclina sinensis and concentration of sulfide in sediment[J]. Journal of Fisheries of China, 2006, 30(6): 796-800. (  0) 0) |
| [19] |
陈志. 盐度、密度和底质对双线紫蛤幼贝存活及生长的影响[J]. 渔业研究, 2017, 39(1): 34-39. Chen Z. Effects of salinity, density and sediment on growth and survival of Sanguinolaria diphos juveniles[J]. Journal of Fisheries Research, 2017, 39(1): 34-39. (  0) 0) |
| [20] |
曹伏君, 刘志刚, 罗正杰. 海水盐度、温度对文蛤稚贝生长及存活的影响[J]. 应用生态学报, 2009, 20(10): 2545-2550. Cao F J, Liu Z G, Luo Z J. Effects of sea water temperature and salinity on the growth and survival of juvenile Meretrix meretrix Linnaeus[J]. Chinese Journal of Applied Ecology, 2009, 20(10): 2545-2550. (  0) 0) |
| [21] |
桑士田, 闫喜武, 杨鹏, 等. 菲律宾蛤仔稚贝最适生长环境条件的响应面法分析[J]. 水产学报, 2012, 36(9): 1410-1417. Sang T S, Yan X W, Yang P, et al. Response surface methodology for optimization of growth condition in juvenile Ruditapes philippinarum[J]. Journal of Fisheries of China, 2012, 36(9): 1410-1417. (  0) 0) |
2. Dongying Haiying Aquatic Product Limited Liability Company, Dongying 257503, China
 2019, Vol. 49
2019, Vol. 49

