2. 海水养殖教育部重点实验室(中国海洋大学),山东 青岛 266003
铜藻(Sargassum horneri)是西北太平洋沿岸的常见种类[1-2],在中国的分布北起辽宁大连,南至广东雷州半岛,呈不连续分布[3-4]。铜藻在浅海区域可形成藻场,为多种经济鱼类和鲍鱼、蝾螺等无脊椎动物提供产卵和育幼的场所[5]。铜藻藻场对水域环境中污染物的净化[6]和水流的稳定[7]也有重要贡献。同时,铜藻也具有较高的经济价值,在东亚国家常用作食物[8];从铜藻中提取的岩藻黄素和海藻酸钠、岩藻多糖硫酸酯等多糖类物质的生物活性物质被用来制作药品和化妆品等[9-14];铜藻粉末对重金属、有机染料等都有很好的吸附作用[15-16]。
定生的铜藻随着藻体的生长,增长的气囊所具有的浮力会持续升高,渐渐高于其固着器的固着力,最后发生断离,形成了漂浮型种群[17]。近年来,随着近海富营养化日益严重,漂浮型种群数量急剧上升,甚至在东海和黄海引发了大面积的金潮,对东海和黄渤海的海水养殖、旅游和生态环境造成了较大破坏[18]。根据mtDNA的分析结果显示,近年大量出现在韩国济州岛沿岸的漂浮铜藻,与出现在中国东海的铜藻属于同一种群,而与韩国本地种在遗传基因中存在较大差别[19]。铜藻引发的金潮灾害对黄渤海沿岸的经济海藻如海带、裙带菜等的养殖也造成极大的威胁。
裙带菜(Undaria pinnatifida)为潮下带大型褐藻,具有很高的经济价值及药用价值[20]。裙带菜是中国海水养殖经济海藻之一,大规模养殖于中国辽宁省和山东省,年产量在40万~50万t[21]。裙带菜的养殖主要采用筏架养殖的方式,而漂浮型铜藻在漂移的过程中,常常会受到养殖设施的阻截,有的缠绕在养殖筏架上,有的漂浮在筏架间的水面上。这些漂浮型铜藻栖息在浅海区的水表层,通过遮阴或者争夺营养盐等多种方式与养殖海藻产生种间竞争,从而影响养殖海藻的产量和品质。2016年12月,东沙的紫菜养殖区受到了漂浮型铜藻的袭击;2017年盐城、南通二市的紫菜生产受铜藻爆发的影响大幅度减产[18];在山东荣成和青岛地区,海带和裙带菜的生产也不同程度地受到漂浮型铜藻的影响。然而,漂浮型铜藻何时影响和如何影响裙带菜的养殖却尚未见报道。
本研究选取了3个生长阶段的养殖裙带菜及同期出现的漂浮型铜藻作为研究对象,通过比较漂浮型铜藻和养殖裙带菜在相同环境条件下的光合作用、生长和物质积累等生理生态学特性的差异,来分析2种褐藻在种间竞争上的优劣势,以此来评估漂浮型铜藻对裙带菜养殖造成的影响。
1 材料与方法 1.1 样品的采集与处理漂浮型铜藻和养殖裙带菜样品均采自山东荣成石岛(36°07′N, 120°19′E)。采集时间分别为2016年1、4和10月。不同的月份,藻体处于不同的生长阶段。对于裙带菜而言,1月为裙带菜的快速生长期,4月为成熟期,10月为幼苗期。对于铜藻而言,1和10月为铜藻的缓慢生长期,4月为铜藻的快速生长期。同时,测量采集地的水温。2016年1月的水温4.8 ℃,4月的水温为6.2 ℃,10月的水温为19.8 ℃。
将铜藻和裙带菜样品反复用过滤后高压灭菌的海水冲洗,去除藻体表面的附着物。铜藻自主枝或侧枝顶端切下长约3 cm的藻段,1和4月的裙带菜自生长点部位用打孔器打下直径约1.4 cm的圆形藻片,10月的裙带菜使用自苗绳上切下的完整的幼孢子体作为实验材料。所有藻段和藻片分别置于装有灭菌海水的锥形瓶中,放入光照培养箱(GXZ-280D,宁波江南仪器厂)中进行充气暂养,以便切口愈合。暂养水温为采集地的水温,光强90 μmol·m-2·s-1,光暗比12L∶12D,每天更换灭菌海水,暂养3 d。
1.2 漂浮型铜藻和养殖裙带菜的光合速率对于生活在海水表层的漂浮型铜藻和养殖裙带菜,水温和光照强度是影响光合作用的两个重要环境因子。因此,实验设置了4个温度梯度(5、10、15和20 ℃)和3个光照强度梯度(30、180和360 μmol·m-2·s-1)共12个组合,在每个组合下测定2种样品的光合速率,每个组合3个平行。
随机选取2~3片裙带菜藻片或铜藻藻段,放入盛有灭菌海水的密闭瓶中,使用光纤测氧仪(Firesting O2, Pyro Science)测定藻体在各温度和光照条件下的海水中氧气浓度的变化。每分钟测定1次,共测定15 min。为使测定更加准确,测定期间需外加磁力搅拌器进行缓慢的搅拌,以保证溶解氧分布均匀,测定表观光合速率v1(以析氧速率表示),之后在黑暗条件下测定藻体的呼吸速率v2(以析氧速率表示),实验结束后,测定藻体重量,并根据以下公式计算总析氧速率,作为光合速率:
| $ v = \left( {{v_1} - {v_2}} \right)/W。$ |
式中:v为光合速率(μmol·h-1·g-1);v1为表观光合速率(μmol·h-1);v2为呼吸速率(μmol·h-1);W为藻体湿重(g)。
1.3 漂浮型铜藻和养殖裙带菜的生长通过12 d的培养实验来测定2种褐藻的生长上的差异。培养实验设置了2个温度梯度(每一阶段的实验温度设置为与当月采集地水温相接近的2个温度,即1和4月为5和10 ℃,;10月为15和20 ℃)、3个光照强度梯度(30、90和180 μmol·m-2·s-1)、3种培养模式(铜藻单养、裙带菜单养、铜藻与裙带菜混养),共18个处理组,每个处理组3个平行,只有混养状态每个处理组4个平行。
随机选取4个裙带菜藻片、或4个铜藻藻段、或2个裙带藻片和2个铜藻藻段,测定湿重后,分别转移至盛有500 mL培养液的充气培养瓶中,再将所有培养瓶放入光照培养箱中,进行充气培养。每3 d更换培养液,每日观察藻段生长情况。
1.3.1 特定生长率的测定实验开始和结束时记录每个实验组所有藻体的湿重,并根据以下公式计算湿重的特定生长率(Specific growth rate, SGR):
| $ {\rm{SGR}} = \left( {\ln {W_t} - \ln {W_0}} \right)/t \times 100\%。$ |
式中:W0为实验开始时4个藻段的总湿重(g);Wt为实验结束时4个藻段的总湿重(g);t为实验进行的时间(d)。
1.3.2 总碳含量和总氮含量的测定从每个处理组中随机选取3个藻段,进行氮含量和碳含量的测定。将藻段用蒸馏水冲洗后,放入80 ℃烘箱,烘至恒重后,研磨成粉末,取2 mg左右的藻粉,使用元素分析仪(Vario EL Ⅲ, Elementar, Germany)测定藻体的总碳含量和总氮含量。
1.3.3 叶绿素a和叶绿素c的测定从每个实验组中随机选取3个藻段,进行叶绿素a和c的测定[22]。藻体使用蒸馏水快速冲洗并吸干,准确称量藻体质量(0.2 g),使用2 mL二甲基亚砜进行第一次萃取,萃取时间为5 min,将溶液完全倒出,加入0.5 mL蒸馏水,混匀后,测定溶液在波长665、631、582和480 nm处的吸光。再加入3 mL丙酮进行第二次萃取,萃取时间为2 h,将溶液完全倒出,加入1 mL的甲醇和1 mL蒸馏水,测定溶液在波长664、631、581和470 nm处的吸光值。计算公式为:
| $ \begin{array}{l} {\rm{Chl}}\;a = [({A_{665}}/72.8) \times {V_1} + ({A_{664}}/73.6) \times {V_2}]/(I \times W), \\ {\rm{Chl}}\;c = [({A_{631}} + {A_{582}} - 0.297 \times {A_{665}})/61.8 \times {V_1} +\\ (A{\prime _{631}} + {A_{581}} - 0.300 \times {A_{664}}){\rm{ }}/62.2 \times {V_2}]/(I \times W)。\end{array} $ |
式中:Chl a为叶绿素a浓度(mg·g-1);Chl c为叶绿素c浓度(mg·g-1);A665、A664、A631、A582、A581分别为波长在665、664、631、582和581处的吸光值,A631代表第一次萃取后在631 nm波长下的光密度值,A′631代表第二次萃取后在波长为631 nm下的光密度值;V1为第一次萃取液的体积;V2为第二次萃取液的体积;I为光径(cm);W为藻体湿重(g)。
1.4 数据分析使用SPSS 23.0软件进行数据统计和分析,采用One-Way ANOVA和T-test检验法进行分析。以P < 0.05作为差异显著标准。
2 实验结果 2.1 漂浮型铜藻和养殖裙带菜光合作用的差异温度和光照强度对不同生长阶段的漂浮型铜藻和养殖裙带菜的光合速率均有显著影响(见图 1)。在裙带菜的快速生长期和成熟期,随着温度的升高,各光照强度下裙带菜的光合速率基本均呈现先上升后下降的趋势,最大光合速率分别出现在10和15 ℃,且180 μmol·m-2·s-1下的光合速率显著高于其他两个光照强度下的值。在幼苗期随着温度升高,各种光照强度下裙带菜的光合速率均呈现不断升高的趋势,最大光合速率出现在20 ℃,且180和360 μmol·m-2·s-1下的光合速率显著高于30 μmol·m-2·s-1。铜藻的光合速率在1和4月有相似的变化趋势,随温度的上升先上升后下降,最大光合速率均出现在温度15 ℃、光照强度360 μmol·m-2·s-1条件下。10月铜藻的光合速率随温度升高而一直升高,最大光合速率均出现在温度15 ℃、光照强度360 μmol·m-2·s-1条件下。2种藻体进行比较,裙带菜的光合速率在幼苗期高于铜藻,快速生长期与铜藻持平,成熟期则低于铜藻。
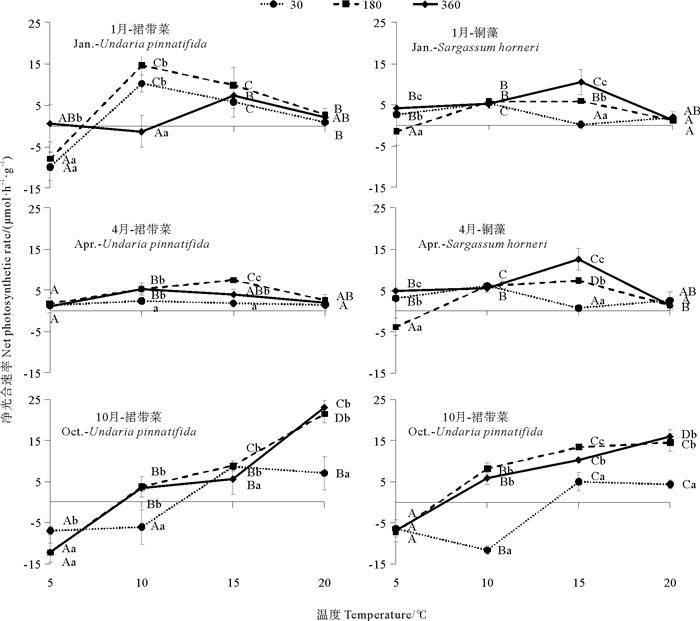
|
( 不同小写字母表示光照强度间的显著差异,不同大写字母表示温度间的显著差异。差异显著水平为P < 0.05。Different small letters indicate significance levels at P < 0.05 among light intensity. Different capital letters indicate significance levels at P < 0.05 among temperature. ) 图 1 三个阶段的漂浮型铜藻和养殖裙带菜在不同的温度和光照强度下的光合速率 Fig. 1 Net photosynthetic rates of drifting S. horneri and cultured U. pinnatifida at three stages under different temperature and light intensity |
漂浮型铜藻和养殖裙带菜在不同光照强度、温度和培养模式下培养12 d后的SGR见图 2。幼苗期的养殖裙带菜的SGR高于快速生长期和成熟期。光照强度对快速生长期和幼苗期裙带菜有影响,90 μmol·m-2·s-1和大部分180 μmol·m-2·s-1下的SGR显著高于30 μmol·m-2·s-1(P < 0.05)。除了个别数值外,温度对SGR影响不显著(P>0.05)。单养裙带菜的SGR显著高于裙带菜与铜藻混养的现象大多出现在快速增长期的30和180 μmol·m-2·s-1处理组,以及成熟期的30 μmol·m-2·s-1处理组;而与混养裙带菜的SGR高于单养裙带菜的现象则多出现在幼苗期的各处理组中。4和10月的铜藻在90和180 μmol·m-2·s-1下的SGR大致相似,而1月的SGR次之。随着光照强度增加,铜藻SGR逐渐提高,这种现象在10 ℃处理组最为显著(P < 0.05)。温度对1和4月的铜藻的SGR有显著影响(P < 0.05),SGR随温度的升高而增加。培养模式仅对4月的部分实验组的铜藻SGR有影响,单独培养的铜藻的SGR大于与裙带菜混合培养的铜藻。2种藻类相比较,成熟期的裙带菜的SGR显著低于同时期的铜藻,快速生长期的裙带菜的SGR显著高于同时期铜藻(P < 0.05)。
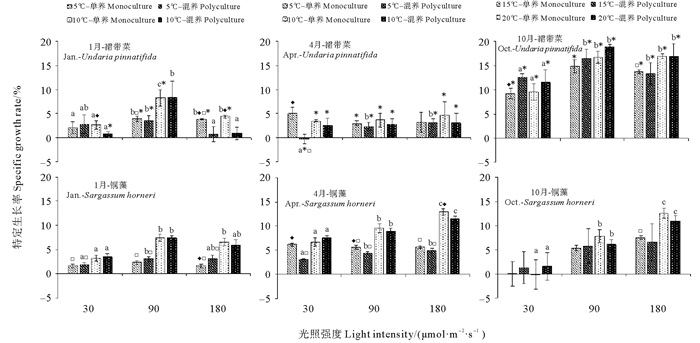
|
( 不同的字母表示光照强度间的显著差异,星号表示海藻种类间的显著差异,菱形表示培养模式间的显著差异,空心正方形表示温度间的显著差异。差异显著性水平为P < 0.05。下图同。Different letters indicate significance levels at P < 0.05 among light intensity. Asterisks indicate significance levels at P < 0.05 among algal species. Diamonds indicate significance levels at P < 0.05 among culture pattern. Blank squares indicate significance levels at P < 0.05 among temperature.The following figures are in the same description. ) 图 2 三个阶段的漂浮型铜藻和养殖裙带菜在不同的温度、光照强度和培养模式的组合下培养12 d后的特定生长率 Fig. 2 The specific growth rates of of drifting S. horneri and cultured U. pinnatifida at three stages cultured for 12 days under different combination of temperature, light intensity and culture pattern |
漂浮型铜藻和养殖裙带菜在不同光照强度、温度和培养模式下培养12 d后的总碳含量如图 3所示。幼苗期的裙带菜的碳含量显著低于快速生长期和成熟期的碳含量(P < 0.05),光照强度对不同生长阶段的裙带菜的碳含量有一定影响,温度的升高会使快速生长期和成熟期的部分实验组的裙带菜的碳含量升高,培养模式仅对快速生长期和成熟期的个别实验组有显著影响。铜藻的碳含量各月份差异显著(P < 0.05),1月的碳含量最高,4月的次之,10月的碳含量最低,光照强度对不同月份的铜藻的碳含量有显著影响(P < 0.05),温度的升高会使1月份单独培养的铜藻的碳含量显著下降(P < 0.05),培养模式仅对4和10月的个别实验组有显著影响。在裙带菜的快速生长期和成熟期时,裙带菜的碳含量高于同时期的铜藻的碳含量,在裙带菜的幼苗期时,铜藻的碳含量高于裙带菜的碳含量(P < 0.05)。
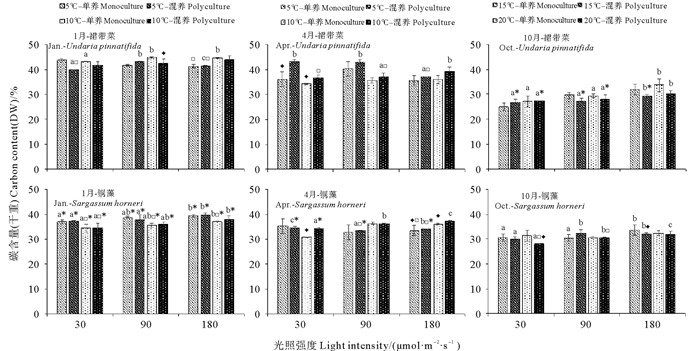
|
图 3 三个阶段的漂浮型铜藻和养殖裙带菜在不同的温度、光照强度和培养模式的组合下培养12 d后的总碳含量 Fig. 3 The carbon contents of drifting S. horneri and cultured U. pinnatifida at three stages cultured for 12 days under different combination of temperature, light intensity and culture pattern |
漂浮型铜藻和养殖裙带菜在不同光照强度、温度和培养模式下培养12 d后的总氮含量如图 4所示。总体来看,幼苗期的裙带菜氮含量低于快速生长期和成熟期的氮含量。快速生长期各实验组裙带菜的氮含量几乎没有显著差异(P>0.05);成熟期时光照强度和温度对氮含量影响显著(P < 0.05);幼苗期光照强度的增加能够使混合培养的裙带菜氮含量下降(P < 0.05)。1月的铜藻氮含量高于4月和10月的氮含量。1月时,在单独培养的条件下,光照强度对氮含量影响显著(P < 0.05);4月时,在大多数实验组中,温度和培养模式对氮含量影响显著(P < 0.05);10月时,培养模式对20 ℃光照强度为90和180 μmol·m-2·s-1的铜藻的氮含量有显著影响(P < 0.05)。2种藻类比较,在裙带菜的快速生长期,2种海藻的氮含量相差不大;在裙带菜的幼苗期和成熟期,铜藻的氮含量在大多数实验条件下均高于裙带菜(P < 0.05)。
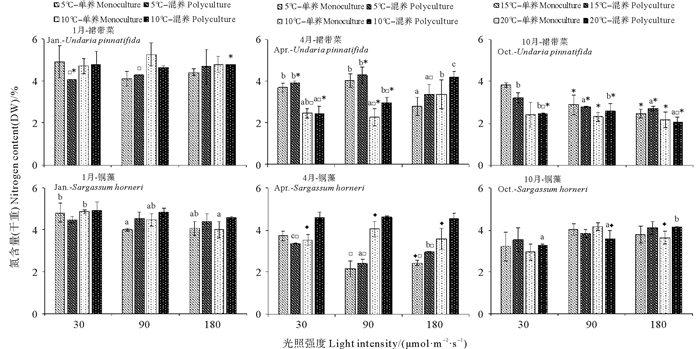
|
图 4 三个阶段的漂浮型铜藻和养殖裙带菜在不同的温度、光照强度和培养模式的组合下培养12 d后的总氮含量 Fig. 4 The nitrogen contents of drifting S. horneri and cultured U. pinnatifida at three stages cultured for 12 days under different combination of temperature, light intensity and culture pattern |
温度、光照强度和培养模式对铜藻和裙带菜的叶绿素含量的影响如图 5、6所示。幼苗期裙带菜的叶绿素a含量高于快速生长期和成熟期的叶绿素a含量,而成熟期的叶绿素c含量显著高于幼苗期和快速生长期(P < 0.05)。光照强度对裙带菜叶绿素含量有显著影响(P < 0.05),温度和培养模式对成熟期的裙带菜叶绿素含量几乎没有影响(P>0.05)。10月的铜藻的叶绿素a和叶绿素c含量略高于1和4月,光照强度对10月的铜藻的叶绿素含量几乎没有影响(P>0.05),温度和培养模式对铜藻叶绿素含量都较小。2种藻类比较,除处于成熟期的裙带菜叶绿素c的含量高于同时期的铜藻叶绿素c含量之外,其他生长阶段裙带菜的2种叶绿素含量均低于同时期的铜藻的叶绿素含量(P < 0.05)。
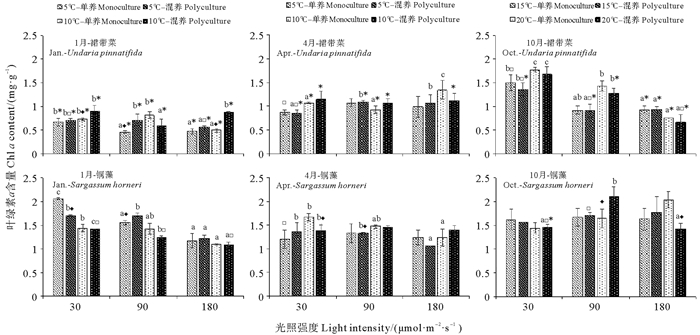
|
图 5 三个阶段的漂浮型铜藻和养殖裙带菜在不同的温度、光照强度和培养模式的组合下培养12 d后的叶绿素a含量 Fig. 5 The chlorophyll a contents of drifting S. horneri and cultured U. pinnatifida at three stages cultured for 12 days under different combination of temperature, light intensity and culture pattern |
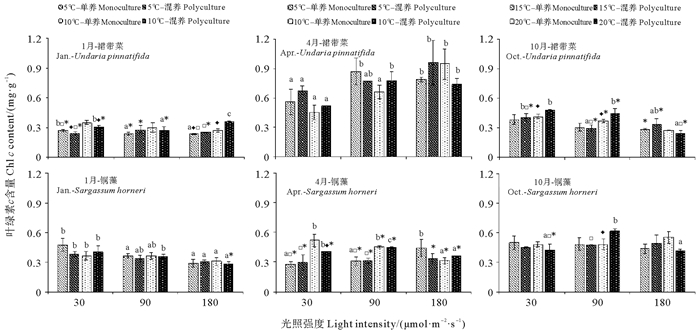
|
图 6 三个阶段的漂浮型铜藻和养殖裙带菜在不同的温度、光照强度和培养模式的组合下培养12 d后的叶绿素c含量 Fig. 6 The chlorophyll c contents of drifting S. horneri and cultured U. pinnatifida at three stages cultured for 12 days under different combination of temperature, light intensity and culture pattern |
光合速率是藻体反映光合作用强弱的最直观的体现。从实验结果可知,裙带菜在幼苗期光合能力高于同时期的铜藻,快速生长期与铜藻持平,而成熟期低于铜藻。2种海藻的光合作用的最适温度和光照强度随季节而波动。温度对于藻体光合作用产生会一定的影响,且低温与高温的影响机制有所不同。高温可抑制藻体PSII的活性[23],且与捕光蛋白发生脱离,还会引起藻胆蛋白的降解,造成不可逆的损伤[24];而低温主要使光合系统各种酶活性降低,这种损伤是可逆的[25]。1和4月,2种藻体的光合速率在温度上升至20 ℃时,有明显的下降,可能是由于当月藻体野外生长的温度为5~10 ℃,突然升高的温度使得藻体受到强烈的高温胁迫,产生了不可逆的损伤,从而影响到光合速率。而且,可以看出,裙带菜的光合作用最适温度比铜藻更低。而10月,藻体野外环境温度为18 ℃左右,所以突然下降的温度同样会使藻体遭受到了相当严重的低温胁迫,从而影响光合速率,因此在低温环境下10月的2种藻体的光合速率明显低于1和4月,裙带菜在20 ℃时光合速率显著高于铜藻,表明在幼苗期的裙带菜具有较强的光合能力。
光照强度对藻体的光合作用也有重要的影响。在光照强度过低的环境下,藻体光合结构吸收光能后进行光合作用的速率低于藻体本身的呼吸速率,因此净光合速率为负值。而在高光照强度下,吸收过多的光能会被转化为热能,通过热耗散的形式来保护PSII反应中心免受高光损伤[26]。铜藻对光强的变化更加敏感,且在光照强度为360 μmol·m-2·s-1的条件下具有最高的光合速率。裙带菜在不同的时期对光照强度的需求不同。幼苗期的裙带菜在高光强(360 μmol·m-2·s-1)下有最高的光合速率,而快速生长期和成熟期的裙带菜在中光强(180 μmol·m-2·s-1)下有最高的光合速率。这可能与2种褐藻生长过程中所处的光条件有关,漂浮型铜藻终生浮在水面生长,常年接受高光强的照射;而养殖裙带菜幼苗时附着在苗绳上,所处的环境光照较强,随着生长藻体不断下沉,所处环境的光照强度也不断减弱,最适的光照强度也随之降低。
在不同的月份,培养模式对于铜藻和裙带菜的生长的影响有一定差异。在裙带菜的快速生长期,在高光强和低光强下单养模式组裙带菜的SGR显著高于混养模式组,而铜藻的生长基本没有受到培养模式的影响,且铜藻的SGR略高于裙带菜。这表明在此阶段,2种褐藻在竞争过程中,铜藻更具生长优势,裙带菜的生长会因铜藻的存在而受到抑制。裙带菜的成熟期正是铜藻的快速生长期,在所有的处理组中,接近一半的处理组中单养组铜藻的SGR显著高于混养组,而且几乎所有处理组中铜藻的SGR均高于裙带菜,说明在此阶段裙带菜已经进入成熟期,生长逐步放缓,温度、光照和培养模式几乎都对其没有显著的影响,而处在快速生长期的铜藻对光照、温度的响应更为敏感,且铜藻对营养盐的需求较大,裙带菜的存在会与铜藻形成营养竞争,从而影响铜藻的生长。在裙带菜的幼苗期,铜藻则是刚由衰退期进入缓慢生长期,裙带菜的SGR在所有处理组中均高于铜藻,且单养组裙带菜的SGR出现低于混养组的现象。产生这一结果的原因,除了由于裙带菜幼孢子体具有旺盛的生长能力,能够争取到更多的营养之外,还有可能在藻体之间产生了克生作用[27]。通常种间竞争可分为利用性竞争和干扰性竞争,前者主要是竞争的个体没有直接的相互作用,而是通过损耗有限的资源而产生的竞争,如营养竞争;后者主要是竞争的个体之间有直接的相互作用,比如通过分泌一些化感物质而产生影响,如克生作用[28]。经历衰退期的铜藻可能会分泌一些促进生长的激素等物质,来促进自身生长的同时,也对裙带菜幼孢子体的生长有一定的促进作用。
在物质积累方面,裙带菜的氮含量均等于或低于同时期的铜藻的氮含量。藻体组织中存在着多种氮库,包括氨基酸及氨基混合物、蛋白质、NO3-、NH4+和叶绿素。藻体吸收多种无机氮,在体内进行转化并转运补充至不同的氮库中去,再用于进行各类生理活动[29]。藻体体内氮库的大小以及对外界无机氮吸收和利用的能力的差异,导致了不同藻类在生理生态学上的差异。2种褐藻在不同生长阶段的氮含量的差异暗示了氮储存策略的差异,相较而言,铜藻组织内的高氮含量能够减少对外界氮源的依赖,从而使藻体能够更有效的抵御外界不良环境,在营养竞争中更具优势,这可能是铜藻能够成为灾害性藻类的原因之一。4月是铜藻的快速生长期,混合培养组的氮含量反而高于单独培养组,表明铜藻在该时期比裙带菜有更强的氮吸收和储存能力。而在碳积累方面,裙带菜的幼苗期碳含量最低,表明藻体在生长的初期,生长和物质积累并非同步,物质积累有一定的滞后性,而且裙带菜的碳含量在其他时期高于铜藻的碳含量,可能与裙带菜更倾向于合成多种多糖类物质有关。总的来说,2种褐藻的种间竞争对各自的物质积累影响较少。
4 结语在相同环境条件下,裙带菜与铜藻的种间竞争机制主要源于2种海藻的生态学特性差异,而两者之间的相互影响次之。就生长而言,幼苗期的裙带菜较铜藻更具生长优势,快速生长期二者相差不大,而成熟期的裙带菜的生长优势劣于铜藻。就物质积累而言,铜藻体内的碳氮含量普遍较裙带菜高,这更有利于铜藻对抗不良环境条件的胁迫。在实际养殖过程中,裙带菜与铜藻经历的环境是不同的。裙带菜随着个体的生长,藻体所处的水层逐渐加深,光照强度逐渐减弱;而铜藻则一直漂浮在水的表层生长,自身不受光照强度的限制,同时还可通过遮阴作用抑制裙带菜获取光资源。由于铜藻的栖息环境较裙带菜更优越,所以铜藻容易形成爆发式增殖,而这种增殖必会对养殖裙带菜的产量产生不利影响,推测这种影响在裙带菜快速生长期和成熟期尤其明显。
| [1] |
Umezaki I. Ecological studies of Sargassum horneri (Turner) C. Agardh in Obama Bay, Japan Sea[J]. Bulletin of the Japanese Society of Scientific Fisheries, 1984, 50(7): 1193-1200. DOI:10.2331/suisan.50.1193
(  0) 0) |
| [2] |
Komatsu T, Ariyama H, Nakahara H, et al. Spatial and temporal distributions of water temperature in a Sargassum forest[J]. Journal of the Oceanographical Society of Japan, 1982, 38(2): 63-72. DOI:10.1007/BF02110292
(  0) 0) |
| [3] |
曾呈奎. 中国海藻志: 第三卷褐藻门: 第二册墨角藻目[M]. 北京: 科学出版社, 2000: 39-42. Tseng C K. Flora Algarum Marinarum Sinicarum: Tomus Ⅲ Phaeophyta: No.Ⅱ Fucales[M]. Beijing: Science Press, 2000: 39-42. (  0) 0) |
| [4] |
曾呈奎, 张峻甫. 关于几种褐藻在中国沿岸的不连续分布[J]. 海洋与湖沼, 1959, 2(2): 82-86. Tseng C K, Chang C F. On the discontinuous distribution of some brown algae on the China coast[J]. Oceanologia Et Limnologia Sinica, 1959, 2(2): 82-86. (  0) 0) |
| [5] |
Komatsu T, Matsunaga D, Mikami A, et al. Abundance of drifting seaweeds in eastern East China Sea[J]. Journal of Applied Phycology, 2008, 20(5): 801-809. DOI:10.1007/s10811-007-9302-4
(  0) 0) |
| [6] |
Pang S J, Liu F, Shan T F, et al. Cultivation of the brown alga Sargassum horneri: Sexual reproduction and seedling production in tank culture under reduced solar irradiance in ambient temperature[J]. Journal of Applied Phycology, 2009, 21(4): 413-422. DOI:10.1007/s10811-008-9386-5
(  0) 0) |
| [7] |
Komatsu T, Murakami S. Influence of a Sargassum forest on the spatial distribution of water flow[J]. Fisheries Oceanography, 1994, 3(4): 256-266. DOI:10.1111/j.1365-2419.1994.tb00103.x
(  0) 0) |
| [8] |
Murakami K, Yamaguchi Y, Noda K, et al. Seasonal variation in the chemical composition of a marine brown alga, Sargassum horneri (Turner) C. Agardh[J]. Journal of Food Composition and Analysis, 2011, 24(2): 231-236. DOI:10.1016/j.jfca.2010.08.004
(  0) 0) |
| [9] |
Nomura M, Kamogawa H, Susanto E, et al. Seasonal variations of total lipids, fatty acid composition, and fucoxanthin contents of Sargassum horneri (Turner) and Cystoseira hakodatensis (Yendo) from the northern seashore of Japan[J]. Journal of Applied Phycology, 2013, 25(4): 1159-1169. DOI:10.1007/s10811-012-9934-x
(  0) 0) |
| [10] |
Susanto E, Fahmi A S, Abe M, et al. Lipids, fatty acids, and fucoxanthin content from temperate and tropical brown seaweeds[J]. Aquatic Procedia, 2016, 7: 66-75. DOI:10.1016/j.aqpro.2016.07.009
(  0) 0) |
| [11] |
Terasaki M, Kawagoe C, Ito A, et al. Spatial and seasonal variations in the biofunctional lipid substances (fucoxanthin and fucosterol) of the laboratory-grown edible Japanese seaweed (Sargassum horneri Turner) cultured in the open sea[J]. Saudi Journal of Biological Sciences, 2017, 24(7): 1475-1482. DOI:10.1016/j.sjbs.2016.01.009
(  0) 0) |
| [12] |
Wen Z S, Liu L J, OuYang X K, et al. Protective effect of polysaccharides from Sargassum horneri against oxidative stress in RAW264.7 cells[J]. International Journal of Biological Macromolecules, 2014, 68: 98-106. DOI:10.1016/j.ijbiomac.2014.04.037
(  0) 0) |
| [13] |
Yamazaki Y, Nakamura Y, Nakamura T. A fluorometric assay for quantification of fucoidan, A sulfated polysaccharide from brown algae[J]. Plant Biotechnology, 2016, 33(2): 117-121. DOI:10.5511/plantbiotechnology.16.0217c
(  0) 0) |
| [14] |
Murphy C, Hotchkiss S, Worthington J, et al. The potential of seaweed as a source of drugs for use in cancer chemotherapy[J]. Journal of Applied Phycology, 2014, 26(5): 2211-2264. DOI:10.1007/s10811-014-0245-2
(  0) 0) |
| [15] |
Southichak B, Nakano K, Nomura M, et al. Marine macroalga Sargassum horneri as biosorbent for heavy metal removal: Roles of calcium in ion exchange mechanism[J]. Water Science and Technology, 2008, 58(3): 697-704. DOI:10.2166/wst.2008.696
(  0) 0) |
| [16] |
Angelova R, Baldikova E, Pospiskova K, et al. Magnetically modified Sargassum horneri biomass as an adsorbent for organic dye removal[J]. Journal of Cleaner Production, 2016, 137: 189-194. DOI:10.1016/j.jclepro.2016.07.068
(  0) 0) |
| [17] |
Yoshida T. Studies on the distribution and drift of the floating seaweeds[J]. Japanese Journal of Bull Tohoku Reg Fish Res Lab, 1963, 23: 141-186.
(  0) 0) |
| [18] |
Qi L, Hu C M, Wang M Q, et al. Floating algae blooms in the East China Sea[J]. Geophysical Research Letters, 2017, 44(22): 11501-11509. DOI:10.1002/2017GL075525
(  0) 0) |
| [19] |
Byeon S Y, Oh H J, Kim S, et al. The origin and population genetic structure of the 'golden tide' seaweeds, Sargassum horneri, in Korean waters[J]. Scientific Reports, 2019, 9: 1-13.
(  0) 0) |
| [20] |
石颖, 侯和胜. 裙带菜的生理作用及药用价值研究进展[J]. 食品与药品, 2013, 15(3): 213-215. Shi Y, Hou H S. Physiological effect and pharmacological importance of Undaria pinnatifida: A literature review[J]. Food and Drug, 2013, 15(3): 213-215. DOI:10.3969/j.issn.1672-979X.2013.03.024 (  0) 0) |
| [21] |
Shan T, Pang S, Li J, et al. Isolation and characterization of eight novel microsatellite loci from the brown alga Sargassum horneri[J]. Journal of Applied Phycology, 2015, 27(6): 2419-2421. DOI:10.1007/s10811-014-0521-1
(  0) 0) |
| [22] |
Seely G R, Duncan M J, Vidaver W E. Preparative and analytical extraction of pigment from brown algae with dimethyl sulfoxide[J]. Marine Biology, 1972, 12: 184-188. DOI:10.1007/BF00350754
(  0) 0) |
| [23] |
梁英, 冯力霞, 田传远, 等. 高温胁迫对盐藻和塔胞藻叶绿素荧光动力学的影响[J]. 中国水产科学, 2007, 14(6): 961-968. Liang Y, Feng L X, Tian C Y, et al. Effects of high temperature stress on chlorophyll fluorescence kinetics of Dunaliella salina and Pyramimonas sp[J]. Journal of Fishery Sciences of China, 2007, 14(6): 961-968. DOI:10.3321/j.issn:1005-8737.2007.06.011 (  0) 0) |
| [24] |
Morgan Kiss R, Ivanov A G, Williams J, et al. Differential thermal effects on the energy distribution between photosystem Ⅱ and photosystem I in thylakoid membranes of a psychrophilic and a mesophilic alga[J]. Biochimica Et Biophysica Acta, 2002, 1561(2): 251. DOI:10.1016/S0005-2736(02)00352-8
(  0) 0) |
| [25] |
梁洲瑞, 王飞久, 孙修涛, 等. 利用液相氧电极技术对鼠尾藻叶光合及呼吸作用的初步研究[J]. 水产学报, 2012, 36(12): 1842-1853. Liang Z R, Wang F J, Sun X T, et al. Primary investigations on the photosynthesis and respiration of leaves of Sargassum thunbergii using liquid-phase oxygen measurement system[J]. Journal of Fisheries of China, 2012, 36(12): 1842-1853. (  0) 0) |
| [26] |
Hanelt D. Photoinhibition of photosynthesis in marine macroalgae[J]. Scientia Marina, 1996, 60(1): 243-248.
(  0) 0) |
| [27] |
孙鹏, 杨娟, 鲁舒琴, 等. 鼠尾藻提取液对米氏凯伦藻的克生作用研究[J]. 鲁东大学学报(自然科学版), 2017, 33(1): 46-51. Sun P, Yang J, Lu S Q, et al. Allelopathic effects of Sargassum thunbergii's extract on Karenia mikimotoi[J]. Journal of Ludong University (Natural Science Edition), 2017, 33(1): 46-51. DOI:10.3969/j.issn.1673-8020.2017.01.009 (  0) 0) |
| [28] |
李丽霞, 董开升, 唐学玺. 2种潮间带大型海藻种间竞争作用对UV-B辐射增强的响应[J]. 环境科学, 2008, 29(10): 2766-2772. Li L X, Dong K S, Tang X X. Response of interspecific competition between Ulva pertusa and Grateloupia filicina to UV-B irradiation enhancement[J]. Chinese Journal of Environmental Science, 2008, 29(10): 2766-2772. DOI:10.3321/j.issn:0250-3301.2008.10.013 (  0) 0) |
| [29] |
McGlathery K J, Pedersen M F, Borum J. Changes in intracellular nitrogen pools and feedback controls on nitrogen uptake in Chaetomorpha linum (Chlorophyta)[J]. Journal of Phycology, 1996, 32(3): 393-401. DOI:10.1111/j.0022-3646.1996.00393.x
(  0) 0) |
2. The Key Laboratory of Mariculture(Ocean University of China), Ministry of Education, Qingdao 266003, China
 2021, Vol. 51
2021, Vol. 51


