2. 烟台市海洋经济研究院, 山东 烟台 264000;
3. 大连海洋大学水产与生命学院, 辽宁 大连 116023
肌肉生长抑制素(Myostatin, MSTN)又称为生长分化因子8(GDF8),属于转化生长因子β超家族(TGF-β),通过抑制生肌决定因子(MyoD)家族成员的转录活性来调控肌细胞的生长,抑止肌卫星细胞的增殖和分化[1],既是骨骼肌发育生长的负向调控因子[2],又是影响骨骼肌生长的关键因子[3]。MSTN基因最早在哺乳动物中发现,随后也在十多种鱼类中克隆到该基因[4]。在动物体内MSTN起初是被翻译成前体蛋白,在蛋白酶的水解作用下形成前肽与成熟肽两部分[5]。成熟肽是该基因的功能域,具有抑制肌肉生长的作用,同时前肽可与成熟肽结合形成二聚体,使成熟肽的功能被抑制[6]。在哺乳动物中,MSTN通过肿瘤生长因子—B途径包括激活素受体,Act RIIB和Smads 2和3的磷酸化抑制成肌细胞增殖和分化[7]。敲除小鼠(Mus musculus)的MSTN基因,发现其不仅能正常生长发育,体重还比野生型增加了数倍,且骨骼肌数量显著增加,该研究首次证实MSTN是肌肉生长的负调控因子[8]。在鱼类中,应俊等通过对大黄鱼(Larimichthys crocea)MSTN-1前肽基因的原核表达、多克隆抗体制备,并采用该抗体注射大黄鱼幼鱼,发现注射组实验鱼增重率比对照组低,证明了MSTN对其生长具有抑制作用[9]。在黄颡鱼(Pelteobagrus fulvidraco) MSTN的全序列中发现有与生长、体重相关的位点[10]。另外,有研究表明MSTN是仔稚幼鱼阶段分化和激活肌细胞的关键转录因子之一[11-12]。
黄条鰤(Seriola aureovittata)属鲈形目(Perciformes)鯵科(Carangidae)鰤属(Seriola),是中国本土分布的大洋性经济鱼类,具有营养丰富、肉质鲜嫩,消费市场潜力大等优点[13-15]。国内外关于黄条鰤生长、发育相关基因的研究报道较少,目前未见黄条鰤MSTN研究报道。本研究对黄条鰤MSTN基因全长cDNA序列进行了克隆,并且对其在不同组织、胚胎发育各时期以及仔稚幼鱼发育阶段的表达特征进行了研究,旨在为探讨MSTN在黄条鰤肌肉生长及早期发育过程中的调控机制奠定分子生物学基础。
1 材料与方法 1.1 实验用鱼及样品处理实验用黄条鰤取自大连富谷水产有限公司。实验用鱼的培育条件:养殖期间投喂新鲜鲜杂鱼饵料,养殖期间控制水温为18~25 ℃、盐度为28~30、pH为8.0~8.3;每日投饵2次,饲喂量为鱼自身体重的2%~5%。一龄黄条鰤(雌性3尾),全长33~35 cm,体重450~500 g。通过MS-222(260 mg/L)麻醉后快速解剖,采集采集脑、垂体、肝脏、肌肉、脾脏、肾脏、鳃、心脏、胃、肠、头肾11个组织投入液氮中速冻,后转入-80 ℃超低冰箱保存,提取总RNA,用于基因克隆和组织表达分布特征研究。
依据黄条鰤胚胎时期发育阶段的划分[16],采用NIKON解剖镜(MSZ800, 日本)进行胚胎发育观察,记录发育时序,并采集受精卵到初孵仔鱼等18个发育时期的胚胎样本。同时,采集孵化后的仔稚幼鱼(1~60日龄)14个生长发育阶段样品。迅速冻于液氮,用于胚胎和仔稚幼鱼发育过程的基因表达分析。
1.2 总RNA提取和cDNA第一链的合成利用RNAiso Plus(TaKaRa, 日本)提取肌肉组织中的总RNA,通过1.2%琼脂糖凝胶电泳检测RNA的完整性,使用Nanodrop2000 (Thermo, 美国)测定RNA浓度。以总RNA为模板,采用PrimeScript RT reagent Kit反转录试剂盒(TaKaRa, 日本)合成cDNA第一链用于保守区域扩增。5′RACE及3′RACE cDNA第一链通过SMARTerTM RACE cDNA Amplification Kit (Clontech, 美国)合成,用于后续的RACE全长实验。
1.3 MSTN基因cDNA的RACE克隆用Primer Premier 5.0软件设计特异扩增引物(见表 1)。保守片段扩增以肌肉cDNA为模板,PCR反应体系包含2 μL cDNA第一链、2 μL 10×PCR Buffer、0.5 μL Taq酶、2.5 μL dNTP Mixture、2 μL的MSTN-F1、2 μL的MSTN-R1、14 μL ddH2O,总体积为25 μL。PCR扩增条件94 ℃ 5 min、95 ℃ 30 s、59 ℃ 30 s、72 ℃ 40 s,36个循环,72 ℃延伸10 min,PCR产物经电泳跑胶检测,通过E.Z.N.A.TM Gel Extraction Kit Manual胶回收试剂盒(Omega, 美国)纯化。将回收的产物与pEASY-T1载体连接,转化入Transl-T1感受态细胞(全式金, 中国),在37 ℃培养箱中培养过夜,对有插入片段的阳性克隆进行测序(上海生工生物工程股份有限公司)。
|
|
表 1 黄条鰤基因克隆、定量分析使用的引物序列 Table 1 Sequence of specific primers used for cloning and quantitative real-time PCR analyses in Seriola aureovittata |
通过得到的保守片段序列设计RACE反应特异引物(见表 1)。根据SMARTerTM RACE cDNA Amplification Kit试剂盒进行5′RACE和3′RACE反应。5′RACE的第一次梯度PCR反应体系包含0.5 μL 50×Advantage 2 Polymerase Mix、17.5 μL Water、2 μL 50×dNTP Mix、2.5 μL 10×Advantage 2 PCR Buf-fer、1 μL模板,1 μL UPM,0.5 μL MSTN-5′-R1,总体积25 μL,混匀并离心。PCR反应条件同上,以10倍稀释后的第一次PCR产物为模板,MSTN-5′-R2、NUP为引物,进行第二次PCR扩增目标基因的5′RACE。3′RACE的PCR体系及反应条件与5′RACE相似。RACE产物测序操作与保守片段克隆实验中测序步骤相同。
1.4 反转录实时荧光定量PCR(RT-qPCR)利用荧光定量PCR检测MSTN基因的表达水平。根据克隆获得的黄条鰤MSTN cDNA全长序列和内参基因18s设计荧光定量PCR引物(见表 1)。参照SYBR Premix Ex TaqTMⅡ (Takara, 日本) 说明书进行荧光定量PCR扩增。PCR扩增体系(20 μL)为SYBR Premix Ex TaqTMⅡ10 μL,ddH2O 6.4 μL,cDNA 2 μL,上、下游引物(10 μmol/L) 各0.8 μL。扩增程序为95 ℃预变性30 s;95 ℃循环变性5 s,60 ℃退火复性20 s,72 ℃延伸30 s,共40个循环。标准曲线以肌肉组织cDNA为模板,通过10倍梯度稀释,选取其中8个梯度浓度绘制而成。每个样品测试所有实验设置3个重复,结果采用2-ΔΔCT对不同基因的表达量进行比较分析[17]。
1.5 序列结构及系统进化分析使用Expasy在线数据库预测(www.expasy.org/tools/protparam.html)进行黄条鰤MSTN的结构、分子量和等电点的预测;使用DNAMAN 6.0软件进行氨基酸序列推导、序列拼接和氨基酸同源性分析;使用NCBI数据库(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi) 进行结构域的预测;SOPM (https://npsa-prabi.ibcp.fr/cgi-bin/npsa-automat.pl/page=npsa-sopma.html) 分析蛋白质二级结构;ClustalW在线软件(http://www.genome.jp/tools-bin/clustalw)进行氨基酸序列多重比对;使用MEGA 6软件的邻接法(NJ)构建系统系统进化树,自展值为1 000。
1.6 数据处理采用平均值±标准差(Mean±S.D.)表示MSTN mRNA相对表达量,采用SPSS 19.0进行单因素方差分析(One-way ANOVA)和Duncan多重比较分析,P < 0.05表示具有显著差异。
2 结果 2.1 MSTN基因结构与氨基酸序列分析对黄条鰤MSTN cDNA扩增获得1 828 bp基因序列(GenBank登录号: MH144053),包括159 bp的5′UTR、1 131 bp的ORF和538 bp的3′UTR,编码376个氨基酸,蛋白预测分子量为42 kDa,等电点为5.4。黄条鰤MSTN包含两段保守区域即TGF-β前肽区域(37~253)和TGF-β功能域(282~376),共有13个半胱氨酸残基,序列中还含有1个糖基化位点,位于第73位氨基酸,前22个氨基酸残基是信号肽序列(见图 1)。

|
(方框表示信号肽序列; 下划线表示TGF-β前肽区域; 双下划线表示TGF-β功能域; *代表终止密码子。The signal peptide sequence was framed. The TGF-β propeptide region was underlined. The TGF-β functional domain was double underlined. "*" indicated the stop codon.) 图 1 黄条鰤MSTN基因cDNA全长序列和预测的氨基酸序列 Fig. 1 The full-length cDNA sequence of S.aureovittata MSTN gene and deduced amino acid sequence |
黄条鰤MSTN蛋白与脊椎动物对应的氨基酸序列显示出保守的同一性。序列比对分析显示,黄条鰤MSTN的氨基酸序列与同属鲈形目高体鰤(S. dume-rili)的同源性最高99.5%,与大黄鱼(Larimichthys crocea)同源性为94.4%,与鲫鱼(Carassius carassius)同源性为82.4%,与人(Homo sapiens)的同源性为65.9%,与鸡(Gallus gallus)的同源性为65.6% (见图 2)。

|
(MSTN氨基酸序列GenBank登录号:GG: 鸡, AAR18244; HS: 人, ABI48390; CC: 鲫鱼,AGK84718; LC: 大黄鱼, AAW34055; SD: 高体鰤, XP_022596066; SA: 黄条鰤, AZQ19980。“*”表示一致的氨基酸残基; “: ”表示高度保守度的氨基酸; “.”表示低保守度的氨基酸.The GenBank accession numbers of MSTN amino acid sequences are as follows: GG: Gallus gallus, AAR18244; HS: Homo sapiens, ABI48390; CC: Carassius carassius, AGK84718; LC: Larimichthys crocea, AAW34055; SD: Seriola dumerili, XP_022596066; SA: Seriola aureovittata, AZQ19980. "*"indicated identical amino acid sequences; ": " indicated highly conserved amino acid sequences; "." indicated amino acid sequences of low degree conserved.) 图 2 黄条鰤MSTN与其他物种的氨基酸序列比较 Fig. 2 Comparison of the amino acid sequences between S.aureovittata MSTN and other species |
利用NJ法构建了基于氨基酸序列的黄条鰤MSTN和其他脊椎动物的系统进化树(见图 3),结果表明进化树中鱼类聚为一枝,其他脊椎动物聚为另一枝。在比对的物种中,黄条鰤的MSTN与高体鰤聚为一支,再与鲈形总目聚为一支;这说明黄条鰤与高体鰤亲缘关系最近,与哺乳类、鸟类、啮齿类亲缘关系较远。
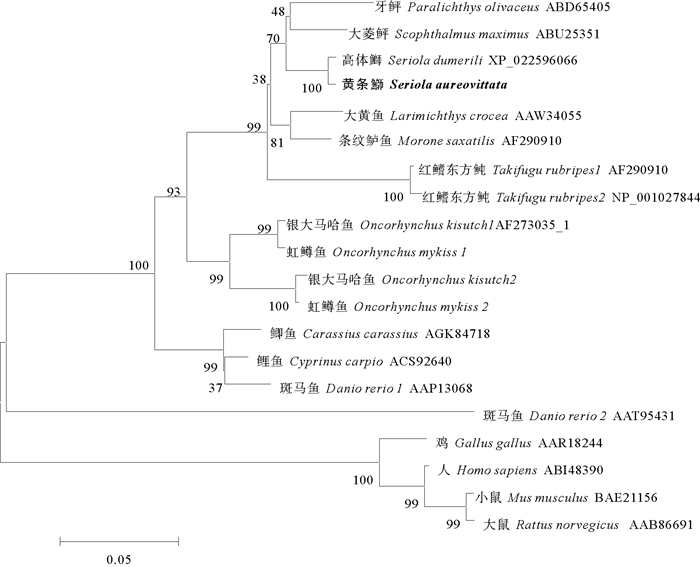
|
图 3 基于MSTN氨基酸序列的NJ系统进化树 Fig. 3 NJ phylogenetic tree based on MSTN amino acid sequences |
RT-qPCR检测到MSTN mRNA在黄条鰤的脑、垂体、肝脏、肌肉、脾脏、肾脏、鳃、心脏、胃、肠、头肾11个组织中均有表达,但其表达量存在差异。分析表明MSTN mRNA在黄条鰤肌肉中表达量最高(P < 0.05),其次在脑和胃中也检测到少量表达,而在垂体、肝、脾、肾、鳃、心、肠和头肾等组织中检测到微量表达(见图 4)。
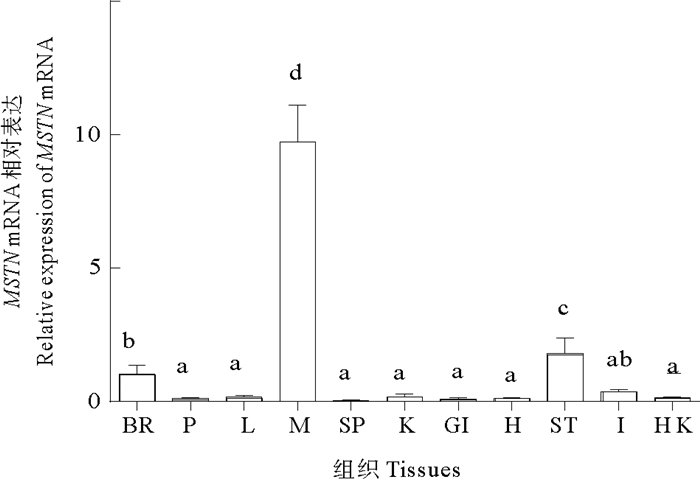
|
(BR: 脑; P: 垂体; L: 肝脏; M: 肌肉; SP: 脾脏; K: 肾脏; GI: 鳃; H: 心脏; ST: 胃; I: 肠; HK: 头肾。不同组织差异显著用不同字母表示, P < 0.05。BR: brain; P: pituitary; L: liver; M: muscle; SP: spleen; K: kindey; GI: gill; H: heart; ST: stomach; I: intestine; HK: head-kidney. Significant diffe-rence in differences tissues are indicated by different letters, P < 0.05.) 图 4 MSTN mRNA在黄条鰤不同组织中的表达 Fig. 4 Relative expression of MSTN mRNA in different tissues of S.aureovittata |
MSTN mRNA在黄条鰤早期胚胎中表达量都较低,在胚体下包1/2之前表达量呈现无规律的上下波动,整体上表达量都较低,且没有显著差异(P>0.05);从胚体下包2/3至孵化期MSTN mRNA的表达量显著上调,至孵化期表达量达到峰值(P < 0.05) (见图 5)。在仔稚幼鱼时期,MSTN mRNA在孵化后3 d内表达量显著上调(P < 0.05),后又在20 d降低至较低水平(P < 0.05),25 d后表达量再次显著升高至30 d达到峰值(P < 0.05),随后呈现显著下降趋势(见图 6)。
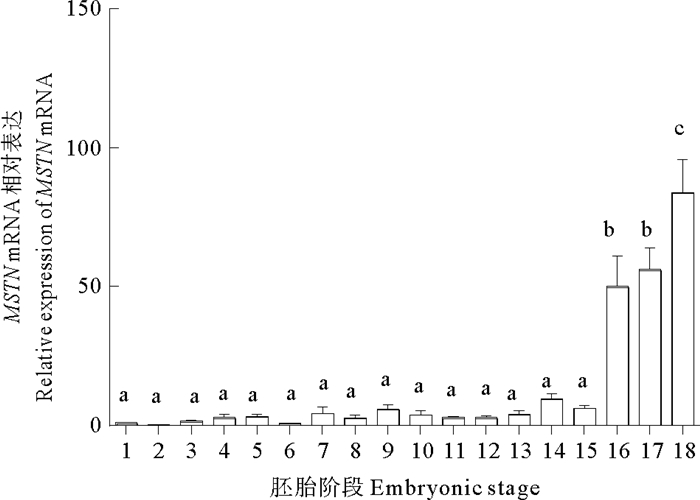
|
(1. 受精卵; 2.2细胞; 3.4细胞; 4.8细胞; 5.16细胞; 6.32细胞; 7. 多细胞; 8.桑椹胚; 9. 高囊胚; 10. 低囊胚; 11. 原肠胚早期; 12. 原肠胚中期; 13. 原肠胚末期; 14. 神经胚; 15. 胚体下包1/2; 16. 胚体下包2/3; 17. 胚体全包; 18. 孵化期; 不同字母表示差异显著, P < 0.05; 以受精卵mRNA表达量为标准1。1. fertilized egg stage; 2.2-cell stage; 3.4-cell stage; 4.8-cell stage; 5.16-cell stage; 6.32-cell stage; 7. multi-cell stage; 8. morula stage; 9. high blastula stage; 10. low blastula stage; 11. early gastrula stage; 12. mid-gastrula stage; 13. late gastrula stage; 14. neurula stage; 15. embryo encirling 1/2 of yolk sac; 16. embryo encircling 2/3 of yolk sac; 17. embryo encricling the whole yolk sac; 18. newly hatched larva; Different letters indicated significant diffe-rence, P < 0.05; A relative abundance of 1 was set arbitrarily for the mRNA expression level in the fertilized egg.) 图 5 MSTN mRNA在黄条鰤胚胎发育时期的表达水平变化 Fig. 5 The expression levels of MSTN mRNA in different embryonic stages of S. aureovittata |
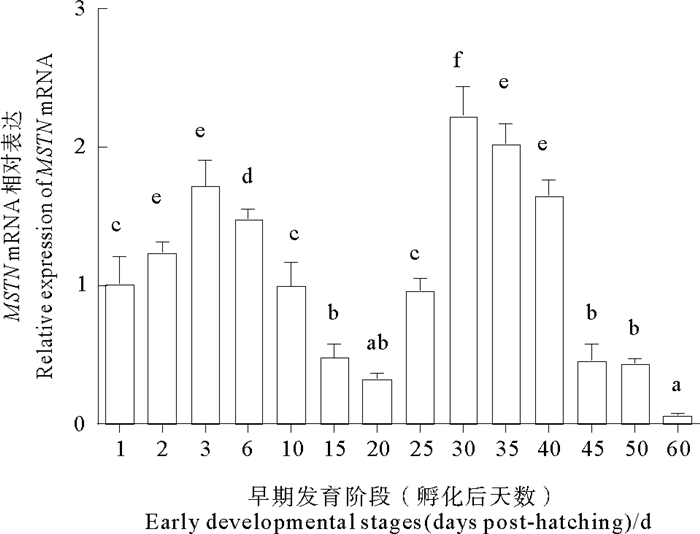
|
(日龄不同字母表示差异显著, P < 0.05; 以孵化后1 d MSTN表达量为标准1。Different letters indicated significant difference, P < 0.05. A relative abundance of 1 was set arbitrarily for the MSTN mRNA expression level in the 1 day after hatching.) 图 6 MSTN mRNA在黄条鰤仔稚幼鱼早期发育阶段的表达水平变化 Fig. 6 The expression levels of MSTN mRNA in early development stages of S. aureovittata |
本研究通过RT-PCR及RACE方法获得了黄条鰤MSTN全长cDNA序列。黄条鰤MSTN氨基酸序列含有N端信号肽、保守的半胱氨酸残基以及TGF-β前肽域和TGF-β功能域等特征,符合TGF-β家族蛋白的特征,与其他物种的MSTN蛋白特征一致[4]。这种结构上的相似性,暗示黄条鰤在MSTN功能上的保守性。同源性分析结果表明,黄条鰤MSTN的氨基酸序列与同属鲈形目高体鰤的同源性高达99.5%,与其他鱼类、鸟类、人的MSTN同源性也较高。系统进化分析表明,黄条鰤的MSTN与高体鰤MSTN聚为一支,再与鲈形总目聚为一支,与哺乳类、鸟类、啮齿类亲缘关系较远;表明鰤属鱼类MSTN进化上具有较强的保守性。
在许多方面,鱼类MSTN的表达特征不同于高等脊椎动物。研究发现MSTN只在小鼠、比利时蓝牛(Bos taurus)和皮尔蒙特牛(Bos taurus)的体节和骨骼肌中表达[5, 18],但鱼类MSTN表达模式与哺乳类有明显的差异。随着研究的深入,发现鱼类的MSTN除了肌肉外,在脑、肠、鳃、肾、性腺等多个组织表达,对其他组织的发育和功能也有影响[19-20]。本研究中,组织表达分析发现MSTN mRNA在黄条鰤肌肉中表达量最高(P < 0.05),这表明MSTN参与了肌肉的生长调控;在黄条鰤脑中也检测到MSTN mRNA微量表达,推断可能在神经系统也有其作用[21]。除肌肉、脑外,MSTN mRNA在黄条鰤肾脏中表达,暗示其参与免疫系统的调控[22]。在斑马鱼(Danio rerio)和金头鲷(Sparus aurata)的肌肉、眼、鳃丝、脾、卵巢、肠、脑组织均检测到MSTN表达,在精巢检测到MSTN微弱的表达[23-24]。结合其他鱼类MSTN广泛的组织表达特性,我们推测黄条鰤MSTN的功能不仅调节肌肉的生长和发育,还作用于其他细胞和组织。
研究发现MSTN过表达导致斑马鱼体节发生期胚胎的背-腹轴缩短;脊索扭曲,体节发育受到强烈抑制而不分化[25],而敲除斑马鱼MSTN则会使胚胎体节数目增多[26];这说明MSTN对于鱼类正常的胚胎发育是必须的。从黄条鰤受精卵到胚体下包1/2 MSTN mRNA的表达量较低,推测此阶段MSTN可能来源于母源性转录本。在斑马鱼中发现MSTN的表达也是母源性的,从1细胞期就开始表达[22]。在黄条鰤胚胎发育后期MSTN mRNA表达量升高,表明是由胚胎转录出来的,这一时期也是黄条鰤肌节、心脏等器官开始形成的阶段;MSTN mRNA大量表达可能是因为黄条鰤胚胎体节发育基本完成,形成生肌节细胞,并进一步激活肌肉特异基因的表达[27]。
研究表明MSTN表达与鱼类肌肉生长相关[28-29]。在武昌鱼(Megalobrama amblycephala),肌肉中MSTN表达在2龄鱼显著高于1龄鱼[30]。在黄条鰤,随着胚后发育的进行,孵化出膜后的0~3 d和25~40 d的阶段,MSTN mRNA表达量维持一个相对较高的表达趋势,这可能与MSTN在个体生长不同阶段肌肉发育过程所起的调控作用相关。在25 d左右为黄条鰤鱼苗大量死亡时期,该阶段MSTN mRNA表达量显著升高,推断出现鱼苗死亡的原因之一可能是MSTN mRNA较高的表达水平导致的。在黄条鰤仔稚幼鱼发育关键阶段,MSTN mRNA表达特征变化与黄条鰤另一个肌肉发育负向调控因子PTEN表达变化趋势相似[31]。MSTN作为肌肉发育的负向调控因子,45 d后MSTN mRNA表达量明显降低并保持较低表达水平,这一阶段黄条鰤鱼苗生长速度较快,MSTN mRNA相对较低的表达说明其与黄条鰤肌肉生长密不可分。今后有必要继续研究MSTN基因在黄条鰤生长发育过程的功能及作用机制。
4 结语本研究聚焦肌肉生长发育的关键负调控基因-生长抑制素基因在黄条鰤不同组织、胚胎发育过程以及仔稚幼鱼发育过程中的表达变化特征,首次揭示了MSTN在黄条鰤的胚胎及早期生长发育过程中发挥重要作用。相关研究结果为探讨MSTN在黄条鰤生长发育的调控机制奠定了分子生物学基础,并为今后开展黄条鰤繁养殖及育种工作提供理论参考。
| [1] |
Garikipati D K, Rodgers B D. Myostatin inhibits myosatellite cell proliferation and consequently activates differentiation: Evidence for endocrineregulated transcript processing[J]. Journal of Endocrinology, 2012, 215(1): 177-187. DOI:10.1530/JOE-12-0260
(  0) 0) |
| [2] |
Thomas M, Langley B, Berry C, et al. Myostatin, a negative regulator of muscle growth, functions by inhibiting myoblast proliferation[J]. Journal of Biological Chemistry, 2000, 275(51): 40235-40243. DOI:10.1074/jbc.M004356200
(  0) 0) |
| [3] |
Zhu X Y, Topouzis S, Liang L, et al. Myostatin signaling through Smad2, Smad3 and Smad4 is regulated by the inhibitory Smad7 by a negative feedback mechanism[J]. Cytokine, 2004, 26(6): 262-272. DOI:10.1016/j.cyto.2004.03.007
(  0) 0) |
| [4] |
杜尚可, 沈睿杰, 陈杰, 等. 团头鲂MSTN基因cDNA结构、表达及过表达对胚胎发育的影响[J]. 水生生物学报, 2017, 41(3): 573-580. Du S K, Shen R J, Chen J, et al. Molecular structure and expression of myostain in megalobrama amblycephala and its overexpression effects in embryo[J]. Acta Hydrobiologica Sinica, 2017, 41(3): 573-580. (  0) 0) |
| [5] |
Mcpherron A C, Huynh T V, Lee S J. Redundancy of myostatin and growth/differentiation factor 11 function[J]. BMC Developmental Biology, 2009, 9(1): 1-9. DOI:10.1186/1471-213X-9-1
(  0) 0) |
| [6] |
Lee S J. Regulation of muscle mass by myostatin[J]. Annual Review of Cell and Developmental Biology, 2004, 20(1): 61-86. DOI:10.1146/annurev.cellbio.20.012103.135836
(  0) 0) |
| [7] |
Lee S J, Mcpherron A C. Regulation of myostatin activity and muscle growth[J]. Proceedings of the National Academy of Sciences of the United States of America, 2001, 98(16): 9306-9311. DOI:10.1073/pnas.151270098
(  0) 0) |
| [8] |
McPherron A C, Lawler A M, Lee S J. Regulation of skeletal muscle mass in mice by a new TGF-β superfamily member[J]. Nature, 1997, 387: 83-90. DOI:10.1038/387083a0
(  0) 0) |
| [9] |
应俊, 薛良义. 大黄鱼肌肉生长抑制素-1前肽原核表达、多克隆抗体制备和功能验证[J]. 中国细胞生物学学报, 2014, 36(10): 1344-1349. Ying J, Xue L Y. Large yellow croaker MSTN-1 prodomain prokaryotic expression, polyclonal antibody preparation and antibody function identification[J]. Chinese Journal of Cell Biology, 2014, 36(10): 1344-1349. (  0) 0) |
| [10] |
陈校辉, 刘朋朋, 王明华, 等. 黄颡鱼(Pelteobagrus fulvidraco)MSTN基因SNP位点与体重的相关性分析[J]. 海洋与湖沼, 2013, 44(6): 1566-1569. Chen X H, Liu P P, Wang M H, et al. SNP sites of MSTN gene and its association with body weight in yellow catfish (Pelteobagrus fulvidraco)[J]. Oceanologia Et Limnologia Sinica, 2013, 44(6): 1566-1569. (  0) 0) |
| [11] |
Codina M, Bian Y H, Gutiérrez J, et al. Cloning and characterization of myogenin from seabream (Sparus aurata) and analysis of promoter muscle specificity[J]. Comparative Biochemistry and Physiology, 2008, 3: 128-139.
(  0) 0) |
| [12] |
Balasch J C, Vargas R, Brandts I, et al. Divergent personalities influence the myogenic regulatory genes myostatin, myogenin and ghr2 transcript responses to Vibrio anguillarum vaccination in fish fingerlings (Sparus aurata)[J]. Physiology & Behavior, 2019, 212: 112697.
(  0) 0) |
| [13] |
史宝, 柳学周, 刘永山, 等. 黄条鰤线粒体全基因组测定及结构特征分析[J]. 中国水产科学, 2019, 26(3): 405-415. Shi B, Liu X Z, Liu Y S, et al. Complete sequence and gene organization of the mitochondrial genome of Seriola aureovittata[J]. Journal of Fishery Sciences of China, 2019, 26(3): 405-415. (  0) 0) |
| [14] |
史宝, 柳学周, 刘永山, 等. 盐度渐变过程对黄条鰤(Seriola aureovittata)幼鱼渗透调节的影响[J]. 海岸工程, 2019, 38(1): 63-70. Shi B, Liu X Z, Liu Y S, et al. Effects of gradual salinity change on osmotic regulation of juvenile yellowtail kingfish (Seriola aureovittata)[J]. Costal Engineering, 2019, 38(1): 63-70. (  0) 0) |
| [15] |
柳学周, 徐永江, 李荣, 等. 黄条鰤(Seriola aureovittata)肌肉营养组成分析与评价[J]. 渔业科学进展, 2017, 38(1): 128-135. Liu X Z, Xu Y J, Li Y, et al. Analysis and evaluation of nutritional composition of the muscle of yellowtail kingfish (Seriola aureovittata)[J]. Progress in Fishery Sciences, 2017, 38(1): 128-135. (  0) 0) |
| [16] |
徐永江, 张正荣, 柳学周, 等. 黄条鰤早期生长发育特征[J]. 中国水产科学, 2019, 26(1): 172-182. Xu Y J, Zhang Z R, Liu X Z, et al. Morphometric characteristics of the embryonic and postembryonic development of yellowtail kingfish, Seriola aureovittata[J]. Journal of Fishery Sciences of China, 2019, 26(1): 172-182. (  0) 0) |
| [17] |
Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262
(  0) 0) |
| [18] |
Kambadur R, Sharma M, Smith T P, et al. Mutations in myostatin (GDF8) in double-muscled Belgian blue and Piedmontese cattle[J]. Genome Research, 1997, 7(9): 910-916. DOI:10.1101/gr.7.9.910
(  0) 0) |
| [19] |
Amali A A, Lin C J, Chen Y H, et al. Overexpression of Myostatin2 in zebrafish reduces the expression of dystrophin associated protein complex (DAPC) which leads to muscle dystrophy[J]. Journal of Biomed Science, 2008, 15: 595-604. DOI:10.1007/s11373-008-9250-2
(  0) 0) |
| [20] |
赵浩斌, 彭扣, 王玉凤, 等. 鱼类肌肉生长抑制素研究进展[J]. 水生生物学报, 2006, 30(2): 227-231. Zhao H B, Peng K, Wang Y F, et al. Progress of studies on myostatin of fish[J]. Acta Hydrobiologica Sinica, 2006, 30(2): 227-231. (  0) 0) |
| [21] |
Garikipati D K, Gahr S A, Roalson E H, et al. Characterization of rainbow trout myostatin-2 genes (rtMSTN-2a and -2b): Genomic organization, differential expression, and pseudogenization[J]. Endocrinology, 2007, 148(5): 2106-2115. DOI:10.1210/en.2006-1299
(  0) 0) |
| [22] |
Helterline D L, Garikipati D D, Rodgers B. Embryonic and Tissue-specific regulation of myostatin-1 and -2 gene expression in zebrafish[J]. General and Comparative Endocrinology, 2007, 151(1): 90-97. DOI:10.1016/j.ygcen.2006.12.023
(  0) 0) |
| [23] |
Maccatrozzo L, Bargelloni L, Radaelli G, et al. Characterization of the myostatin gene in the gilthead seabream (Sparus aurata): Sequence, genomic structure, and expression pattern[J]. Marine Biotechnology, 2001, 3(3): 224-230. DOI:10.1007/s101260000064
(  0) 0) |
| [24] |
Amali A A, Lin C J, Chen Y H, et al. Up-regulation of muscle-specific transcription factors during embryonic somitogenesis of zebrafish (Danio rerio) by knock-down of myostatin-1[J]. Developmental Dynamics, 2004, 229(4): 847-856. DOI:10.1002/dvdy.10454
(  0) 0) |
| [25] |
Xu C, Wu G, Zohar Y, et al. Analysis of myostatin gene structure, expression and function in zebrafish[J]. Journal of Experimental Biology, 2003, 206(22): 4067-4079. DOI:10.1242/jeb.00635
(  0) 0) |
| [26] |
Ji S Q, Losinski R L, Cornelius S G, et al. Myostatin expression in porcine tissues: Tissue specificity and developmental and postnatal regulation[J]. American Journal of Physiology, 1998, 275(4): 1265-1273.
(  0) 0) |
| [27] |
濮剑威, 孙成飞, 蒋霞云, 等. 草鱼两个肌肉生长抑制素cDNA克隆、表达及过量表达对胚胎发育的影响[J]. 生物技术通报, 2011, 8: 153-160. Pu J W, Sun C F, Jiang X Y, et al. Two cDNAs cloning, expression and overexpression in embryo of Myostatin from grass carp (Ctenopharyngodon idellus)[J]. Biotechnology Bulletin, 2011, 8: 153-160. (  0) 0) |
| [28] |
Johansen K A, Overturf K. Quantitative expression analysis of genes affecting muscle growth during development of rainbow trout (Oncorhynchus mykiss)[J]. Marine Biotechnology, 2005, 7(6): 7576-7587.
(  0) 0) |
| [29] |
Zhang Y, Tan X, Zhang P J, et al. Characterization of muscle-regulatory gene, MyoD, from flounder (Paralichthys olivaceus) and analysis of its expression patterns during embryogenesis[J]. Marine Biotechnology, 2006, 8: 139-148. DOI:10.1007/s10126-005-5042-0
(  0) 0) |
| [30] |
Zhu K C, Wang H L, Wang H J, et al. Characterization of muscle morphology and satellite cells, and expression of muscle-related genes in skeletal muscle of juvenile and adult Megalobrama amblycephala[J]. Micron, 2014, 64: 66-75. DOI:10.1016/j.micron.2014.03.009
(  0) 0) |
| [31] |
孙冉冉, 史宝, 柳学周, 等. 黄条鰤PTEN基因克隆、组织分布及早期发育阶段的表达分析[J]. 大连海洋大学学报, 2019, 34(1): 47-55. Sun R R, Shi B, Liu X Z, et al. Molecular cloning and tissue and temporal expression of PTEN gene in early development of goldstriped amberjack Seriola aureovittata[J]. Journal of Dalian Ocean University, 2019, 34(1): 47-55. (  0) 0) |
2. Yantai Marine Economic Research Institute, Yantai 264000, China;
3. College of Fisheries and Life Science, Dalian Ocean University, Dalian 116023, China
 2021, Vol. 51
2021, Vol. 51


