四溴双酚A(TBBPA)是目前全球用量最大的溴代阻燃剂。2004年,全球溴代阻燃剂的使用量超过了170 000 t,其中TBBPA占据了60%[1]。而且,有研究表明[2-3],TBBPA可通过不同的途径进入环境中,在水体、沉积物以及生物体内均检测出TBBPA的存在,并且其含量日益增加,这使得TBBPA的毒理研究受到越来越多的关注。
近年来,桡足类作为海洋环境中重要的生物类群成为了研究热点。桡足类在海洋生态系统中占据着重要的生态位[4-5],是海洋生态系统食物链中的关键组成部分。另外,桡足类具有数量庞大、种类繁多、分布广泛、对污染物暴露敏感等特点,使之成为海洋污染监测及风险评估的理想受试生物。目前,桡足类已被广泛应用到污染研究中,曾艳艺等[6]和Andre等[7]分别研究了重金属和多环芳烃对桡足类毒性作用。Xu等[8]和Andy等[9]分别指出了DDT、三苯基锡对桡足类的毒性效应。此外,Jarvis等[10]揭示新型污染物纳米材料对桡足类的潜在毒性。
上述研究都表明了污染物对桡足类的毒性影响,但是都是在一定环境条件下进行的,很少关注环境因子对污染物毒性效应的影响。而环境因子的变化能直接影响桡足类对有机污染物的响应。因此,本文选用海洋环境中分布广泛、数量庞大的拟长腹剑水蚤[11-12],研究不同环境条件下TBBPA对其生长、发育以及繁殖的影响。不仅探讨了TBBPA和环境因子对桡足类的影响,更重要的是研究了环境因子对TBBPA毒性效应的影响,为TBBPA的毒性研究提供数据,也为海洋环境中污染物的检测提供较为系统的方法和材料。
1 材料和方法 1.1 拟长腹剑水蚤的采集及培养拟长腹剑水蚤于2014年11月中旬采集于山东省青岛市崂山区南窑虾池。实验前拟长腹剑水蚤需驯化2周,驯化条件同采集地,光照周期12 hL:12 hD,水温20 ℃,盐度20。培养所用的海水经0.45 μm孔径的滤膜过滤,充分曝气24 h后使用。投喂球等鞭金藻(Isochroysisgalbana)1.0×105ind/mL。
1.2 急性毒性实验实验设定空白对照组、溶剂对照组D(助溶剂为二甲亚砜DMSO)、0.4、0.64、1.024、1.638、2.621、4.196和6.711 mg·L-1 TBBPA共9组。每组有3个平行,每个平行组20只拟长腹剑水蚤成体。实验条件同1.1。记录每天水蚤死亡数并将死亡个体挑出,计算48 h-LC50[17, 30]。
根据48 h-LC50值,设定TBBPA浓度组分别是2.485、3.106、3.883 mg·L-1,对照组为溶剂对照组。设定温度梯度10、20、30℃(盐度20)和盐度梯度10、20、30(温度20 ℃)。每组有3个平行。每个平行组挑入20只拟长腹剑水蚤成体,实验条件同1.1,测定死亡率[17, 30]。
1.3 慢性毒性实验慢性毒性实验分别在温度15、20、25 ℃(盐度20);盐度10、20、30(温度20℃)条件下进行。其他条件同上,设定溶剂对照组、1/100 LC50组、1/10 LC50组。每组3个平行,每个平行24只。挑选孵化时间 < 24 h的无节幼虫置于24孔板中,待发育至桡足幼体阶段,挑至50 mL的烧杯中培养至挂卵雌体出现,然后将挂卵雌体挑至12孔板中待其孵化,记录发育时间、产卵量以及孵化的无节幼虫数。每24 h换水50%并记录死亡个体数[17, 30]。
1.4 数据分析实验所有数据都使用SPSS 19.0软件进行分析,P < 0.05,差异显著,P < 0.01,差异极显著。
2 结果 2.1 急性毒性实验 2.1.1 TBBPA对拟长腹剑水蚤48 h急性毒性实验结果经SPSS 19.0软件线性回归分析得出TBBPA对拟长腹剑水蚤48 h-LC50值为3.106 mg·L-1。
|
|
表 1 TBBPA对拟长腹剑水蚤48 h的急性毒性 Table 1 Acute toxicity of TBBPA to O.similis in 48 h |
在盐度20条件下,10、20、30 ℃组拟长腹剑水蚤的死亡率均与TBBPA浓度呈正相关关系(见图 1)。而暴露在2.485、3.106和3.883 mg·L-1 TBBPA中,死亡率都随着温度的升高而上升。温度30℃组与10℃组相比,死亡率分别增加了58.56%、61.05%和52.11%。
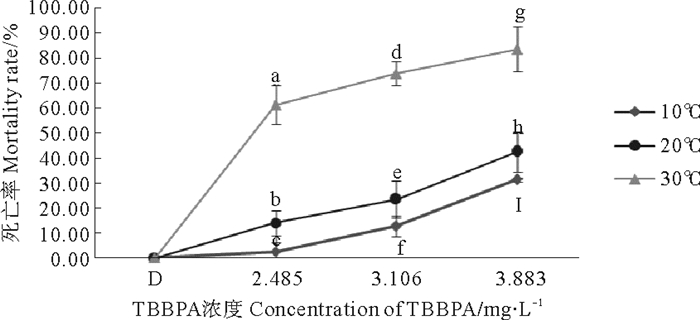
|
(不同字母P < 0.05;相同字母P > 0.05。Different letters P < 0.05; Same letters P > 0.05) 图 1 暴露在不同温度和不同TBBPA浓度下拟长腹剑水蚤48 h死亡率 Fig. 1 Average mortality of O. Similis expose to various concentrations of TBBPA under different temperature for 48 h |
经分析,各TBBPA浓度组间与各温度组间差异极其显著(P < 0.01),说明TBBPA和温度对拟长腹剑水蚤存活影响极其显著。
2.1.3 不同盐度下TBBPA对拟长腹剑水蚤的急性毒性图 2显示,2.485、3.106和3.883 mg·L-1 TBBPA组的死亡率随盐度的升高而降低,同时,在盐度10、20、30条件下,拟长腹剑水蚤的死亡率随着TBBPA浓度的升高呈现上升趋势。暴露在3.883 mg·L-1 TBBPA中,各盐度组死亡率达到最高,盐度10、20和30组分别是81.17%、65.65%和35.91%。分析得出各盐度组和各浓度组间差异极其显著(P < 0.01)。
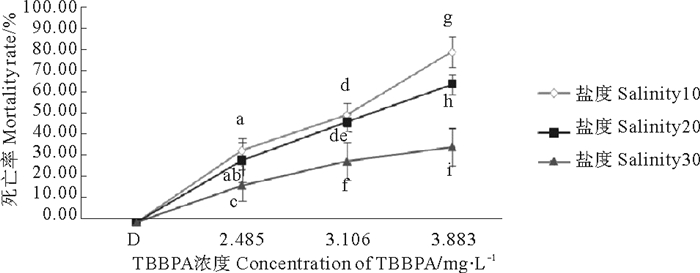
|
图 2 暴露在不同盐度和不同TBBPA浓度下拟长腹剑水蚤48 h死亡率 Fig. 2 Average mortality of O. Similis expose to various concentrations of TBBPA under different salinity for 48 h |
不同温度、盐度和浓度组间,在生长发育过程中,拟长腹剑水蚤的存活率均 > 80%(见表 2),分析结果显示各组间并没有显著差异(P > 0.05),可以认为实验设定的温度、盐度以及TBBPA对拟长腹剑水蚤的存活影响不明显。
|
|
表 2 暴露在不同盐度不同温度不同TBBPA浓度下无节幼虫的死亡率 Table 2 Average mortality ofnaupliiexpose to various concentrations of TBBPA under different salinity and temperature |
结果显示,温度15~25 ℃,D组、0.031、0.310 mg·L-1 TBBPA组无节幼虫发育至桡足幼体的时间呈现缩短趋势。温度20和25 ℃条件下,暴露在0.031和0.310 mg·L-1TBBPA中会缩短发育时间(见图 3)。此外,在15 ℃条件下,无节幼虫在第16 d依然未发育到幼体阶段,所以之后的实验没有讨论15 ℃组。
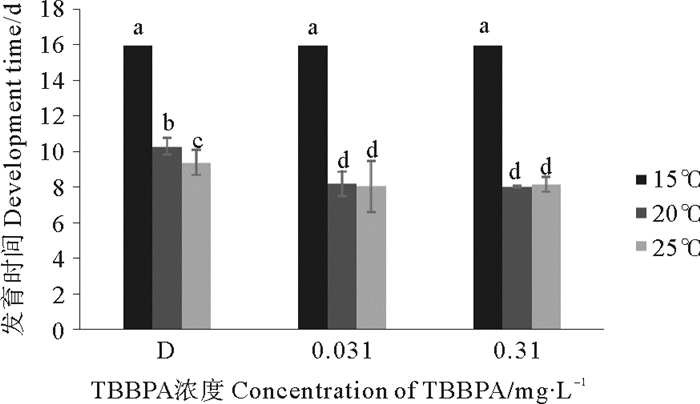
|
图 3 暴露在不同温度不同浓度TBBPA中无节幼虫发育至桡足幼体的时间 Fig. 3 The development time from nauplii to copepodid expose to various concentrations of TBBPA under different temperature |
温度15 ℃与20、25 ℃间差异显著(P < 0.05);D组和TBBPA浓度组差异显著(P < 0.05)。其余组间差异不显著(P > 0.05)。
无节幼虫到桡足幼体的发育时间在盐度10、20和30组中,均随着盐度的降低而缩短,D组在盐度10条件下的发育时间,相对于盐度20和30分别缩短了2.50和2.47 d(见图 4);另外,在各盐度条件下,TBBPA都会缩短发育时间。
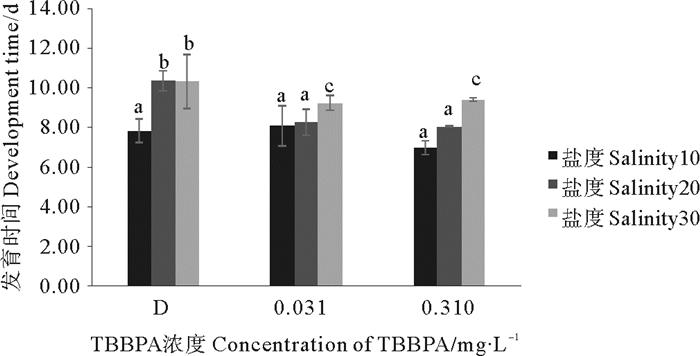
|
图 4 暴露在不同盐度不同浓度TBBPA中无节幼虫发育至桡足幼体的时间 Fig. 4 The development time from nauplii to copepodid expose to various concentrations of TBBPA under different salinity |
分析得出,D组与TBBPA浓度组间差异显著(P < 0.05);各盐度组间差异极其显著(P < 0.01);0.310与0.0310 mg·L-1TBBPA组只有在盐度10条件下才显示明显差异(P < 0.05)。
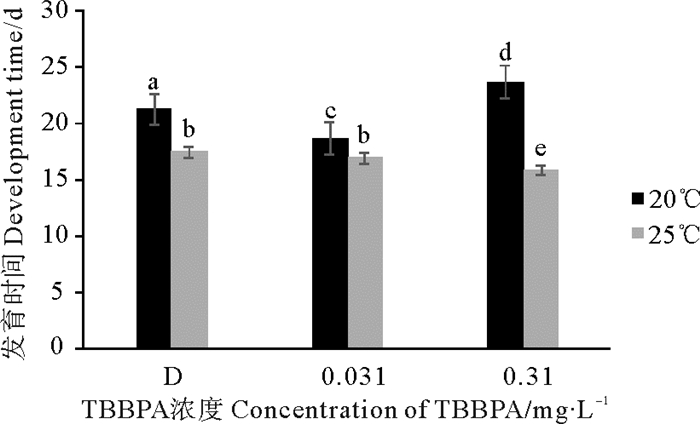
2.2.2.2 对桡足幼体至成体发育时间的影响桡足幼体与20 ℃组相比,25 ℃组的拟长腹剑水蚤发育至成体的时间明显缩短,D组、0.031和0.310 mg·L-1 TBBPA组的发育时间分别缩短了3.8、1.7和7.9 d(见图 5)。在20 ℃条件下,与D组相比,0.031 mg·L-1 TBBPA组发育时间会缩短,0.310 mg·L-1 TBBPA组会延长;但在25 ℃条件下,2个TBBPA浓度组发育时间都会缩短。分析得出,温度组和浓度组间差异均显著(P < 0.05)。
|
图 5 暴露在不同温度不同浓度TBBPA中桡足幼体发育至成体的时间 Fig. 5 The development time from copepodid to adult expose to various concentrations of TBBPA under different temperature |
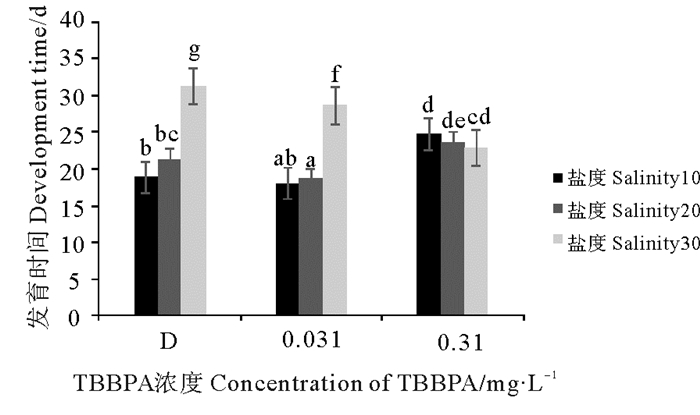
桡足幼体发育至成体的时间随着盐度的升高,在D组和0.031 mg·L-1TBBPA组显示逐渐延长趋势;在0.310 mg·L-1 TBBPA组显示逐渐降低趋势。同盐度条件下,0.031 mg·L-1 TBBPA会促进桡足类的发育。而0.310 mg·L-1 TBBPA,只在盐度30组显示促进拟长腹剑水蚤的发育(见图 6)。分析显示,各盐度组间差异极其显著(P < 0.01),但在各浓度组间差异不显著(P > 0.05)。
|
图 6 暴露在不同盐度不同浓度TBBPA中桡足幼体发育至成体的时间 Fig. 6 The development time from copepodid to adult expose to various concentrations of TBBPA under different salinity |
D组在盐度10、20、30条件下,第一只挂卵雌体出现的时间分别是第27、29和38 d(见表 3),随盐度的升高而延长,而0.031和0.310 mg·L-1 TBBPA组在盐度20条件下第一只挂卵雌体出现的时间最短,在盐度10条件下最长。D组、0.031和0.310 mg·L-1 TBBPA组第一只挂卵雌体出现的时间在盐度10条件下逐渐延长;在盐度20条件下逐渐缩短;在盐度30条件下没有明显变化。分析得出盐度组间差异及其显著(P < 0.01);浓度组间差异不显著(P > 0.05)。
|
|
表 3 暴露在不同盐度不同温度不同浓度TBBPA中第一只挂卵雌体出现的时间 Table 3 The mature time of first female expose to various concentrations of TBBPA under different salinity and temperature |
与20 ℃条件相比,25 ℃条件下第一只挂卵雌体出现的时间明显缩短(P < 0.01),D组、0.031、0.310 mg·L-1 TBBPA组分别缩短了5.7、7.7、7.7 d(见表 3)。20和25 ℃条件下,0.031和0.310 mg·L-1 TBBPA组的挂卵雌体出现时间都有明显缩短,0.310 mg·L-1 TBBPA组的时间最短(P < 0.01)。
2.2.3 温度和盐度对暴露在TBBPA中的拟长腹剑水蚤繁殖的影响 2.2.3.1 对产卵量的影响D组在不同盐度条件下,产卵量无明显的变化规律。盐度10条件下,0.031 mg·L-1 TBBPA组产卵量最少;在盐度20条件下,产卵量随着TBBPA浓度的升高呈现上升趋势;在盐度30条件下,0.031 mg·L-1 TBBPA组产卵量最高(见表 4)。各浓度组间和各温度组间差异均不显著(P > 0.05)。
|
|
表 4 暴露在不同盐度不同温度不同浓度TBBPA中拟长腹剑水蚤的产卵量 Table 4 Egg production of O. similis expose to various concentrations of TBBPA under different salinity and temperature |
如表 4,产卵量在25 ℃条件下的产卵量要明显高于20 ℃条件下的,在0.310 mg·L-1 TBBPA组(20 ℃:10.05只;25 ℃:14.24只)。D组、0.031和0.310 mg·L-1 TBBPA组在20和25 ℃时拟长腹剑水蚤的产卵量都呈现升高趋势。数据分析显示,温度组间差异显著(P > 0.05);浓度组间差异不显著(P > 0.05)。
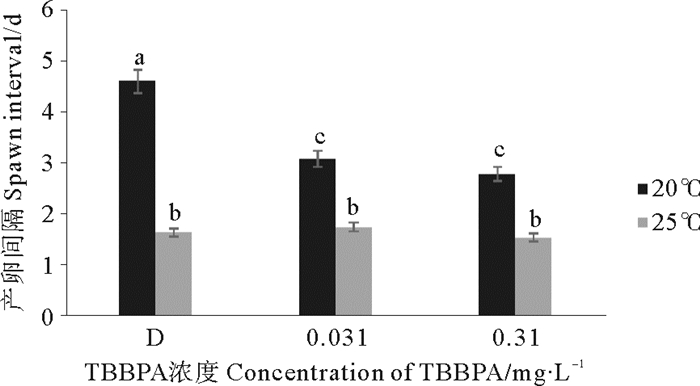
2.2.3.2 对产卵间隔的影响20 ℃与25 ℃组相比,20 ℃的产卵间隔明显延长(P < 0.01)。D组、0.031、0.310 mg·L-1 TBBPA组在20 ℃条件下的产卵间隔相比25 ℃分别延长了3、1.4和1.3 d(见图 7);与D组相比,TBBPA组在20 ℃下会缩短拟长腹剑水蚤的产卵间隔(P < 0.05),但在25 ℃条件下,没有明显差异(P > 0.05)。
|
图 7 暴露在不同温度不同浓度TBBPA中拟长腹剑水蚤的产卵间隔 Fig. 7 Spawn interval of O. similis expose to various concentrations of TBBPA under different temperature |
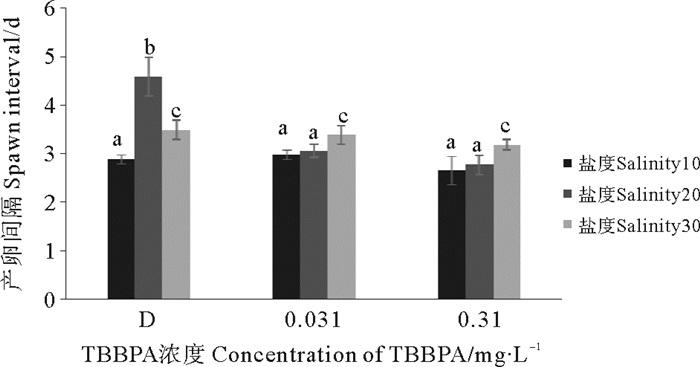
D组、0.031、0.310 mg·L-1 TBBPA组的产卵间隔在盐度10的条件下最短(见图 8)。除了盐度20条件下的D组外,其他组都显示盐度越低产卵间隔越短(P < 0.05)。而TBBPA浓度组相对于对照组,产卵间隔有缩短的趋势,但差异并不明显(P > 0.05)。
|
图 8 暴露在不同盐度不同浓度TBBPA中拟长腹剑水蚤的产卵间隔 Fig. 8 Spawn interval of O. similis expose to various concentrations of TBBPA under different salinity |
在不同温度和盐度条件下,浓度组间无节幼虫孵化率并没有显著差异(P > 0.05),均 > 80%,可认为在温度20~25 ℃,盐度10~30的范围内,0.031和0.310 mg·L-1的TBBPA对无节幼虫的孵化没有显著影响。
3 讨论目前的研究认为,TBBPA引起哺乳动物的急性毒性效应的剂量相对较高,达到一定的剂量的要求才会引起毒害效应,而对于水生动物而言,TBBPA对其具有较高的急性毒性[13]。有研究表明TBBPA对大型溞[14]、栉孔扇贝幼贝[15]、斑马鱼[16]的48 h-LC50分别是8.590、4.169和2.310 mg·L-1。TBBPA对拟长腹剑水蚤成体48 h-LC50为3.106 mg·L-1。与其他水生生物相比,拟长腹剑水蚤对TBBPA的敏感性相对较高。而且,有研究表明[34]污染物对生物的48 h-LC50在1~10 mg·L-1范围内,被认为该污染物对该生物是有毒的。所以说,TBBPA对于上述水生生物都是有毒性的。
在急性毒性实验中,设定TBBPA浓度为2.485、3.106和3.883 mg·L-1,温度梯度10、20、30 ℃和盐度梯度10、20、30,测定48 h的死亡率。结果表明,暴露在相同TBBPA浓度中,在温度10~30 ℃范围内,拟长腹剑水蚤的死亡率会随着温度的上升而升高;在盐度10~30的范围内,拟长腹剑水蚤的死亡率会随着盐度的降低而升高。相似的结果也在其他一些研究中得到验证。Kwok等[17]研究指出Cu和TBT对日本虎斑猛水蚤的毒性效应随着温度的升高和盐度的降低而增强。黄瑛等[18]发现温度的升高会增强三丁基氧化锡(TBTO)对火腿许水蚤的毒性效应,而火腿许水蚤在盐度15比25敏感性更高。这些研究表明不同污染物对不同种类的毒性效应受温度和盐度影响相同,温度升高和盐度降低都能放大污染物的毒性效应。Raymond Gaudy等[19]研究表明桡足类的呼吸速率在高温和低盐的条件下最高。Changling Li等[20]得出,温度升高促进桡足类的摄食率和滤水率,在盐度25~35范围内,盐度越高摄食率和滤水率越低。Siriporn等[21]研究表明,温度和盐度会影响BPA在生物体内的累计和毒性。可以得出结论:温度和盐度的改变会影响桡足类的新陈代谢,从而影响TBBPA对拟长腹剑水蚤的毒性效应,暴露在TBBPA中,温度升高或盐度降低都能放大TBBPA对桡足类的毒性效应。
在慢性毒性实验中,研究了不同温度和盐度条件下,TBBPA对拟长腹剑水蚤的生长发育和繁殖过程的影响。结果显示,在生长发育过程中,在温度15~25 ℃,盐度10~30范围内,0.031和0.310 mg·L-1 TBBPA对拟长腹剑水蚤的存活没有显著影响,所有组中拟长腹剑水蚤的存活率均大于80%。说明0.031和0.310 mg·L-1 TBBPA不会对拟长腹剑水蚤产生致死效应,改变温度和盐度,TBBPA对拟长腹剑水蚤的毒性效应也不明显。
在不同盐度和温度条件下,拟长腹剑水蚤发育时间对TBBPA的敏感性实验中,从无节幼虫到桡足幼体阶段的发育时间、桡足幼体到成体的发育时间以及第一只挂卵雌体出现的时间这三个指标得出结论:(1)在温度15~25 ℃,盐度10~30范围内,拟长腹剑水蚤的发育时间会随着温度的升高和盐度的降低而缩短(见表 3,图 3、4、5、6)。这与Stottrup等[22]、Rhyne等[23]、Santhanam等[24]和Alexander等[25]研究结果一致,低温会延长桡足类的发育时间,高温会缩短其发育时间。还有Chinnery等[26]发现,5~20 ℃条件下,20 ℃时桡足类无节幼虫最早发育至桡足幼体阶段。Shayegan等[31]指出汤氏纺锤水蚤Acartiatonsa的发育时间随盐度的升高而延长。Kyun等[27]表明温度升高和盐度降低,都能使无节幼虫的发育时间缩短。上述研究都表明桡足类在温度较高,盐度相对降低的条件下发育更快。Alexander等[25]研究表明温度和盐度会通过改变桡足类新陈代谢速度,从而影响发育时间。也就是说,在一定温度和盐度范围内,高温和低盐条件会促进拟长腹剑水蚤的发育。(2)对照组和TBBPA浓度组比较发现,在一定时间内0.031和0.310 mg·L-1 TBBPA会促进拟长腹剑水蚤的发育,但生物体内蓄积的TBBPA达到一定量时又会抑制拟长腹剑水蚤的发育(见图 5、6)。盐度10、温度25 ℃条件下的0.310 mg·L-1的TBBPA表现出了对桡足类发育的抑制作用(见图 5、6),这可能是低盐高温促进了TBBPA在桡足类体内的积累达到了抑制效应浓度,从而表现出抑制作用。Piazza等[32]研究表明温度升高和盐度降低都能放大镉对纹藤壶幼虫的毒性效应。在拟长腹剑水蚤发育阶段,温度升高和盐度降低会使桡足类对TBBPA的摄入和吸收加快,进而增加了TBBPA在桡足类体内的蓄积量,蓄积量达到一定剂量,产生毒性效应。可以得出结论,温度的升高和盐度的降低放大了TBBPA对拟长腹剑水蚤的毒性效应。
在不同盐度和温度条件下,TBBPA对拟长腹剑水蚤繁殖过程的影响实验中,从产卵量、产卵间隔以及无节幼虫孵化率这3个指标可以得出结论:(1)在温度20~25,盐度10~30范围内,产卵间隔会随着温度的升高和盐度的降低而缩短(见图 7、8)。Cortney L. Ohs等[28]研究表明,桡足类的产卵间隔在随盐度升高而延长,而温度对产卵间隔的影响研究中,Andrew L. Rhyne等[23]指出,温度越高产卵间隔越短。可以得出结论高温低盐条件促进桡足类的新陈代谢,加速了卵的成熟,缩短了生活史周期。(2)在本文研究发现产卵量会随温度的升高而增加,而盐度对产卵量的影响不显著(见表 4)。P. Santhanam等[29]和Andrew L. Rhyne等[23]研究也分别表明,桡足类在15~26和24~28 ℃范围内,分别在26和28 ℃条件下产卵量达到最高。Ohs等[33]研究中也得出盐度10~35,对Pseudodiaptomuspelagicus的产卵量没有显著影响。温度升高会促进桡足类繁殖,而盐度影响不明显。(3)在对照组和TBBPA浓度组间的比较中发现,0.031和0.310 mg·L-1 TBBPA会缩短拟长腹剑水蚤的产卵间隔(见图 7),增加产卵量(见表 4),而无节幼虫的孵化率没有受到显著影响(见表 5)。这就说明温度升高和0.310 mg·L-1 TBBPA存在都会促进繁殖,而盐度变化对拟长腹剑水蚤的繁殖影响只表现在产卵间隔上。综上,温度、盐度、TBBPA都会对拟长腹剑水蚤繁殖过程产生影响,TBBPA对拟长腹剑水蚤繁殖的毒性效应受温度和盐度影响显著。
|
|
表 5 暴露在不同盐度不同温度不同浓度TBBPA中拟长腹剑水蚤的孵化率 Table 5 Hatching rate interval of O. similis expose to various concentrations of TBBPA under different salinity and temperature |
总之,温度、盐度、TBBPA对桡足类的生长、发育和繁殖有显著影响,另外,温度和盐度还会通过影响桡足类的新陈代谢水平,从而影响TBBPA的摄入量以及在体内的积累量,导致桡足类对TBBPA的敏感性变化。本文讨论了TBBPA对拟长腹剑水蚤的毒性效应,以及环境因子对这种毒性效应的影响,为之后污染检测提供较为完善的方法和材料。
| [1] |
Nuria Ortuo. Formation of brominated pollutants during the pyrolysis and combustion of tetrabromobisphenol A at different temperatures[J]. Environmental Pollution, 2014, 191: 31-37. DOI:10.1016/j.envpol.2014.04.006
(  0) 0) |
| [2] |
Sellström U, Jansson B. Analysis of tetrabromobisphenol A in a product and environmental samples[J]. Chemosphere, 1995, 31: 3085-3092. DOI:10.1016/0045-6535(95)00167-7
(  0) 0) |
| [3] |
Hakk H, Letcher R J. Metabolism in the toxicokinetics and fate of brominated flame retardants—a review[J]. Environ Int, 2003, 29: 801-828. DOI:10.1016/S0160-4120(03)00109-0
(  0) 0) |
| [4] |
Kovath C E, Chandler G T, Coall B C. Utility of a full life-cycle copepod bioassay approach of sediment-associated contaminant mixtures[J]. Marine Pollution Bulletin, 1999, 38: 692-701. DOI:10.1016/S0025-326X(99)00029-6
(  0) 0) |
| [5] |
Hamed El-Serehy1, Sawsan Aboul-Ezz, Amein Samaan, et al. On the ecological role of Copepoda in the Suez Canal marine ecosystem[J]. Egyptian Journal of Biology, 2001, 3: 116-123.
(  0) 0) |
| [6] |
曾艳艺, 黄小平. 重金属对海洋桡足类的影响研究进展[J]. 生态学报, 2010, 30(4): 1042-1049. Zeng Yanyi, Huang Xiaoping. The effects of heavy metals on marine copepods : A review[J]. Acta Ecologica Sinica, 2010, 30(4): 1042-1049. (  0) 0) |
| [7] |
Andre's H. Arias, AnissaSouissi, MarionRoussin, et al. Bioaccumulation of PAHs in marine zooplankton: An experimental study in the copepod Pseudodiaptomus marinus[J]. Environ Earth Sci, 2016, 75: 691. DOI:10.1007/s12665-016-5472-1
(  0) 0) |
| [8] |
XU Donghui, LIU Guangxing. The effects of DDT on the feeding, respiration, survival, and reproduction of Sinocala nustenellus (Copepoda: Calanoida)[J]. Acta Oceanol, 2014, 33(9): 133-138. DOI:10.1007/s13131-014-0524-4
(  0) 0) |
| [9] |
Yi Andy Xianliang, Han Jeonghoon, Lee Jae-Seong, et al. Ecotoxicity of triphenyltin on the marine copepod Tigriopus japonicus at various biological organisations: From molecular to population-level effects[J]. Ecotoxicology, 2014, 23: 1314-1325. DOI:10.1007/s10646-014-1274-y
(  0) 0) |
| [10] |
Jarvis TA1, Miller R J, Lenihan H S, et al. Toxicity of ZnO nanoparticles to the copepod Acartiatonsa, exposed through a phytoplankton diet[J]. Environ Toxicol Chem, 2013, 32(6): 1264-9. DOI:10.1002/etc.v32.6
(  0) 0) |
| [11] |
Claudia Castellani1, Carol Robinson, Tania Smith, et al. Temperature affects respiration rate of Oithonasimilis[J]. Marine Ecology Progress Series, 2005, 285: 129-135. DOI:10.3354/meps285129
(  0) 0) |
| [12] |
Humberto E. Gonzalez, Victor Smetacek. The possible role of the cyclopoid copepod Oithona in retarding vertical flux of zooplankton faecal material[J]. Marine Ecology Progress Series, 1994, 113: 233-246. DOI:10.3354/meps113233
(  0) 0) |
| [13] |
陈玛丽. 四溴双酚A对鱼类的毒性效应[D]. 上海: 华东师范大学, 2008. Chen Mali. Toxic Effects of Tetrabromobisphenol A (TBBPA) on Fish[D]. Shanghai: East China Normal University, 2008. http://cdmd.cnki.com.cn/Article/CDMD-10269-2008146301.htm (  0) 0) |
| [14] |
刘建梅, 刘济宁, 陈英文, 等. 四溴双酚A和三溴苯酚对大型溞的急性和慢性毒性[J]. 环境科学学报, 2015, 35(6): 1946-1954. Liu J M, Liu J N, Chen Y W, et al. Acute and chronic toxicity of tetrabromobisphenol A and tribromophenol to Daphnia magna[J]. Acta Scientiae Circumstantiae, 2015, 35(6): 1946-1954. (  0) 0) |
| [15] |
宫晓莉. 四溴双酚A(TBBPA)对栉孔扇贝毒性效应与差异基因筛选的研究[D]. 青岛: 中国海洋大学, 2012. Gong Xiaoli. Toxicity effects and different gene Selected in chlamysfarreri in Response to Exposure to Tetrabromobisphenol A[D]. Qingdao: Ocean university of China, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10423-1012505004.htm (  0) 0) |
| [16] |
Yang S W, Yan Z G, Xu F F, et al. Development of freshwater aquatic life criteria for tetrabromobisphenol A in China[J]. Environ Pollut, 2012, 169: 59-63. DOI:10.1016/j.envpol.2012.05.023
(  0) 0) |
| [17] |
Kwok K W H, Leung K M Y. Toxicity of antifouling biocides to the intertidal harpacticoid copepod Tigriopus japonicus (Crustacea, Copepoda): Effects of temperature and salinity[J]. Marine Pollution Bulletin, 2005(51): 830-837.
(  0) 0) |
| [18] |
黄瑛, 朱丽岩. 不同环境条件下三丁基氧化锡对火腿许水蚤(Schmakeria poplesia)的毒性效应[J]. 生态毒理学报, 2012, 7(2): 148-154. Huang Ying, Zhu Liyan. Toxic effects of bis(Tributyltin) oxide on calanoid copepod (Schmakeria poplesia) under different Environmental conditions[J]. Asian Journal of Ecotoxicology, 2012, 7(2): 148-154. (  0) 0) |
| [19] |
Raymond Gaudy, Guillermo Cervetto, Marc Pagano. Comparison of the metabolism of Acartiaclausi and A. tonsa: influence of temperature and salinity[J]. Journal of Experimental Marine Biology and Ecology, 2000, 247: 51-65. DOI:10.1016/S0022-0981(00)00139-8
(  0) 0) |
| [20] |
Changling Li, Xiaoxia Luo, Xianghu Huang, et al. Effects of Temperature, Salinity, pH, and Light on Filtering and Grazing Rates of a Calanoid Copepod (Schmackeria dubia)[J]. The Scientific World JOURNAL, 2008, 8: 1219-1227. DOI:10.1100/tsw.2008.153
(  0) 0) |
| [21] |
Siriporn Borrirukwisitsak, Helen E. Keenan and Caroline Gauchotte-Lindsay. Effects of Salinity, pH and Temperature on the Octanol-Water Partition Coefficient of Bisphenol A[J]. International Journal of Environmental Science and Development, 2012, 3: 460-464.
(  0) 0) |
| [22] |
Stottrup J G. The elusive copepods: their production and suitability in marine aquaculture[J]. Aquaculture, 2000, 31: 703-711. DOI:10.1046/j.1365-2109.2000.00488.x
(  0) 0) |
| [23] |
Rhyne A L, Ohs C L, Stenn E. Effects of temperature on reproduction and survival of the calanoid copepod Pseudodiaptomus pelagicus[J]. Aquaculture, 2009, 292: 53-59. DOI:10.1016/j.aquaculture.2009.03.041
(  0) 0) |
| [24] |
Santhanam P, Perumal P. Effect of temperature, salinity and algal food concentration on population density, growth and survival of marine copepod Oithonarigida Giesbrecht[J]. Indian Journal of Geo-Marine Sciences, 2012, 41(4): 369-376.
(  0) 0) |
| [25] |
Alexander K, Brazenor, Kate S. Hutson. Effect of temperature and salinity on egg hatching and description of the life cycle of Lernanth ropuslatis(Copepoda: Lernanthropidae) infecting barramundi, Latescalcarifer[J]. Parasitology International, 2013, 62: 437-447. DOI:10.1016/j.parint.2013.05.005
(  0) 0) |
| [26] |
Chinnery F E, Williams J A. The influence of temperature and salinity on Acartia nauplii (Copepoda: Calanoida) survival[J]. Marine Biology, 2004, 145: 733-738.
(  0) 0) |
| [27] |
Kyun Woo LEE, HeumGi PARK. Effect of temperature and salinity on productivity and growth of five copepod species[J]. J K or Fish Soc, 2005, 38(1): 12-19.
(  0) 0) |
| [28] |
Cortney L Ohs, Andrew L Rhyne, Scott W Grabe, et al. Effects of salinity on reproduction and survival of the calanoid copepod Pseudodiaptomus pelagicus[J]. Aquaculture, 2010, 307: 219-224. DOI:10.1016/j.aquaculture.2010.07.017
(  0) 0) |
| [29] |
Santhanam P, Perumal P. Feeding, survival, egg production and hatching rate of the marine copepod Oithonarigida Giesbrecht (Copepoda: Cyclopoida) under experimental conditions[J]. J. Mar Biol Ass, 2012, 54(1): 38-44.
(  0) 0) |
| [30] |
徐风风. 四溴联苯醚(BDE-47)对两种海洋桡足类动物的毒性效应[D]. 青岛: 中国海洋大学海洋生命学院, 2013: 1-63. http://www.cqvip.com/QK/88536X/201305/47779752.html
(  0) 0) |
| [31] |
Shayegan M, Fereidouni A E, Agh N, et al. Effects of salinity on egg and fecal pellet production, development and survival, adult sex ratio and total life span in the calanoid copepod, Acartiatonsa: a laboratory study[J]. Chinese Journal of Oceanology and Limnology, 2016, 34(4): 709-718. DOI:10.1007/s00343-016-5030-4
(  0) 0) |
| [32] |
Piazza V, Gambardella C, Canepa S, et al. Temperature and salinity effects on cadmium toxicity on lethal and sublethal responses of Amphibalanusam phitritenauplii[J]. Ecotoxicology and Environmental Safety, 2016, 8-17.
(  0) 0) |
| [33] |
Ohs C L, Rhyne A L, Grabe S W, et al. Effects of salinity on reproduction and survival of the calanoid copepod Pseudodiaptomus pelagicus[J]. Aquaculture, 2010, 307(3): 219-224.
(  0) 0) |
| [34] |
Trombini C, Hampel M, Blasco J, et al. Evaluation of acute effects of four pharmaceuticals and their mixtures on the copepod Tisbebattagliai[J]. Chemosphere, 2016, 319-328.
(  0) 0) |
 2018, Vol. 48
2018, Vol. 48


