2. 青岛海洋科学与技术试点国家实验室 海洋药物与生物制品功能实验室,山东 青岛 266237
甲壳素/壳聚糖(Chitin/Chitosan)被称为动物纤维,主要是以海洋虾蟹壳为原料提取制备,因此,称为海洋生物多糖,是自然界中唯一的聚阳离子多糖。甲壳素/壳聚糖的发现已经有260年历史了,但对其深入研究和应用是在近20年。2000年前后甲壳素/壳聚糖相关学术论文年全球发表量少于1 000篇,到2020年其年发表量已超过15 000篇,呈现出爆发式增长,相关研究成果在食品、轻工业、农业、医疗、环保等领域展现出巨大的应用前景。特别是在生物医用材料领域,因其良好的生物相容性、抑菌性、生物可降解性和促进创伤组织修复等特性,被用于血管支架、神经导管、创口贴、止血剂、预防粘连剂和引导组织再生等医用生物辅料。总结发现,甲壳素/壳聚糖功效的多样性不但取决于其骨架结构和官能团,还还受到材料表观物理形态的影响,如晶须、溶液、纤维、膜、凝胶、微/纳米颗粒及3D材料等,这些特殊形态结构为其生物功效的发挥起到非常重要的作用。
1 甲壳素/壳聚糖存在与基本结构甲壳素是自然界中除蛋白质外储量最大的含氮有机物,也是仅次于纤维素的第二大天然聚多糖。主要存在于部分节肢动物(如虾、蟹等)、软体动物、环节动物、原生动物、腔肠动物、海藻以及真菌中。在甲壳纲,如虾皮、蟹壳中甲壳素含量为20%~30%;在昆虫纲,如蚕、蝶、蚊、蝇等蛹壳中甲壳素含量为20%~60%;在多足纲,如蜘蛛、蝎等外甲中甲壳素含量达4%~22%。
甲壳素化学名称为β-(1, 4)-2-乙酰氨基-2-脱氧-D-葡萄糖(β-(1, 4)-2-acetylamino-2-deoxy-D-glucose),是由乙酰氨基葡萄糖结构单元以β-1,4糖苷键构成的直链聚多糖。其分子链规整性高,具有刚性,可形成分子内和分子间氢键,因此容易形成结晶结构。基于甲壳素分子内和分子间氢键类型的不同,自然状态的甲壳素分为三种晶型结构:α型、β型和γ型,分别具有不同的性质。自然界中α-甲壳素通常与矿物质沉积在一起,形成坚硬的外壳,常存在于节肢动物的角质层和一些真菌中。β-甲壳素分子链以平行方式排列,具有更多的无定型结构,多以水合物的形态存在,稳定性较低, 常存在于枪乌贼的外骨骼中。γ-甲壳素由三条糖链上下排列构成,其中两条链同向、一条链反向,属于一种二维有序而C轴无序的结晶,结构不稳定,易向其他晶型转变,主要存在于甲虫的茧和枪乌贼外骨骼。γ-甲壳素和β-甲壳素常与胶原蛋白相联结,表现出一定的硬度、柔韧度和流动性,还具有与支撑体不同的许多功能,如电解质的控制和聚阴离子物质的运送等。β-甲壳素和γ-甲壳素在一定条件下,可以转变成α-甲壳素,如γ-甲壳素在硫氰酸锂的作用下可转化为α-甲壳素,β-甲壳素在6 mol/L的盐酸中会变成α-甲壳素。
壳聚糖是甲壳素脱乙酰基后的产物,化学名称为β-(1, 4)-2-氨基-2-脱氧-D-葡萄糖(β-(1, 4)- 2-amino-2-deoxy-D-glucose), 分子链上分布着大量的羟基、氨基和一些残余的N-乙酰氨基,会形成各种分子内和分子间的氢键,进而形成结晶区。壳聚糖的晶体结构与其制备条件、水合程度等密切相关,呈现多种异构体。氨基的质子化导致壳聚糖可以在酸性水溶液中溶解,也是其与甲壳素理化性质的基本区别。
2 甲壳素晶须结构与性能甲壳素晶须(Chitin whiskers, CWs),是甲壳素的单晶形态,由甲壳素分子链有序堆积而成,外观呈纳米级针状,其分子链排列高度有序,具有高强度和高模量的特点,是一种性能优异、绿色环保的天然增强材料。CWs具有良好的生物可降解性、吸湿性、透湿性、抗菌性和生物相容性等。
我们实验室夏桂雪等[1]通过3 mol/L的硫酸煮沸加超声技术获得了CWs。透射电镜分析表明,CWs呈长棒状结构,形态一致,分布均匀。激光粒度仪测定CWs的长轴为(128.2±1.3) nm,短轴为(16.5±2.5) nm,zeta电位为+(23.4±) 2.6 mV。此外,CWs的双端点与处理过程中的硫酸发生作用后,有-NH3+形成,因而具有交联剂的部分性质。将CWs加入到羟丁基壳聚糖(Hydroxybutyl chitosan, HBC)温敏水凝胶(HBC-HG)中以研究CWs对HBC-HG的流变学性质的影响。结果表明CWs加入后HBC-HG仍可保持温敏性,CWs浓度与成胶温度呈负相关,与机械强度呈正相关。黄亮等[2]分别制备了不同来源的CWs:雪蟹壳晶须(CWSC)、中华绒鳌蟹壳晶须(CWCC)、草虾壳晶须(CWBS)和印度白虾壳晶须(CWIS),并对它们的理化性质、尺寸、表面电荷、红外光谱、XRD光谱、抗菌性和机械强度进行了比较(见图 1)。研究结果发现不同来源的CWs在形态和分散性方面非常相近,但粒径分布各有不同,抑菌性能也有差异,其中CWCC抑菌性最强,CWSC抑菌性最弱。抑菌性大小和Zeta电位大小呈正相关,且电荷的影响远大于尺寸的影响。用CWCC制备复合膜的杨氏模量、断裂强度和拉伸强度最大,四种CWs复合膜的杨氏模量、断裂强度和拉伸强度与其晶须尺寸大小成正比。
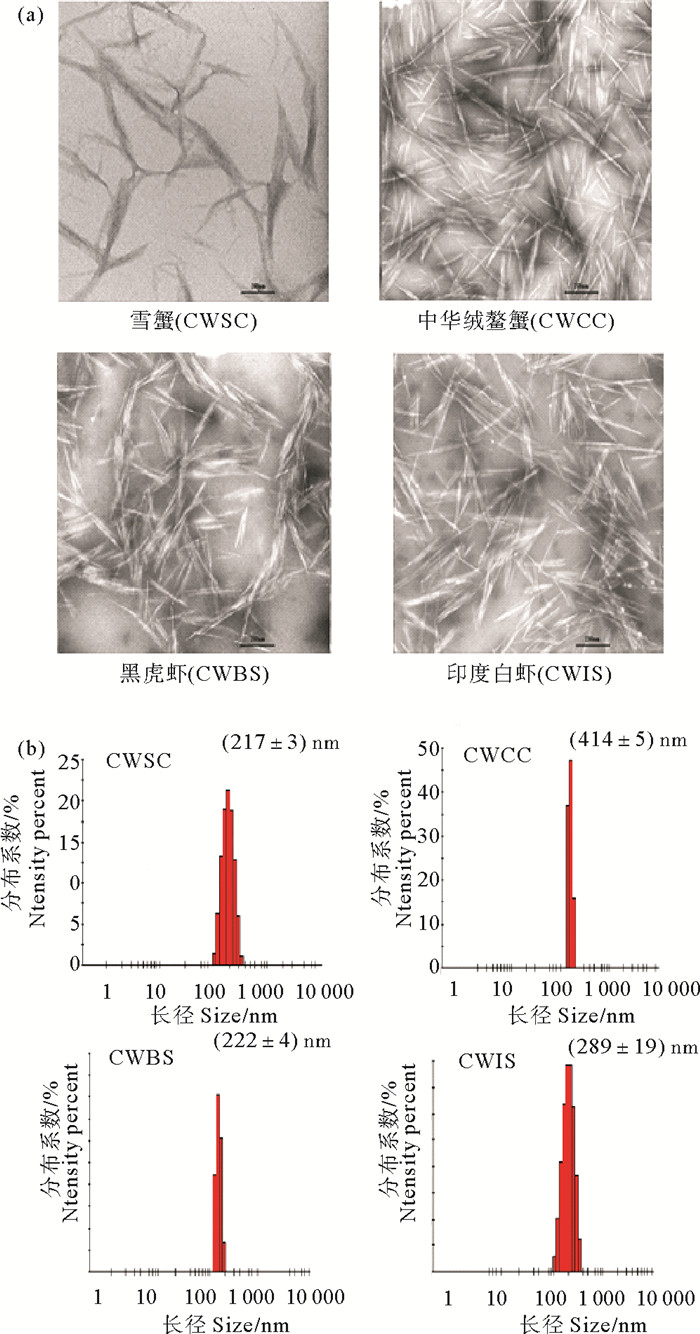
|
((a.晶须的电镜图片; b.晶须的粒度分布(n=3)。a. TEM images of chitosan whiskers; b. The particle size distribution(n=3).) ) 图 1 不同原料的甲壳素晶须(CWSC,CWCC,CWBS和CWIS) Fig. 1 Chitosan whiskers from different sources (CWSC, CWCC, CWBS和CWIS) |
水溶液是生物大分子之间相互作用的必然媒介,然而甲壳素和壳聚糖都是不溶于水的。甲壳素只能溶解于强酸性溶液、极性溶液和离子液中,为此人们不断探索温和的溶解方法。壳聚糖因其具有游离的氨基,可以溶解于稀醋酸溶液中,成为其常用溶剂,但酸溶液中水解导致的分子量下降和粘度不稳定成为其应用的主要障碍。本研究团队刘楠等[3]利用醋酸降解,研究了壳聚糖溶液的抑菌活性,研究结果发现在壳聚糖浓度高于200 mg/s才会显示出抑菌性,且低分子量壳聚糖对大肠杆菌(E. coli)的抑菌性要高于高分子量,而中分子量壳聚糖(9.0×104 Da)反而会促进细菌生长。李燕等[4]改进了溶解方法,采用非均相技术制备了固体壳聚糖醋酸盐,溶解后24 h内降解缓慢,并用琼脂平板法证明了0.15%(m/v)浓度的壳聚糖醋酸盐对金黄色葡萄球菌(S.aureus)和E.coli均具有100%的抑制效果。党奇峰等[5]用壳聚糖醋酸盐溶液涂覆在水果表面作为保鲜涂层,发现其具有抑菌和防止水分流失的作用,同时还可以诱导水果内过氧化物酶活性的增强,是一种很有潜力的食品保鲜材料。
化学修饰也是获得甲壳素/壳聚糖溶液(的)主要方法。陈西广等[6-7]研究报道了水溶性羧甲基化壳聚糖(O-carboxymethyl chitosans),其在水溶液中具有促进皮肤成纤维细胞生长和抑制瘢痕成纤维细胞生长的活性。李晶晶等[8]研制了羟丁基壳聚糖(HBC),其水溶液具有温度敏感性,可以实现溶液-凝胶两种状态间的可逆转变,是一种新型医用生物材料。周忠政等[9]研究了季铵盐壳聚糖(Quaternary ammonium chitosan),其溶液的抑菌活性得到极大提高。
甲壳素/壳聚糖的碱/尿素溶解体系是目前最新的溶解技术,最早由张丽娜等[10-12]提出,主要应用于纤维素的绿色溶解,随后被证明也适用于溶解甲壳素/壳聚糖,该技术需要低温(-20 ℃)和反复冻融。在此基础上,本研究团队的毕世超等[13-14]通过KOH与NaOH替换,以及壳聚糖预处理,缩短了溶解时间,实现2 h内溶解,过程绿色、温和,建立了KOH/尿素速溶体系。研究结果表明,该壳聚糖溶液4 ℃存放30 d仍保持良好的稳定性。紧密水合半径更小的K+能够形成比Na+更加稳定的复合氢键结构,是KOH/尿素体系比NaOH/尿素体系热稳定性更高的内在因素(见图 2)。这种新的溶解体系将在甲壳素/壳聚糖均相化学修饰和生物材料制造等领域表现出巨大的潜力。
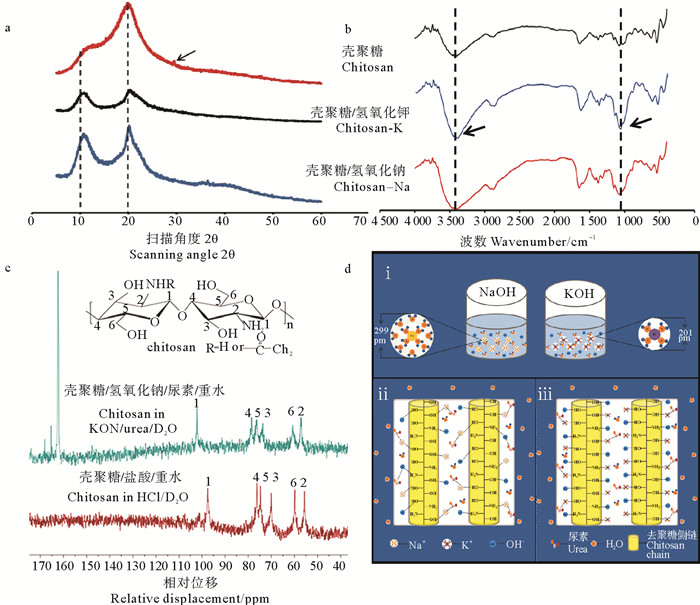
|
((a. X射线衍射; b.傅里叶红外光谱; c. 13C核磁共振图谱; d.溶解机制图. a. X-ray diffraction, b. FTIR; c. 13C NMR; d. dissolution and the mechanism.) ) 图 2 壳聚糖KOH/尿素和NaOH/尿素溶液系统 Fig. 2 Chitosan solution in the KOH/urea and NaOH/urea system |
此外,经生物酶、酸碱、微波等技术降解后,高聚合度的甲壳素/壳聚糖可以转变为分子量低于100 00 Da的壳寡糖,也具备溶解度高、易吸收、生物活性强等诸多特性[15]。
4 甲壳素/壳聚糖水凝胶水凝胶是由高分子聚合物与水组成的三维网络体系,类似于天然生物组织, 是一类新型的生物材料,被广泛应用于创伤敷料、药物释放、细胞培养、组织工程支架等生物医学领域。甲壳素/壳聚糖水凝胶因其良好的生物相容性、抑菌性、生物可降解性以及多方面的生物学活性而备受关注。
Chenite A等[16]和Ruel-Gariépy E等[17]研究发现壳聚糖稀醋酸溶液在低温下与β-甘油磷酸(Glycerol-β-phosphate)共混,升温到37 ℃能够形成稳定的水凝胶。本研究团队的周慧云等[18-19]用α,β-甘油磷酸(Glycerol-α,β-phosphate)制备了可注射型壳聚糖水凝胶(CS-α,β-GP),pH为6.8~7.2。发现溶液在低温下是由弱碱性的甘油磷酸盐以静电方式与壳聚糖分子上的氨基结合,保持水合状态,因此在中性条件下也不发生沉淀;当温度逐渐升高,体系中的氢键减弱,壳聚糖分子间的疏水作用增强,分子链相互缠绕交联,体系由溶胶状态转变为凝胶状态。吉秋霞等[20-21]利用壳聚糖(CS)、季铵盐壳聚糖(HTCC)复配α, β-GP制备了可原位注射温敏水凝胶(CS/HTCC-GP)。发现CS/HTCC-GP的溶胶-凝胶转变温度可控制在25 ℃以上,且能够包载和缓释生长因子,表现出优良的促进牙周组织再生效果;并且CS/HTCC-GP对常见牙周致病菌-牙龈卟啉单胞菌(Porphyromonas gingivalis)、中间普氏菌(Prevotella intermedia)和伴放线放线杆菌(Actinobacillus antinomycetemcomitans)有较强的抑制效果。党奇峰等[22-23]研究发现对虾淋巴细胞能够在CS-α,β-GP水凝胶上进行2D、3D培养和传代。吴广升等[24]研究发现用CS-α,β-GP可以实现基质细胞源性因子-1α和antimiR-138的原位控释,并促进颅骨再生。
本研究团队的李晶晶等[8, 25]制备了羟丁基壳聚糖水凝胶(HBC-gel), 不需任何交联剂, 仅通过升/降温度即实现溶液/凝胶之间的相转变,具有热可逆性。研究发现HBC-gel无细胞毒性、溶血率低、体内可降解、组织相容性良好。包子娴等[26-27]利用HBC-gel制备了包载5-氟尿嘧啶和地塞米松磷酸钠双药体系,开展了皮肤瘢痕组织修复研究,建立了瘢痕组织离体培养研究模式(见图 3),并发现其能够使瘢痕组织的结节状胶原束逐渐变细,变松散,检查到组织块中胶原束出现了先减少后增加的现象。
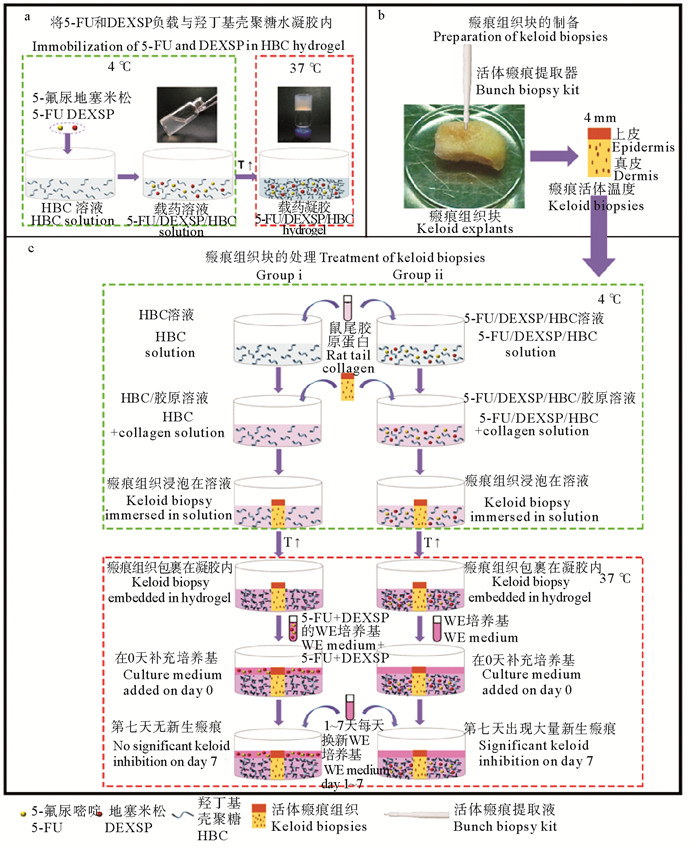
|
((a. 5-FU/DEXSP与HBC水凝胶复合;b.瘢痕疙瘩组织切片(Φ=4 mm); c.瘢痕疙瘩活检的治疗, i:5-FU/DEXSP/HBC组,WE培养基培养0天;ii:HBC组,含5-FU/DEXSP-5的WE培养基培养0天。两组均每日更换一半培养基,补充新鲜WE培养基至7 d。a. Incorporation of 5-FU and DEXSP into the HBC hydrogel. B. Keloid tissues were dissected into biopsies (4 mm diameter). C.Treatment of keloid biopsies. Group i, the keloid biopsies were embedded in the 5-FU/DEXSP/HBC-5 hydrogel, and cultured with WE culture medium on day 0; Group ii, the keloid biopsies were embedded in the HBC hydrogel, and cultured with WE culture medium containing 5-FU/DEXSP-5 solution on day 0. For both groups, half of the culture medium was changed every day and supplemented with fresh WE medium up to 7 days.) ) 图 3 HBC水凝胶和5-FU/DEXSP/HBC水凝胶体外治疗瘢痕疙瘩 Fig. 3 Schematic representation of the treatment of keloid tissues with the HBC hydrogel and the 5-FU/DEXSP/HBC hydrogel |
Duan等[28]结合低温冷冻和LiOH/KOH/尿素溶剂体系制备了高强度壳聚糖水凝胶。本研究团队毕世超等[29-30]构建了羟基磷灰石表层矿化壳聚糖/聚乙烯醇双网络水凝胶(见图 4)。研究结果表明矿化增强了水凝胶的机械强度、抗溶胀性和疏水性,表面微观结构有利于骨髓间充质干细胞的贴附、增殖和成骨分化,动物实验发现其能够降低骨损区炎症反应、提升成骨指示蛋白表达量,加速缺损部位骨再生和修复。
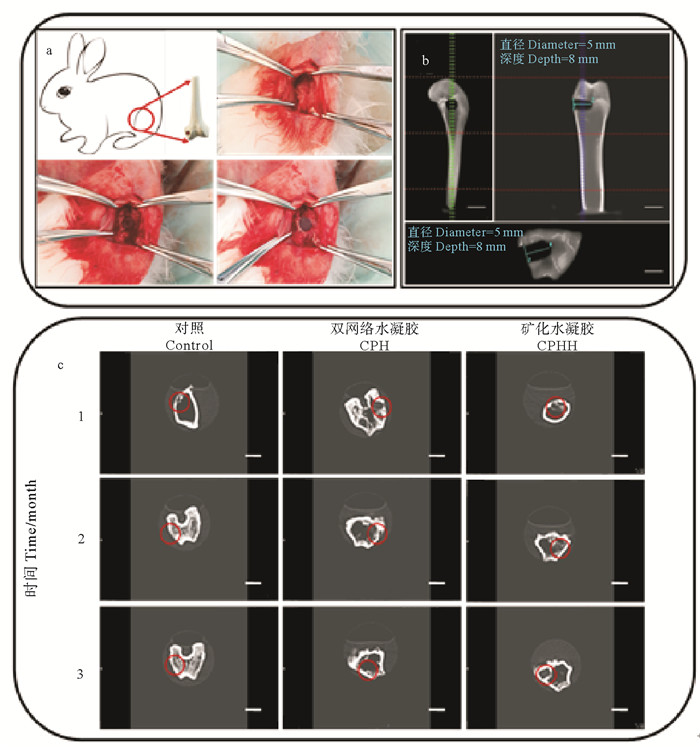
|
((a.将凝胶柱(直径5 mm,长度8 mm)植入缺损(直径5 mm,深度8 mm)股骨外侧髁骨中;b.骨缺损模型的CT图像。(前、纵、横);c.术后4、8、12周骨缺损的CT图像。(比例尺:1 cm) a.Illustration of gel implantation in the bone defect (5 mm in diameter and 8 mm in deep) created in the lateral femoral condyle, and a cylindrical shaped test samples (5.2 mm in diameter and 8 mm in length) were implanted into the bone defect; b. CT images of bone defects model. (Front, Longitudinal section and Cross section); c. CT images of gel implanted and nonimplanted bone defects after 4, 8 and 12 weeks. (Scale bar: 1 cm)) ) 图 4 兔股骨缺损模型及水凝胶修复 Fig. 4 Rabbit model of femoral defect and hydrogel repair |
甲壳素/壳聚糖溶液中加入膨化试剂或者直接冻干,可以制备成海绵状结构。其具有多孔、比表面积大、透气性和吸水性;还能够保持创面湿润、抗菌、止血、保护创面和促进创伤组织修复,已被临床应用于医用生物辅料。但由于壳聚糖的水不溶性,其海绵的亲水性较差,不能达到与创面无缝衔接或大面积伤口使用。本实验室胡世浩等[31]采用壳聚糖醋酸盐溶液和羟丁基壳聚糖(HBC)共混,制备成复合海绵(CS-HBC)。实验证明CS-HBC保持了壳聚糖原有的机械强度和性能,提升了亲水性(见图 5a)。研究发现CS-HBC复合海绵的孔径大小取决于壳聚糖与HBC的比例(见图 5b-f);CS-HBC可将游离水转化成结合水,长时间锁住水分维持伤口湿润环境;CS在复合海绵中起物理支撑作用,使HBC在水合态下保持良好的三维结构。CS-HBC支持上皮细胞的浸润、爬行、生长,能够加速创面愈合,并减少疤痕的产生;同时发现CS-HBC对革兰氏阳性菌(S. aureus)和革兰氏阴性菌(E. coli)都具有很好的抑制效果,其浸提液(60 mg/mL)的抑菌率达到了100%。

|
((a.复合海绵照片(直径13 mm; 厚10 mm); b~f.海绵多孔结构的电镜观察结构:CS、HC-1、HC-2、HC-3、HBC。A. Photograph of the sponge samples (13 mm diameter, 10 mm thickness). b~f. SEM image of the interior porous structure of the CS, HC-1, HC-2, HC-3, HBC.) ) 图 5 CS-HBC复合海绵 Fig. 5 CS-HBC Composite sponge |
甲壳素/壳聚糖作为高分子天然多糖具有良好的成膜性、生物相容性好、可被生物降解等优点,可被用作细胞培养支持物、药物缓释的载体、伤口愈合材料等。早在1985年,Popowicz等[32]用壳聚糖醋酸溶液蒸发制成透明薄膜,成功地用于细胞培养, 发现培养的细胞保持了与体内一样的生长形态和许多功能。随后,壳聚糖膜被制成人造皮肤,临床应用证明其不致敏、无刺激、无排斥、透气性好,可促进皮肤细胞生长,且有抑菌、止血和抑制瘢痕生长的效果,还把抗菌、抗病毒、抗炎等药物加入其中,将其植入患病处或口、鼻、粘膜等处,实现长时间持续给药治疗效果。
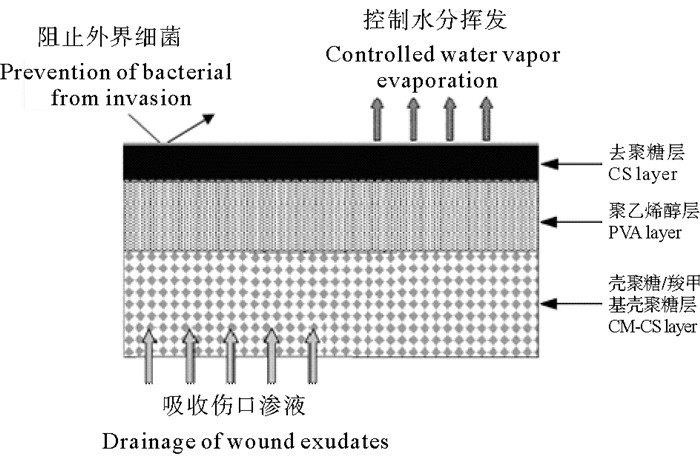
本研究团队的陈西广等[33]研究了不同分子量壳聚糖膜与生理小分子之间的相互作用,发现其对氯化钠、葡萄糖和氨基酸类均具有亲和性和透过性。郑立等[34]制备了不同分子量的壳聚糖膜与羧甲基壳聚糖膜(CMCH),研究了皮肤成纤维细胞的体外培养。实验结果表明,壳聚糖和CMCH在成膜性和通透性上都依赖于分子量;成纤维细胞可在两种膜上贴附和生长,不聚集脱落;并发现CMCH膜可以明显促进皮肤成纤维细胞的生长,且分子量越小,作用越显著。倪思亮[35]在此研究基础上,加入了PVA层,采用流延法制备了壳聚糖/PVA/羧甲基壳聚糖三层复合膜(C-P-C)。该复合膜是一种不对称膜,上层是具有抑菌作用的壳聚糖膜,中间是高韧性的PVA膜,下层是具有促进组织修复效果的羧甲基壳聚糖膜(见图 6)。实验结果表明,C-P-C透光性达80%以上,水蒸气通透性达到2 500 g·m-2·d-1,接近于人工皮肤理想状态的透气性指标。C-P-C复合膜对S. aureus、E. coli、白色念珠菌(C. albicans)均有接触性抑制;能明显促进创面愈合,有效地密封出血创面,有良好的创伤保护和修复功能,为其作为皮肤修复材料提供了理论依据。
|
图 6 C-P-C三层复合人工皮肤支架模型图 Fig. 6 Design of the C-P-C triple-layer artificial skin scaffold |
甲壳素因难溶解的问题,其纤维制备还存在技术障碍。目前能够实现壳聚糖纤维制备,包括普通纤维和纳米纤维。壳聚糖纤维(CS-fiber)具有诸多优良特性,如透气、吸湿、生物相容、抑菌等,被广泛应用于生物医药领域,如创口贴、止血纱布、止血棉球、手术缝合线和组织工程支架等。然而,临床应用中发现CS-fiber存在韧性低、吸水少、抑菌效果差等缺陷,对其医用功效有一定的限制。
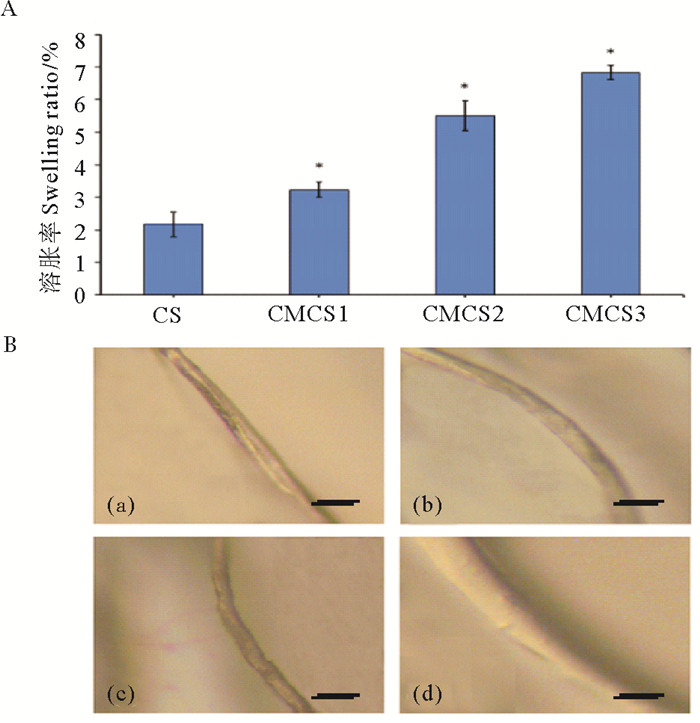
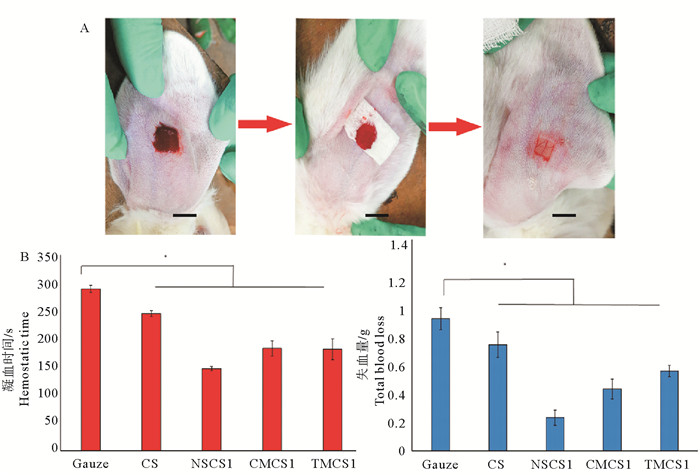
颜冬等[36-37]通过软糖纤维表层羧甲基化(CMCS)改性,制备了不同羧化度的壳聚糖纤维(见图 7)。发现其吸水溶胀效率显著提高,并与取代度成正比(见图 7A);溶胀后纤维表面呈凝胶状(见图 7B);CMCS纤维可抑制90%以上的S. aureus和80%以上的E. coli。孙国辉等[38]制备了琥珀酰改性的壳聚糖纤维(NSCS),其溶胀率提高了近10倍,相比于CMCS纤维,NSCS纤维吸水性更优越。夏桂雪等[39]研究发现NSCS纤维的琥珀酰基团可水解产生质子,供给氨基质子化,中性环境中对E. coli和S. aureus的抑制率均达90%以上。周忠政等[9]制备了季铵化壳聚糖纤维(TMCS),随着纤维表面季铵化程度提升,抑菌率也相应提高,高取代度(32%)TMCS纤维对E. coli的抑制率可达90%,对S. aureus可达99%,抑菌功效得到了极大提升。研究发现相比CS纤维,CMCS、NSCS和TMCS纤维无纺布可快速吸附伤口渗出血液。不同CS改性纤维表现出不同的止血效果,并与修饰基团和取代度密切相关。例如,NSCS纤维携带负电荷,可引发内源性凝血,在兔耳出血模型实验中止血效果更佳(见图 8)。
|
((A. CS-fiber和不同取代度的CMCS纤维的溶胀率(CS:CS-fiber,CMCS1:15.0%,CMCS2:20.6%,CMCS3:30.2%);B.显微照片:(a)干燥CS-fiber,(b)湿润CS-fiber, (c)干燥的CMCS纤维, (d)湿润的CMCS纤维。(比例尺:100 μm) A. The swelling rate of CS-fiber and CMCS fiber (CS:CS-fiber, CMCS1:15.0%, CMCS2:20.6%, CMCS3:30.2%); B. The micrographs of fiber:(a)dried CS-fiber, (b)wet CS-fiber, (c)dried CMCS fiber, (d)wet CMCS fiber. (Scale bar: 100 μm)) ) 图 7 壳聚糖纤维和羧甲基壳聚糖纤维溶胀率及显微照片 Fig. 7 Swelling ratio and micrographs of Chitosan fiber and CM-chitosan fiber |
|
((A.兔耳动脉损伤模型; B.止血时间和总失血量:纱布(Gauze)、壳聚糖纤维(CS)、低取代度琥珀酰壳聚糖纤维(NSCS1)、羧甲基壳聚糖纤维(CMCS1)和季铵化壳聚糖纤维(TMCS1)。(比例尺:1 cm) A. Rabbit artery injury model; B. Hemostasis time and total blood loss: Gauze, chitosan fiber(CS), succinyl chitosan fiber(NSCS1)、CM-chitosan fiber(CMCS1)and quaternary ammonium chitosan fiber(TMCS1). (Scale bar: 1 cm)) ) 图 8 壳聚糖纤维与兔耳型止血 Fig. 8 Chitosan fiber and rabbit ear hemostasis |
总之,经表面亲水改性的壳聚糖纤维,可吸附伤口渗出液形成凝胶,为伤口提供湿润的愈合环境,提高了抑菌活性,避免创面感染,并易于从伤口表面剥离,避免产生二次伤害。通过控制取代度,可实现溶胀行为仅发生在纤维表面,而核心仍保持纤维形态,维持敷料的机械性能。
8 甲壳素/壳聚糖微米球微球状甲壳素/壳聚糖(Chitin/chitosan microspheres, CM)一般指粒径范围在几微米到毫米的球状结构,具有良好的分散性和流动性。在载药、吸附、缓释、细胞微载体、植入栓塞剂等医用生物材料领域有广泛应用。根据需求的不同,其制备方法有多种,主要包括:乳化交联法(化学交联、离子交联和物理交联)、凝聚法、溶剂蒸发法、溶液包衣法、乙酰化法、喷雾法等。不同技术制备的CM在物理形态方面有明显的差异,如:光滑型、粗糙型、多孔型、空心型、实心型以及亲水型和疏水型等,其功效性能也明显不同。
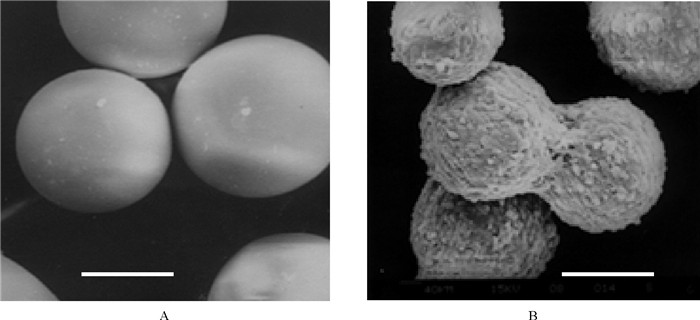
本研究团队陈西广等[40]曾用乳化交联技术制备了光滑型的CM,粒径分布在100~200 μm,密度1.01~1.06 g/cm3,比表面积3 000~4 000 cm2/g,扰动下能够悬浮于培养基中,静置时自然下沉(见图 9)。实验表明,该微球具有良好的细胞贴壁性,适合贴壁依赖性细胞附着和高密度生长,是一种良好的细胞生长微载体。孔明[41]通过对CM表面基团修饰,制备了疏水界面(乙酰化,油酰化)微球,和强亲水界面(羧甲基化)微球,用其建立了一种新型的壳聚糖抑菌分散体。研究表明,微球界面疏水性提高,能加快其表面细菌菌膜的渗透性,导致菌膜破坏和菌体死亡(见图 10)。同时发现用微球体系开展抑菌性研究,可以排除壳聚糖分子进入菌体内的干扰因素,是研究壳聚糖界面接触抑菌及其机理的理想模型。张维芬[42-44]采用喷雾干燥技术制备的复合CM具有蓬松的内外结构,粒径分布在0.5~7 μm,可显著提高茶碱的携载量,提高其用于肺吸入给药的生物利用度,是一种新型的哮喘治疗药物制剂。
|
((A.空白微球; B.皮肤成纤维细胞培养120 h。比例尺:100 μm,D比例尺1 μm。A. The chitosan microcarrier beads; B. The skin fibroblast growth on the beads 120 h. Scale bar: 100 μm.) ) 图 9 壳聚糖微球载体电镜扫描 Fig. 9 The SEM of micrographs of chitosan microcarriers |
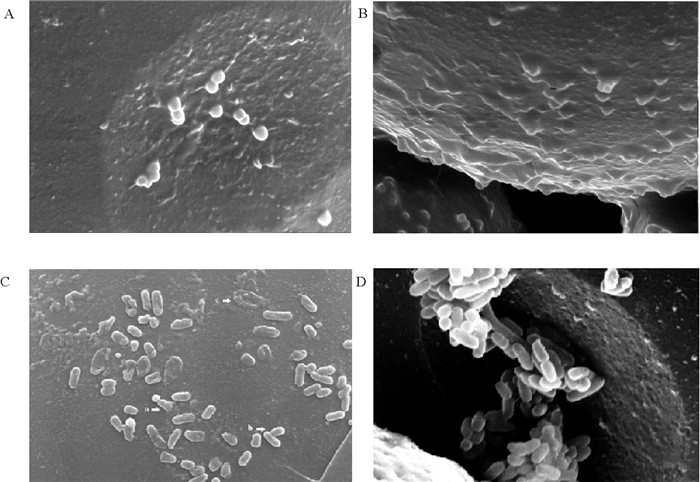
|
((A.壳聚糖微球与油酰壳聚糖微球; B.壳聚糖微球作用于S. aureus; C.壳聚糖微球与油酰壳聚糖微球; D.壳聚糖微球作用于E. coli。A、B、C比例尺:10 μm,D比例尺1 μm。A. Chitosan microspheres and oleoyl chitosan microspheres; B. S. aureus on chitosan microspheres; C. Chitosan microspheres and oleoyl chitosan microspheres; D. E. coli on chitosan microspheres. Scale bar for A, B and C was 10 μm, for D was 1 μm)) 图 10 壳聚糖微球界面抑菌照片:壳聚糖微球 Fig. 10 Antibacterial photos of chitosan microspheres interface:S.aureus on chitosan microspheres |
此外,基于CM粒径分布的可控性和生物相容性,其可被应用于血管栓塞剂。本研究团队的王启钊等[45]用乳化交联制备可变形CM,并进行了表面亲/疏水修饰。所制备的CM表面光滑,且粒径分布均一,体外血管栓塞实验效果良好。在此基础上,周旋等[46]对乙酰壳聚糖微球进行了动物栓塞实验研究,研究发现兔耳动脉栓塞后3 d,兔耳发炎水肿,耳尖血管发黑、结痂;栓塞后7 d,兔耳消肿,耳尖明显发黑、结痂、缺血性坏死;栓塞15 d,耳尖部位小动脉萎缩消失,周围组织干性坏死,部分发生脱落。表明该栓塞微球能有效的阻止血液流动,栓塞效果显著。
9 甲壳素/壳聚糖纳米载体纳米药物载体是一种属于纳米级范畴的亚微粒药物递送系统,近年来,在生物、医疗和制药领域中表现出巨大的应用潜力和发展空间。壳聚糖具有亲水性,这一性质可以减少其纳米颗粒被巨噬细胞吞噬,有利于体内循环; 同时, 壳聚糖良好的生物相容性、无毒性、生物可降解性使其更加安全。壳聚糖纳米颗粒(Chitosan nanoparticles)的制备有很多报道,包括:共价交联法、离子交联法、沉淀析出法、大分子复合法、自组装法等。壳聚糖纳米组装始见于1995年, Amiji[47]用单分子荧光探针吡,发现了壳聚糖在水溶液中产生的自聚集现象。之后Lee等[48]将脱氧胆酸接枝到壳聚糖分子链上,强化了壳聚糖的定向自聚集性,制备的纳米级胶束可以装载和递送基因。
本研究团队陈西广等[49]曾采用亚油酸修饰壳聚糖成功制备了自组装纳米载体(Oleyl chitosan nano-carriers, OCNC),粒径200~600 nm,核心富亚油酸基,呈疏水性;外壳则富集壳聚糖,呈亲水性。OCNC具有携载脂溶性药物(维生素E)的功能,可以良好的分散在水相中。李彦艳等[50-51]采用油酸修饰壳聚糖实现了自聚集纳米载体的制备,并完成了抗菌药物利福平(rifampicin)的包载和释药。在此基础上,刑珂等[52-54]进行了壳聚糖纳米抑菌体系构建。研究结果发现其对E. coli和S. aureus最小抑菌浓度在31.25~125 mg/L之间,是通过吸附于细菌表面,诱导细胞壁破裂,胞浆溢出实现有效杀菌。张静等[55-58]将化疗药物阿霉素(doxorubicin)包载于油酰壳聚糖纳米载体中,研究了A549 cells对壳聚糖纳米药物的摄取,结果显示纳米载体表现出良好的药物递送功能和抗肿瘤活性。孔明等[59-60]进一步研究发现壳聚糖纳米载体能够显著提高细胞透过效率,实现胞内释药,达到抗癌目的。
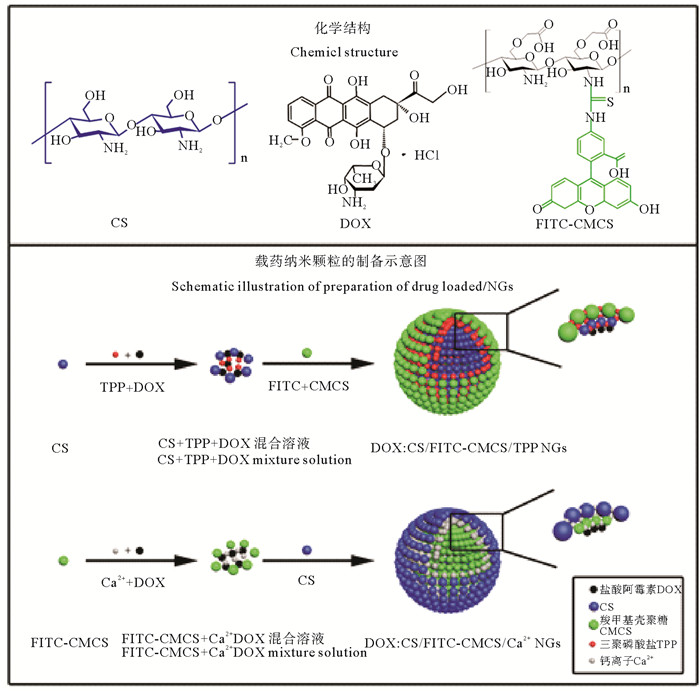
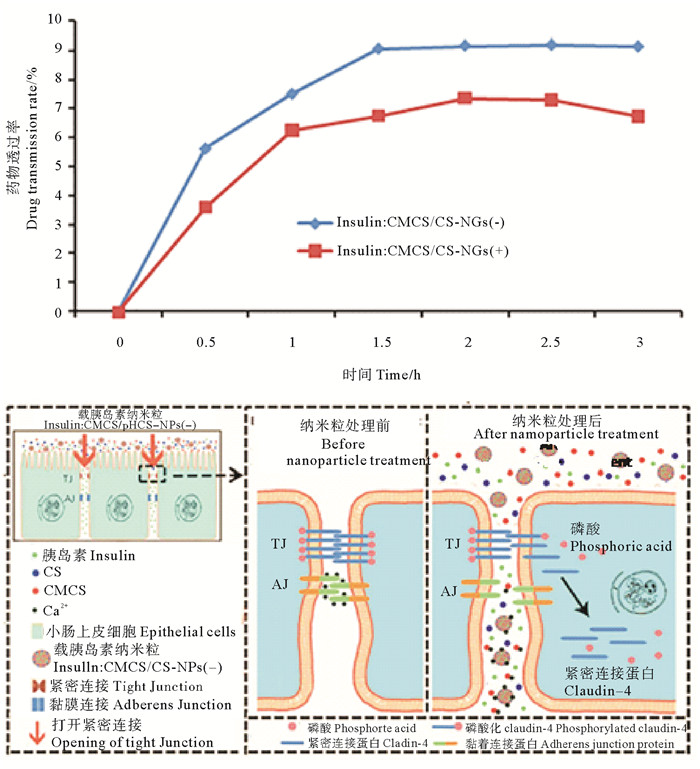
本研究团队的刘雅等[61-64]采用壳聚糖纳米颗粒作为载体实现了疫苗的口服递送,采用双亲性壳聚糖衍生物与透明质酸制备复合纳米颗粒,包载细菌抗原分子(蛋白质及DNA),对鲤鱼进行口服给药,能够在鲤鱼的血清中检测到高水平的抗体,达到很好的口服免疫效果。高萍等[65]用壳聚糖/羧甲基壳聚糖纳米粒包载卵清蛋白进行口服疫苗递送,并检测了纳米载体在大菱鲆体内36 h的分布情况,结果显示荧光纳米粒主要分布在后肠、肝脏和脾脏中,显著提高了疫苗的口服利用率。冯超等[66-68]采用壳聚糖与CMCS复合纳米载体包载化疗药物DOX,研究其在大鼠小肠部位的吸收效率(见图 11)。结果表明,DOX在大鼠小肠部位实现了有效的渗透和吸收,生物利用度达到42%。王娟等[69-70]制备两种了表面电荷相反的壳聚糖/CMCH复合纳米载体,粒径240~260 nm,对于胰岛素的包封率和载药率分别达到了75%和30%。动物实验结果表明,负电荷纳米载体对血糖控制效果要明显优与正电荷组。并进一步研究发现了肠道粘膜吸收的两个途径:(1)通过网格蛋白介导,以及非网格蛋白依赖性的内吞途径,经肠道细胞转运进入体循环;(2)通过打开细胞间紧密连接,经细胞旁途径进入体循环(见图 12)。壳聚糖纳米颗粒羧甲基可以打开细胞间紧密连接,促进胞间吸收,这一作用可能是通过改变紧密连接蛋白claudin-4的去磷酸化水平来实现的。
|
图 11 壳聚糖复合纳米药物DOX:CS/CMCS/TPP NGs和DOX:CS/CMCS/Ca2+ NGs Fig. 11 Preparation of DOX:CS/CMCS/TPP NGs and DOX:CS/CMCS/Ca2+ NGs |
|
((A.药物透过率:Insulin: CMCS/CS-NPs(+)和insulin:CMCS/CS-NPs(-)中的胰岛素在Caco-2细胞单层中4 ℃的表观渗透系数(Papp)(n=4);B.纳米载体透黏膜机制B:CMCS/CS纳米粒介导的可逆的紧密连接(TJ)开放机制。A. Drug transmittance:insulin:CMCS/CS-NPs(+) and insulin:CMCS/CS-NPs(-) on Caco-2 monolayer, (4 ℃, n=4);B. The mechanism of nanaocarrier through mucosa:Reversible tight junction (TJ) opening mechanism mediated by CMCs / CS-NPs.) ) 图 12 CMCs/CS-NG携载胰岛素的肠粘膜渗透与释放 Fig. 12 Infiltration and release of insulin in intestinal mucosa by CMCs/CS-NG |
本研究团队的杨奎昆等[71-72]制备的叶酸-HBC纳米载体,研究结果表明,其具有乳腺癌靶向性和温度敏感性,能实现在肿瘤组织内部高效释药。周忠政等[73]用季铵盐化壳聚糖制备了纳米载体,体内外实验结果验证了其能够靶向作用于口腔菌斑生物膜,并提高抗菌药物的定向杀菌能力。胡芳等[74]的研究表明,季铵化壳聚糖/脂质体/多西环素复合纳米粒对牙龈卟啉单胞菌(Porphyromonas gingivalis)和中间普氏菌(Prevotella intermedia)的抑制能力相比季铵化壳聚糖提高了三倍。而且动物实验表明,该复合纳米粒可附着在牙龈表面,持续杀灭细菌,并阻止细菌生物膜的形成。于晓萍等[75]采用物理包埋与化学接枝相结合,将西替利嗪(Cetirizine)包载到壳聚糖纳米颗粒中,制备了双级释药的纳米载体,体外实验取得了良好的鼻黏膜给药效果,适用于慢性鼻炎的局部用药。
壳聚糖还可以制备成更多有特殊功能的复合纳米载体,例如我们实验室马方奎等[76]制备了壳聚糖-PLGA复合纳米载体,李静等[77]制备了壳聚糖-PLA复合纳米载体;冯超等[78]制备了多层复合壳聚糖-褐藻胶纳米递送载体。大量的研究结果表明,纳米状态的壳聚糖载体具有良好载药、递药和释药等功能,在纳米药物领域具有巨大的应用潜力。
10 甲壳素/壳聚糖的3D打印材料3D生物打印是指能够将细胞、生长因子和支架结合在一起形成整体结构的一种新兴技术,同时能够实现不同类型的细胞在支架内部准确定位,进行有序的相互作用,实现组织功能化。适合壳聚糖的3D打印技术,需要在常温或者低温下进行,尤其是复合有细胞或生长因子等活性物质的打印,条件更加苛刻,既要求材料具有一定的流动性,保证快速精确打印,又要具有合适的固化方法,能完成立体塑形,同时在打印过程中还要保持细胞等的生物活性。因此,壳聚糖所具有的多种物理形态有利于其3D生物打印领域发挥重要作用,如壳聚糖温敏水凝胶、微球、纳米载体、晶须等都可以作为3D生物打印的良好“墨水”。单独壳聚糖材料的力学性能比较差,壳聚糖水凝胶与细胞等组装形成的三维结构没有抗压能力或抗缝合能力,因此需要将壳聚糖与其他材料如生物陶瓷、聚合物等结合起来,才能为细胞形成功能组织(或器官)提供稳定的结构和环境。打印功能化壳聚糖基生物支架,还需要制造技术、材料科学、生物学和医学等多个学科交叉结合。整个打印系统工艺还需要进行生物安全性评估和相应法规及标准考核。因此,通过3D生物打印实现组织或器官的修复和功能重建,将是一项长期且很有意义的科研方向。
11 总结与展望甲壳素/壳聚糖已经成为日益重要的医用生物材料,其物理结构,特别是其微纳米结构和物理形态对其活性功效的发挥起到越来越不可忽视的作用,且在创伤修复、组织引导再生、抑菌、止血、智能化、药物递送和3D打印材料等领域不断被发现和验证。这些研究结果为甲壳素/壳聚糖在医用生物材料制造和相关领域的研究提供了良好的引导和借鉴,但进一步实现其应用仍然极具挑战性,需要广大科研工作者的不懈努力。
致谢: 本文在资料整理和撰写过程中得到了程晓杰、孔明、刘雅、冯超、毕世超、王梦阳等同仁的大力协助,一并致谢!
| [1] |
Xia G, Liu Y, Tian M, et al. Nanoparticles/thermosensitive hydrogel reinforced with chitin whiskers as a wound dressing for treating chronic wounds[J]. Journal of Materials Chemistry B, 2017, 5(17): 3172-3185. DOI:10.1039/C7TB00479F
(  0) 0) |
| [2] |
Huang L, Bi S, Pang J, et al. Preparation and characterization of chitosan from crab shell (Portunus trituberculatus) by NaOH/urea solution freeze-thaw pretreatment procedure[J]. International Journal of Biological Macromolecules, 2020, 147: 931-936. DOI:10.1016/j.ijbiomac.2019.10.059
(  0) 0) |
| [3] |
Liu N, Chen X G, Park H J, et al. Effect of MW and concentration of chitosan on antibacterial activity of Escherichia coli[J]. Carbohydrate Polymers, 2006, 64(1): 60-65.
(  0) 0) |
| [4] |
Li Y, Chen X G, Liu N, et al. Physicochemical characterization and antibacterial property of chitosan acetates[J]. Carbohydrate Polymers, 2007, 67: 227-232. DOI:10.1016/j.carbpol.2006.05.022
(  0) 0) |
| [5] |
Dang Q F, Yan J Q, Li Y, et al. Chitosan acetate as an active coating material and its effects on the storing of Prunus avium L[J]. Journal of Food Science, 2010, 75(2): S125-S131.
(  0) 0) |
| [6] |
Chen X G, Wang Z, Liu W S, et al. The effect of carboxymethyl -chitosan on proliferation and collagen secretion of normal and keloid skin fibroblasts[J]. Biomaterials, 2002, 23: 4609-4614. DOI:10.1016/S0142-9612(02)00207-7
(  0) 0) |
| [7] |
Chen X G, Park H J. Chemical characteristics of O-carboxymethyl chitosans related to the preparation conditions[J]. Carbohydrate Polymer, 2003, 53(4): 355-359.
(  0) 0) |
| [8] |
李晶晶, 党奇峰, 程晓杰, 等. 壳聚糖羟丁基衍生物的制备及性质[J]. 吉林大学学报, 2011, 49(5): 958-963. Li JJ, Dang Q F, Cheng X J, et al. Preparation and properties of chitosan hydroxybutyl derivatives[J]. Journal of Jilin University, 2011, 49(5): 958-963. (  0) 0) |
| [9] |
Zhou Z, Yan D, Cheng X, et al. Biomaterials based on N, N, N-trimethyl chitosan fibers in wound dressing applications[J]. International Journal of Biological Macromolecules, 2016, 89: 471-476. DOI:10.1016/j.ijbiomac.2016.02.036
(  0) 0) |
| [10] |
Fang Y, Duan B, Lu A, et al. Intermolecular interaction and the extended wormlike chain conformation of chitin in NaOH/urea aqueous solution[J]. Biomacromolecules, 2015, 16(4): 1410-1417. DOI:10.1021/acs.biomac.5b00195
(  0) 0) |
| [11] |
Liu H, Liu J, Qi C, et al. Thermosensitive injectable in-situ forming carboxymethyl chitin hydrogel for three-dimensional cell culture[J]. Acta Biomaterialia, 2016, 35: 228-237. DOI:10.1016/j.actbio.2016.02.028
(  0) 0) |
| [12] |
Peng N, Ai Z, Fang Z, et al. Homogeneous synthesis of quaternized chitin in NaOH/urea aqueous solution as a potential gene vector[J]. Carbohydrate Polymers, 2016, 150: 180-186. DOI:10.1016/j.carbpol.2016.04.110
(  0) 0) |
| [13] |
Bi S, Bao Z, Bai X, et al. Tough chitosan hydrogel based on purified regeneration and alkaline solvent as biomaterials for tissue engineering applications[J]. International Journal of Biological Macromolecules, 2017, 104(Pt A): 224-231.
(  0) 0) |
| [14] |
Bi S, Hu S, Zhou Z, et al. The green and stable dissolving system based on KOH/urea for homogeneous chemical modification of chitosan[J]. International Journal of Biological Macromolecules, 2018, 120(Pt A): 1103-1110.
(  0) 0) |
| [15] |
Yue L, Sun D, Mahmood Khan I, et al. Cinnamyl alcohol modified chitosan oligosaccharide for enhancing antimicrobial activity[J]. Food Chemistry, 2020, 309: 125513. DOI:10.1016/j.foodchem.2019.125513
(  0) 0) |
| [16] |
Chenite A, Chaput C, Wang D, et al. Novel injectable neutral solutions of chitosan form biodegradable gels in situ[J]. Biomaterials, 2000, 21: 2155-2161. DOI:10.1016/S0142-9612(00)00116-2
(  0) 0) |
| [17] |
Ruel-Gariépy E, Leclair G, Hildgen P, et al. Thermosensitive chitosan-based hydrogel containing liposomes for the delivery of hydrophilic molecules[J]. Journal of Control Release, 2002, 82: 373-383. DOI:10.1016/S0168-3659(02)00146-3
(  0) 0) |
| [18] |
Zhou H Y, Wang J, Zhang W F, et al. Preparation, cytotoxicity and degradability of chitosan-based thermosensitive hydrogels as drug delivery system[J]. Advanced Materials Research, 2009, 79(82): 1531-1534.
(  0) 0) |
| [19] |
Zhou H Y, Chen X G, Kong M, et al. Preparation of chitosan-based thermosensitive hydrogels for drug delivery[J]. Journal of Applied Polymer Science, 2009, 112(3): 1509-1515. DOI:10.1002/app.29721
(  0) 0) |
| [20] |
Ji Q X, Chen X G, Zhao Q S, et al. Injectable thermosensitive hydrogel based on chitosan and quaternized chitosan and the biomedical properties[J]. Journal of Materials Science: Materials in Medicine, 2009, 8(20): 21603-21610.
(  0) 0) |
| [21] |
Ji Q X, Zhong D Y, Lü R, et al. In vitro evaluation of the biomedical properties of chitosan and quaternized chitosan for dental applications[J]. Carbohydrate Research, 2009, 344(11): 1297-1302. DOI:10.1016/j.carres.2009.05.014
(  0) 0) |
| [22] |
Dang Q F, Yan J Q, Li J J, et al. Controlled gelation temperature, pore diameter and degradation of a highly porous chitosan-based hydrogel[J]. Carbohydrate Polymers, 2011, 83: 171-178. DOI:10.1016/j.carbpol.2010.07.038
(  0) 0) |
| [23] |
Dang Q F, Yan J Q, Lin H, et al. Design and evaluation of a highly porous thermosensitive hydrogel with low gelation temperature as a 3D culture system for Penaeus chinensis lymphoid cells[J]. Carbohydrate Polymers, 2012, 88: 361-368. DOI:10.1016/j.carbpol.2011.12.014
(  0) 0) |
| [24] |
Wu G, Feng C, Quan J, et al. In situ controlled release of stromal cell-derived factor-1α and antimiR-138 for on-demand cranial bone regeneration[J]. Carbohydrate Polymers, 2018, 182: 215-224. DOI:10.1016/j.carbpol.2017.10.090
(  0) 0) |
| [25] |
Li J, Shi Q, Wu X, et al. In vitro and in vivo evaluation of 3D biodegradable thermo/pH sensitive sol-gel reversible hydroxybutyl chitosan hydrogel[J]. Materials Science and Engineering: C, 2020, 108: 110419. DOI:10.1016/j.msec.2019.110419
(  0) 0) |
| [26] |
Bao Z, Jiang C, Wang Z, et al. The influence of solvent formulations on thermosensitive hydroxybutyl chitosan hydrogel as a potential delivery matrix for cell therapy[J]. Carbohydrate Polymers, 2017, 170: 80-88. DOI:10.1016/j.carbpol.2017.04.038
(  0) 0) |
| [27] |
Bao Z, Gao P, Xia G, et al. A thermosensitive hydroxybutyl chitosan hydrogel as a potential co-delivery matrix for drugs on keloid inhibition[J]. Journal of Materials Chemistry B, 2016, 4: 3936-3944. DOI:10.1039/C6TB00378H
(  0) 0) |
| [28] |
Duan J, Liang X, Cao Y, et al. High strength chitosan hydrogels with biocompatibility via new avenue based on constructing nanofibrous architecture[J]. Macromolecules, 2015, 48(8): 2706-2714. DOI:10.1021/acs.macromol.5b00117
(  0) 0) |
| [29] |
Bi S, Bao Z, Bai X, et al. Tough chitosan hydrogel based on purified regeneration and alkaline solvent as biomaterials for tissue engineering applications[J]. International Journal of Biological Macromolecules, 2017, 104(Pt A): 224-231.
(  0) 0) |
| [30] |
Bi S, Wang P, Hu S, et al. Construction of physical-crosslink chitosan/PVA double-network hydrogel with surface mineralization for bone repair[J]. Carbohydrate Polymers, 2019, 224(15): 115176.
(  0) 0) |
| [31] |
Hu S, Bi S, Yan D, et al. Preparation of composite hydroxybutyl chitosan sponge and its role in promoting wound healing[J]. Carbohydrate Polymers, 2018, 184: 154-163. DOI:10.1016/j.carbpol.2017.12.033
(  0) 0) |
| [32] |
Popowicz P, Kurzyca J, Dolinska B. Cultivation of MDCK epithelial cells on chitosan membranes[J]. Biomed Biochim Acta, 1985, 44(9): 1329-1333.
(  0) 0) |
| [33] |
Chen X G, Zhen L, Wang Z, et al. Molecular affinity and permeability of different molecular weight chitosan membranes[J]. Journal of Agriculture Food Chemistry, 2002, 50(21): 5915-5918. DOI:10.1021/jf020151g
(  0) 0) |
| [34] |
郑立, 陈西广, 刘万顺, 等. 羧甲基壳聚糖膜对皮肤成纤维细胞相容性研究[J]. 生物化学与生物物理学学报, 2003, 30(2): 314-319. Zheng L, Chen X G, Liu W S, et al. Biocompatibility of carboxymethyl chitosan membrane to skin fibroblasts[J]. Acta Biochimica et Biophysica Sinica, 2003, 30(2): 314-319. (  0) 0) |
| [35] |
倪思亮, 陈西广, 钟德玉, 等. 壳聚糖与羧甲基壳聚糖复合不对称膜生物相容性[J]. 高技术通讯, 2005, 15(8): 61-66. Ni S L, Chen X G, Zhong D Y, et al. Biocompatibility of composite asymmetric membrane of chitosan and carboxymethyl chitosan[J]. High Technology Letters, 2005, 15(8): 61-66. DOI:10.3321/j.issn:1002-0470.2005.08.012 (  0) 0) |
| [36] |
Yan D, Zhou Z Z, Jiang C, et al. Sodium carboxymethylation-functionalized chitosan fibers for cutaneous wound healing application[J]. Frontiers of Materials Science, 2016, 4: 1-9.
(  0) 0) |
| [37] |
Yan D, Hu S H, Zhou Z Z, et al. Different chemical groups modification on the surface of chitosan nonwoven dressing and the hemostatic properties[J]. International Journal of Biological Macromolecules: Structure, Function and Interactions, 2018, 107: 463-469.
(  0) 0) |
| [38] |
Sun G, Feng C, Kong M, et al. Development of part-dissolvable chitosan fibers with surface N-succinylation for wound care dressing[J]. Frontiers of Materials Science, 2015, 9: 272-281. DOI:10.1007/s11706-015-0303-y
(  0) 0) |
| [39] |
Xia G, Lang X, Kong M, et al. Surface fluid-swellable chitosan fiber as the wound dressing material[J]. Carbohydrate Polymers, 2016, 136: 860-866. DOI:10.1016/j.carbpol.2015.09.074
(  0) 0) |
| [40] |
Chen X G, Liu C S, Liu C G, et al. Preparation and biocompatibility of chitosan microcarriers as biomaterial[J]. Biochemical Engineering Journal, 2006, 27: 269-274. DOI:10.1016/j.bej.2005.08.021
(  0) 0) |
| [41] |
Kong M, Chen X G, Liu C S, et al. Antibacterial mechanism of chitosan microshperes in a solid dispersing system against E. coli[J]. Colloids and Surfaces B: Biointerfaces, 2008, 65(2): 197-202. DOI:10.1016/j.colsurfb.2008.04.003
(  0) 0) |
| [42] |
Zhang W F, Chen X G, Li P W, et al. Preparation and characterization of carboxymethyl chitosan and β-cyclodextrin microspheres by spray drying[J]. Drying Technology, 2008, 26: 108-115.
(  0) 0) |
| [43] |
Zhang W F, Chen X G, Li P W, et al. Preparation and characterization of theophylline loaded chitosan/β-cyclodextrin microspheres[J]. Journal of Materials Science: Materials in Medicine, 2008, 19: 305-310.
(  0) 0) |
| [44] |
Zhang W F, Zh ou, H Y, Chen X G, et al. Biocompatibility study of theophylline/chitosan/ β-cyclodextrin microspheres as pulmonary delivery carriers[J]. Journal of Materials Science: Materials in Medicine, 2009, 20(6): 1321-1330. DOI:10.1007/s10856-008-3680-2
(  0) 0) |
| [45] |
Wang Q Z, Chen X G, Li Z X, et al. Preparation and blood coagulation evaluation of chitosan microspheres[J]. Journal of Materials Science: Materials in Medicine, 2008, 19: 1371-1377. DOI:10.1007/s10856-007-3243-y
(  0) 0) |
| [46] |
Zhou X, Kong M, Cheng X J, et al. In vitro and in vivo evaluation of chitosan microspheres with different deacetylation degree as potential embolic agent[J]. Carbohydrate Polymers, 2014, 113: 304-313. DOI:10.1016/j.carbpol.2014.06.080
(  0) 0) |
| [47] |
Amiji M M. Pyrene fluorescence study of chitosan self-association in aqueous solution[J]. Carbohydrate Polymers, 1995, 26: 211-213. DOI:10.1016/0144-8617(94)00095-B
(  0) 0) |
| [48] |
Lee K Y, Kwon I C, Kim Y H, et al. Preparation of chitosan self-aggregates as a gene delivery system[J]. Journal of Controlled Release, 1998, 51: 213-220. DOI:10.1016/S0168-3659(97)00173-9
(  0) 0) |
| [49] |
Chen X G, Lee C M, Park H J. O/W emulsification for the self-aggregation and nanoparticle formation of linoleic acid-modified chitosan in the aqueous system[J]. Journal of Agriculture Food Chemistry, 2003, 51(10): 3135-3139. DOI:10.1021/jf0208482
(  0) 0) |
| [50] |
Li Y Y, Chen X G, Liu C S, et al. Effect of the molecular mass and degree of substitution of oleoylchitosan on the structure, rheological properties, and formation of nanoparticles[J]. Journal of Agriculture Food Chemistry, 2007, 55: 4842-4847. DOI:10.1021/jf062648m
(  0) 0) |
| [51] |
Li Y Y, Chen X G, Zhang J, et al. In vitro release of rifampicin and biocompatibility of oleoylchitosan nanoparticles[J]. Journal of Applied Polymer Science, 2008, 111(5): 2269-2274.
(  0) 0) |
| [52] |
Xing K, Chen X G, Li Y, et al. Antibacterial activity of oleoyl-chitosan nanoparticles: A novel antibacterial dispersion system[J]. Carbohydrate Polymers, 2008, 74: 117-120.
(  0) 0) |
| [53] |
Xing K, Chen X G, Liu C S, et al. Oleoyl-chitosan nanoparticles inhibits Escherichia coli and Staphylococcus aureus by damaging the cell membrane and putative binding to extracellular or intracellular targets[J]. International Journal of Food Microbiology, 2009, 132: 127-133. DOI:10.1016/j.ijfoodmicro.2009.04.013
(  0) 0) |
| [54] |
Xing K, Chen X G, Kong M, et al. Effect of oleoyl-chitosan nanoparticles as a novel antibacterial dispersion system on viability, membrane permeability and cell morphology of Escherichia coli and Staphylococcus aureus[J]. Carbohydrate Polymers, 2009, 76(1): 17-22.
(  0) 0) |
| [55] |
Zhang J, Chen X G, Li Y Y, et al. Self-assembled nanoparticles based on hydrophobically modified chitosan as carriers for doxorubicin[J]. Nanomedicine: Nanotechnology, Biology and Medicine, 2007, 3(4): 258-265. DOI:10.1016/j.nano.2007.08.002
(  0) 0) |
| [56] |
Zhang J, Chen X G, Liu C S, et al. Investigation of polymeric amphiphilic nanoparticles as antitumor drug carriers[J]. Journal of Materials Science: Materials in Medicine, 2009, 20: 991-999. DOI:10.1007/s10856-008-3656-2
(  0) 0) |
| [57] |
Zhang J, Chen X G, Peng W B, et al. Uptake of oleoyl-chitosan nanoparticles by A549 cells[J]. Nanomedicine: Nanotechnology, Biology and Medicine, 2008, 4(3): 208-214. DOI:10.1016/j.nano.2008.03.006
(  0) 0) |
| [58] |
Zhang J, Chen X G, Sun G Z, et al. Effect of molecular weight on the oleoyl-chitosan nanoparticles as carriers for doxorubicin[J]. Colloids and Surfaces B: Biointerfaces, 2010, 77: 125-130. DOI:10.1016/j.colsurfb.2009.12.020
(  0) 0) |
| [59] |
Kong M, Park H J, Cheng X J, et al. Spatial-temporal event adaptive characteristics of nanocarrier drugdelivery in cancer therapy[J]. Journal of Controlled Release, 2013, 172: 281-291. DOI:10.1016/j.jconrel.2013.08.022
(  0) 0) |
| [60] |
Kong M, Zuo Y, Wang M, et al. Simply constructed chitosan nanocarriers with precise spatiotemporal control for efficient intracellular drug delivery[J]. Carbohydrate Polymers, 2017, 169: 341-350. DOI:10.1016/j.carbpol.2017.03.090
(  0) 0) |
| [61] |
Liu Y, Cheng X J, Dang Q F, et al. Preparation and evaluation of oleoyl-carboxymethy-chitosan (OCMCS) nanoparticles as oral protein carriers[J]. Journal of Materials Science: Materials in Medicine, 2012, 23(2): 375-384. DOI:10.1007/s10856-011-4470-9
(  0) 0) |
| [62] |
Liu Y, Zang H D, Kong M, et al. In vitro evaluation of mucoadhesion and permeation enhancement of polymeric amphiphilic nanoparticles[J]. Carbohydrate Polymers, 2012, 89(2): 453-460. DOI:10.1016/j.carbpol.2012.03.028
(  0) 0) |
| [63] |
Liu Y, Kong M, Cheng X J, et al. Self-assembled nanoparticles based on amphiphilic chitosan derivative and hyaluronic acid for gene delivery[J]. Carbohydrate Polymers, 2013, 94: 309-316. DOI:10.1016/j.carbpol.2012.12.058
(  0) 0) |
| [64] |
Liu Y, Kong M, Feng C, et al. Biocompatibility, cellular uptake and biodistribution of the polymeric amphiphilic nanoparticles as oral drug carriers[J]. Colloids and Surfaces B: Biointerfaces, 2013, 103: 345-353. DOI:10.1016/j.colsurfb.2012.11.012
(  0) 0) |
| [65] |
Gao P, Xia G, Bao Z, et al. Chitosan based nanoparticles as protein carriers for efficient oral antigen delivery[J]. International Journal of Biological Macromolecules, 2016, 91: 716-723. DOI:10.1016/j.ijbiomac.2016.06.015
(  0) 0) |
| [66] |
Feng C, Wang Z, Jiang C, et al. Chitosan/o-carboxymethyl chitosan nanoparticles for efficient and safe oral anticancer drug delivery: In vitro and in vivo evaluation[J]. International Journal of Pharmaceutics, 2013, 457: 158-167. DOI:10.1016/j.ijpharm.2013.07.079
(  0) 0) |
| [67] |
Feng C, Sun G, Wang Z, et al. Transport mechanism of doxorubicin loaded chitosan based nanogels across intestinal epithelium[J]. European Journal of Pharmaceutics and Biopharmaceutics, 2014, 87(1): 197-207. DOI:10.1016/j.ejpb.2013.11.007
(  0) 0) |
| [68] |
Feng C, Li J, Kong M, et al. Surface charge effect on mucoadhesion of chitosan based nanogels for local anti-colorectal cancer drug delivery[J]. Colloids and Surfaces B: Biointerfaces, 2015, 128: 439-447. DOI:10.1016/j.colsurfb.2015.02.042
(  0) 0) |
| [69] |
Wang J, Xu M, Cheng X, et al. Positive/negative surface charge of chitosan based nanogels and lts potential influence on oral insulin delivery[J]. Carbohydrate Polymers, 2016, 136: 867-874. DOI:10.1016/j.carbpol.2015.09.103
(  0) 0) |
| [70] |
Wang J, Kong M, Zhou Z, et al. Mechanism of surface charge triggered intestinal epithelial tight junction opening upon chitosan nanoparticles for insulin oral delivery[J]. Carbohydrate Polymers, 2017, 157: 596-602. DOI:10.1016/j.carbpol.2016.10.021
(  0) 0) |
| [71] |
Yang K K, Kong M, Wei Y N, et al. Folate-modified-chitosan-coated liposomes for tumor-targeted drug delivery[J]. Journal of Materials Science, 2013, 48: 1717-1728. DOI:10.1007/s10853-012-6930-0
(  0) 0) |
| [72] |
Yang K K, Gao T, Bao Z, et al. Preparation and characterization of a novel thermosensitive nanoparticle for drug delivery in combined hyperthermia and chemotherapy[J]. Journal of Materials Chemistry B, 2013, 1: 6442-6448. DOI:10.1039/c3tb20772b
(  0) 0) |
| [73] |
Zhou Z, Hu F, Hu S, et al. Ph-activated nanoparticles with targeting for the treatment of oral plaque biofilm[J]. Journal of Materials Chemistry B, 2018, 6(4): 586-592. DOI:10.1039/C7TB02682J
(  0) 0) |
| [74] |
Hu F, Zhou Z, Xu Q, et al. A novel pH-responsive quaternary ammonium chitosan-liposome nanoparticles for periodontal treatment[J]. International Journal of Biological Macromolecules, 2019, 129: 1113-1119. DOI:10.1016/j.ijbiomac.2018.09.057
(  0) 0) |
| [75] |
Yu X, Mu Y, Xu M, et al. Preparation and characterization of mucosal adhesive and two-step drug releasing cetirizine-chitosan nanoparticle[J]. Carbohydrate Polymers, 2017, 173: 600-609. DOI:10.1016/j.carbpol.2017.05.067
(  0) 0) |
| [76] |
Ma F K, Li J, Kong M, et al. Preparation and hydrolytic erosion of differently structured PLGA nanoparticles with chitosan modification[J]. International Journal of Biological Macromolecules, 2013, 54: 174-179. DOI:10.1016/j.ijbiomac.2012.12.019
(  0) 0) |
| [77] |
Li J, Kong M, Cheng X J, et al. Preparation of biocompatible chitosan grafted poly(lactic acid) nanoparticles[J]. International Journal of Biological Macromolecules, 2012, 51(3): 221-227. DOI:10.1016/j.ijbiomac.2012.05.011
(  0) 0) |
| [78] |
Feng C, Song R, Sun G, et al. Immobilization of coacervate microcapsules in multilayer sodium alginate beads for efficient oral anticancer drug delivery[J]. Biomacromolecules, 2014, 15(3): 985-996. DOI:10.1021/bm401890x
(  0) 0) |
2. Laboratory for Marine Drugs and Bioproducts, Pilot National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266237, China
 2020, Vol. 50
2020, Vol. 50

