2. 长岛海洋生态文明综合试验区海洋经济促进中心, 山东 烟台 265800
随着环渤海地区经济的发展和人类对海洋资源不合理的开发利用,海洋生态环境受到一定程度的干扰和破坏[1-2]。长岛位于黄海和渤海交汇处,由于其海域适合海洋生物的生长繁殖,因此海洋渔业和水产养殖是该地区长期主要经济来源。近年来,由于海岛开发规划的缺乏、渔业和养殖业规模的扩大以及大型作业机器的污染物排放等问题的存在,受污染的海水势必会对该海域的海洋生态造成威胁[3]。而保护海洋生物多样性在维持和调控长岛海域生态系统生产力、渔业以及藻类的生长等方面发挥着重要作用,因此评估长岛海域的海洋生物多样性也是保护该海域海洋生态的必要研究之一。
浮游植物是海洋的初级生产力[4],在水生生态系统物质循环、能量流动和信息传递中占有重要地位[5]。童毅等[6]和王媛媛等[7]对长岛周边海域的浮游植物和环境因子进行了调查,阐述了不同季节浮游植物的优势物种以及环境因子对浮游植物的影响。浮游动物也是海洋生态系统的重要组成部分[8-9],其作为海洋生物泵的主要驱动者,具有将能量在食物链中向更高营养级传递的能力[10]。韦章良等[3]首次对长岛海域浮游动物种的时空分布进行了调查研究,阐明了浮游动物群落结构的季节性变化特征,也总结了影响浮游动物时空分布的温度、盐度和溶解氧含量等关键环境因子。大型底栖动物同样对生态系统的平衡和稳定起着重要作用[11-12],底栖生物的敏感特性使其可以作为监测海水环境变化的良好指示生物[13]。王金宝等[14]对长岛潮间带大型底栖动物的研究发现,软体动物和甲壳动物为该海域底栖生物量的主要成分, 但该海域底栖生物的物种数、平均密度和生物量均没有明显的季节变化规律。虽然已经有许多关于长岛地区的海洋生物季节变化与环境因子的研究,但与研究单一类的浮游生物相比,全面对浮游植物、浮游动物和底栖生物进行生态学统计并揭示其相互作用关系,同时探究环境因子的影响,能够更全面地阐述海洋生态系统中复杂的海洋生物网络。
本研究连续三年在春季和秋季(2019年4月、2019年10月、2020年10月、2021年4月以及2021年10月)对长岛海域的浮游植物、浮游动物和底栖生物进行了多样性调查。运用最新的生态学统计分析方法来探究以下科学问题:(1)长岛海域浮游动物、浮游植物以及底栖生物的季节性变化规律及其同关键的环境因子的关系;(2)浮游动物、浮游植物和底栖生物三者间的相互作用关系,以及具有季节性变化的标记性物种。本研究结果为长岛海域渔业资源的合理利用以及海洋生态环境的保护提供理论支撑。
1 材料与方法 1.1 样品采集现场调查工作严格按照《海洋调查规范》(GB12763—2007)、《海洋监测规范》(GB17378—2007)和《近岸海域环境监测技术规范》(HJ422—2020)进行。采样时间为2019年4月(T1,春季)、2019年10月(T2,秋季)、2020年10月(T3,秋季)、2021年4月(T4,春季)和2021年10月(T5,秋季)。2020年春季因疫情未采集。采样站位的设置严格按照文献[15]的要求,根据海区实际调查情况,将调查海区划分为资源分布较为均匀的小区域:S1、S2、S3、S4、S5、S6、S7和S8为示范区;S9、S10、S11和S12为对照区。具体的采样位点如图 1所示。
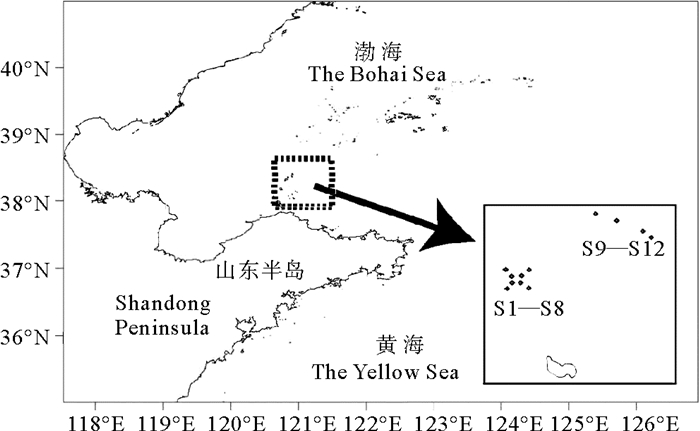
|
图 1 长岛海域采样位点信息 Fig. 1 Information of sampling sites in the Changdao Island Sea |
以浅水Ⅲ型浮游生物网(网口直径为37 cm,网全长1.5 m,筛绢孔径0.076 mm)和浅水Ⅰ型浮游生物网自海底至表层垂直拖网,样品经5%福尔马林溶液固定保存浮游植物和浮游动物。以开口面积为0.06 m2的抓斗式表面采泥器采集海底泥样,将生物样品经1 mm套筛淘洗后,以75%酒精固定保存底栖生物。
海洋浮游植物、浮游动物以及底栖生物的检测参照文献[16]进行。检测方法均为镜检法,使用的仪器分别为BM2000生物显微镜、Z00M645体视显微镜以及Z00M645体视显微镜。室内分析鉴定按照文献[16-17]中规定的方法进行,用浮游植物、浮游动物和底栖生物的个体密度(cells/m3、个/m3和个/m2)作为调查水域的现存量指标。
1.3 环境因子的测定根据文献[18]及监测方案,水质样品以开闭式有机玻璃采水器采集瞬时样品。
水温、pH值、溶解氧、化学需氧量、硝酸盐、亚硝酸盐、铵盐以及活性磷酸盐的检测均参照文献[19]进行。其中,水温的检测使用颠倒温度计法(SWJ-73),使用pH计测定海水的酸碱度,使用碘量法进行溶解氧的测定,而硝酸盐、亚硝酸盐、铵盐和活性磷酸盐的测定分别使用的是锌镉还原法、盐酸萘乙二胺比色法、次溴酸盐氧化法和磷钼蓝分光光度法,均在UV-1100紫外可见分光光度计下进行。
1.4 数据统计分析本研究所有的数据分析及可视化均在R 3.5.2软件环境下进行。两组数据的独立性分析均使用均值方差检验,多组数据的差异性分析使用最小显著性差异法(Least-significant difference, LSD),两组数据的相关性分析均使用Pearson相关性检验。
使用vegan软件包[20]计算浮游植物、浮游动物和底栖生物的物种α多样性(Shannon指数),基于Bray-Curtis距离对浮游植物、浮游动物和底栖生物的物种分布进行非度量多维尺度分析(Non-metric multidimensional scaling,NMDS)。使用典范对应分析(Canonical correspondence analysis,CCA)探究浮游植物、浮游动物和底栖生物三者群落同环境因子的关系,同时使用Mantel相关性分析来探究浮游植物、浮游动物和底栖生物三者群落的组成同环境因子的相关性。使用基于Spearman相关性的网络分析探究海洋生物之间的相互关系,使用随机森林分类模型来探究季节变化的代表性物种。本研究的显著性水平均为P<0.05。
2 结果 2.1 浮游植物、浮游动物和底栖生物的物种多样性在为期3年共5个周期的循环取样中,每个位点经多次采样得到的浮游植物物种数量平均值的变化范围为4~16,在T5中所检测到的浮游植物物种数量平均值最多,为13个。T1和T4阶段所检测到的浮游植物物种数量平均值最少,分别为6.4和5.1个。从LSD检验的结果来看,T1和T4中所检测到的浮游植物的物种数目均显著低于T2、T3和T5所检测到的物种数目(P<0.05),即长岛海域浮游植物在春季的物种数目显著低于其在秋季的物种数目(见图 2(A))。所检测到的浮游动物的物种数目变化范围为4~18。在T2阶段所检测到的浮游动物的物种数目最多,为13.3个,其次是在T3阶段所检测到的浮游动物的物种数目,为12.6个。在T4阶段所检测到的浮游动物的物种数目最少,为7.3个。与浮游植物的趋势相同,所检测到的浮游动物在T1和T4阶段的物种数目均显著低于其在T2、T3和T5(P<0.05)阶段的物种数目,即春季长岛海域浮游动物的物种数目显著低于秋季。而对于底栖生物,在T3阶段检测到的底栖生物物种数目最多,为18.2个,在T5阶段所检测到的底栖生物物种数目最少,为3.8个。底栖生物春秋季节变化不如浮游植物和浮游动物明显,仅在2021年春季(T4)阶段,底栖生物的物种数目显著高于冬季。
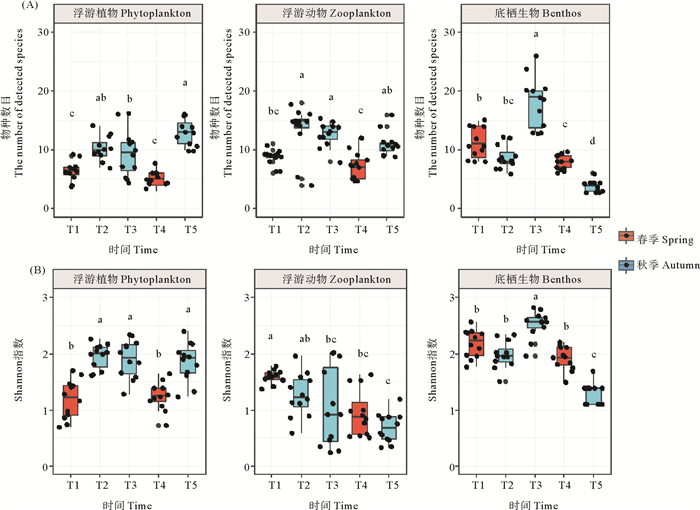
|
( (A)检测到的物种数目;(B)以Shannon指数表示物种多样性。T1—T5表示不同采样时间;a、b、c、d均表示使用LS-T检验的差异的显著性,如标记a所代表的p值显著大于标记b所代表的p值,标记b所代表的p值显著大于标记c所代表的p值,标记ab所代表的p值与bc所代表的p值无显著差异。(A)The number of detected species; (B)The α-diversity shown in Shannon index。T1—T5 represent different sampling times; a, b, c and d all indicate the significance of the difference using the LS-T test. For example, the p-value represented by marker a is significantly greater than the p-value represented by marker b, the p-value represented by marker b is significantly greater than that represented by marker c, and the p-value represented by marker ab is not significantly different from the p-value represented by bc. ) 图 2 不同时间所检测到的浮游植物、浮游动物和底栖生物的α多样性 Fig. 2 α-diversity of phytoplankton, zooplankton and benthos at different times |
从物种多样性来看(见图 2(B)),浮游植物在春季的多样性(T1和T4阶段)的Shannon指数分别为1.2和1.3显著低于其在秋季的多样性(T2、T3和T5阶段的Shannon指数分别为2.0、1.9和1.9)。浮游动物在春、秋两季的多样性指数并未呈现显著差异。底栖生物的多样性和物种数目之间正相关,在2019年的春、秋两季的物种多样性差异不显著,而在2021年的春季底栖生物的多样性指数显著高于秋季。
2.2 浮游植物、浮游动物和底栖生物的物种分布情况由NMDS的分析结果可见(见图 3),浮游植物和浮游动物的群落结构随着时间的变化呈现出时间差异性(PERMANOVA检验,P<0.05),且在春、秋两季中,浮游植物的群落结构和浮游动物的群落结构也差异显著。不同于物种数目和多样性的是,浮游植物和浮游动物的群落结构一直处于动态变化之中。5个时期底栖生物的群落结构也呈现出时间差异性(PERMANOVA检验,P<0.05),但底栖动物不同时间段之间的Bray-Curtis距离明显低于浮游植物和浮游动物二者各自不同时间段之间的Bray-Curtis距离,且长岛海域地区底栖生物春季和秋季的群落结构差异不显著(PERMANOVA检验,P>0.05)。
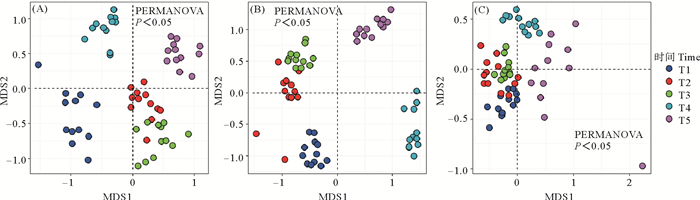
|
( T1—T5表示不同采样时间。(A)浮游植物;(B)浮游动物; (C)底栖生物。T1—T5 represent different sampling times. (A)Phytoplankton; (B)Zooplankton; (C)Benthos. ) 图 3 浮游植物、浮游动物和底栖生物的β多样性 Fig. 3 β-diversity of phytoplankton, zooplankton and benthos |
从总丰度变化情况看(见图 4),浮游植物春季的总丰度显著低于秋季(LSD, P<0.05)(T1和T4阶段的总丰度分别为27 089和14 825个/m3,而T2、T3和T5阶段的总丰度分别为48 581、37 243和326 326个/m3)。T1—T5阶段的优势物种分别为具槽帕拉藻(Paralia sulcata )、尖刺伪菱形藻(Nitzschia pungens)、密连角毛藻(Chaetoceros densus)和圆筛藻(Coscinodiscus sp.)。在2021年秋季(T5阶段)浮游植物呈现出了爆发式的增长,其总丰度显著高于其他4个时期,该阶段的圆筛藻和具槽帕拉藻的丰度分别为95 643和73 333个/m3。
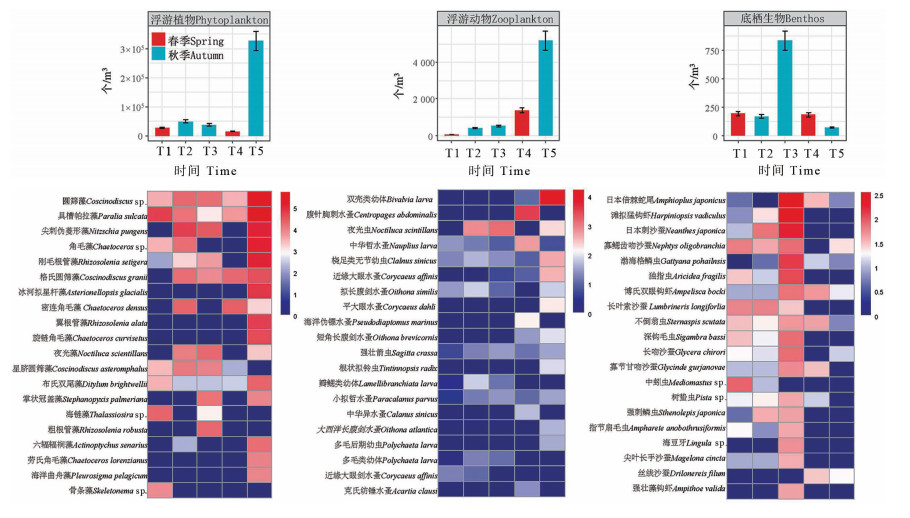
|
( 用物种丰度取平方根并进行对数转换来表示相对丰度;T1—T5表示不同采样时间。Species abundances were averaged and log-transformed to represent the relative abundances; T1—T5 represent different sampling times. ①浮游植物Environmental; ②浮游动物Factors; ③底栖生物Phytoplankton. ) 图 4 不同时间所检测到的浮游植物、浮游动物和底栖生物的物种丰度变化 Fig. 4 Abundance of phytoplankton, zooplankton and benthos at different times |
浮游动物的丰度并未呈现出季节性差异,从T1到T5阶段其丰度一直呈现升高的状态(从T1阶段的41个/m3到T5阶段的5 189个/m3),这与浮游动物的物种多样性呈现了相反的变化趋势。T1—T5阶段的优势种分别为桡足类无节幼虫(Nauplius larva (Copepoda))、夜光虫(Noctiluca scintillans)、腹针胸刺水蚤(Centropages abdominalis)和双壳类幼体(Bivalvia larva)。与浮游植物的增长势头相同,在2021年秋季(T5阶段), 浮游动物也出现了爆发式的增长,其优势种双壳类幼体的丰度高达4 548个/m3。
底栖生物总丰度的变化同其物种数目和多样性均呈现一致的规律,在T3阶段丰度达到最高,为836个/m3,其优势种为日本倍棘蛇尾(Amphioplus japonicus)和滩拟猛钩虾(Harpiniopsis vadiculus),而2019年的春、秋两季差异不显著,2021年的春季总丰度显著高于秋季总丰度(LSD, P<0.05)。
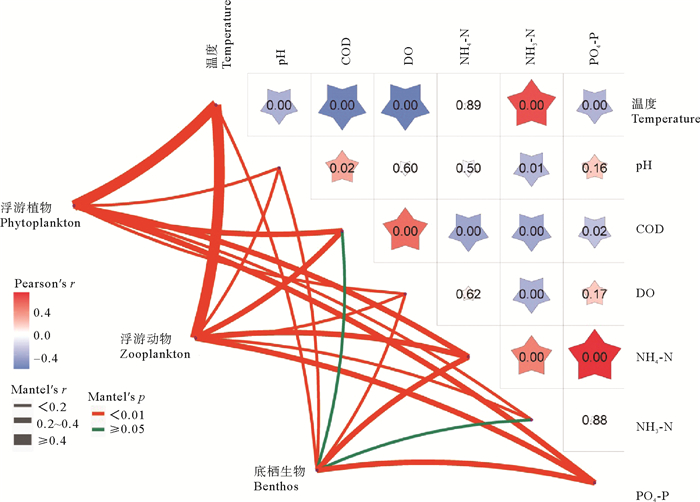
2.4 环境因子对浮游植、动物和底栖生物群落的影响从浮游植物、浮游动物和底栖生物的群落组成与环境因子Mantel相关性来看(见图 5),温度的变化始终是影响浮游植物、浮游动物和底栖生物群落变化的最主要因素,其次为活性磷酸盐。温度、pH、化学需氧量、溶解氧含量、氨氮含量、硝酸盐含量和活性磷酸盐含量同浮游植物和浮游动物的群落组成均呈现显著相关性,而底栖生物化学需氧量和硝酸盐并未与底栖生物的群落结构呈现相关性。由此可见,长岛海域地区环境因子对浮游植物和浮游动物的影响大于对底栖生物的影响。
|
( 矩阵部分为环境因子之间的相关性,连线部分表示浮游植物、浮游动物和底栖生物与环境因子的Mantel分析。The matrix is the correlation between environmental factors, the lines represent the Mantel analysis of phytoplankton, zooplankton, benthos and environmental factors. ) 图 5 环境因子与浮游植物、浮游动物和底栖生物的Mantel相关性分析 Fig. 5 Mantel test between environmental factors and phytoplankton, zooplankton, benthos |
以CCA的分析结果来看(见图 6),长岛海域中的环境因子溶解氧、温度、pH和活性磷酸盐均对浮游植物的群落多样性差异具有贡献,其中温度和pH是造成浮游植物春季和秋季群落组成差异的主要环境因素,而同样为春季的T1和T4,影响其浮游植物群落差异的主要环境因子为溶解氧和活性磷酸盐。长岛海域浮游动物群落的变化受温度、氨氮、活性磷酸盐、溶解氧、pH和化学需氧量的影响,其中对浮游动物群落影响最大的环境因子为温度和活性磷酸盐。其中温度、溶解氧和pH是造成浮游动物春季和秋季群落组成差异的主要环境因素,而造成T1和T4春季浮游动物群落差异的主要的环境因子为氨氮、活性磷酸盐和化学需氧量。环境因子对底栖生物的影响比其对浮游植、动物的影响都要小,仅有温度、pH和活性磷酸盐对底栖生物的群落变化产生了影响。由于2021年春季长岛海域中活性磷酸盐浓度的升高,使该地区底栖生物的群落结构在这个时期同其他时间存在显著差异。

|
( T1—T5表示不同采样时间。(A)浮游植物; (B)浮游动物; (C)底栖生物。T1—T5 represent different sampling times.(A)Phytoplankton; (B)Zooplankton; (C)Benthos. ) 图 6 环境因子对浮游植物、浮游动物和底栖生物的影响 Fig. 6 Effects of environmental factors on phytoplankton, zooplankton and benthos community |
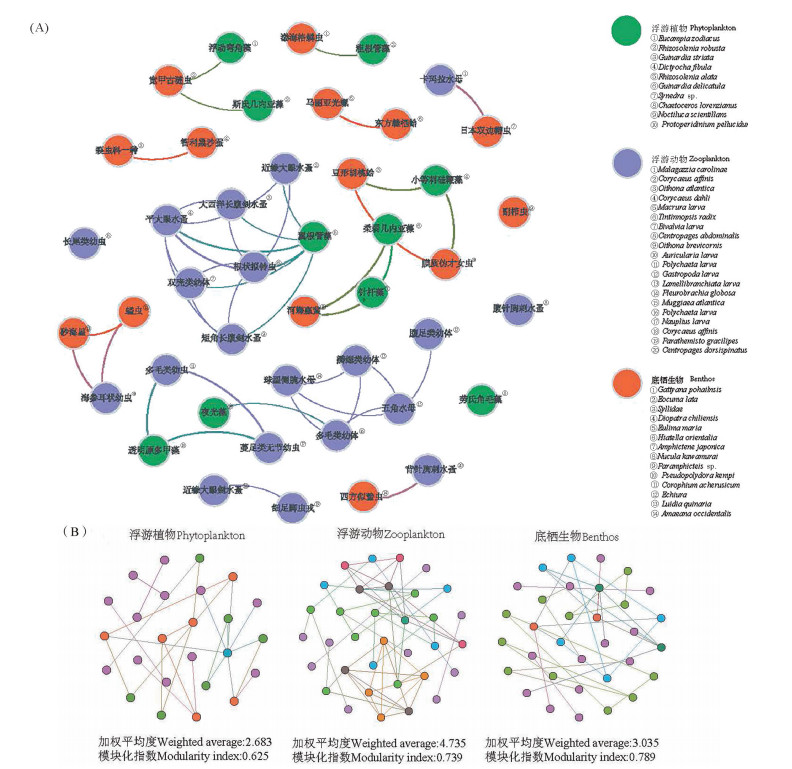
浮游动物和底栖生物均存在更多的种内相互作用关系(见图 7(A)),其网络的节点数分别为34和33,正相关的边数分别为53和34,均显著高于浮游植物。这同时验证了浮游动物和底栖生物中存在更多的捕食和被捕食的关系。其中浮游动物网络的加权平均度为4.73,网络结构最为复杂,证明了浮游动物种内最复杂的相互关系。而浮游植物作为海洋初级生产力,其网络加权平均度仅为2.86,证明浮游植物种内的相互关系较为疏远。
|
( (A)种间相互作用;(B)种内相互作用。图(B)中,不同的颜色代表不同的模块(每一种模块代表一个相似物种的聚类)。加权平均度越大,模块化程度越高,说明微生物之间的相互作用越复杂。(A)Interspecific interactions; (B)Intraspecific interactions. In figure (B), different colors represent different modules (Each module represents a cluster of similar species). The greater the weighted average degree, namely the higher the modularity degree, means the more complex the interaction between microorganisms. ) 图 7 浮游植物、浮游动物和底栖生物的种间以及种内网络分析 Fig. 7 Interspecific and intraspecific network analysis of phytoplankton, zooplankton and benthos |
而在种间关系上,浮游植物、浮游动物以及底栖生物三者之间均正相关(见图 7(B))。浮游植物中的翼根管藻(Rhizosolenia alata)、夜光藻(Noctiluca scintillans)同浮游动物中的双壳类幼体(Bivalvia larva)、多毛类幼体(Polychaeta larva)显著相关;浮游植物中的粗根管藻(Rhizosolenia robusta)同底栖生物的渤海格鳞虫(Gattyana pohailnsis)显著相关;浮游动物中的卡玛拉水母(Malagazzia carolinae)、海参耳状幼虫(Auricularia larva)同底栖生物的日本双边帽虫(Amphictene japonica)、砂海星(Luidia quinaria)显著相关。然而需注意的是,具有显著相关性的浮游动物和底栖生物的物种丰度均较低,因此后续不对其作讨论。
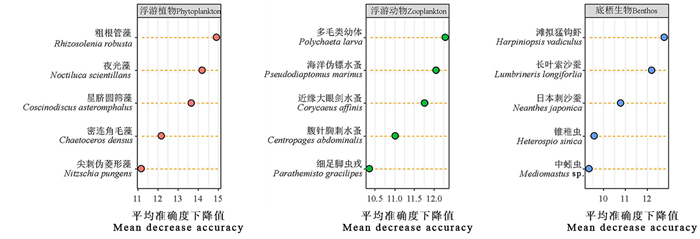
2.6 浮游植物、浮游动物和底栖生物随季节和时间变化的标记性物种以机器学习中的随机森林分类模型来探究季节性变化的标记性物种,平均准确度下降值(Mean decrease accuracy)越大表明该物种越具有分类代表性。其中粗根管藻、夜光藻、星脐圆筛藻(Coscinodiscus asteromphalus)和密连角毛藻(Chaetoceros densus)等为区分时间和季节性变化的标记性浮游植物,其平均准确度下降值范围为11.1~14.9;多毛类幼体(Polychaeta larva)、海洋伪镖水蚤(Pseudodiaptomus marinus)、近缘大眼剑水蚤(Corycaeus affinis)、腹针胸刺水蚤(Centropages abdominalis)和细足脚虫戎(Parathemisto gracilipes)为区分时间和季节性变化的标记性浮游动物,其平均准确度下降值范围为10.3~12.3;滩拟猛钩虾(Harpiniopsis vadiculus)、长叶索沙蚕(Lumbrineris longiforlia)、日本刺沙蚕(Neanthes japonica)、锥稚虫(Heterospio sinica)和中蚓虫(Mediomastus sp.)为区分时间和季节性变化的标记性底栖生物,其平均准确度下降范围为9.3~12.8(见图 8)。
|
图 8 随机森林揭示区分不同季节的标记性物种 Fig. 8 Marker species which can distinguish different seasons revealed by random forest |
浮游植物在春季的物种数目、多样性均显著低于其二者在秋季的物种数目和多样性。春季气温较低(T1和T4阶段的气温均值分别为10.2和11.8,T2、T3和T5阶段的气温均值分别为18.2、17.3和17.3),因此较低的温度是长岛海域浮游植物物种数目在春季低于其在秋季的主要原因,这同于萍[21]对东海浮游植物的研究相符,表明了温度的升高促进了浮游植物的生长和繁殖。在2019年秋季与2020年秋季中,浮游植物的优势种均为尖刺伪菱形藻,表明浮游植物在该时间段内变化不大,基于浮游植物群落的NMDS分析也证明了其在T2和T3阶段的Bray-Curtis距离都很小。但在2021年秋季,浮游植物的丰度出现了爆发式的增长,其优势种也变为了圆筛藻,具槽帕拉藻和尖刺伪菱形藻的丰度也出现了大幅度的增加。潘雪峰等[22]证明了活性磷酸盐是限制圆筛藻生长的关键因子,而同2020年秋季海水相比,其化学需氧量、溶解氧以及营养盐的含量并未出现显著的差异,因此2021年秋季浮游植物丰度显著升高的主要原因可以归结于2021年春季活性磷酸盐含量的升高。由水文水质检测结果发现,长岛海域的化学需氧量、溶解氧含量和无机氮含量均高于其各自在海水四类水质标准中的浓度,活性磷酸盐的浓度也仅在2021年4月份高于海水四类水质标准的活性磷酸盐浓度,因此长岛海域地区发生赤潮的可能性较低。查阅渤海赤潮的历史、现状及其特点发现,渤海地区赤潮发生的主要优势浮游植物种类为夜光藻、球形棕囊藻、叉角藻、红色中缢虫和中肋骨条藻等[23],而这些藻类均不是此次调查海域的优势物种。
浮游动物的物种数目在春季显著低于秋季,说明温度的升高同样增加了浮游动物的物种数目。但是浮游动物的多样性随时间的变化而降低,而其丰度却随着时间推移而升高,两者之间呈现出了相反的趋势,主要原因就是优势种随时间逐渐升高,单一优势种丰度的增加会引起物种多样性的降低。与浮游植物相同,2019年秋季的浮游动物群落结构同2020年秋季的较为类似,其优势种为夜光虫,这同夏、秋季黄河口及其邻近海域浮游动物的优势种类似[24];但2021年秋季浮游动物主要的优势种为双壳类幼体。底栖生物的季节性变化规律不明显,其受环境因子的影响显著小于浮游植物和浮游动物,这可能同底栖生物的生活环境相关,不同于浮游植物和浮游动物的生活环境,底质的组成状况直接影响了底栖生物的种类组成和数量分布[14],此外,大多数底栖生物对环境因子(如温度和pH)的耐受力较强,这也成为了长岛海域地区底栖生物季节性变化小于浮游植物和浮游动物季节性变化的原因之一。底栖生物的物种数目、多样性和物种丰度在2020年的秋季均显著高于其他季节,其优势种为滩拟猛钩虾和日本刺沙蚕,而该时期的温度、pH、溶解氧、化学需氧量和营养盐等与2021年秋季的并未出现显著差异,因此该时期底栖生物物种数目、多样性和丰度的升高是否同底质物理化学特性的变化相关有待后续研究。
3.2 浮游植物、浮游动物和底栖生物的相互作用关系浮游植物的种内相互作用显著低于浮游动物的和底栖生物的,这与浮游植物细胞特性相关,浮游植物主要为光能自养型,无法像浮游动物那样自由移动。除少数肉食性浮游动物种类外,一般的浮游动物尤其是甲壳动物主要依靠浮游植物为食[25]。所以,在浮游植物丰富的水体中,滤食性浮游动物一般也较多,因此2021年秋季浮游植物丰度的显著增加也造成了浮游动物丰度的显著升高。双壳类幼体是2021年秋季浮游动物的主要优势种,经网络分析发现,其与翼根管藻显著相关,因此长岛海域中双壳类幼体可能主要以捕食翼根管藻为主。此外夜光藻作为2019年秋季和2020年秋季的主要浮游植物之一,其丰度同多毛类幼体丰度显著相关,表明夜光藻为多毛类幼体的食物之一。浮游动物丰度不止同浮游植物丰度具有显著相关性,浮游动物种内丰度也存在显著相关关系,证明了在浮游动物种内也存在捕食与被捕食关系。例如2021年春季,腹针胸刺水蚤为主要的浮游动物优势种,其丰度同海洋伪镖水蚤丰度具有显著相关性,这两个物种之间可能存在捕食关系。而对于以浮游植物和浮游动物为食的底栖生物,在网络分析中虽然三者之间存在相关关系,但主要集中于丰度较低的底栖生物物种。在2020年秋季底栖生物的丰度增加同浮游植物和浮游动物的丰度并无直接关系。
此外,经随机森林计算,浮游植物中的粗根管藻和夜光藻、浮游动物中的多毛类幼体和海洋伪镖水蚤、底栖生物中的滩拟猛钩虾和长叶索沙蚕等为区分不同季节、不同时间的标记性物种,这些物种虽然不都是当季的优势种,但是其随着时间、海水环境因子以及海洋底质的变化较为敏感,结合其种内与种间的相互作用关系,使其成为预测海水水质变化以及发生赤潮的潜在性物种。本调查中足够的采样位点、物种检测数目为使用机器学习方法提供了必要的基础数据保证,同时也为后期探究长岛海洋生态的关键物种的方法提供参考。
本研究详细地探究了长岛海域地区浮游植物、浮游动物和底栖生物的春秋两季的变化及其同环境因子的关系。同时也将浮游植物、浮游动物和底栖生物之间的相互作用关系进行了初步分析。虽然最近3年调查发现长岛海域水文水质基本符合标准(仅2021年春季的活性磷酸盐超标便造成了浮游植物和浮游动物丰度的增加),但随着该地区渔业和养殖业的规模不断的扩大,海洋作业及船舶的活动也使其海域受到不同程度的污染,势必会对海洋生态环境造成了一定的破坏,因此后续的调查研究不能够仅仅关注常规指标的变化,同时也应该综合考虑石油烃、重金属、农药等污染物对海洋生物的影响。因此,基础的水文水质评价要同长岛海域环境污染、人类活动等因素相结合,应综合评估浮游植物、浮游动物和底栖生物的种质资源变化,以预测该海域发生赤潮的环境风险,也要评估环境污染对其海水生态环境的破坏程度,提出控制措施和策略。
4 结论本研究对长岛海域12个站位的浮游植物、浮游动物和底栖生物的多样性、群落结构、物种丰度以及三者之间的相互作用关系进行了详细的分析和阐述,主要结论如下:
(1) 浮游植物和浮游动物的物种数目均呈现明显的季节性变化,秋季温度的偏高使其相较于春季具有更高的物种数目。
(2) 浮游植物的物种丰度在2021年秋季呈现爆发式升高,这同2021年春季活性磷酸盐浓度超过四类水质标准的活性磷酸盐浓度有关,而浮游植物丰度的升高也造就了浮游动物丰度的升高。
(3) 以浮游植物为食的浮游动物种内和种间关系最为复杂,而底栖生物受环境因子的影响小于浮游生物, 三者之间构成了复杂的食物网。
| [1] |
Ma C, Zhang G Y, Zhang X C, et al. Application of multiple indicators in environment evaluation of coastal restoration engineering: A case study in Bohai Bay in China[J]. Applied Mechanics & Materials, 2012, 170-173: 2228-2232. (  0) 0) |
| [2] |
Guoli Z. An analysis on the influence of marine culture and marine ecological environment protection: Based on the research data of St. John's Island[J]. Meteorological and Environmental Research, 2020, 11(4): 71-74. (  0) 0) |
| [3] |
韦章良, 柴召阳, 石洪华, 等. 渤海长岛海域浮游动物的种类组成与时空分布[J]. 上海海洋大学学报, 2015, 24(4): 550-549. Wei Z L, Chai S Y, Shi H H, et al. Species composition, abundance and distribution of zooplankton along the coast of Chang Island in the Bohai Sea, China[J]. Journal of Shanghai Ocean University, 2015, 24(4): 550-549. (  0) 0) |
| [4] |
罗先香, 单宇, 杨建强. 黄河口及邻近海域浮游植物群落分布特征及与水环境的关系[J]. 中国海洋大学学报(自然科学版), 2018, 48: 16-23. Luo X X, Shan Y, Yang J Q. Distribution of phytoplankton community and its relationship with water environmrnt in the Yellow River estuary[J]. Periodical of Ocean University of China, 2018, 48: 16-23. (  0) 0) |
| [5] |
温旭. 不同面积芦苇稻对幼蟹塘水质净化和浮游生物群落结构的影响[D]. 上海: 上海海洋大学, 2017. Wen X. The Studies on the Effects of Different Areas of Reed Type Rice on the Water Purification and the Structure of Plankton Community in the Young Crab Pond[D]. Shanghai: Shanghai Ocean University, 2017. (  0) 0) |
| [6] |
童毅, 汪先锋, 孔旭, 等. 春季长岛周边海域水环境特征及其对浮游植物分布的影响[J]. 青岛理工大学学报, 2016, 37(2): 96-103. Tong Y, Wang X F, Kong X, et al. Water environment characteristics in surrounding waters of Changdao Island in spring and its influence in phytoplankton distribution[J]. Journal of Qingdao University of Technology, 2016, 37(2): 96-103. (  0) 0) |
| [7] |
王媛媛, 李捷, 李芬, 等. 长岛周边海域浮游植物分布及其环境影响因素[J]. 海洋科学, 2016(3): 23-31. Wang Y Y, Li J, Li F, et al. Phytoplankton distribution and its environmental impact factors in waters surrounding Changdao Island[J]. Marine Science, 2016(3): 23-31. (  0) 0) |
| [8] |
霍元子. 黄海浮游动物功能群的研究[D]. 青岛: 中国科学院研究生院(海洋研究所), 2008. Huo Y Z. Study on the Zooplankton Functional Groups in the Yellow Sea[D]. Qingdao: Graduate School of Chinese Academy of Sciences (Institute of Oceanography), 2008. (  0) 0) |
| [9] |
孙跃, 沈阳, 戴铃灵, 等. 夏冬季黄海浮游动物群落结构及其影响因素[J]. 中国海洋大学学报(自然科学版), 2020, 50(7): 82-93. Sun Y, Shen Y, Dai L L, et al. Zooplankton distribution and influencing factors in the Yellow Sea in summer and winter[J]. Periodical of Ocean University of China, 2020, 50(7): 82-93. (  0) 0) |
| [10] |
张武昌, 王荣. 海洋微型浮游动物对浮游植物和初级生产力的摄食压力[J]. 生态学报, 2001, 21(8): 1360-1368. Zhang W C, Wang R. Grazing pressure of microzooplankton on phytoplankton and primary production in marine ecosystem[J]. Acta Ecologica Sinica, 2001, 21(8): 1360-1368. (  0) 0) |
| [11] |
胡知渊. 生境干扰对滩涂湿地大型底栖动物群落结构的影响[D]. 金华: 浙江师范大学, 2009. Hu Z Y. The Ecological Impact and Effect of Habitat Disturbance on Macrobenthic Community in Tidal Flat Wetland[D]. Jinhua: Zhejiang Normal University, 2009. (  0) 0) |
| [12] |
陈海燕, 周红, 慕芳红, 等. 北黄海小型底栖生物丰度和生物量时空分布特征[J]. 中国海洋大学学报(自然科学版), 2009, 39(4): 657-663. Chen H Y, Zhou H, Mu F H, et al. Thespatial-temporal distribution characteristics of meiobenthic abundance and biomass in the northern Yellow Sea[J]. Periodical of Ocean University of China, 2009, 39(4): 657-663. (  0) 0) |
| [13] |
胡芮, 王儒晓, 杜诗雨, 等. 扬州宝应湖底栖大型无脊椎动物的生物多样性及其变化[J]. 生物多样性, 2020, 28(12): 1558-1569. Hu R, Wang R X, Du S Y, et al. Biodiversity and spatiotemporal variations of benthic macroinvertebrates in the Baiying Lake, Yangzhou, Jiangsu[J]. Biodiversity Science, 2020, 28(12): 1558-1569. (  0) 0) |
| [14] |
王金宝, 李新正, 王洪法, 等. 山东长岛潮间带大型底栖动物生态特征研究[J]. 海洋科学, 2018, 42(10): 41-52. Wang J B, Li X Z, Wang H F, et al. Macrobenthic ecology in the interridal zones of Changdao Island in Shandong Province[J]. Marine Science, 2018, 42(10): 41-52. (  0) 0) |
| [15] |
中华人民共和国农业部. SC/T9403—2012海洋渔业资源调查规范[S]. 北京: 中国标准出版社, 2013. Ministry of Agriculture of the People's Republic of China. SC/T9403—2012 Technical specification for marine fisheryresources survey[S]. Beijing: Standards Press of China, 2013. (  0) 0) |
| [16] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. GB 17378.7—2007海洋监测规范第7部分: 近海污染生态调查和生物监测[S]. 北京: 中国标准出版社, 2008. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration of the People's Republic of China. GB 17378.7—2007 The specification for marine monitoring-Part 7: Ecological survey for offshore pollution and biological monitoring[S]. Beijing: Standards Press of China, 2008. (  0) 0) |
| [17] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. GB/T12763.6—2007海洋调查规范第6部分: 海洋生物调查[S]. 北京: 中国标准出版社, 2007. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration of the People's Republic of China. GB/T12763.6—2007 Specifications for oceanographic survey-Part 6: Marine biological survey[S]. Beijing: Standards Press of China, 2008. (  0) 0) |
| [18] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. GB 17378.3—2007海洋监测规范第3部分: 样品采集、贮存与运输[S]. 北京: 中国标准出版社, 2008. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration of the People's Republic of China. GB 17378.3—2007 The specification for marine monitoring-Part 3: Sample collection, storage and transportation[S]. Beijing: Standards Press of China, 2008. (  0) 0) |
| [19] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. GB 17378.4—2007海洋监测规范第4部分: 海水分析[S]. 北京: 中国标准出版社, 2008. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration of the People's Republic of China. GB 17378.4—2007 The specification for marine monitoring-Part 4: Seawater analysis[S]. Beijing: Standards Press of China, 2008. (  0) 0) |
| [20] |
Dixon P M. VEGAN, a package of R functions for community ecology[J]. Journal of Vegetation Science, 2003, 14(6): 927-930. (  0) 0) |
| [21] |
于萍. 温度、光照及种间相互作用对东海典型浮游植物生长的影响[D]. 青岛: 中国海洋大学, 2005. Yu P. Effect of Temperature, Irradiance and Population Interaction on the Growth of Phytoplankton of East China Sea[D]. Qingdao: Ocean University of China, 2005. (  0) 0) |
| [22] |
潘雪峰, 张鹰, 张东, 等. 海州湾圆筛藻与环境因子的关系研究[J]. 环境监测管理与技术, 2007, 19(1): 15-18. Pan X F, Zhang Y, Zhang D, et al. Study on the relationship between Coscinodiscus sp. and environmental factors in Haizhou Bay[J]. Environmental monitoring management and technology, 2007, 19(1): 15-18. (  0) 0) |
| [23] |
林凤翱, 卢兴旺, 洛昊, 等. 渤海赤潮的历史、现状及其特点[J]. 海洋环境科学, 2008, 27: 1-5. Lin F A, Lu X W, Luo H, et al. History, present situation and characteristics of red tide in Bohai Sea[J]. Marine Environmental Science, 2008, 27: 1-5. (  0) 0) |
| [24] |
王文杰. 夏、秋季黄河口及其邻近海域中小型浮游动物群落生态学研究[D]. 青岛: 中国海洋大学, 2011. Wang W J. Studies on the Mesozooplankton and Microzooplankton Community in the Yellow River Estuary and Its Adjacent Area in Summer and Autumn[D]. Qingdao: Ocean University of China, 2011. (  0) 0) |
| [25] |
侯来利. 淮南市高塘湖水域浮游动物群落特征研究[D]. 淮南: 安徽理工大学, 2007. Hou L L. Study on the Community Characteristics of Zooplankton of Gaotang Lake in Huainan[D]. Huainan: Anhui University of Science and Technology, 2007. (  0) 0) |
2. Marine Economic Promotion Center of Changdao Island Marine Ecological Civilization Comprehensive Test Zone, Yantai 265800, China
 2024, Vol. 54
2024, Vol. 54


