2. 中国海洋大学海洋环境与生态教育部重点实验室,山东 青岛 266100
根据《2020年中国渔业统计年鉴》,2019年中国海水养殖面积1.992×106 hm2,产量3.28×107 t,海水养殖产值达3 575.29亿元[1]。为了预防细菌性疾病、提高养殖产量,在养殖过程中普遍投加抗生素[2-3]。研究表明,投加的抗生素只有20%~30%可被养殖生物吸收利用,其余大部分均进入养殖环境[4];近年来,海水养殖区、附近水域甚至水产品中已经检出多种抗生素残留,引起人们的广泛关注[5-8]。残留的抗生素会富集抗性基因及抗性菌,对生态系统造成破坏,并进一步对人类和动物健康形成潜在风险[9]。
磺胺甲恶唑(SMX)作为广谱抗菌剂,抗菌作用强,常用于海水养殖中的细菌病害防治,集约化的养殖模式导致SMX成为高频率检出抗生素之一。受取样地点、取样季节等因素影响,SMX检出浓度差异较大,从ng·L-1~mg·L-1均有报道[7],其在养殖水体环境中的检出浓度甚至可达5.57 mg·L-1[8]。目前针对海水养殖废水处理通常采用生物处理工艺,然而,活性污泥法或生物膜法对SMX的去除效率极低[10],SMX不能通过传统的废水处理工艺有效去除[11],这也是其在地表水中经常被检测出的主要原因,对人类健康和生态系统构成长期威胁。Lu等[12]采集了中国近1.8万公里海岸线附近的水样,发现SMX的短期和长期生态风险均处于较高水平。更值得注意的是,由于生物处理工艺中微生物长期接触低浓度抗生素,这些生物处理工艺被认为是富集细菌抗生素抗性基因的理想环境[13]。因此,迫切需要应用有效的处理措施提高SMX的降解效率。
以UV、Fenton、O3以及过硫酸盐(PDS)等为基础的高级氧化工艺(AOP),由于强氧化能力和非选择性,已广泛应用于废水中降解有机污染物,如城市和工业废水中抗生素等的去除[14-15]。UV/H2O2除了在去除废水中的微污染物效果显著外,还可降低毒性副产物的形成[16]。Lee等[17]发现相比于O3,UV/H2O2可以实现优异的微污染物减排,降低能耗,减少氧化副产物(如二甲基亚硝胺、溴酸盐)的生成。由于SMX的吸收光谱图在UV-C段有较强的吸收峰,且在水处理过程中,相比于其他高级氧化处理工艺,UV/H2O2不会引入新的污染物,且运行稳定。因此,考虑到SMX的紫外敏感性和H2O2的促进作用[18],UV/H2O2在去除SMX有很强的应用价值和实际意义。Borowska等[19]研究pH为4.8时SMX的降解情况,发现波长在255~579 nm的UV光源可有效降解SMX;Zhu等[20]研究了UV/H2O2对SMX在含有多种磺胺类抗生素混合溶液中的光化学氧化作用,发现磺胺类化合物在UV/H2O2体系中可完全去除,并提出了相应的降解途径。
然而,海水体系复杂,影响因素较多,有关SMX在海水体系中的降解过程还需要深入研究。此外,现有研究往往只关注了SMX的去除效率,而忽略了在去除过程中抗生素的矿化度以及体系生物毒性的变化。因此本研究通过UV/H2O2对海水养殖废水中SMX的去除实验,解析UV和H2O2的作用,优化UV/H2O2去除SMX的工艺条件,评估处理过程中SMX矿化程度以及毒性变化,通过测定SMX降解过程主要中间产物推测可能降解路径,研究可为含抗生素的海水养殖废水高效处理提供理论依据。
1 材料与方法 1.1 仪器与试剂SMX(纯度>98%)购自中国阿拉丁公司,HPLC级甲醇、乙腈购自德国Merck公司,HPLC级甲酸和甲酸铵购自美国Sigma公司,其他化学品均为分析纯,购自中国国药。色谱柱型号:Waters Xterra MS C18(100 mm×4.6 mm,3.5 μm)。发光细菌冻干粉购自青岛顺禾公司。
1.2 UV/H2O2反应装置本研究的紫外处理实验在平行光仪(新大陆环境,中国)中进行。该系统配备了一根40 W低压汞灯,提供波长为254 nm的紫外平行光源。下方放置一个直径为10 cm,高度为5 cm,顶口无盖的圆柱形玻璃反应装置,反应器下面配置转速为100 r·min-1的磁力搅拌器以确保溶液充分混合。通过改变紫外灯管与玻璃反应器的距离来调整紫外强度,光强通过紫外辐照计(LS125,林上中国)进行测量。反应装置四周安装黑色遮光板,以减弱其他光源的干扰,并确保操作人员的安全。除特殊说明,反应条件为:灯管距离液面25 cm,平均光强为1.1 mW·cm-2,每次实验反应器中样品溶液为200 mL,深度约为2.5 cm。
1.3 UV/H2O2实验设计为阐明UV、H2O2在处理SMX过程中的协同作用以及各工艺条件的影响,通过预实验确定实验基本反应条件为:SMX初始浓度10 mg·L-1,H2O2初始浓度0.2 mmol·L-1,pH为5.0,在此基础上开展批次实验。单独UV、H2O2以及UV/H2O2耦合处理SMX以验证其协同作用。分别改变紫外强度(0.056、0.083、0.35、1.1 mW·cm-2),SMX初始投加量(1、2、5、8、10 mg·L-1),H2O2浓度(0.1、0.2、0.5、0.8、1、5、10 mmol·L-1),pH(3.0、5.0、7.0、9.0、11.0),探究不同工艺条件对SMX降解的影响,获得SMX去除效率最优的工艺条件。条件优化的实验均在超纯水进行,以排除其他水质因素的干扰。
为探究UV/H2O2在处理海水养殖废水中SMX时水质因素的影响,以海水为反应基质,按照条件优化后的基本反应条件,选择海水养殖废水中典型阴离子Cl-、CO32-、NO3-为变量,以实际环境中的浓度范围设置梯度,分别改变Cl-(5、10、16 mg·L-1)、CO32-(1、2.5、5、7.5、10 mmol·L-1)、NO3-(0.01、0.02、0.05、0.08、0.1 mol·L-1),探究海水中典型阴离子对SMX降解的影响。为探究海水养殖废水处理过程中SMX降解机制并评估体系矿化度、急性毒性变化,同样以海水为反应基质,按照上述基本反应条件比较UV与UV/H2O2在SMX处理过程中的差异。海水养殖废水按照逄文慧等[21]的方法配制,在超纯水中加入浓缩海水晶使盐度达到30±0.5,模拟海水养殖废水样品的水质参数为:[Cl-]=15 g·L-1;[CO32-]=8.47 mg·L-1;[HCO3-]=2.879 mg·L-1;[NO3-]=0.26 mg·L-1;[SO42-]=1.976 1 g·L-1;COD=0.82 mg·L-1。
上述批次实验过程为:实验前先将紫外灯管预热10 min以保持紫外强度稳定。打开平行光仪反应即开始并开始计时,反应一段时间后,在固定的取样时间点(0、0.33、1、2.5、5、7.5、10 min)取出5 mL水样,添加0.5 mL 10 mmol·L-1硫代硫酸钠来淬灭残余H2O2并用0.22 μm滤膜过滤,在4 ℃保存待下一步处理。整个反应在室温进行。
1.4 化学指标检测方法SMX及中间产物在检测前的处理采用固相萃取法。具体过程为:取0.5 mL待测水样用超纯水稀释至5 mL。取5 mL甲醇和10 mL超纯水对HLB萃取柱(OASIS,美国)进行活化,活化后加入5 mL样品进行上样,之后用10 mL超纯水进行冲洗,将柱子内壁残余样品过柱并冲洗HLB柱中的盐离子,最后用5 mL甲醇洗脱。全程萃取流速控制在每秒1滴左右。取1 mL洗脱液经0.22 μm滤膜过滤后装入色谱瓶并在4 ℃保存待测。参照文献[22]采用液相色谱-质谱联用仪(LC-MS)(赛默飞,美国)测定SMX。将SMX母液(100 mg·L-1)分别稀释到1000、500、200、100、50、20、10 μg·L-1作为标准溶液进样检测,根据峰面积拟合得到线性关系良好的标准曲线(R2≥0.99)。对于SMX降解过程中间产物的检测,采用超高液相色谱-质谱联用仪(UPLC-MS)在80~500的质荷比范围(m/z)对样品进行全质谱扫描采集,配备Q-TOF高分辨率质谱仪(maXis,Bruker)的Ultimate 3000液相色谱系统用于鉴定SMX降解过程中的中间产物。
pH采用PHS-3C(雷磁,中国)测定,反应溶液的pH用HCl(1 mol·L-1)和NaOH(1 mol·L-1)进行调节。TOC采用总有机碳分析仪TOC-Vpcn(岛津,日本)测定。生物毒性采用生物毒性检测仪LumiFox2000(朗石,中国)测定。使用前先用复苏稀释液将发光细菌冻干粉复苏15 min,之后加入渗透压调节液500 μL,再将超纯水(校准)或待测样品加入到发光细菌中反应15 min,最后在生物毒性检测仪进行读数,发光细菌存活率越低说明毒性越大。
1.5 降解动力学研究·OH是一种活性很强的自由基,其寿命极短,为纳秒级[23],当实验过程中UV强度保持不变时,·OH浓度通常被认为是恒定的[24]。所以SMX降解过程符合准一级动力学模型,见方程式(1)。构建模型用于评估反应条件下的SMX降解动力学。
| $ \ln \left( {{C_{\rm{t}}}/{C_0}} \right) = - kt。$ | (1) |
式中:Ct和C0分别为反应时间为t和0的SMX浓度(μg·L-1);t为反应时间(min);k是反应速率常数(min-1)。通过线性回归得到k值并用于反映SMX处理效率。
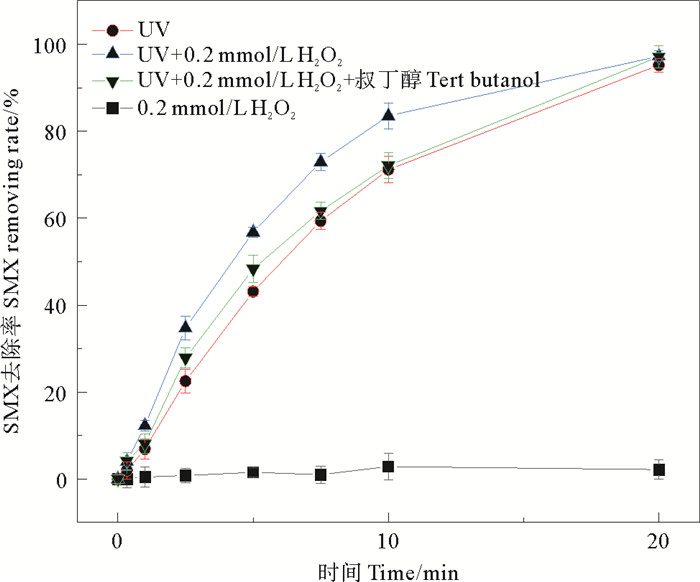
2 结果与分析 2.1 工艺条件对SMX的去除效率的影响 2.1.1 UV和H2O2的协同作用为探究UV、H2O2对SMX的作用,比较了UV、H2O2、UV/H2O2以及添加了·OH淬灭剂叔丁醇之后各体系中SMX的去除率,结果如图 1。
|
图 1 SMX在UV、0.2 mmol·L-1 H2O2、UV/H2O2以及加入·OH淬灭剂的去除率 Fig. 1 Removing rate of SMX in UV, 0.2 mmol·L-1 H2O2, UV/H2O2 and with addition of ·OH quencher |
在整个处理过程中,SMX在0.2 mmol·L-1 H2O2的作用下浓度一直保持在10 mg·L-1左右,这表明SMX水解、自然光降解和H2O2诱导的自降解影响可以忽略不计。单独UV降解10 min后,SMX的去除率达到71.17%,降解速率常数k为0.125 4 min-1,而UV/H2O2处理SMX的效率在相同时间内为83.50% 降解速率常数为0.180 0 min-1。加入·OH的淬灭剂叔丁醇后,10 min后SMX去除率下降到72.08%,接近UV处理条件下的去除效率。加入叔丁醇淬灭·OH后SMX去除反应速率高于UV处理的原因可能是叔丁醇淬灭效率小于·OH产生速率,仍有一小部分·OH参与降解SMX。可见,UV光解对SMX降解起主要作用,由H2O2在紫外线辐射后产生的·OH(·OH氧化电位为2.8 V)也在一定程度内加快SMX降解效率,Skodic等[25]在UV/H2O2、H2O2/UV/Fe2+等多种高级氧化工艺(AOPs)处理活性染料RB4的实验中也得到了类似的结果。
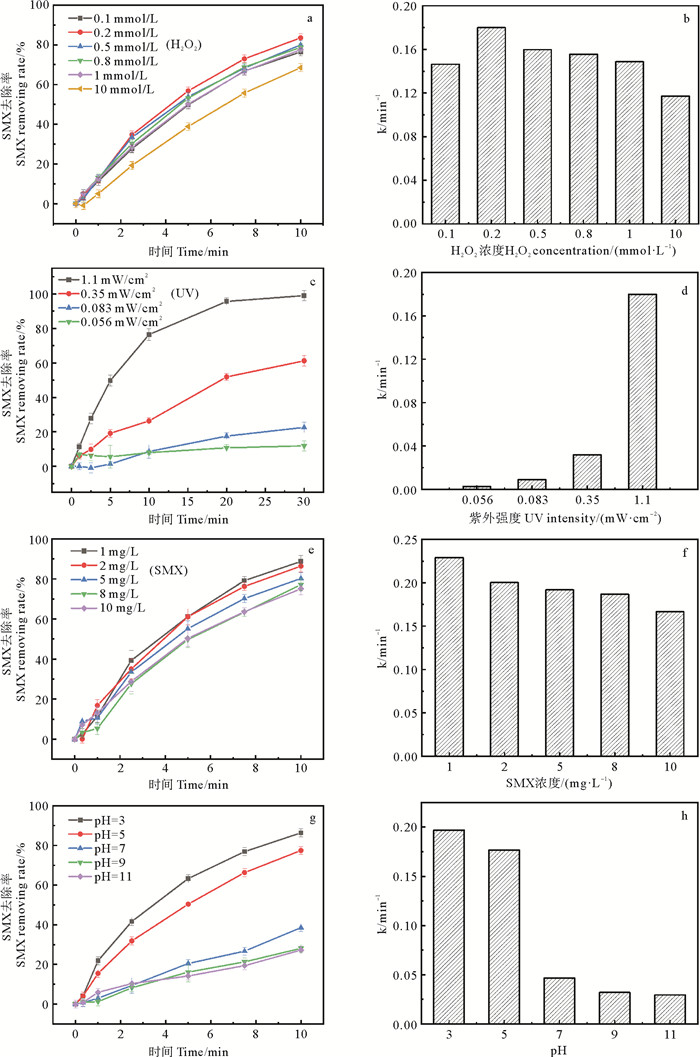
2.1.2 H2O2浓度影响H2O2经UV照射后产生·OH,其剂量会影响处理效率和运营成本[26]。因此采用浓度为0.1、0.2、0.5、0.8、1、5、10 mmol·L-1的H2O2剂量探究其对SMX去除的影响。图 2中(a、b)显示,在不同H2O2浓度下,SMX去除率在10 min内的整体趋势基本一致。反应速率常数从0.146 8 min-1上升到0.180 0 min-1,之后持续下降。最优投加量为0.2 mmol·L-1。随着H2O2投加量增加,体系中的·OH也会逐步增加,进而有利于整个氧化体系对于目标污染物的去除,而当体系中H2O2浓度继续升高,达到了H2O2与目标污染物最优摩尔比时,高浓度的H2O2条件下,H2O2会和反应体系中的·OH结合,生成氧化还原电位较低的HO2·,产生淬灭效果。HO2·和·OH均会发生自淬灭反应生成H2O2,当·OH的生成量小于淬灭量时,整个反应体系的氧化能力就会减弱[19],如反应式(2~5)所示。此外,过量的H2O2会与SMX竞争UV,进一步降低SMX去除效率。当H2O2浓度达到10 mmol·L-1时,反应速率显著降低,甚至低于单独UV处理SMX的效率。
|
图 2 不同H2O2浓度(a、b)、紫外辐照强度(c、d)、SMX初始浓度(e、f)、pH(g、h)对SMX在UV/H2O2体系中去除效率的影响 Fig. 2 Effects of H2O2 concentration (a、b), UV irradiation intensity (c、d), SMX concentration (e、f) and pH (g、h) on SMX removal efficiency in UV/H2O2 system |
| $ {{\rm{H}}_2}{{\rm{O}}_2} + \cdot {\rm{OH}} \to {\rm{H}}{{\rm{O}}_2} + {{\rm{H}}_2}{\rm{O}}{\rm{。}} $ | (2) |
| $ {\rm{HO}}_2^ - + \cdot {\rm{OH}} \to {\rm{H}}{{\rm{O}}_2} \cdot + {\rm{O}}{{\rm{H}}^ - }。$ | (3) |
| $ {\rm{H}}{{\rm{O}}_2} \cdot + \cdot {\rm{O}}{{\rm{H}}^ - } \to {{\rm{H}}_2}{{\rm{O}}_2} + {{\rm{O}}_2}。$ | (4) |
| $ \cdot {\rm{OH}} + \cdot {\mathop{\rm OH}\nolimits} \to {{\rm{H}}_2}{{\rm{O}}_2}。$ | (5) |
在UV/H2O2体系中,UV既可以直接光解SMX,也可以激发H2O2产生·OH作用于SMX,直接决定了降解所需时间,因此是工艺中重要的条件。因SMX降解速率随着光强的减弱下降很快,取样时间延长至20 min。不同光强变化时对SMX去除效能的影响如图 2(c、d)所示。由图可得,不同紫外光强对SMX去除率的影响差异明显。保持其他条件一致,在紫外光强为0.056、0.083、0.35、1.1 mW·cm-2时,反应10 min后SMX的去除率分别为7.97%,8.63%,26.35%,76.37%。降低紫外光强的造成SMX去除效率明显下降,由此可见紫外光强度是影响去除效率的主要因素。与之类似,Beretsou等[27]在研究UV/H2O2处理含有难降解抗生素(氨苄西林、克拉霉素、红霉素、氧氟沙星、磺胺甲恶唑、四环素和甲氧苄啶)混合物时,也证实为了达到充分降解的目的,需要比污水厂通常用于消毒的UV强度高得多。因此在实际应用去除水中SMX的时候,需要注意适当提高紫外灯光源的强度。
2.1.4 SMX投加量影响不同初始浓度的SMX在UV/H2O2体系中去除情况如图 2(e)、(f)。当SMX浓度从1 mg·L-1上升到10 mg·L-1,去除率从88.7%下降到77.1%,反应速率从0.229 0 min-1下降到0.166 8 min-1。这是因为随着SMX初始浓度的增加,由于紫外线强度不变,更多的SMX分子参与竞争利用UV,从而降低了单位SMX利用UV的效率。并且相应的也会与H2O2竞争UV,从而影响·OH的生成。此外,在较高初始SMX浓度下产生的更多中间产物与SMX竞争UV和·OH,这也导致SMX去除率降低。Li等[28]同样发现,在UV/H2O2体系去除SMX时,SMX的降解速率随着SMX初始浓度的升高而降低。
2.1.5 pH影响通过改变pH探究pH对SMX去除效率的影响。由图 2(g)、(h)可得,在酸性条件下,SMX的反应速率显著高于中性和碱性条件。在中性条件下,反应10 min后,SMX的去除率只有38.6%。在pH为11时,反应10 min SMX去除率只有28.1%。
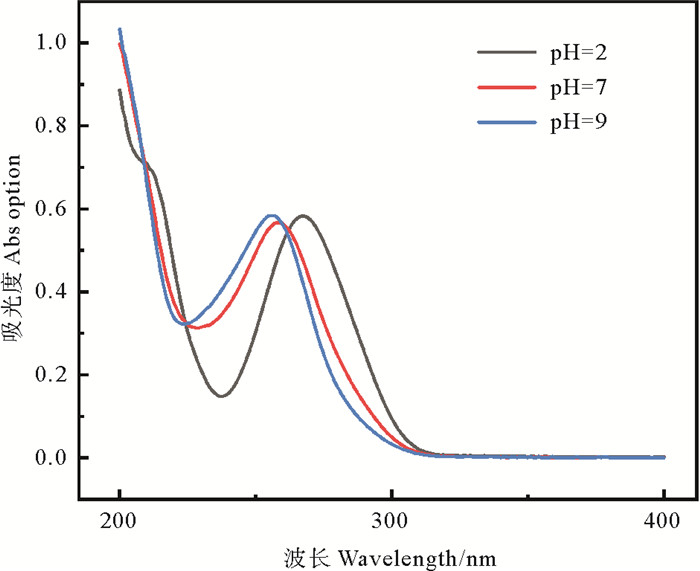
出现这样结果的原因首先是pH对SMX自身性质的影响。SMX有两个解离常数: pKa1=1.85,pKa2=5.6[29]。当pH < 1.85时,SMX主要以阳离子形态存在;当1.85 < pH < 5.60时,SMX主要以中性分子形态存在;pH >5.60时,SMX主要以阴离子形态存在。中性和弱碱性条件促进了SMX从中性形态向阴离子形态的转化。不同形态的SMX其对光的摩尔吸收系数也不同[19]。较高摩尔吸收系数有助于通过UV加速自身光解。有研究表明[29],SMX对光的摩尔吸收系数规律为,阳离子>中性状态>阴离子状态。如图 3所示,波长在240~260 nm范围的紫外光下,pH为7、9时,吸收光谱特征几乎一致,这是因为在这两种pH下,溶液中SMX都是以阴离子形态为主;随着pH不断减弱,最大吸收波长明显发生了红移,两种不同形态的SMX吸收光谱也不同,且在250~290 nm间吸收峰增大。类似地,Baeza等[30]发现磺胺类抗生素(磺胺甲恶唑、磺胺二甲嘧啶、磺胺嘧啶)在阳离子和中性分子表现出比其阴离子形式更好的紫外吸收作用。因为紫外光解是SMX主要降解机制,所以pH对SMX形态的影响是降解速率变化的主要原因。
|
图 3 SMX在pH为2、7、9时的吸收光谱 Fig. 3 Absorption spectra of SMX at pH 2, 7 and 9 |
此外pH会影响·OH的生成。因为H2O2呈弱酸性, 反应溶液为碱性时会促进H2O2发生电离生成HO2-,而HO2-会与·OH反应[31]从而消耗·OH。这也是导致SMX降解速率降低的原因。
2.2 海水中阴离子对SMX去除率的影响高含氮量和高盐度是海水养殖废水的典型特征[32],因此根据条件优化确定的基本反应条件(紫外强度1.1 mW·cm-2、0.2 mmol·L-1 H2O2、SMX投加量10 mg·L-1、pH=5),分别改变海水中特定阴离子浓度探究阴离子对SMX去除的影响。
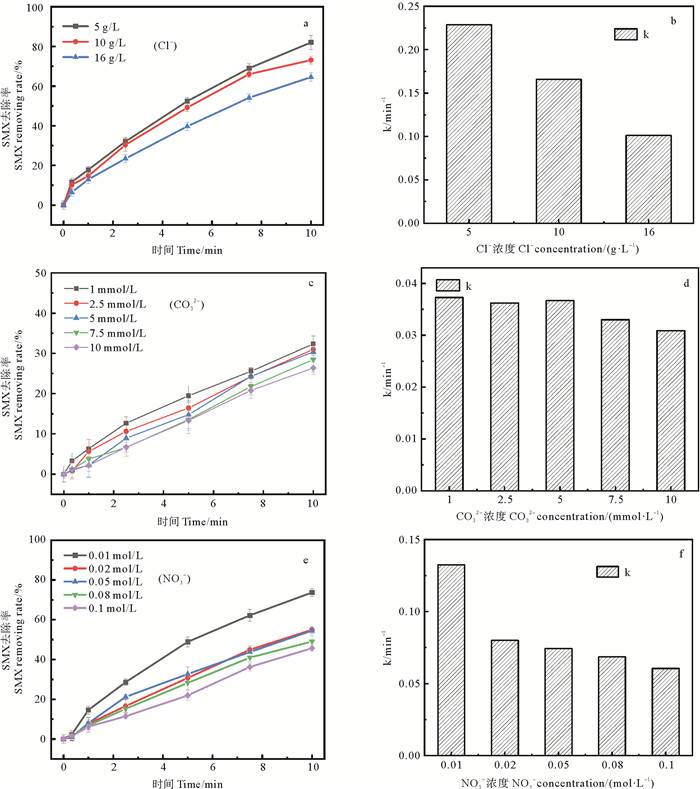
2.2.1 Cl-对SMX去除率的影响不同Cl-浓度条件下的SMX去除情况如图 4(a)、(b)。当Cl-浓度分别为5、10和16 mg·L-1时,10 min时去除率分别为82.0%、73.1%、64.5%,反应速率从0.228 7 min-1下降到0.101 2 min-1。对SMX降解有明显的抑制。这是因为氯离子会与水中的·OH结合生成氧化还原电位较低的氯自由基(Cl·)和二氯自由基(Cl2-·),二氯自由基(Cl2-·)也能和H2O2反应导致反应体系的H2O2和·OH减少,从而降低了整个反应体系的氧化能力,使得SMX去除受到影响;此外生成的OH-导致反应体系pH变化,也会抑制SMX去除效率,见方程式(6~8)。
|
图 4 不同Cl-浓度(a、b)、CO32-浓度(c、d)和NO3-浓度(e、f)对SMX在UV/H2O2体系中去除效率的影响 Fig. 4 Effects of Cl- concentrations (a, b), CO32- concentrations (c, d) and NO3- concentrations (e, f) on removal efficiency of SMX in UV/H2O2 system |
| $ \cdot {\mathop{\rm OH}\nolimits} + {\rm{C}}{{\rm{l}}^ - } \to {\rm{Cl}} \cdot + {\rm{O}}{{\rm{H}}^ - }。$ | (6) |
| $ {\rm{Cl}} \cdot + {\rm{C}}{{\rm{l}}^ - } \to {\rm{Cl}}_2^ - \cdot 。$ | (7) |
| $ {\rm{Cl}}_2^ - \cdot + {{\rm{H}}_2}{{\rm{O}}_2} \to 2{\rm{C}}{{\rm{l}}^ - } + {{\rm{H}}^ + } + {\rm{H}}{{\rm{O}}_2} \cdot 。$ | (8) |
图 4(c)、(d)显示,向反应体系中投加CO32-时,反应速率相比于未投加时显著降低。CO32-的引入导致反应速率显著降低的原因是一方面CO32-会水解生成HCO3-(方程式9),水解过程产生的氢氧根离子使得体系pH升高,降低反应速率;另一方面是CO32-以及HCO3-与·OH的反应活性高于SMX[32],会直接与·OH反应(方程式10~11),降低氧化能力。此外,在较高的pH值下,·OH的氧化还原电位降低也是反应速率降低的原因[33]。
| $ {\rm{CO}}_3^{2 - } + {{\rm{H}}_2}{\rm{O}} \to {\rm{HCO}}_3^ - + {\rm{O}}{{\rm{H}}^ - }。$ | (9) |
| $ {\rm{CO}}_3^{2 - } + \cdot {\mathop{\rm OH}\nolimits} \to \cdot {\rm{CO}}_3^ - + {\rm{O}}{{\rm{H}}^ - }。$ | (10) |
| $ {\rm{HCO}}_3^ - + \cdot {\mathop{\rm OH}\nolimits} \to \cdot {\rm{CO}}_3^ - + {{\rm{H}}_2}{\rm{O}}{\rm{。}} $ | (11) |
随着CO32-浓度从1 mmol·L-1上升到10 mmol·L-1,10 min时SMX去除率从32.4%下降到26.4%。反应速率从0.037 3 min-1下降到0.030 9 min-1,原因可能在于水解反应增多导致的pH不断升高。因此CO32-的抑制作用主要表现在对·OH的清除作用和pH升高的诱导作用。Baeza等[30]同样发现,CO32-浓度的升高抑制了·OH与抗生素之间的反应。
2.2.3 NO3-对SMX去除率的影响NO3-对UV/H2O2体系中SMX的去除影响如图 4(e、f)。随着NO3-的引入,SMX在UV/H2O2中反应速率呈下降趋势,由0.132 5 min-1下降至0.060 5 min-1。NO3-在UV照射下的反应方程式见(12)[34]。
| $ {\rm{NO}}_3^ - + {{\rm{H}}_2}{\rm{O}} \to {\rm{NO}}_2^ \cdot + {\rm{O}}{{\rm{H}}^ - }。$ | (12) |
根据报道NO3-可以吸收UV发生反应,并形成一层内滤膜,以阻挡UV透过水溶液[32],这是反应速率下降的主要原因。但同时,一些研究发现该过程会产生更多的·OH,反应体系的氧化能力被加强从而促进抗生素的氧化。Martijn等[35]在对富硝酸盐地表水进行UV/H2O2处理研究时发现,硝酸盐加强了反应活性以及有毒副产物的生成,本研究未表现出去除速率增强的原因可能是硝酸盐浓度较低,且UV光强对SMX去除速率的影响更强。
2.3 矿化度根据基本反应条件(紫外强度1.1 mW·cm-2、0.2 mmol·L-1 H2O2、SMX投加量10 mg·L-1、pH=5),对UV、UV/H2O2处理(纯水体系)、UV/H2O2处理(海水体系)的TOC进行测定,探究体系中SMX的矿化情况。溶液中SMX和TOC在经UV/H2O2处理后的去除率对比见图 5(a)、(b),纯水中20 min后SMX去除率达到99%以上,TOC仅去除了43.4%;海水中20 min后SMX去除率同样达到99%以上,TOC去除率为37.4%。可见UV/H2O2体系虽然可以有效去除SMX,但并未完全转化为二氧化碳和水,很大一部分转化为中间产物残留在体系中。由图 5(c)可见,虽然UV对SMX的去除占主要比重,但UV单独处理10min后,TOC去除率仅有16.27%,而UV和H2O2的组合显著提高了SMX的矿化度,纯水基质中TOC去除率升高到43.37%,海水基质中TOC去除率为37.4%。说明在·OH的作用下,SMX被矿化的程度更高。Yang等[14]和Borowska等[19]的研究也发现·OH增强了SMX的矿化。在海水体系中,SMX经UV/H2O2处理后虽然也可以基本去除,但TOC去除效率明显低于纯水基质。这是由于海水基质相对复杂,存在大量无机阴离子(Cl-、HCO3-等)以及有机物,这些物质会与SMX竞争对TOC起主要作用的·OH,从而影响SMX矿化度[36]。另一方面,溶液中的HCO3-能够淬灭水中自由基,和·OH结合生成·CO3-。
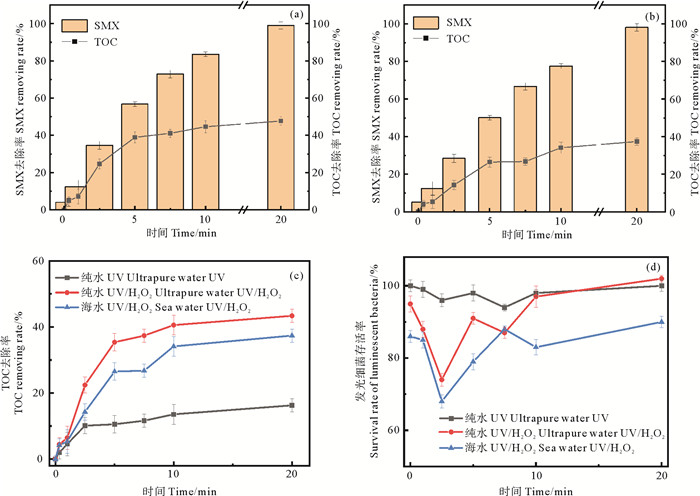
|
图 5 SMX和TOC在纯水(a)和海水养殖废水(b)中经UV/H2O2处理的去除率变化及UV、UV/H2O2处理体系种矿化度的变化(c)和发光细菌急性毒性变化(d) Fig. 5 Changes of removing rates of SMX and TOC in pure water (a), mariculture wastewater (b) treated by UV/H2O2, changes of TOC in UV and UV/H2O2 treatment systems (c) and acute toxicity of luminescent bacteria (d) |
在5 min后,矿化度提高速率明显下降,这可能是随着H2O2消耗,体系中·OH含量降低,氧化能力下降。但值得注意的是,虽然H2O2被完全消耗,但从图中看矿化度仍在不断提高。据Lam研究[37],在没有其他化学源的条件下,UV光解过程中也会产生·OH,这也是UV光解矿化度依旧会不断提高的原因。
2.4 反应过程毒性变化发光细菌法是一种用于评价水质综合毒性的新型生物毒性监测技术,利用发光细菌毒性试验可以检测环境污染物的急性毒性[38]。通过测定溶液发光细菌急性毒性评估经UV/H2O2处理的溶液毒性,随着环境污染物毒性的增加,发光抑制率也会更加。
SMX经UV光解和UV/H2O2处理后中间产物的毒性变化如图 5(d)所示。在初始状态,只含有SMX的超纯水体系中发光细菌存活率为100%,因此认为SMX母体化合物毒性可忽略不计;添加了H2O2的超纯水体系中发光细菌存活率为95%,说明H2O2对生物具有一定的氧化剂毒性;海水中复杂的成分抑制了发光细菌的存活率,在初始状态存活率为86%。反应开始后5 min内,三种体系中毒性水平均显著升高,对比图 5(c)发现SMX主要被矿化的时间也在前5 min,因此认为毒性的升高与中间产物的生成直接相关[20]。在之后的20 min反应时间内,随着处理时间的延长毒性逐渐下降并恢复至初始水平。这说明在处理过程中产生了毒性更高的中间产物。但随着处理时间的延长,中间产物逐渐矿化,毒性又恢复到原始溶液。光解是产生毒性最低的过程,可能与SMX矿化度不高,生成的中间产物较少有关[39]。值得注意的是,经过20 min处理,添加了H2O2的海水和超纯水体系毒性均下降到低于原始溶液的水平,说明虽然降解过程会导致SMX产生有毒性降解产物,但延长处理时间可以有效地将它们进一步转化为毒性较低的降解产物。
综上,SMX母体化合物并未表现出毒性,但在UV/H2O2处理SMX的过程中,处理后的溶液均出现毒性增强的现象。UV光解是毒性产生最低的过程,可能是由于矿化缓慢,中间产物生成较少或者生成的中间产物毒性较小。在实际应用中,应注意延长处理时间以减弱毒性。SMX的降解产物相比于母体化合物在化学结构和性质方面存在差异,而毒性的强弱也与中间产物直接相关。因此在毒性评估的基础上,对SMX处理过程中生成的降解产物测定尤为重要。
2.5 SMX降解路径了解UV/H2O2降解SMX的途径有助于对反应过程进行控制和风险评估。分别在第0、5、10、20 min对经UV、UV/H2O2处理的溶液取样,固相萃取提纯后通过LC-MS对碎片进行检测。将在不同辐照时间获得的样品的LC-MS色谱图与初始样品进行比较,新峰的出现以及响应值的变化表明了中间产物的出现,由此确定了8种最主要的中间产物如表 1所示。根据这些中间产物和已知文献报道,提出了SMX降解路径,包括磺酰胺键(S-N)断裂、羟基的取代、氨基的氧化以及SMX的同分异构体的形成。此外通过对比UV/H2O2与单独UV处理过程碎片的不同,推出UV和·OH在SMX降解过程中发挥的不同作用。
|
|
表 1 SMX降解过程中产生的中间产物 Table 1 The analytical information LC-MS during the degradation of SMX |
在单独UV处理中,检测出的碎片仅有C2、C3、C6和C7,降解过程包括磺酰胺基断裂,基团光异构化以及一部分羟基化,而在UV/H2O2处理过程中,检测出的碎片种类包含C1~C8。
SMX的磺酰胺键极不稳定,在UV照射和·OH的作用下易发生断裂生成C3(异恶唑)和C6(磺胺酸)碎片,这也是前人研究中发现的SMX最常见的降解路径[41],之后的反应有些是在磺酰胺键断裂的基础上发生。
C7化合物与母体化合物SMX具有相同的质荷比,但出峰时间不同,因此认为是SMX的同分异构体。Zhou等[40]也发现了这一结果,并提出是UV导致异恶唑环产生光异构化反应。所以体系处理后生成的中间产物可能仍然具有与母体化合物相同或近似的结构。C4可能是异恶唑环上的烯烃双键被·OH攻击的结果,加成反应导致双键断裂,之后氢离子被-OH取代。C5比C4质荷比接近,推测是-OH取代-H的位置不同。Liu等[41]通过LC-TOF-MS技术证实,SMX在降解过程中苯环上的-H也会被-OH取代,这也解释了C5的生成。C5中·OH取代的位置可能为苯胺的邻位或对位,Solar等[42]研究了苯胺自由基经·OH攻击后的吸光度特性,他们发现54%的一级产物是·OH与苯胺的邻位反应产生的,而36%的·OH与-NH2基团直接反应,其余10%的·OH可能攻击对位,这解释了C5产生的机理。
C1是C3的氨基被氧化形成的,由于磺胺酸苯环上的氨基相比于异恶唑环的氨基稳定,因此并未被氧化,只发生了取代反应,生成C2。此外,由生成的光转化产物仍能有部分与母体化合物SMX相同的结构这一推论[43],判断C8是·OH攻击C6的结果,破坏了苯环结构但保留了一部分氨基苯基砜的产物。
综上所述,基于中间产物的鉴定以及文献报道,SMX在UV/H2O2下的降解路径如图 6所示。虽然UV对SMX降解起主要作用,但·OH的参与显著影响中间产物。UV/H2O2与直接光解的主要区别在于羟基化产物的形成[44]。在没有·OH存在的条件下,UV导致的磺酰胺键断裂(路径(1))是SMX基础的降解路径,还有异恶唑环在UV作用下产生的光异构化反应(路径(4))。随着·OH的引入,体系氧化性变强,中间产物进一步被氧化,羟基的取代反应(路径(2))和氧化反应(路径(3))增多,甚至破坏苯环结构(路径(5)),这也论证了引入·OH后体系矿化度相比于单独UV处理有所提高。
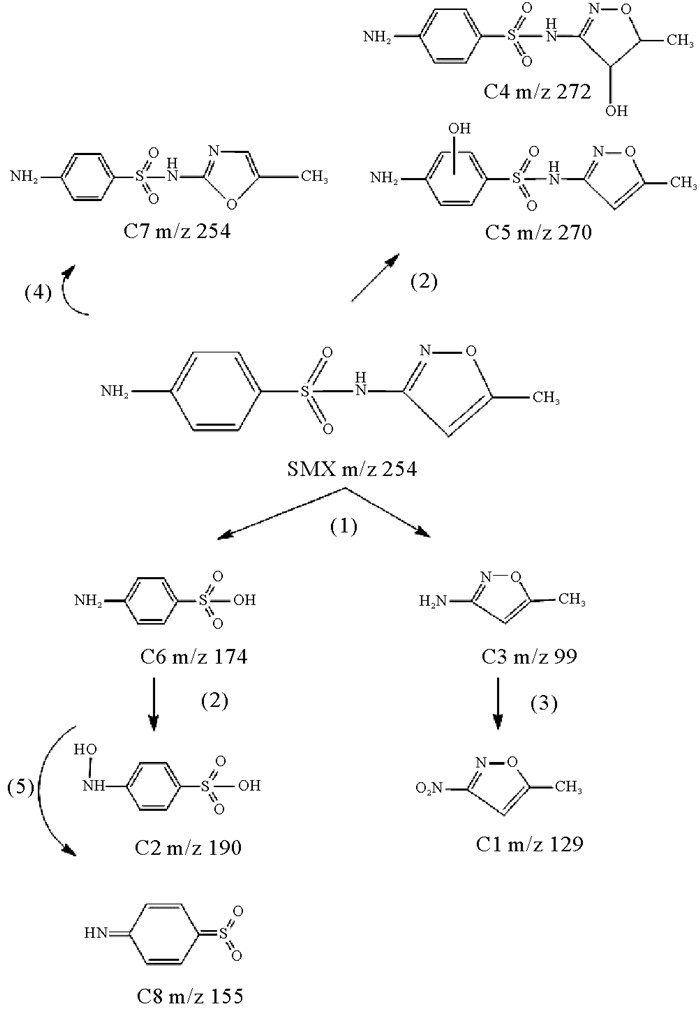
|
图 6 SMX降解路径 Fig. 6 SMX degradation path |
本研究考察了UV/H2O2去除海水养殖废水中SMX的效率以及SMX的可能降解机制。
(1) SMX在UV/H2O2体系中的降解遵循准一级动力学模型(R2≥0.99)。
(2) 通过不同工艺条件对比,发现紫外强度与pH对SMX去除率影响显著,且较高的UV辐照强度、浓度为2 mmol·L-1的H2O2、SMX为阳离子或中性分子的pH条件有利于SMX降解。
(3) 氯离子和碳酸根离子可竞争·OH并导致pH化,从而抑制SMX去除效率,硝酸根离子在UV照射下形成内滤膜,减弱光照从而抑制SMX去除速率。
(4) 相比于单独UV,UV/H2O2体系中的·OH可有效提高体系的矿化度。
(5) SMX降解过程产生的中间产物使得处理体系发光细菌急性毒性上升,延长处理时间可有效降低发光细菌急性毒性。
(6) 在UV/H2O2体系中,SMX主要通过磺酰胺键断裂、羟基取代和氨基的氧化作用被去除,鉴定出八种主要中间产物并推测了主要降解路径。除了磺胺类典型抗生素SMX外,还需要对存在于实际废水中的其他抗生素进行研究,以获得有效处理抗生素问题方案,彻底解决抗生素问题。
| [1] |
中国水产学会. 2020中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2020. Chinese Fisheries Association. 2020 Chinese Fishery Statistics Yearbook[M]. Beijing: China Agriculture Press, 2020. (  0) 0) |
| [2] |
Chen H, Liu S, Xu X R, et al. Antibiotics in typical marine aquaculture farms surrounding Hailing Island, South China: Occurrence, bioaccumulation and human dietary exposure[J]. Marine Pollution Bulletin, 2015, 90: 181-187. DOI:10.1016/j.marpolbul.2014.10.053 (  0) 0) |
| [3] |
Chen H, Liu S, Xu X R, et al. Antibiotics in the coastal environment of the Hailing Bay region, South China Sea: Spatial distribution, source analysis and ecological risks[J]. Marine Pollution Bulletin, 2015, 95: 365-373. DOI:10.1016/j.marpolbul.2015.04.025 (  0) 0) |
| [4] |
王彦斌. 抗生素在畜禽养殖业中的应用、潜在危害及去除[J]. 农业开发与装备, 2015, 12: 1-6. Wang Y B. Application, potential harm and removal of antibiotics in livestock and poultry breeding[J]. Agricultural Development and Equipment, 2015, 12: 1-6. (  0) 0) |
| [5] |
He X, Deng M, Wang Q, et al. Residues and health risk assessment of quinolones and sulfonamides in cultured fish from Pearl River Delta, China[J]. Aquaculture, 2016, 458: 38-46. DOI:10.1016/j.aquaculture.2016.02.006 (  0) 0) |
| [6] |
Sun J T, Zeng Q T, et al. Antibiotics in the agricultural soils from the Yangtze River Delta, China[J]. Chemosphere, 2017, 740: 140001. (  0) 0) |
| [7] |
Le T X, Munekage Y. Residues of selected antibiotics in water and mud from shrimp ponds in mangrove areas in Viet Nam[J]. Marine Pollution Bulletin, 2005, 49(11-12): 922-929. (  0) 0) |
| [8] |
Zhao M, Ma X H, Liao X R, et al. Characteristics of algae-derived biochars and their sorption and remediation performance for sulfamethoxazole in marine environment[J]. Chemical Engineering Journal, 2022, 430(4): 133092. (  0) 0) |
| [9] |
Prasannamedha G, Kumar P S. A review on contamination and removal of sulfamethoxazole from aqueous solution using cleaner techniques: Present and future perspective[J]. Journal of Cleaner Production, 2020, 250: 119553. DOI:10.1016/j.jclepro.2019.119553 (  0) 0) |
| [10] |
Wang S, Liu Y, Wang J. Iron and sulfur co-doped graphite carbon nitride (FeOy/S-g-C3N4) for activating peroxymonosulfate to enhance sulfamethoxazole degradation[J]. Chemical Engineering Journal, 2020, 382: 122836. DOI:10.1016/j.cej.2019.122836 (  0) 0) |
| [11] |
Wang J, Wang S. Removal of pharmaceuticals and personal care products (PPCPs) from wastewater: A review[J]. Journal of Environmental Management, 2016, 182: 620-640. DOI:10.1016/j.jenvman.2016.07.049 (  0) 0) |
| [12] |
Lu J, Wu J, Zhang C, et al. Occurrence, distribution, and ecological-health risks of selected antibiotics in coastal waters along the coastline of China[J]. Science of the Total Environment, 2018, 644: 1469-1476. DOI:10.1016/j.scitotenv.2018.07.096 (  0) 0) |
| [13] |
Merlin C, Bonot S, Courtois S, et al. Persistence and dissemination of the multiple-antibiotic-resistance plasmid pB10 in the microbial communities of wastewater sludge microcosms[J]. Water Research, 2011, 45(9): 2897-2905. DOI:10.1016/j.watres.2011.03.002 (  0) 0) |
| [14] |
Yang L, X Liang, Han Y, et al. The coupling use of advanced oxidation processes and sequencing batch reactor to reduce nitrification inhibition of industry wastewater: Characterization and optimization[J]. Chemical Engineering Journal, 2019, 360: 1577-1586. DOI:10.1016/j.cej.2018.10.232 (  0) 0) |
| [15] |
Rodríguez-Chueca J, Varella Della Giustina S, Rocha J, et al. Assessment of full-scale tertiary wastewater treatment by UV-C based-AOPs: Removal or persistence of antibiotics and antibiotic resistance genes?[J]. Science of The Total Environment, 2019, 652: 1051-1061. DOI:10.1016/j.scitotenv.2018.10.223 (  0) 0) |
| [16] |
Yu H, Anumol T, Park M, et al. On-line sensor monitoring for chemical contaminant attenuation during UV/H2O2 advanced oxidation process[J]. Water Research, 2015, 81: 250-260. DOI:10.1016/j.watres.2015.05.064 (  0) 0) |
| [17] |
Lee Y, Gerrity D, Lee M, et al. Organic contaminant abatement in reclaimed water by UV/H2O2 and a combined process consisting of O3/H2O2 followed by UV/H2O2: Prediction of abatement efficiency, energy consumption, and byproduct formation[J]. Environmental Science & Technology, 2016, 50(7): 3809-3819. (  0) 0) |
| [18] |
Kim I, Yamashita N, Tanaka H. Performance of UV and UV/H2O2 processes for the removal of pharmaceuticals detected in secondary effluent of a sewage treatment plant in Japan[J]. Journal of Hazardous Materials, 2009, 166(2-3): 1134-1140. DOI:10.1016/j.jhazmat.2008.12.020 (  0) 0) |
| [19] |
Borowska E, Felis E, Miksch K. Degradation of Sulfamethoxazole Using UV and UV/H2O2 Processes[J]. Journal of Advanced Oxidation Technologies, 2016, 18: 69-77. (  0) 0) |
| [20] |
Zhu G, Sun Q, Wang C, et al. Removal of sulfamethoxazole, sulfathiazole and sulfamethazine in their mixed solution by UV/H2O2 process[J]. International Journal of Environmental Research and Public Health, 2019, 16(10): 1797. DOI:10.3390/ijerph16101797 (  0) 0) |
| [21] |
逄文慧, 赵阳国, 郑冰冰, 等. 不同污染负荷对移动床生物膜反应器处理海水养殖废水的性能及微生物群落的影响[J]. 中国海洋大学学报(自然科学版), 2018, 48(S1): 137-145. Pang W H, Zhao Y G, Zheng B B, et al. Effects of different pollution loads on the performance and microbial community of mariculture wastewater treatment by moving bed biofilm reactor[J]. Journal of Ocean University of China (Natural Science Edition), 2018, 48(S1): 137-145. DOI:10.16441/j.cnki.hdxb.20180076 (  0) 0) |
| [22] |
Chen C Q, Zheng L, Zhou J L, et al. Persistence and risk of antibiotic residues and antibiotic resistance genes in major mariculture sites in Southeast China[J]. Science of the Total Environment, 2017, 580: 1175-1184. DOI:10.1016/j.scitotenv.2016.12.075 (  0) 0) |
| [23] |
Liu D, Liu J, Wen J. Elevation of hydrogen peroxide after spinal cord injury detected by using the Fenton reaction[J]. Free Radical Biology & Medicine, 1999, 27(3-4): 478-482. (  0) 0) |
| [24] |
Wu Y, Zhou S, Qin F, et al. Modeling the oxidation kinetics of Fenton's process on the degradation of humic acid[J]. Journal of Hazardous Materials, 2010, 179(1-3): 533-539. DOI:10.1016/j.jhazmat.2010.03.036 (  0) 0) |
| [25] |
Skodic L, Vajnhandl S, Valh J V, et al. Comparative study of reactive anthraquinone dyes oxidation by H2O2/UV, H2O2/UV/Fe2+ and H2O2/UV/Fe processes[J]. Ozone Science and Engineering, 2016, 39(1): 14-23. (  0) 0) |
| [26] |
Qiu W, Zheng M, Sun J, et al. Photolysis of enrofloxacin, pefloxacin and sulfaquinoxaline in aqueous solution by UV/H2O2, UV/Fe(Ⅱ), and UV/H2O2/Fe(Ⅱ) and the toxicity of the final reaction solutions on zebrafish embryos[J]. Science of the Total Environment, 2019, 651: 1457-1468. DOI:10.1016/j.scitotenv.2018.09.315 (  0) 0) |
| [27] |
Beretsou V G, Michael-Kordatou I, Michael C, et al. A chemical, microbiological and (eco)toxicological scheme to understand the efficiency of UV-C/H2O2 oxidation on antibiotic-related microcontaminants in treated urban wastewater[J]. Science of The Total Environment, 2020, 744: 140835. DOI:10.1016/j.scitotenv.2020.140835 (  0) 0) |
| [28] |
Liu F, Zhou H, Pan Z, et al. Degradation of sulfamethoxazole by cobalt-nickel powder composite catalyst coupled with peroxymonosulfate: Performance, degradation pathways and mechanistic consideration[J]. Journal of Hazardous Materials, 2020, 400: 123322. DOI:10.1016/j.jhazmat.2020.123322 (  0) 0) |
| [29] |
Peiris C, Gunatilake S R, Mlsna T E, et al. Biochar based removal of antibiotic sulfonamides and tetracyclines in aquatic environments: A critical review[J]. Bioresource Technology, 2017, 246: 150-159. DOI:10.1016/j.biortech.2017.07.150 (  0) 0) |
| [30] |
Baeza C, Knappe D. Transformation kinetics of biochemically active compounds in low-pressure UV photolysis and UV/H2O2 advanced oxidation processes[J]. Water Research, 2011, 45(15): 4531-4543. DOI:10.1016/j.watres.2011.05.039 (  0) 0) |
| [31] |
杨海燕, 贾九敏, 郭金鹏. UV/H2O2降解磺胺甲恶唑和环丙沙星的对比研究[J]. 中国给水排水, 2016, 32(13): 82-86. Yang H Y, Jia J M, Guo J P. Comparison of sulfamethoxazole and ciprofloxacin degradation by UV/H2O2[J]. China Water & Wastewater, 2016, 32(13): 82-86. (  0) 0) |
| [32] |
Ao X, Liu W. Degradation of sulfamethoxazole by medium pressure UV and oxidants: Peroxymonosulfate, persulfate, and hydrogen peroxide[J]. Chemical Engineering Journal, 2017, 313: 629-637. DOI:10.1016/j.cej.2016.12.089 (  0) 0) |
| [33] |
Qian M, Yang L, Chen X, et al. The treatment of veterinary antibiotics in swine wastewater by biodegradation and Fenton-like oxidation[J]. Science of the Total Environment, 2020, 710: 136299. DOI:10.1016/j.scitotenv.2019.136299 (  0) 0) |
| [34] |
Bossmann S H, Oliveros E, Göb S, et al. New evidence against hydroxyl radicals as reactive intermediates in the thermal and photochemically enhanced fenton reactions[J]. The Journal of Physical Chemistry A, 1998, 102(28): 5542-5550. DOI:10.1021/jp980129j (  0) 0) |
| [35] |
Martijn A J, Boersma M G, Vervoort J M, et al. Formation of genotoxic compounds by medium pressure ultraviolet treatment of nitrate-rich water[J]. Desalination & Water Treatment, 2014, 52(34-36): 6275-6281. (  0) 0) |
| [36] |
Han Y, Yang L, Chen X, et al. Removal of veterinary antibiotics from swine wastewater using anaerobic and aerobic biodegradation[J]. Science of the Total Environment, 2019, 709: 136094. (  0) 0) |
| [37] |
Lam M W, Mabury S A. Photodegradation of the pharmaceuticals atorvastatin, carbamazepine, levofloxacin, and sulfamethoxazole in natural waters[J]. Aquatic Sciences, 2005, 67(2): 177-188. DOI:10.1007/s00027-004-0768-8 (  0) 0) |
| [38] |
Ji Q, He H, Gao Z, et al. UV/H2O2 oxidation of tri(2-chloroethyl) phosphate: Intermediate products, degradation pathway and toxicity evaluation[J]. Journal of Environmental Sciences, 2020, 98(12): 57-63. (  0) 0) |
| [39] |
Alharbi S K, Kang J, Nghiem L D, et al. Photolysis and UV/H2O2 of diclofenac, sulfamethoxazole, carbamazepine, and trimethoprim: Identification of their major degradation products by ESI-LC-MS and assessment of the toxicity of reaction mixtures[J]. Process Safety and Environmental Protection, 2017, 112: 222-234. DOI:10.1016/j.psep.2017.07.015 (  0) 0) |
| [40] |
Zhou W, Moore D E. Photochemical decomposition of sulfamethoxazole[J]. International Journal of Pharmaceutics, 1994, 110(1): 55-63. DOI:10.1016/0378-5173(94)90375-1 (  0) 0) |
| [41] |
Liu S, Fu Y, Wang G, et al. Degradation of sulfamethoxazole by UV/sulfite in presence of oxygen: Efficiency, influence factors and mechanism[J]. Separation and Purification Technology, 2021, 268(1): 118709. (  0) 0) |
| [42] |
Solar S, Solar W, Getoff N. Resolved multisite OH-attack on aqueous aniline studied by pulse radiolysis. International Journal of Radiation Applications and Instrumentation[J]. Part C Radiation Physics and Chemistry, 1986, 28(2): 229-234. (  0) 0) |
| [43] |
Trovo A G, Nogueira R, Agueera A, et al. Photodegradation of sulfamethoxazole in various aqueous media: Persistence, toxicity and photoproducts assessment[J]. Chemosphere, 2009, 77(10): 1292-1298. DOI:10.1016/j.chemosphere.2009.09.065 (  0) 0) |
| [44] |
Yang Y, Lu X, Jiang J, et al. Degradation of sulfamethoxazole by UV, UV/H2O2 and UV/persulfate (PDS): Formation of oxidation products and effect of bicarbonate[J]. Water Research, 2017, 118: 196-207. DOI:10.1016/j.watres.2017.03.054 (  0) 0) |
2. The Laboratory of Marine Environmental Science and Ecology, Ministry of Education, Ocean University of China, Qingdao 266100, China
 2022, Vol. 52
2022, Vol. 52


