2. 中国海洋大学海洋环境与生态教育部重点实验室, 山东 青岛 266100;
3. 中国海洋大学海洋生命学院, 山东 青岛 266003
随着纳米技术的发展,纳米材料越来越多的被应用于抗菌物质、药物载体、污水处理等领域[1]。早在16世纪,人类就发现银及其复合物具有较强的抑菌杀菌作用,银在抗菌抑菌方面具有更多其他材料不具备的优点,诸如具有持久性、光谱性、耐热性等理化性能[2]。与Ag+相比,纳米银的抑菌能力更有效和持久,并且可以防止细菌二次污染,被广泛应用于各领域,在生产、运输、消费和处置的过程中,纳米银等重金属会通过大气沉降、地表径流等形式汇入海洋[3-4]。目前,在近岸海域已检测到多种纳米材料的存在,其环境预测浓度已达到“mg/L”级别。已有研究表明,工业排放水中纳米银浓度范围可达1~6 mg/kg,青岛近海位于纳米银进入环境,发生迁移行为的路径上,同时随着排放量的增加其环境浓度呈指数上升[5-6]。尽管进入环境中的纳米银背景浓度不高,但是其在环境中具有持久性和生物积累效应,进入水体中的纳米银可能会对碎屑分解、生物地球化学循环和基础食物链的物质传递产生消极影响[7-9]。而微生物是这些重要生态过程的主要参与者和完成者,同时也是物质和能量的储存库,在生态系统循环中发挥着不可替代的重要作用。
纳米银体积极小,具有小尺寸效应和表面效应,可吸附在细菌细胞壁表面上,细菌细胞壁成分主要成分肽聚糖中的-NH-、-COOH官能团可与纳米银发生反应,导致细胞壁腐蚀,纳米银镶嵌入细胞膜中[10]。当纳米银嵌入细胞膜后,会释放Ag+,使细菌细胞膜的通透性遭到破坏,导致细胞内的蛋白质、无机盐和还原糖外漏,影响细菌细胞正常的跨膜运输,破坏了细菌细胞的代谢系统和与外界的通信,使生长速度降低,从而抑制细菌的生长与活性[11]。当纳米银彻底渗透进入菌体内部后,会与细菌的酶蛋白巯基迅速结合,导致酶失去活性,由此造成细菌自身不能进行新陈代谢而最终死亡[12-13]。有研究表明,纳米银能与大肠杆菌的胞内蛋白和酶相互作用[12],而细菌可通过胞外酶的释放,将水生生态系统食物网很难利用的相对较大的颗粒转化为可供低营养级生物利用的能量(碳)和营养物质[14],但纳米银对细菌胞外酶的影响的研究却很少,且绝大部分的研究都是在培养基条件下进行。探讨纳米银对自然海水中浮游细菌生长及活性的影响对深入研究纳米材料对海洋生态系统的作用机制具有重要的参考价值,而青岛沿岸经济发达,受人类活动影响较大,因此探讨纳米银对青岛近海浮游细菌的影响具有重要意义。
水体中的大颗粒物质无法直接通过细菌细胞膜,浮游细菌利用胞外酶从水体中的大颗粒物质中获取碳、氮、磷等营养物质,碱性磷酸酶可以作用于有机物或无机物的单磷酸酯键,细菌可以通过碱性磷酸酶从胞外获取磷和碳;氨肽酶可以作用于氨基酸的N端,细菌可以通过氨肽酶从胞外获取氮和碳,这两种酶是细菌维持正常生长和活性的重要胞外酶。本研究通过现场采样、实验室模拟培养,研究了不同浓度纳米银对青岛近海海水中细菌胞外酶活性(碱性磷酸酶活性和氨肽酶活性)、蛋白质含量和细菌死亡率的影响,为深入探讨纳米银对近海海水环境的生态影响机制及环境效应提供科学依据。
1 材料与方法 1.1 实验用纳米银及预处理本研究所用纳米银粉购自SIGMA-ALDRICHⓇ,粒径 < 100 nm,银纯度>99.5%。取一定量的纳米银,加入一定量经0.22 μm滤膜过滤的灭菌去离子水。纳米银溶液需要现用现配,为了防止纳米银聚集,使用前在冰浴条件下,将所用纳米银悬浮液用超声波(230 V,50 kHz)超声分散40 min。
1.2 样品采集与环境因子测定本研究所用海水于2018年1月采自青岛附近海域S站位(120° 22′ 52.32″ E,36°2′ 27.96″N)(见图 1)。使用酸清洗过的无菌聚乙烯塑料瓶采集表层海水水样,立即用2 μm滤膜过滤(去除原生动物),低温保存立即带回实验室。采集海水样品的同时,采用YSI6600多参数水质测定仪测定现场海水pH值、盐度和电导率等环境参数,现场环境理化参数为:pH=7.92、盐度30.7、电导率32 156 μS/cm。
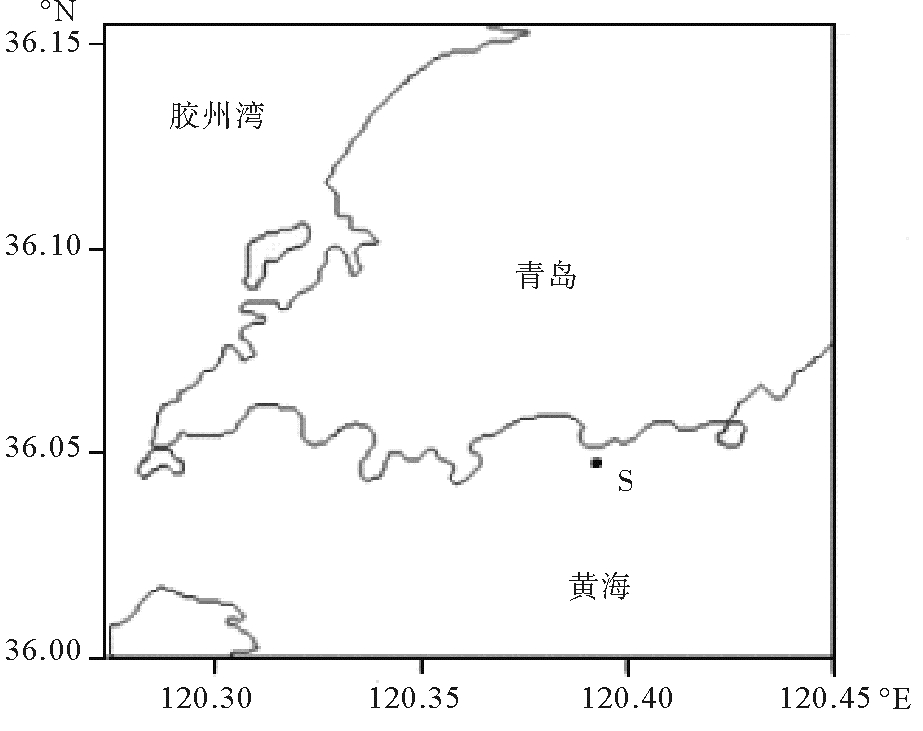
|
图 1 采样站位 Fig. 1 Samples stations |
实验共设置3个不同浓度的纳米银处理组和1个对照组,分别为对照组C(0 mg/L)、低浓度纳米银组L(0.5 mg/L)、中浓度纳米银组M(5 mg/L)以及高浓度纳米银组H(50 mg/L),各组设置3个平行实验组。将水样分装于12个无菌NalgeneTM聚碳酸酯瓶(Thermo ScientificTM),每瓶装入过滤海水2 L,取一定量纳米银储备液分别加入各试验水体中,混匀,用无菌半透膜封口,置于室温振荡培养48 h。分别在0、4、8、16、24、36和48 h于各组培养体系取出一定量样品,用于测定碱性磷酸酶活性、亮氨酸氨肽酶活性、蛋白质含量和死、活细菌数量。
1.4 样品测定 1.4.1 碱性磷酸酶活性(APA)测定将采集的样品以磷酸苯二钠为底物,37 ℃培养15 min,采用紫外可见分光光度计(TU-1810)于510 nm下测定酚含量。以单位时间内每1 mL样品水解底物产生的酚含量表示碱性磷酸酶活性[15]。
1.4.2 氨肽酶活性(ALP)测定将采集的样品以L-亮氨酸-4-硝基苯胺(现用现配,以无水乙醇充分溶解,置于棕色试剂瓶中,避光保存)为底物,58 ℃培养15 min。反应结束后立即取出,冰浴终止反应,于用紫外可见分光光度计(TU-1810)在405 nm下测定吸光度值。以单位时间内每1 mL样品水解底物产生的对硝基苯胺(p-NA)含量表示氨肽酶活性[16]。
1.4.3 蛋白质含量测定将采集的样品加入考马斯亮蓝G-250试剂,混匀后静置,用紫外分光光度法于595 nm波长下测定吸光度值,计算蛋白质含量[17]。
1.4.4 细菌死亡率测定采用染料SYBR green1与碘化丙啶(PI)双染色法判定死、活细胞,其中,染料SYBR green1能够穿透活细胞完整的细胞膜与核酸物质结合产生520 nm (绿色)荧光[18];染料PI只能穿透结构受损的细胞膜与其核酸物质结合,产生617 nm (红色)荧光[19]。
细菌细胞死/活状态采用流式细胞仪(BD公司,美国)测定,激发波长488 nm。采用FL1通道收集SYBR荧光,FL2通道收集PI荧光,分别表征活细胞和死亡细胞,如图 2所示[20]。
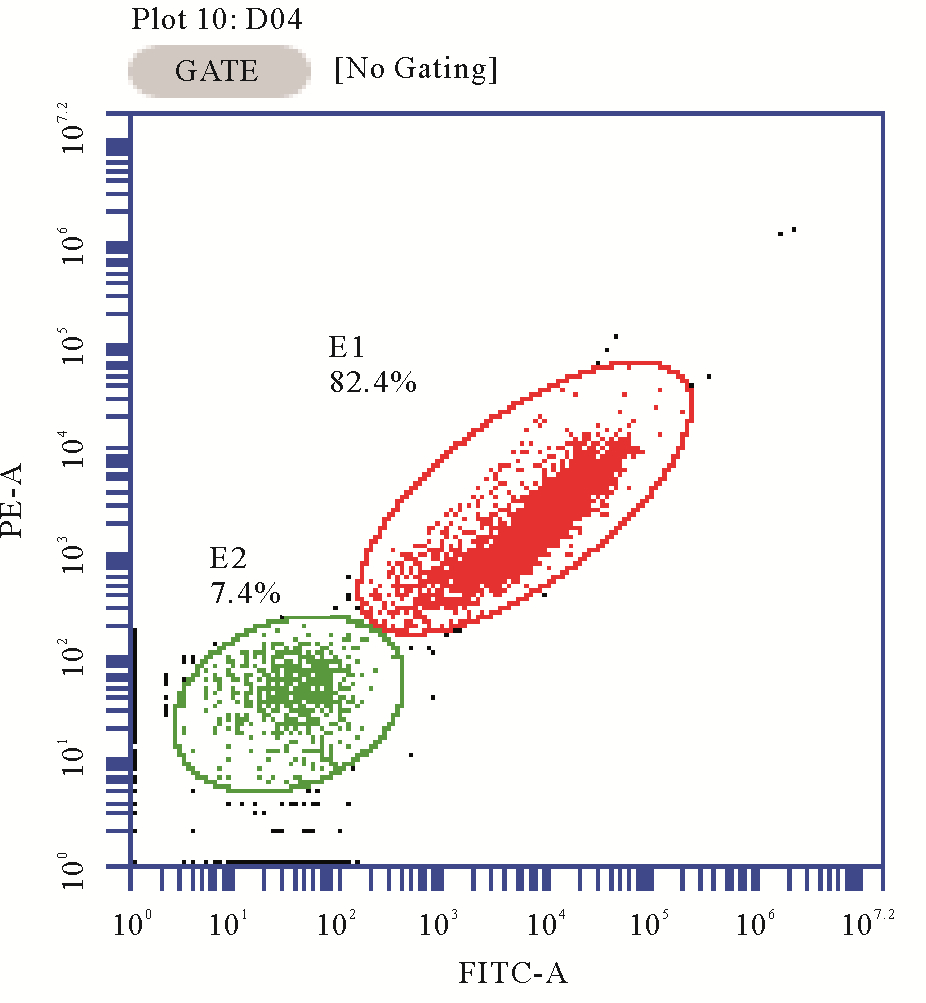
|
(图中E1为PI染色的死细胞;E2为SYBR green1染色的活细胞。E1 represents death cells;E2 represents survival cells.) 图 2 流式细胞仪细胞死/活状态计数图 Fig. 2 Death/survival cell count of flow cytometry |
细菌细胞死/活状态由细菌死亡率(P)表示,其计算公式[21]为:
| $ P\left( \% \right) = \frac{{死细胞数}}{{总细胞数(死细胞数+活细胞数)}} \times 100\% $ |
采用BD Accuri C6 Plus软件(BD公司,美国)对流式细胞仪数据进行分析统计细胞数。所有数据用Excel 2013和SPSS 19.0分析软件进行数据处理、分析和统计。使用Origin8.5作图软件进行图形绘制。
2 结果与分析 2.1 纳米银对浮游细菌死亡率的影响不同浓度纳米银作用下,海水中细菌死亡率随时间变化趋势如图 3所示。在没有外界营养物质输入的情况下,细菌对营养物质的竞争,和培养体系中存在的病毒噬菌体的裂解作用,导致空白组的细菌死亡率出现上升趋势。各实验组0~4 h的细菌的死亡率有明显升高,于4 h时高浓度纳米银组细菌死亡率达到高值,为88.20%,是同期空白组的1.72倍,此时纳米银对细菌死亡率的影响最为明显,各实验组对浮游细菌死亡率表现出极显著的抑制效应(P < 0.01);在8~24 h,实验组细菌死亡率出现逐渐降低又升高的趋势,并在暴露24 h后,高浓度纳米银组死亡率达到峰值88.69%,是同期空白组的1.33倍;在24~48 h,除高浓度纳米银组,其余实验组细菌死亡率呈现下降趋势,但变化过程缓慢。低、中浓度纳米银组的前半期变化趋势与高浓度纳米银组的变化趋势类似,但不同于高浓度纳米银组的是,在培养后期,细菌死亡率呈现持续降低的趋势,可能是由于细菌对纳米银胁迫产生了一定的适应性。
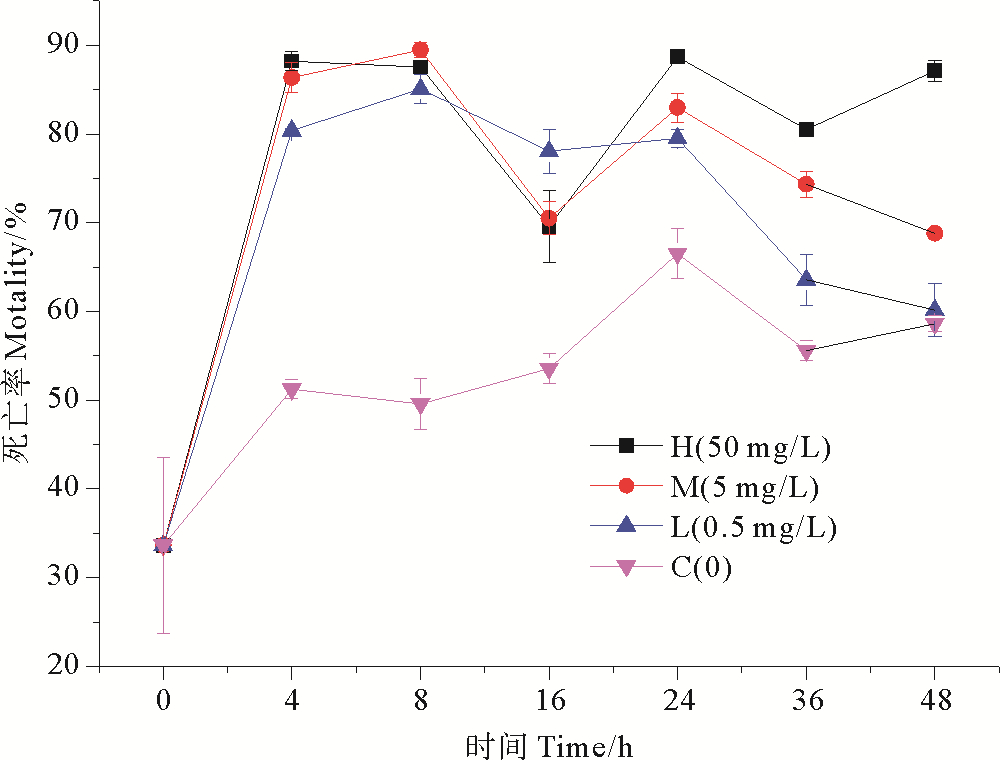
|
图 3 纳米银对细菌死亡率的影响 Fig. 3 Effect of nano-silver on bacterial mortality |
纳米银对细菌生长具有明显的抑制作用。随着纳米银浓度的升高,对细菌生长的抑制率也随之升高,具有明显的浓度梯度效应[22]。在不同浓度纳米银作用下,细菌死亡率在短时间内显著升高,但随着时间的推移,呈现缓慢恢复的状态。随着胁迫时间延长,细菌产生了一定的抗性,表明细菌对于纳米银胁迫具有一定的适应性,但到后期在纳米银和营养物质减少的双重作用下,细菌数量再一次降低,进而导致死亡率再次上升[23]。
2.2 纳米银对蛋白质含量的影响不同浓度纳米银作用下,海水中蛋白质含量的变化趋势如图 4所示。纳米银暴露8 h后,高浓度纳米银组蛋白质含量达到最低值21.453 mg/L,此时抑制效率最高,相比空白组降低了29.80%,在培养前期各实验组较对照组都有显著的抑制作用(P < 0.05)。在16 h后,各实验组蛋白质含量开始呈现出上升趋势,高浓度纳米银组蛋白质含量达到28.021 mg/L,但仍比对照组低8.32%,而中浓度和低浓度组蛋白质含量均高于对照组,细菌对纳米银胁迫开始出现适应性;在16~24 h蛋白质含量又缓慢降低,可能是由于水体中营养物质的减少,实验组细菌死亡率升高,导致蛋白质含量降低,细菌体内碱性磷酸酶和氨肽酶受到诱导,活性有所增加。在培养后期各实验组蛋白质含量都表现出了波动,但在培养结束时,各实验组蛋白质含量均低于对照组。中浓度纳米银组与低浓度纳米银组的变化趋势类似。由单因素方差分析结果可以看出,高浓度纳米银添加组较对照组表现出显著的抑制效应(P < 0.05),低、中浓度组相比的抑制效应物显著性差异(P>0.05),因此纳米银对细菌蛋白质含量的抑制作用没有明显的浓度梯度效应。
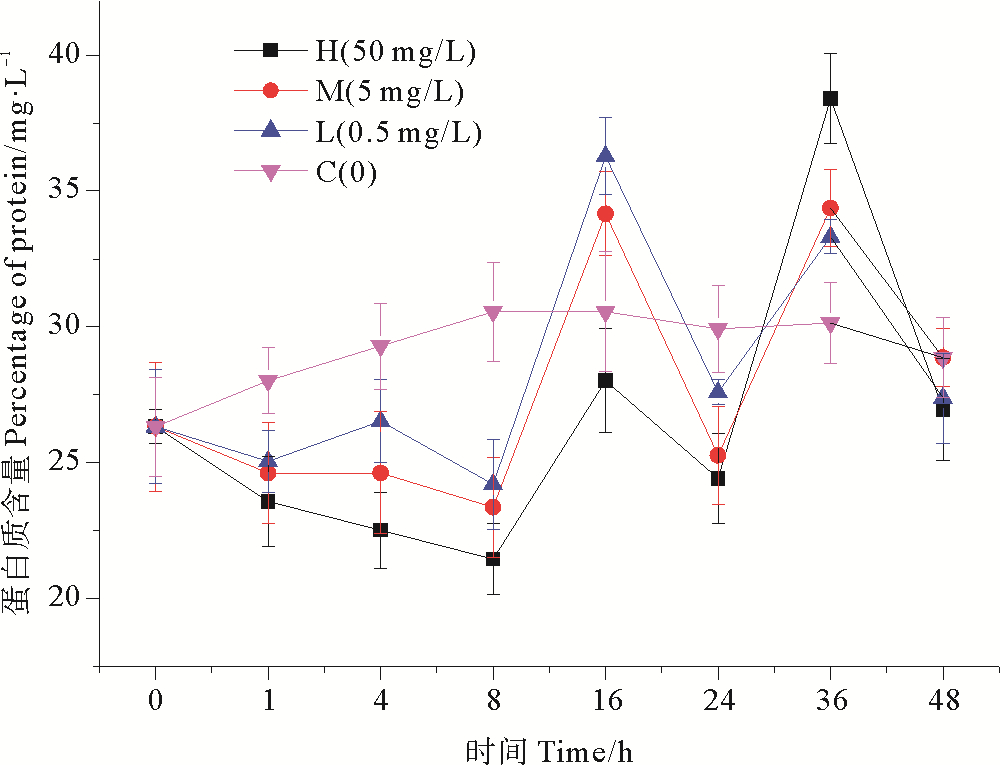
|
图 4 纳米银对细菌蛋白质的影响 Fig. 4 Effect of nano-silver on bacterial protein |
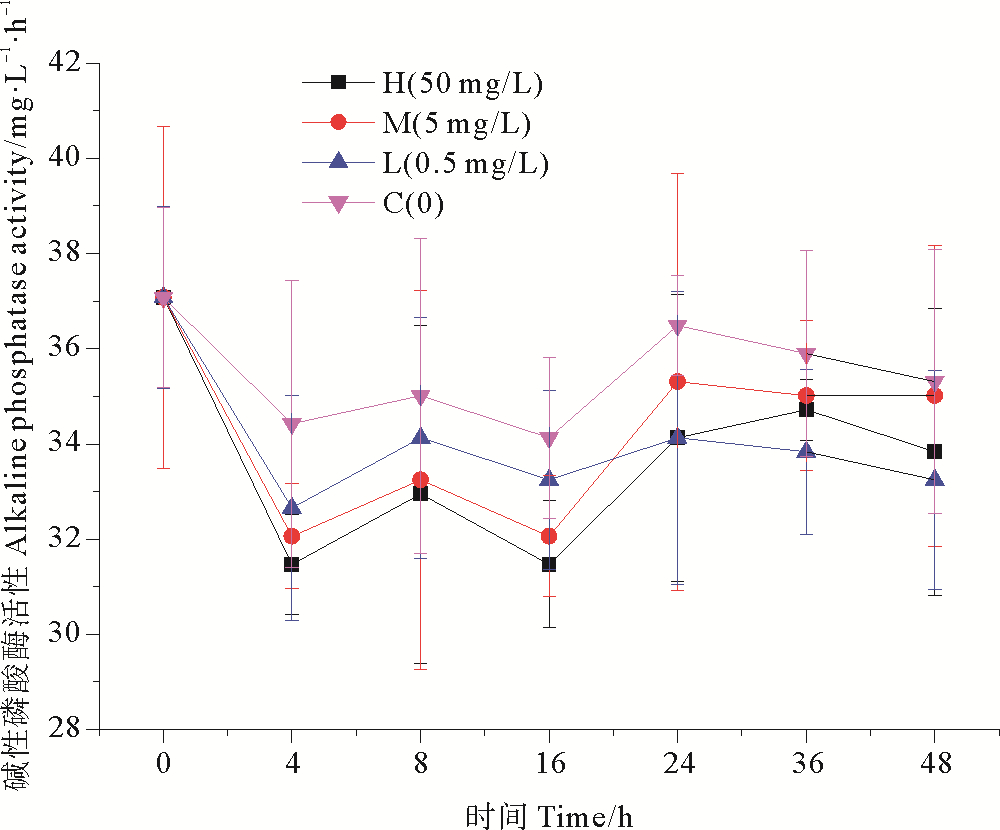
不同浓度纳米银作用下,海水中碱性磷酸酶活性的变化趋势如图 5所示。在纳米银添加后,各实验组碱性磷酸酶活性都出现不同程度的降低,细菌对纳米银胁迫表现出急性毒性效应,在培养1~4 h抑制效应最强,高浓度组碱性磷酸酶活性达到最低值31.469 mg·L-1·h-1,相比空白组降低了8.58%。在暴露16 h后,高浓度组碱性磷酸酶活性降到最低值31.469 mg·L-1·h-1,此时相比空白组降低了7.78%;在培养后期,碱性磷酸酶活性呈现恢复趋势,可能是由于细菌对纳米银暴露产生适应性恢复。在实验室模拟培养周期内,低、中浓度纳米银组和高浓度纳米银组的变化趋势类似,但碱性磷酸酶活性始终高于同期高浓度组。从单因素方差分析中可以看出,高浓度组碱性磷酸酶活性较对照组有极其显著的差异性(P < 0.01),且浓度越高,显著性差异越明显。由此可见,不同纳米银浓度作用下酶活性受到抑制的程度不同,高浓度组碱性磷酸酶活性抑制最为明显(P < 0.01),表现出明显的浓度梯度效应。
|
图 5 纳米银对碱性磷酸酶活性的影响 Fig. 5 Effect of nano-silver on alkaline phosphatase activity |
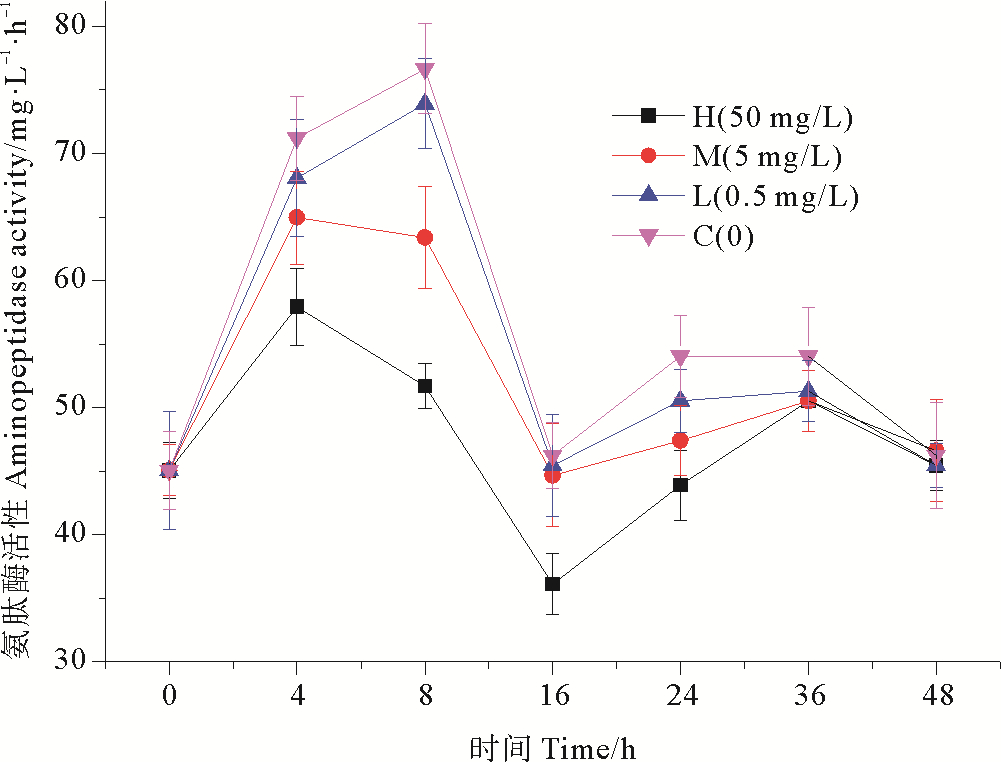
不同浓度纳米银作用下,培养体系中氨肽酶活性的变化趋势如图 6所示。各实验组氨肽酶活性较对照组都有降低,在纳米银胁迫下4 h后,高浓度组氨肽酶活性相比于对照组抑制率达到18.62%,抑制效应显著(P < 0.01);16 h后,高浓度组氨肽酶活性相比空白组降低了32.55%,抑制效率达到最高;在16~24 h内,氨肽酶活性呈现恢复趋势,细菌对纳米银胁迫表现出适应性恢复。中浓度组和低浓度组变化趋势与高浓度组基本相同,但是氨肽酶活性也是始终高于高浓度组,基本趋势为纳米银浓度越高,酶活性越低。在实验周期内,细菌氨肽酶活性在短时间内受到抑制,但在培养后期逐渐恢复,由此可见,纳米银对细菌氨肽酶活性的影响是短暂的[24]。由单因素方差分析可以看出,在0~24 h,高浓度组相比于对照组具有极显著性差异(P < 0.01),中浓度组对比于对照组也具有显著性差异(P < 0.05),低浓度组无显著性差异(P>0.05);在24~36 h,各浓度组相比于对照组无显著性差异(P>0.05)。由此可知,细菌氨肽酶活性受纳米银抑制的大小具有浓度梯度效应且在培养后期氨肽酶活性受纳米银胁迫影响较小。
|
图 6 纳米银对氨肽酶活性的影响 Fig. 6 Effect of nano-silver on aminopeptidase activity |
综合纳米银对两种细菌重要胞外酶活性的影响可以看出,纳米银暴露环境下,细菌胞外酶活性均具有明显抑制效应,且纳米银浓度越高,抑制效应越显著。在纳米银加入前期,细菌就会产生强烈的应激反应,在纳米银暴露4 h后,各实验组纳米银相比于对照组对细菌酶活性的抑制最强,表现出急性毒性效应,在纳米银暴露16 h后,酶活性达到最低值,16 h后,各实验组酶活性缓慢升高,细菌对纳米银暴露产生了一定的适应性。
3 讨论本研究中,在纳米银胁迫4 h后所有实验组浮游细菌死亡率较同期对照达到了峰值,实验组细菌死亡率较对照组有明显区别,纳米银浓度越高,细菌死亡率越高。然而,纳米银对细菌的抑制效应在培养16 h后开始减小,实验组细菌死亡率与同期对照差异减小,浮游细菌开始出现适应性。这说明了本研究中使用的纳米银对细菌具有毒性效应,但纳米银对细菌的抑制在培养后期出现了适应性,高浓度纳米银对细菌的抑制效应相对较强,细菌的适应性较弱。随着纳米银暴露浓度的增加,纳米银颗粒的数量增加,因此随着更多纳米银颗粒与细菌的动态混合,导致海水中的纳米银对细菌生长产生更加明显的抑制作用,呈现出一定的剂量效应关系。由此可见,高浓度纳米银对细菌有极显著的抑制效应,其可能原因有三种,即抑制细菌增殖、诱导细菌凋亡或诱导细菌死亡。纳米材料对海洋生态系统的短期影响可能出现在局部水体或纳米材料点源输入附近的地点,但随着时间的推移,在远离近岸和纳米银输入点源的海区这种影响可以通过在海水中的稀释来克服[25]。
纳米银进入水体后释放的Ag+可以通过攻击细胞膜上或者细胞内部的含硫蛋白质破坏细胞的结构和功能,Ag+与含硫、磷的基团结合或与蛋白质三维结构中的二硫键结合,使蛋白质结构破坏而失去活性,从而抑制细菌细胞的新陈代谢[26]。实验组蛋白质含量在培养前期较对照组有明显抑制(P < 0.05),但在纳米银添加16 h后,蛋白质含量出现波动,细菌对纳米银胁迫出现适应性。细菌的DNA碱基对也可以与纳米银释放的Ag+发生化学反应,与细菌DNA中的嘌呤和嘧啶相邻的氢键发生置换反应,形成复杂的交叉链接,导致DNA无法自我复制和转录,致使蛋白质空间结构破坏失去活性进而导致细菌细胞死亡[27-29]。但纳米银对细菌的抑制是短暂的,培养后期,实验组的蛋白质含量与空白组相近。在整个过程中,蛋白质含量随着胁迫时间延长出现恢复的迹象,这种恢复可能与部分不敏感的细菌群落有关。当细菌受到纳米银胁迫时,会产生更多的蛋白质(如:酶、无序蛋白或其他应激蛋白等)通过解毒代谢来减轻伤害,由此导致细菌活性升高而出现对纳米银胁迫具有一定的适应性。而高浓度的纳米银造成蛋白质含量的减少可能是因为蛋白质合成过程受到干扰,减少了蛋白质的合成,或者因为蛋白质的分解加速[30]。
在本研究中,纳米银添加对细菌碱性磷酸酶和氨肽酶都有明显的抑制。在大肠杆菌培养实验中,纳米银添加使细菌胞内色氨酸酶的活性降低60%以上,纳米银屏蔽了酶的部分活性基团或改变了酶的结构而导致酶活性降低甚至失去活性[31]。纳米银颗粒接触并进入细菌后,会与酶的氧、氮和巯基等重要功能基团结合,引起酶的三维构象改变,或替换出酶中的金属离子,进而影响酶的稳定性,最终影响酶发挥催化功能[32]。当水体中的营养物质浓度较低,不足以维持细菌生长时,细菌体内碱性磷酸酶和氨肽酶将受到诱导,使其活性显著地增加[32]。但由于纳米银的持续影响,酶活性增长率低于抑制率,使其在1~8 h内活性并没有明显升高,但在16 h后,与对照组酶活性相差幅度减小,在暴露36 h后,酶活性显示恢复的迹象。在培养的中后期,各浓度纳米银作用条件下,酶活性都表现出了恢复的趋势,表明细菌胞外酶的活性对纳米银的胁迫具有一定的适应性。
4 结论(1) 纳米银对青岛近海水体中的细菌生长和活性具有一定的抑制作用。纳米银作用下细菌酶活性和蛋白质含量都显著下降,纳米银胁迫会影响细菌正常生理代谢,导致细菌死亡率升高和环境功能的下降。
(2) 在纳米银暴露初期,细菌死亡率显著升高,细菌酶活性和蛋白质含量受抑制程度最高,但在暴露后期呈现缓慢恢复的趋势,表现出对纳米银胁迫具有一定的适应性。
(3) 随着纳米银浓度的升高,细菌死亡率和酶活性的抑制率均随之升高,蛋白质含量降低,表明纳米银对细菌生长和酶活性的抑制具有显著的浓度梯度效应。
| [1] |
Shrivastava S, Bera T. Characterization of enhanced antibacterial effects of novel silver nanoparticles[J]. Nanotechnology, 2007, 18(22): 225103-225112. DOI:10.1088/0957-4484/18/22/225103
(  0) 0) |
| [2] |
Amber N, Alistair H. Silver nanoparticles embedded in zeolite membranes: Release of silver ions and mechanism of antibacteria action[J]. International Journal of Nanomedicine, 2011, 6: 1833-1852.
(  0) 0) |
| [3] |
Erental A, Sharon I, Engelberg-Kulka H. Two programmed cell death systems in Escherichia coli: An apoptotic-like death is inhibited by the maz EF-mediated death pathway[J]. PLOS Biology, 2012, 10(3): e1001281. DOI:10.1371/journal.pbio.1001281
(  0) 0) |
| [4] |
Daniel J D, Jonathan A W. Identification and characterization of programmed cell death markers in bacterial models[J]. Springer, 2013, 1004: 145-159.
(  0) 0) |
| [5] |
Moore M N. Do nanoparticles present ecotoxicological risks for the health of the aquatic environment?[J]. Environment International, 2006, 32(8): 967-976. DOI:10.1016/j.envint.2006.06.014
(  0) 0) |
| [6] |
周东美. 纳米银在土壤中的迁移转化及其环境效应[J]. 环境化学, 2015, 34(4): 605-613. Zhou D M. Transport and transformation of nano-Ag particle in soils and its environmental effects[J]. Environmental Chemistry, 2015, 34(4): 605-613. (  0) 0) |
| [7] |
Liu Y, Nie Y G, Wang J J, et al. Mechanisms involved in the impact of engineered nanomaterials on the joint toxicity with environmental pollutants[J]. Ecotoxicology and Environmental Safety, 2018, 162(1): 92-102.
(  0) 0) |
| [8] |
Wang Z, Zhang L, Zhao J, et al. Environmental processes and toxicity of metallic nanoparticles in aquatic systems as affected by natural organic matter[J]. Environmental Science and Technology, 2016, 3(2): 240-255.
(  0) 0) |
| [9] |
Liu K, Liu X, Zhao J. Toxic effects of the interaction of titanium dioxide nanoparticles with chemicals or physical factors[J]. International Journal of Nanomedicine, 2013, 8(1): 2509-2520.
(  0) 0) |
| [10] |
姜威, 虞俊超, 魏潇然.氧化物纳米颗粒对细胞膜的作用及损伤机制研究[C].贵阳: 第七届全国环境化学学术大会, 2013. Jiang W, Yu J C, Wei X R. Effect of Oxide Nanoparticles on Cell Membrane and Mechanism of Damage[C]. Guiyang: The 7th National Conference on Environmental Chemistry, 2013. (  0) 0) |
| [11] |
陈飞飞, 陈艳芳, 王叶云, 等. 纳米银灭菌机制及应用研究进展[J]. 安徽农业科学, 2016(9): 28-30. Chen F F, Chen Y F, Wang Y Y, et al. Research progress on the mechanism and application of nano-silver sterilization[J]. Joumal of Anhui Agricultural Sciences, 2016(9): 28-30. DOI:10.3969/j.issn.0517-6611.2016.09.010 (  0) 0) |
| [12] |
Nagy A, Harrison A, Sabbani S, et al. Silver nanoparticles embedded in zeolite membranes: Release of silver ions and mechanism of antibacterial action[J]. International Journal of Nanomedicine, 2011, 6: 1833-1852.
(  0) 0) |
| [13] |
Karlesson H L. The comet assay in nanotoxicology research[J]. Analytical and Bioanalytical Chemistry, 2010, 398(2): 651-666. DOI:10.1007/s00216-010-3977-0
(  0) 0) |
| [14] |
王静, 冀志江, 水中和, 等. 纳米银溶胶与大肠杆菌作用及作用机理研究[J]. 材料导报, 2013(24): 4-8. Wang J, Ji Z J, Shui Z H, et al. Researh on the interaction and mechanism of Escherichia coli with nano silver soil[J]. Materials Review, 2013(24): 4-8. (  0) 0) |
| [15] |
陈姝颖, 李海毅, 李昭阳. 纳米银对水体中消化细菌活性的影响[J]. 东北师大学报, 2018, 50(2): 151-155. Chen S Y, Li H Y, Li Z Y. Effects of silver nanoparticles on the activity of digestive bacteria in water[J]. Northeast Normal University Newspaper, 2018, 50(2): 151-155. (  0) 0) |
| [16] |
Chuang Y, Chen I, Chen C. The surface modification of silver nanoparticles by phosphoryl disulfides for improved biocompatibility and intracellular uptake[J]. Biomaterials, 2008, 29(12): 1807-1816. DOI:10.1016/j.biomaterials.2007.12.032
(  0) 0) |
| [17] |
M M Bradford. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 1976, 72(1-2): 248-254. DOI:10.1016/0003-2697(76)90527-3
(  0) 0) |
| [18] |
Bhalgat M K, Haugland R P, Pollack J S, et al. Green- and red-fluorescent nanospheres for the detection of cell surface receptors by flow cytometry[J]. Journal of Immunological Methods, 1998, 219(1998): 57-68.
(  0) 0) |
| [19] |
Jones K H, Senft J A. An improved method to determine cell viability by simultaneous staining with fluorescein diacetate-propidium iodide[J]. Journal of Histochemistry & Cytochemistry Official Journal of the Histochemistry Society, 1985, 33(1): 77-79.
(  0) 0) |
| [20] |
Manti Ai, Boi P, Falcioni T C, et al. Bacterial cell monitoring in wastewater treatment plants by flow cytometry[J]. Water Environ Res, 2008, 80(4): 346-54. DOI:10.2175/106143007X221418
(  0) 0) |
| [21] |
Tsai A T, Gong G C, Chao C F. Contribution of viral lysis and nanoflagellate grazing to bacterial mortality at surface waters and deeper depths in the coastal ecosystem of Subtropical Western Pacific[J]. Estuaries and Coasts, 2016, 39(5): 1357-1366. DOI:10.1007/s12237-016-0098-9
(  0) 0) |
| [22] |
Zhao G M, WangY L, Tian W, et al. Changes of arginyl and leucyl aminopeptidase activities in biceps femoris along Jinhua ham processing[J]. Meat Sci, 2006, 74(3): 450-458. DOI:10.1016/j.meatsci.2006.03.016
(  0) 0) |
| [23] |
Bindhu M R, Umadevi M. Surface plasm on resonance optical sensor and antibacterial activities of biosynthesized silver nanoparticles[J]. Spectrochimica Acta Part A Molecular & Biomolecular Spectroscopy, 2014, 121(5): 596-604.
(  0) 0) |
| [24] |
Kim J S, Kuk E, Yu K N, et al. Antimicrobial effects of silver nanoparticles[J]. Nanomedicine Nanotechnology Biology & Medicine, 2007, 3(1): 95.
(  0) 0) |
| [25] |
Pranab D, Maeguerite A, Xenopoulos, et al. effects of silver nanoparticles on bacterial activity in natural waters[J]. Environmental Toxicology and Chemistry, 2012, 31(1): 122-130. DOI:10.1002/etc.716
(  0) 0) |
| [26] |
Li W R, Xie X B, Shi Q S, et al. Antibacterial activity and mechanism of silver nanoparticles on Escherichia coli[J]. Applied Microbiology & Biotechnology, 2010, 85(4): 1115-1122.
(  0) 0) |
| [27] |
谢小保, 李文茹, 曾海燕, 等. 纳米银对大肠杆菌的抗菌作用及其机制[J]. 材料工程, 2008(10): 106-109. Xie X B, Li W R, Zeng H Y, et al. Antibacterial effect of silver nanoparticles on Escherichia coli and its mechanism[J]. Joumal of Materials Engineering, 2008(10): 106-109. DOI:10.3969/j.issn.1001-4381.2008.10.028 (  0) 0) |
| [28] |
Feng Q L, Wu J, Chen G Q, et al. A mechanistic study of the antibacterial effect of silver ions on Escherichia coli and Staphylococcus aureus[J]. Journal of Biomedical Materials Research, 2000, 52(4): 662-668. DOI:10.1002/1097-4636(20001215)52:4<662::AID-JBM10>3.0.CO;2-3
(  0) 0) |
| [29] |
Rai M, Yadav A, Gade A. Silver nanoparticles as a new generation of antimicrobials[J]. Biotechnology Advances, 2009, 27(1): 76-83. DOI:10.1016/j.biotechadv.2008.09.002
(  0) 0) |
| [30] |
王娟.纳米银对土壤氮素微生物转化过程的影响及其机制[D].安徽: 安徽农业大学, 2017. Wang J. Effects of Silver Nanoparticles on Microbial Transformation of Soil Nitrogen and Its Mechanism[D]. Anhui: Anhui Agricultural University, 2017. (  0) 0) |
| [31] |
Wigginton N S, De Titta A, Piccapietra F, et al. Binding of silver nanoparticles to bacterial proteins depends on surface modifications and inhibits enzymatic activity[J]. Environment Science Technology, 2010, 44: 2163-2168. DOI:10.1021/es903187s
(  0) 0) |
| [32] |
徐盛平, 王升启, 刘琪琦. 纳米抗菌剂抗菌性能研究进展[J]. 生物技术通讯, 2016(6): 870-873. Xu S P, Wang S Q, Liu Q Q. Research progress of antibacterial properties of nanometer antibacterial agents[J]. Letters in Biotechnology, 2016(6): 870-873. DOI:10.3969/j.issn.1009-0002.2016.06.028 (  0) 0) |
| [33] |
高光, 高锡芸, 秦伯强, 等. 太湖水体中碱性磷酸酶的作用阈值[J]. 湖泊科学, 2000(4): 353-358. Gao G, Gao X Y, Qin B Q, et al. The action threshold of alkaline phosphatase in taihu lake water[J]. Joumal of Lake Sciences, 2000(4): 353-358. DOI:10.3321/j.issn:1003-5427.2000.04.009 (  0) 0) |
2. The Key Laboratory of Environment and Ecology, Ministry of Education, Ocean University of China, Qingdao 2661000, China;
3. College of Marine Life Sciences, Ocean University of China, Qingdao 266003, China
 2020, Vol. 50
2020, Vol. 50


