2. 广东海大集团股份有限公司,广东 广州511400;
3. 海洋活性物质与现代分析技术重点实验室(自然资源部第一海洋研究所),山东 青岛 266061
近年来,微藻因富含多种生物活性物质而逐步成为开发医疗药物、保健品等高附加值产品的重要原料[1-3]。与其它生物药物原料相比,微藻具有生长繁殖迅速、适应能力强、可大规模培养等优势[4-5]。众多研究表明,微藻活性物质应用于医疗保健领域潜力巨大,其中,微藻胞外多糖和藻胆蛋白是一类重要的生物活性物质[6-7],因其具有抗肿瘤、降血糖、抗氧化及抗辐射等诸多药用价值而逐步成为国内外研究热点[8-12]。这些活性物质含量变化很大程度上与微藻种类及培养条件有关[3]。因此,研究影响微藻活性物质积累的因子具有重要意义。
NaHSO3是一种成本低廉、安全环保且效果明显的光合作用促进剂[13]。目前,已有不少国内外学者进行了NaHSO3对农作物光合作用促进效应的研究,研究结果均表明,一定浓度的NaHSO3能够提高农作物光合速率,促进光合产物积累,增加农作物产量并改善其品质[14-18]。近年来,将NaHSO3应用于微藻的研究也逐渐开展起来[19-20]。Wang等[19]研究发现,低浓度NaHSO3可促进集胞藻PCC6803(Synechocystis sp. PCC6803)的光合放氧速率和细胞干重增加。程建峰等[20]研究发现一定浓度的NaHSO3能够促使盐生杜氏藻(Dunaliella salina)胞内叶绿素含量上升,进而提高其光合速率。
紫球藻(Porphyridium violaceum)属于红毛菜目(Bangiales)紫球藻科(Porphyridiaceae)紫球藻属(Porphyridium)[21]。蓝隐藻(Chroomonas placoidea)属于隐藻目(Cryptomonadales)隐鞭藻科(Cryptomonadaceae)蓝隐藻属(Chroomonas)[22]。研究表明,紫球藻和蓝隐藻在生长过程中会产生硫酸酯多糖、β-藻红蛋白、花生四烯酸和藻胆蛋白等多种活性物质,具有较高经济和药用价值[23-25]。目前,有关NaHSO3对紫球藻和蓝隐藻生长影响的报道尚未见到。本实验以紫球藻和蓝隐藻为研究对象,探究不同浓度NaHSO3对其生长、叶绿素荧光特性、胞外多糖和藻胆蛋白含量的影响,筛选出对紫球藻和蓝隐藻生长及相关活性物质积累的最适NaHSO3浓度,以期为2种微藻的开发利用提供理论依据。
1 材料与方法 1.1 藻种实验所用紫球藻(Porphyridium violaceum MACC/R17)和蓝隐藻(Chroomonas placoidea MACC/T11)藻种均取自中国海洋大学微藻种质库。
1.2 实验设计根据预实验结果,分别设定紫球藻和蓝隐藻的NaHSO3浓度,其中紫球藻的NaHSO3浓度设定为0(对照组)、0.25、0.5、1、2和3 mmol/L,蓝隐藻的NaHSO3浓度设定为0(对照组)、0.06、0.12、0.24、0.48和0.96 mmol/L,每个浓度梯度设置3个平行。实验藻种的培养在500 mL锥形瓶中进行,培养条件为:温度(23±1)℃,盐度32,光照强度60 μmol·m-2·s-1,光周期18L:6D,采用连续充气培养。定时(次/2d)定量(5 mL/次)取样,测定细胞密度和叶绿素荧光参数,培养结束后测定细胞干重及胞外多糖和藻胆蛋白含量。
1.3 细胞密度测定分别采用标准曲线法和血球计数板法对紫球藻和蓝隐藻进行细胞密度测定。
1.4 细胞干重测定紫球藻通过建立光密度值与干重之间的标准曲线进行细胞干重的测定;蓝隐藻通过取适量藻液,进行离心(离心条件为4 000 r/min,10 min)、砂芯过滤器抽滤收获,冷冻干燥后直接称其干重。
1.5 叶绿素荧光参数测定按照梁英等[26]的方法,用Water-PAM水样叶绿素荧光仪进行叶绿素荧光参数的测定。测定的参数包括Fv/Fm(最大光能转化效率)、rETR(相对电子传递速率)、qP(光化学淬灭系数)及NPQ(非光化学淬灭系数)。
1.6 胞外多糖和藻胆蛋白测定分别采用浓硫酸-苯酚法[27]和蛋白试剂盒进行胞外多糖和藻胆蛋白含量的测定。
1.7 数据处理用Origin8.5软件绘图,SPSS19.0软件进行单因素方差分析和多重比较,P<0.05表示差异显著。
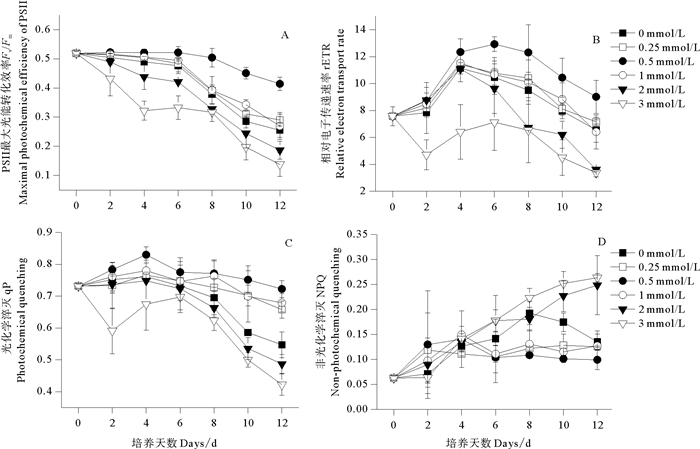
2 结果与分析 2.1 不同浓度NaHSO3对紫球藻叶绿素荧光参数的影响图 1表示不同浓度NaHSO3对紫球藻叶绿素荧光参数的影响。单因子方差分析结果显示,不同浓度NaHSO3对该藻各叶绿素荧光参数(Fv/Fm、rETR、qP、NPQ)均有显著影响(P<0.05)。由图 1可知,对照及各处理组的Fv/Fm值随培养时间增加整体呈下降趋势,多重比较结果表明,0.5 mmol/L处理组的该参数随培养时间变化不显著(P>0.05),且在第8~12天显著高于对照及其他处理组;高浓度处理组(2~3 mmol/L)的Fv/Fm值下降幅度较大,在第4~12天显著低于对照及低浓度处理组(0.25~1 mmol/L)。第6~12天,0.5 mmol/L处理组的rETR值显著高于对照及其他处理组,0.25和1 mmol/L处理组的该参数与对照组差异不显著(P>0.05);第8~12天,高浓度处理组(2~3 mmol/L)的rETR值显著低于对照组。第10~12天,低浓度处理组(0.25~1 mmol/L)的qP值显著高于对照及高浓度处理组(2~3 mmol/L),且3 mmol/L处理组的qP值最小,其次是2 mmol/L处理组。对照及各处理组的NPQ值随培养时间增加整体呈上升趋势,其中,高浓度处理组(2~3 mmol/L)的该参数上升幅度较大,实验结束时,上述处理组的NPQ值显著高于对照及低浓度处理组(0.25~1 mmol/L)。
|
图 1 不同浓度NaHSO3对紫球藻叶绿素荧光参数的影响 Fig. 1 Effects of different NaHSO3 concentrations on the chlorophyll fluorescence parameters of P. violaceum |
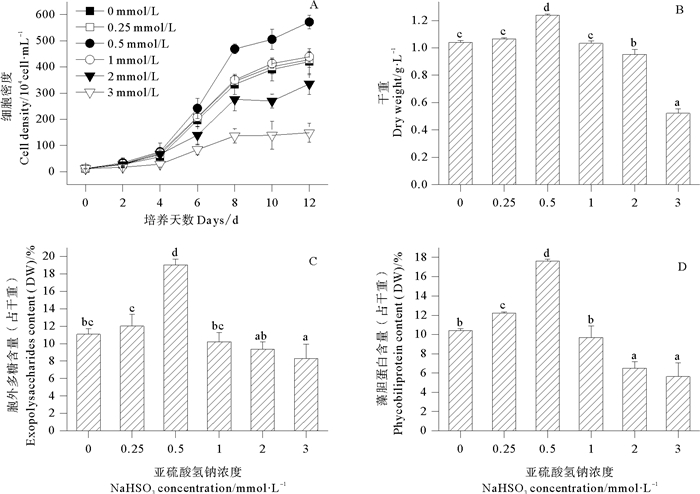
图 2反映了不同浓度NaHSO3对紫球藻细胞密度、干重、胞外多糖和藻胆蛋白含量的影响。由图 2可知,在整个培养周期中,对照及各处理组的细胞密度均呈上升趋势,实验结束时,细胞密度由大到小顺序为0.5 mmol/L处理组>1 mmol/L处理组>0.25 mmol/L处理组>对照组>2 mmol/L处理组>3 mmol/L处理组,其中,0.5 mmol/L处理组细胞密度最大,比对照组增加了36.0%,显著高于对照及其他处理组;而高浓度NaHSO3(2~3 mmol/L)则显著抑制该藻细胞密度增加。由图 2可知,0.25~0.5 mmol/L浓度NaHSO3能促进紫球藻干重、胞外多糖和藻胆蛋白含量增加,其中,NaHSO3浓度为0.5 mmol/L时促进效果最佳,该处理组的上述参数分别比对照组增加了19.1%、71.8%和69.0%,显著高于对照及其他处理组;1 mmol/L处理组与对照组差异不显著(P>0.05);而高浓度处理组(2~3 mmol/L)的细胞干重、胞外多糖和藻胆蛋白含量均显著小于对照及低浓度处理组(0.25~1 mmol/L),说明NaHSO3浓度为2~3 mmol/L时抑制紫球藻干重的增加及胞外多糖和藻胆蛋白的合成。
|
(abcd表示方差分析差异程度,相同字母表明处理组间差异不显著;不同字母表明处理组间差异显著(P<0.05)。abcd indicates variance analysis in the difference degree, the same letters are no significantly different from each other; the different letters are significantly different from each other (P < 0.05). ) 图 2 不同浓度NaHSO3对紫球藻细胞密度、干重、胞外多糖和藻胆蛋白含量的影响 Fig. 2 Effects of different NaHSO3 concentrations on the cell density, dry weight, exopolysaccharide and phycobiliprotein contents of P. violaceum |
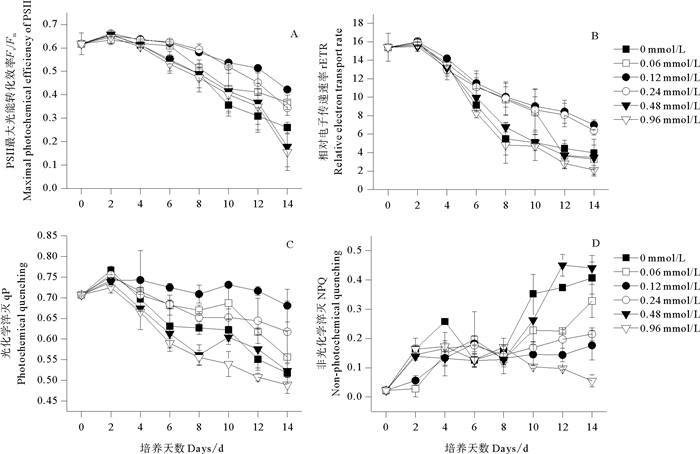
不同浓度NaHSO3对蓝隐藻叶绿素荧光参数Fv/Fm、rETR、qP和NPQ的影响见图 3。单因子方差分析结果表明,不同浓度NaHSO3对上述参数均有显著影响(P<0.05)。由图 3可知,对照及各处理组的Fv/Fm值随培养时间增加均呈下降趋势,其中,高浓度处理组(0.48~0.96 mmol/L)的该参数下降幅度较大;多重比较结果表明,实验结束时,低浓度处理组(0.06~ 0.24 mmol/L)的Fv/Fm值显著高于对照及高浓度处理组(0.48~0.96 mmol/L),其中,0.12 mmol/L处理组的Fv/Fm值最大。第12~14天,0.12~0.24 mmol/L处理组的rETR和qP值均显著高于对照及高浓度处理组(0.48~0.96 mmol/L),其中,0.12 mmol/L处理组的上述参数值最大。不同浓度NaHSO3对荧光参数NPQ的影响随培养天数的不同而变化,第8~14天,0.96 mmol/L处理组的NPQ值呈下降趋势,与对照及其他处理组的变化趋势相反;第12~14天,0.48 mmol/L处理组的NPQ值最大,低浓度处理组(0.06~0.24 mmol/L)及0.96 mmol/L处理组的该参数显著低于对照组,其中,0.96 mmol/L处理组的NPQ值最低。
|
图 3 不同浓度NaHSO3对蓝隐藻叶绿素荧光参数的影响 Fig. 3 Effects of different NaHSO3 concentrations on the chlorophyll fluorescence parameters of C. placoidea |
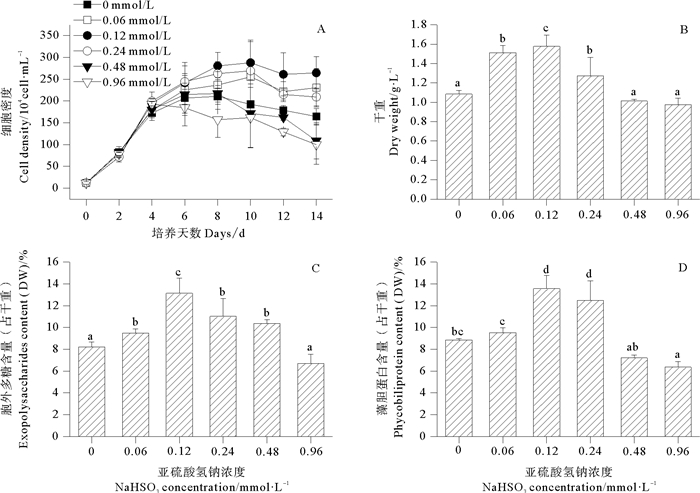
图 4反映了蓝隐藻在不同浓度NaHSO3培养条件下细胞密度、干重、胞外多糖和藻胆蛋白含量的变化趋势。由图 4可知,低浓度NaHSO3(0.06~0.24 mmol/L)显著促进蓝隐藻细胞密度增加,其中,NaHSO3浓度为0.12 mmol/L时促进效果最佳,实验结束时,该组细胞密度比对照组增加了60.8%;而高浓度NaHSO3(0.48~0.96 mmol/L)则显著抑制该藻细胞密度增加。由图 4可知,蓝隐藻干重、胞外多糖和藻胆蛋白含量随NaHSO3浓度增加均呈先上升后下降的趋势。低浓度NaHSO3(0.06~0.24 mmol/L)能促进蓝隐藻细胞干重及藻胆蛋白含量增加,其中,0.12 mmol/L浓度NaHSO3的促进效果最佳,该组的干重和藻胆蛋白含量分别比对照组增加了45.4%和53.1%;而高浓度NaHSO3(0.48~0.96 mmol/L)则不利于该藻细胞干重增加和藻胆蛋白的合成。0.06~0.48 mmol/L浓度NaHSO3均能促进蓝隐藻胞外多糖含量增加,其中,0.12 mmol/L处理组的胞外多糖含量最大,比对照组增加了60.0%,显著高于对照及其他处理组;0.96 mmol/L处理组的胞外多糖含量最低,但与对照组差异不显著(P>0.05)。
|
(abcd表示方差分析差异程度,相同字母表明处理组间差异不显著,不同字母表明处理组间差异显著(P<0.05)。abcd indicates variance analysis in the difference degree, the same letters are no significantly different from each other; the different letters are significantly different from each other (P < 0.05). ) 图 4 不同浓度NaHSO3对蓝隐藻细胞密度、干重、胞外多糖和藻胆蛋白含量的影响 Fig. 4 Effects of different NaHSO3 concentrations on the cell density, dry weight, exopolysaccharide and phycobiliprotein contents of C. placoidea |
NaHSO3是一种强还原剂,已有不少研究者将其应用于高等植物,研究结果均表明,较低浓度NaHSO3可促进植物生长,提高植物产量和品质,而过高浓度NaHSO3则会成为胁迫因子抑制植物生长[28-31]。廖飞勇等[13]总结前人研究指出,促进棉花、葡萄生长的最适NaHSO3浓度为1 mmol/L,小麦、茄子、油菜、草莓和番茄等为2 mmol/L,柑桔为5 mmol/L。近年来,将NaHSO3应用于微藻的研究也取得了一定进展。沈银武等[32]的研究表明,低浓度NaHSO3(0.01~0.1 mmol/L)能促进鱼腥藻(Anabaena sp.)生长及生物量的增加,浓度为0.05 mmol/L时促进效果最佳,当NaHSO3浓度达到0.2 mmol/L时藻体出现下沉及停止生长现象。Wang等[19]报道了低浓度NaHSO3(0.02~0.2 mmol/L)可显著提高集胞藻PCC6803的光合放氧速率和细胞干物质积累量,最适NaHSO3浓度为0.05 mmol/L,而高浓度NaHSO3(0.5~1 mmol/L)显著抑制该藻生长。程建峰等[20]研究发现,低浓度NaHSO3(≤0.4 mmol/L)对盐生杜氏藻的生长及光合色素含量具有促进作用,以0.07 mmol/L效果最佳。本实验结果也表明,较低浓度NaHSO3显著促进紫球藻和蓝隐藻生长及细胞干重的增加,较高浓度NaHSO3则显著抑制2种微藻的生长及细胞干物质积累量,促进紫球藻和蓝隐藻生长的最适NaHSO3浓度分别为0.5和0.12 mmol/L。
通过以上研究结果比较发现,不同高等植物、不同微藻种类及高等植物与微藻之间的适宜NaHSO3浓度具有差异性。促进微藻生长的最适NaHSO3浓度(0.05~0.5 mmol/L)远低于多细胞高等植物(1~5 mmol/L),这可能与施用方法(多细胞高等植物一般采用叶面喷施,而藻类直接添加在培养液中)及藻类自身特性(单细胞,结构简单)有关。不同种类的微藻也具有不同的NaHSO3适宜浓度,这可能是由于种间差异性(不同微藻种类细胞通透性强弱不同,对NaHSO3的敏感度和耐受力不同)及培养条件不同(培养基和光周期等),如沈银武等[32]、Wang等[19]和程建峰等[20]分别采用HB111[33]、BG-11[34]和Pick[35]配方培养基,光周期设定分别为12L:12D、连续光照和12L:12D,而本实验采用f/2培养基,光周期设定为18L:6D。从以上研究结果可以总结出:由于不同植物种类对NaHSO3响应不一及NaHSO3施用方法和实验条件的不同,适宜的NaHSO3浓度也有所不同,但均表现为较低浓度NaHSO3促进生长,较高浓度NaHSO3抑制生长,因此,选择适宜的NaHSO3浓度对微藻的培养至关重要。
3.2 NaHSO3对紫球藻和蓝隐藻叶绿素荧光特性的影响叶绿素荧光作为研究光合作用的良好探针,被称为探测植物环境胁迫下光合能力及光合器官状态的快速灵敏、无损伤的新型植物活体诊断技术[36-37]。通过分析各叶绿素荧光参数,可获得光合机构对光能的利用途径[38]。Fv/Fm为PSII最大光能转化效率,rETR表示PSII的表观电子传递速率,qP为光化学淬灭,表示的是PSII天线色素吸收的光能用于光化学电子传递的部分[39]。本实验结果发现,NaHSO3浓度分别为0.5和0.12 mmol/L时,紫球藻和蓝隐藻的Fv/Fm、rETR和qP值均显著高于对照组,较高NaHSO3浓度处理组的上述参数则低于对照及低浓度处理组。Wang等[19]的研究也表明,集胞藻PCC6803在最适NaHSO3浓度(0.05 mmol/L)下的Fv/Fm值显著高于对照组,高浓度NaHSO3处理组(0.5~1 mmol/L)的Fv/Fm值显著低于对照组。以上实验结果说明,适宜浓度NaHSO3可提高微藻PSII反应中心活性,使光能利用率和转化效率升高,进而促进光合作用,高浓度NaHSO3胁迫下使PSII反应中心受损,光合电子传递活性降低,导致碳的固定和同化效率降低。非光化学淬灭NPQ表示PSII天线色素吸收的光能中不能用于光化学反应而以热辐射形式耗散掉的份额[40],紫球藻和蓝隐藻在高浓度NaHSO3处理组的该参数高于对照及低浓度处理组,原因可能是微藻在高浓度NaHSO3胁迫下,PSII通过叶黄素循环使过剩的能量耗散,减轻光氧化,这是植物保护光合机构的一种方式。此外,本实验发现,蓝隐藻在高浓度NaHSO3处理组(0.96 mmol/L)的NPQ值在第8天呈下降趋势,且在实验后期,该处理组的NPQ值显著低于对照及其他处理组,这可能是由于NaHSO3浓度过高破坏了蓝隐藻的正常生理功能,导致热耗散系统对热能的耗散能力逐渐丧失。已有研究表明,低浓度NaHSO3可促进腺苷三磷酸(Adenosine triphosphate,ATP)的形成[15],因此,推测低浓度NaHSO3促进微藻光合作用的机理是通过增加ATP的供应来提高PSⅠ的循环电子传递效率,进而间接促进PSII的电子传递,最终提高藻细胞对光能的利用率,表现为叶绿素荧光参数(Fv/Fm、rETR和qP)数值的升高,而高浓度NaHSO3可能破坏藻类膜结构[41]或漂白其叶绿素[29],从而降低藻细胞光合速率表现为各叶绿素荧光参数值的下降。
3.3 NaHSO3对紫球藻和蓝隐藻胞外多糖和藻胆蛋白含量的影响微藻胞外多糖和藻胆蛋白的合成易受外界环境的影响,因此可通过改变培养条件定向筛选和促进该种生物活性物质的生成。本实验中,促进紫球藻和蓝隐藻胞外多糖和藻胆蛋白合成的最适NaHSO3浓度分别为0.5和0.12 mmol/L,2种微藻在较高浓度NaHSO3处理组中的胞外多糖和藻胆蛋白含量低于对照及低浓度处理组,这说明较高浓度NaHSO3不利于2种微藻的胞外多糖和藻胆蛋白合成。目前,对影响微藻胞外多糖和藻胆蛋白合成的研究多集中于氮源、光强及pH等方面[42-43],关于NaHSO3对微藻胞外多糖和藻胆蛋白影响的相关文献还未见报道。NaHSO3对微藻生长及相关活性物质合成的影响是一个十分复杂的过程,其对微藻细胞相关酶活性、基因表达调控及信号分子传导均可能产生影响,具体作用机理还需进一步研究。
4 结语不同浓度NaHSO3对紫球藻和蓝隐藻的生长、叶绿素荧光参数、细胞干重及胞外多糖和藻胆蛋白含量均有显著影响。NaHSO3浓度分别为0.5和0.12 mmol/L时,紫球藻和蓝隐藻的生长及叶绿素荧光参数均达到较理想状态,且它们的细胞干重、胞外多糖和藻胆蛋白含量达到最高;当NaHSO3浓度分别为2~3 mmol/L和0.48~0.96 mmol/L时,紫球藻和蓝隐藻的上述参数均受到抑制。因此,适合紫球藻和蓝隐藻生长及胞外多糖和藻胆蛋白合成的NaHSO3浓度分别为0.5和0.12 mmol/L。此结果为紫球藻和蓝隐藻的开发利用提供了理论依据。
| [1] |
Raposo M F, de Morais R M, Am B D M. Bioactivity and applications of sulphated polysaccharides from marine microalgae[J]. Marine Drugs, 2013, 11(1): 233-252. DOI:10.3390/md11010233
(  0) 0) |
| [2] |
Barbosa M, Valentão P, Andrade P B. Bioactive compounds from macroalgae in the new millennium: Implications for neurodegenerative diseases[J]. Marine Drugs, 2014, 12(9): 4934. DOI:10.3390/md12094934
(  0) 0) |
| [3] |
DeMorais M G, Vaz B D S, DeMorais E G, et al. Biologically active metabolites synthesized by microalgae[J]. Biomed Research International, 2015, 2015: 1-15.
(  0) 0) |
| [4] |
Spolaore P, Joannis-Cassan C, Duran E, et al. Commercial applications of microalgae[J]. Journal of Bioscience & Bioengineering, 2006, 101(2): 87-96.
(  0) 0) |
| [5] |
梁英, 黄徐林, 田传远, 等. 海洋药源微藻研究进展[J]. 中国海洋大学学报(自然科学版), 2016, 46(11): 32-43. Liang Y, Huang X L, Tian C Y, et al. Advances in studies on marine medicinal microalgae[J]. Periodical of Ocean University of China (Natural Science Edition), 2016, 46(11): 32-43. (  0) 0) |
| [6] |
Campo J A D, Rodríguez H, Moreno J, et al. Accumulation of astaxanthin and lutein in Chlorella zofingiensis (Chlorophyta)[J]. Applied Microbiology and Biotechnology, 2004, 64(6): 848. DOI:10.1007/s00253-003-1510-5
(  0) 0) |
| [7] |
Lorenz, Todd R, Cysewski, et al. Commercial potential for Haematococcus microalgae as a natural source of astaxanthin[J]. Trends in Biotechnology, 2000, 18(4): 160-167. DOI:10.1016/S0167-7799(00)01433-5
(  0) 0) |
| [8] |
刘红辉, 李敏, 汲红丽, 等. 紫球藻胞外多糖抗氧化和保湿性能的研究[J]. 食品研究与开发, 2014(5): 1-6. Liu H H, Li M, Ji H L, et al. Antioxidation and moisture retention activity of extracellular polysaccharides from Porphyridium cruentum[J]. Journal of Shandong Institute of Commerce and Technology, 2014(5): 1-6. DOI:10.3969/j.issn.1005-6521.2014.05.02 (  0) 0) |
| [9] |
王凌, 孙利芹, 赵小惠. 一种微藻多糖理化性质及抗氧化和保湿活性研究[J]. 精细化工, 2012, 29(1): 21-24. Wang L, Sun L Q, Zhao X H, et al. Physicochemical property analysis of polysaccharides from marine microalgae and their antioxidation, hygroscopicity and moisture retention activities[J]. Fine Chemicals, 2012, 29(1): 21-24. (  0) 0) |
| [10] |
Sun L, Wang C, Shi Q, et al. Preparation of different molecular weight polysaccharides from Porphyridium cruentum and their antioxidant activities[J]. International Journal of Biological Macromolecules, 2009, 45(1): 42. DOI:10.1016/j.ijbiomac.2009.03.013
(  0) 0) |
| [11] |
Sun L, Wang L, Zhou Y. Immunomodulation and antitumor activities of different-molecular-weight polysaccharides from Porphyridium cruentum[J]. Carbohydrate Polymers, 2012, 87(2): 1206-1210. DOI:10.1016/j.carbpol.2011.08.097
(  0) 0) |
| [12] |
王慧岭, 张晋阳, 罗建涛, 等. 微藻在食品领域的应用[J]. 安徽农业科学, 2018, 46(17): 44-47. Wang H L, Zhang J Y, Luo J T, et al. Application of microalgae in food field[J]. Journal of Anhui Agricultural Sciences, 2018, 46(17): 44-47. DOI:10.3969/j.issn.0517-6611.2018.17.013 (  0) 0) |
| [13] |
廖飞勇, 叶海燕, 何平. NaHSO3对光合作用的影响及其应用[J]. 吉首大学学报(自科版), 2005, 26(3): 49-52. Liao F Y, Ye H Y, He P. Effects of NaHSO3 on the photosynthesis and its application[J]. Journal of Jishou University (Natural Science Edition), 2005, 26(3): 49-52. (  0) 0) |
| [14] |
Yang W J, Chen H F, Zhu F Y, et al. Low concentration of bisulfite enhances photosynthesis in tea tree by promoting carboxylation efficiency in leaves[J]. Photosynthetica, 2008, 46(4): 615-617. DOI:10.1007/s11099-008-0103-z
(  0) 0) |
| [15] |
Wang H W, Shen Y G. How bisulfite enhances photosynthesis[J]. Acta Photophysiologica Sinica, 2002, 28: 247-252.
(  0) 0) |
| [16] |
司瑞利, 李永健, 许鸿源. 不同浓度亚硫酸氢钠对花生生理特性的影响[J]. 南方农业学报, 2008, 39(3): 309-312. Si R L, Li Y J, Xu H Y. Effects of different concentrations of NaHSO3 on the physiological characteristics of peanut[J]. Journal of Southern Agriculture, 2008, 39(3): 309-312. DOI:10.3969/j.issn.2095-1191.2008.03.012 (  0) 0) |
| [17] |
李海东, 张永征, 徐坤, 等. NaHSO3对姜叶片光合作用与活性氧及氮代谢关键酶活性的影响[J]. 园艺学报, 2013, 40(8): 1494-1500. Li H D, Zhang Y Z, Xu K, et al. Effects of NaHSO3 on photosynthesis and reactive oxygen and nitrogen metabolism enzyme activity in ginger leaves[J]. Acta Horticulturae Sinica, 2013, 40(8): 1494-1500. (  0) 0) |
| [18] |
程建峰, 陈根云, 沈允钢, 等. 低浓度NaHSO3对不同基因型小麦光合性能的影响[J]. 麦类作物学报, 2012, 32(2): 254-259. Cheng J F, Chen G Y, Shen Y G, et al. Effects of concentration NaHSO3 on the photosynthetic characteristics of various wheat cultivars[J]. Journal of Triticeae Crops, 2012, 32(2): 254-259. (  0) 0) |
| [19] |
Wang H W, Mi H, Ye J Y, et al. Low concentrations of NaHSO3 increase cyclic photophosphorylation and photosynthesis in Cyanobacterium synechocystis PCC6803[J]. Photosynthesis Research, 2003, 75(2): 151. DOI:10.1023/A:1022813402265
(  0) 0) |
| [20] |
程建峰, 胡芬红, 沈允钢. NaHSO3对盐生杜氏藻生长和光合色素含量的影响[J]. 热带海洋学报, 2010, 29(3): 65-70. Cheng J F, Hu F H, Shen Y G. Effects of NaHSO3 on the growth and contents of photosynthetic pigments in Dunaliella salina[J]. Journal of Tropical Oceanography, 2010, 29(3): 65-70. DOI:10.3969/j.issn.1009-5470.2010.03.010 (  0) 0) |
| [21] |
陈必链, 黄键, 梁世中. 紫球藻的研究进展[J]. 海洋通报, 2002, 21(5): 75-81. Chen B L, Huang J, Liang S Z. Progress in the studies of Porphyridium sp.[J]. Marine Science Bulletin, 2002, 21(5): 75-81. DOI:10.3969/j.issn.1001-6392.2002.05.011 (  0) 0) |
| [22] |
陈明耀. 生物饵料培养[M]. 北京: 中国农业出版社, 1995. Chen M Y. Live Food Cultivatology[M]. Beijing: China Agriculture Press, 1995. (  0) 0) |
| [23] |
沙沙.氮源对紫球藻生理的影响及紫球藻蛋白酶的初步研究[D].济南: 山东大学, 2012. Sha S. The effect of Nitrogen Source on the Physiological Effects of Porphyridium cruentum and the Preliminary Study of Porphyridium cruentum Protease[D]. Jinan: Shandong University, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10422-1012464704.htm (  0) 0) |
| [24] |
Cohen Z, Vonshak A, Richmond A. Effect of environmental conditions on fatty acid composition of the red alga Porphyridium cruentum : Correlation to growth rate[J]. Journal of Phycology, 1988, 24(3): 328-332.
(  0) 0) |
| [25] |
李文军, 陈敏. 蓝隐藻藻蓝蛋白结构与功能稳定性研究[J]. 海洋科学, 2013, 37(7): 33-40. Li W J, Chen M. Structural and functional stability of phycocyanin from Chroomonas placoidea[J]. Marine Sciences, 2013, 37(7): 33-40. (  0) 0) |
| [26] |
Liang Y, Sun M H, Tian C Y, et al. Effects of salinity stress on the growth and chlorophyll fluorescence of Phaeodactylum tricornutum and Chaetoceros gracilis (Bacillariophyceae)[J]. Botanica Marina, 2014, 57(6): 469-476.
(  0) 0) |
| [27] |
李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000: 194-197. Li H S. Experiment Principle and Technology of Plant Physiology and Biochemistry[M]. Beijing: High Education Press, 2000: 194-197. (  0) 0) |
| [28] |
陈屏昭, 蒋彬, 刘忠荣, 等. 亚硫酸氢盐影响植物光合特性的生理学分析[J]. 北方园艺, 2010(5): 206-210. Chen P Z, Jiang B, Liu Z R, et al. Physiological analysis for effect of bisulfite on plants photosynthetic characteristics[J]. Northern Horticulture, 2010(5): 206-210. (  0) 0) |
| [29] |
武卫华, 祁岑, 蒋彬, 等. 低浓度亚硫酸氢钠对植物光合作用的促进效应研究进展[J]. 贵州农业科学, 2010, 38(6): 60-64. Wu W H, Qi C, Jiang B, et al. Research progress in promoting effect of sodium bisulfite with low concentration on photosynthesis[J]. Guizhou Agricultural Sciences, 2010, 38(6): 60-64. DOI:10.3969/j.issn.1001-3601.2010.06.019 (  0) 0) |
| [30] |
马红群, 洪鸿, 周忆堂, 等. NaHSO3对UV-B辐射增强下菠菜幼苗光合作用的影响[J]. 园艺学报, 2009, 36(3): 369-376. Ma H Q, Hong H, Zhou Y T, et al. Effects of NaHSO3 on photosynthesis in spinach seedlings under enhanced UV-B radiation[J]. Acta Horticulturae Sinica, 2009, 36(3): 369-376. DOI:10.3321/j.issn:0513-353X.2009.03.009 (  0) 0) |
| [31] |
陈功楷, 王晓艳, 康华靖, 等. NaHSO3处理对大豆和玉米叶片气体交换及荧光参数的影响[J]. 核农学报, 2017, 31(2): 379-385. Chen G K, Wang X Y, Kang H J, et al. Effect of different NaHSO3 concentrations on gas exchange and fluorescence parameters in beans and maize[J]. Journal of Nuclear Agricultural Sciences, 2017, 31(2): 379-385. (  0) 0) |
| [32] |
沈银武, 刘永定, 利群, 等. 亚硫酸氢钠对鱼腥藻生长的影响[J]. 水生生物学报, 1993, 17(3): 211-215. Shen Y W, Liu Y D, Li Q, et al. Effect of NaHSO3 on the growth of Anabaena[J]. Acta Hydrobiologica Sinica, 1993, 17(3): 211-215. DOI:10.3321/j.issn:1000-3207.1993.03.007 (  0) 0) |
| [33] |
黎尚豪. 固氮蓝藻作为晚稻肥源的研究[J]. 水生生物学报, 1981(3): 417-423. Li S H. Study on nitrogen fixation Cyanobacteria as fertilizer source of late rice[J]. Acta Hydrobiologica Sinica, 1981(3): 417-423. (  0) 0) |
| [34] |
Allen, Mennes M. Simple conditions for growth of unicellular blue-green algae on plates[J]. Journal of Phycology, 1968, 4(1): 1. DOI:10.1111/j.1529-8817.1968.tb04667.x
(  0) 0) |
| [35] |
Pick U, Karni L, Avron M. Determination of ion content and ion fluxes in the halotolerant alga Dunaliella salina[J]. Plant Physiology, 1986, 81: 92-96. DOI:10.1104/pp.81.1.92
(  0) 0) |
| [36] |
Blache U, Jakob T, Su W, et al. The impact of cell-specific absorption properties on the correlation of electron transport rates measured by chlorophyll fluorescence and photosynthetic oxygen production in planktonic algae[J]. Plant Physiology Biochemistry, 2011, 49(8): 801-808. DOI:10.1016/j.plaphy.2011.04.010
(  0) 0) |
| [37] |
Perron M C, Qiu B, Boucher N, et al. Use of chlorophyll a fluorescence to detect the effect of microcystins on photosynthesis and photosystem Ⅱ energy fluxes of green algae[J]. Toxicon Official Journal of the International Society on Toxinology, 2012, 59(5): 567. DOI:10.1016/j.toxicon.2011.12.005
(  0) 0) |
| [38] |
刘忠荣, 樊钦平, 李祥, 等. 叶绿素荧光动力学参数对亚硫酸氢钠生理响应研究进展[J]. 广东农业科学, 2011, 38(9): 117-121. Liu Z R, Fan Q P, Li X, et al. Physiological respond of chlorophyll fluorescence kinetic parameters to treatment of sodium bisulfite[J]. Guangdong Agricultural Sciences, 2011, 38(9): 117-121. DOI:10.3969/j.issn.1004-874X.2011.09.041 (  0) 0) |
| [39] |
Muller P, Li X P, Niyogi K K. Non-photochemical quenching: A response to excess light energy[J]. Plant Physiology, 2001, 125: 1558-1566. DOI:10.1104/pp.125.4.1558
(  0) 0) |
| [40] |
曹春晖, 孙世春, 王学魁, 等. 锰浓度对米氏凯伦藻叶绿素荧光特性及生长的影响[J]. 生态学报, 2010, 30(19): 5280-5288. Cao C H, Sun S C, Wang X K, et al. Effects of manganese concentrations on the chlorophyll fluorescence characteristics and growth of Karenia mikimotoi[J]. Acta Ecologica Sinica, 2010, 30(19): 5280-5288. (  0) 0) |
| [41] |
Lüttge U, Osmond C B, Ball E, et al. Bisulfite compounds as metabolic inhibitors: Nonspecific effects on membranes[J]. Plant & Cell Physiology, 1972, 13(3): 505-514.
(  0) 0) |
| [42] |
葛红梅, 周旭萍, 夏令, 等. 光强和氮源对念珠藻胞外多糖分泌的影响[J]. 水生生物学报, 2014, 38(3): 480-486. Ge H M, Zhou X P, Xia L, et al. Effects of light and nitrogen source on the secretion of extracellular polysaccharides from Nostoc sp.[J]. Acta Hydrobiologica Sinica, 2014, 38(3): 480-486. (  0) 0) |
| [43] |
王经洁.环境因子对微囊藻胞外多糖以及藻毒素分泌的影响研究[D].南京: 南京大学, 2011. Wang J J. Study on the Factors Affecting the Exudation of Extracellular Polysaccharides and Microcystins by Microcystis aeruginosa FACHB-905[D]. Nanjing: Nanjing University, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10284-1011126799.htm (  0) 0) |
2. Guangdong Haid Group Co., Limited, Guangzhou 511400, China;
3. Key Laboratory of Marine Bioactive Substance, the First Institute of Oceanography, Ministry of Natural Resources, Qingdao 266061, China
 2020, Vol. 50
2020, Vol. 50

