2. 青岛海洋科学与技术试点国家实验室 海洋生态与环境科学功能实验室, 山东 青岛 266237;
3. 青岛农业大学食品科学与工程学院, 山东 青岛 266109
微塑料的海洋污染在近几年得到国内外学者的普遍关注[1-2]。微塑料通常是指直径小于5 mm的塑料碎片、颗粒及纤维,根据形成途径的不同,可将其分为两种类型:初级微塑料(工业直接制造的直径小于5 mm的原生微塑料,如带有磨砂颗粒的洁面乳、洗衣粉以及牙膏等)和次级微塑料(较大体积塑料在风力、潮汐等机械作用和紫外线辐射下,破碎、分解形成的二次微塑料)[3]。研究表明,目前微塑料已经遍布全球[4-5],在大西洋东北部发现微塑料密度为2.46个·m-3[6]。
微塑料对海洋生物的影响研究目前主要集中在滤食性动物(如桡足类、贻贝、牡蛎、磷虾)和蟹、鱼等[7-12]。用荧光标记的微塑料研究表明,微塑料可以被海洋生物摄入肠道内,附着在口器、附肢等[9]。微塑料造成的“饱腹感”会降低海洋生物对饵料的摄食,从而导致能量摄入的不足,进一步影响其生殖功能[13],如Sussarellu等[10]用聚苯乙烯微球对太平洋牡蛎暴露两个月,牡蛎卵母细胞的数量、直径和精子速度显著下降,同时被暴露的牡蛎后代的产量和发育也分别有所下降。除了摄食和生殖活动,微塑料还会干扰海洋生物的内分泌,对生长、性发育、繁殖能力产生一定的影响[1, 14]。附着在体表的微塑料会引起海洋生物游泳等行为的不适,影响其生理活动。微塑料并非只是单纯的进入动物体内再排泄出而不引起其他变化,实验证明紫贻贝摄食微塑料后,会在其肠道和消化道中累积,进一步从肠道转移到循环系统[7-8]。
目前国内学者也开展了关于中国近海微塑料的分布、转移以及对海洋生物的影响研究[2, 15-19]。Sun等[2]以东海浮游动物为研究对象,系统地研究了10个浮游动物类群微塑料的特征、生物累积浓度和残留率,对微塑料的残留和特征进行了系统地论述。武芳竹等[12]研究发现鱼类摄入微塑料后会存在于其体内组织和器官,对其生殖、发育、代谢、神经系统以及内分泌等都会有一定的影响。微塑料对海洋生物可能会产生两种损伤,一种是物理损伤,另一种是化学损伤[15]。物理损伤是指微塑料会阻碍生物进行摄食和消化,对肠道带来一定的伤害;化学损伤是指微塑料和有机污染物结合后被摄入生物体内所带来的伤害。微塑料由于具有大的比表面积、疏水性较高,容易与一些重金属离子、持久性有机污染物(POPs,如多氯联苯、滴滴涕、壬基酚等)相互作用并结合在一起,从而对海洋生物造成联合毒性效应[20]。
海洋桡足类在食物链以及海洋生态系统中具有重要的地位和作用,目前虽然已有少量关于微塑料对海洋生物的生态学影响的相关研究,但微塑料对海洋桡足类摄食生态、行为的影响及其作用机理目前尚不清楚。聚酰胺-6(Polyamid 6,简称PA 6,俗称尼龙6)是由己内酰胺聚合而成的塑料材料,被广泛应用于纤维、工程塑料及薄膜三大领域[21],同时也被广泛应用于汽车行业、电子电器市场、家用电器等领域,是目前囯内外产量最大,应用范围最广的一种聚酰胺材料。针对目前微塑料对海洋桡足类影响的研究不足,我们将海洋桡足类短期暴露于微塑料尼龙6中,研究微塑料对其摄食、排泄和生殖的影响,进而分析微塑料对桡足类的生态学及海洋食物网的影响。
1 材料与方法 1.1 浮游植物以三角褐指藻(Phaeodactylum tricornutum)作为桡足类的饵料,在温度为(18 ± 1)℃、光照为60 μmol·m-2·s-1、光周期为12 L: 12 D的条件下培养至对数生长期后待用。培养藻的海水为经0.45 μm滤膜过滤的pH为8.1、盐度为32的海水,在0.1 MPa条件下高压灭菌20 min,冷却后加入f/2培养基。
1.2 海洋桡足类选用猛水蚤(Harpacticus sp.)作为实验材料,猛水蚤是胶州湾、汇泉湾海水中常见的底栖桡足类。猛水蚤于2018年11月用200目小型浮游动物网采自青岛鲁迅公园潮间带,暂养于2 L塑料桶中,带回实验室,立即挑取活泼成体进行培养。以浓度为10×104 cells·mL-1的三角褐指藻作为饵料,盐度调节至30,在室温下培养。取其健康活泼的子代雌体为实验动物。
1.3 微塑料聚酰胺-6(Polyamid 6,简称PA 6,俗称尼龙6)颗粒,粒径为5~20 μm,购自Sigma Aldrich公司,光学显微镜和扫描电镜照片见图 1。

|
图 1 尼龙6微粒的光学显微镜(A)和扫描电镜(B)照片 Fig. 1 Image of nylon 6 beads in optical microscope (A) and scanning electron microscope (B) |
根据Rehse等[22]设置的微塑料实验浓度,设置尼龙6浓度梯度为0、12.5、25、50、100和200 mg·L-1 6个浓度梯度,每个浓度梯度不加桡足类(对照组)和加桡足类(实验组)各设置3个平行样。在100 mL聚碳酸酯(PC)瓶中装满饵料浓度为15×104 cell·mL-1的三角褐指藻藻液,每个瓶中加入10只猛水蚤。固定在转速为1 r·min-1的摄食轮上,防止藻沉底。实验前,猛水蚤饥饿驯化24 h。猛水蚤摄食24 h后测定饵料浓度,滤水率和摄食率按照Frost[23]的公式进行计算:
| $ \begin{align} & F\text{ }=(V/N)\times (\text{ln}{{C}_{t}}~-\text{ ln}{{C}_{tf}})/t,~ \\ & G\text{ }=\text{ }F\times ({{C}_{tf}}~-\text{ }{{C}_{0}})/(\text{ln}{{C}_{tf}}~-\text{ ln}{{C}_{0}})。\\ \end{align} $ |
式中:F—滤水率(mL·ind-1·h-1);G—摄食率(cells·ind-1·h-1);V—实验海水体积(mL);N—猛水蚤数量(ind);t—摄食时间(h);Ctf—实验组(加桡足类)最终饵料浓度(×104 cell·mL-1);Ct—对照组(不加桡足类)最终饵料浓度(×104 cell·mL-1);C0—起始饵料浓度(×104 cell·mL-1)。
1.5 排粪率、粪便颗粒体积及沉降速率的测定摄食24 h后,用光学显微镜观察并计数粪便颗粒,单只动物产生的粪便颗粒数即为排粪率(ind·copepod-1·d-1)。粪便颗粒尺寸用目镜测微尺测定,并根据形状(椭球体)计算粪便颗粒的体积。按照Cole等[24]的方法进行粪便沉降速率的测定,即在装满灭菌海水的奈斯勒比色管(高37.5 cm,直径2 cm)管壁上每隔1 cm用记号笔作上标记,室温下将粪便颗粒用吸管吸入、轻轻放入海水中并马上计时,每个处理5个平行样,计算粪便颗粒的平均沉降速率(m·d-1)。
1.6 抱卵率的测定实验选用饥饿72 h未抱卵的猛水蚤雌体,以保证实验开始时所有猛水蚤雌体生殖状态基本相同。尼龙6浓度梯度设置与1.4部分相同,每一个浓度梯度设置3个平行样,每个实验PC瓶中装满15×104 cells·mL-1的三角褐指藻藻液,每只瓶中挑入10只未抱卵的成熟雌体,每天记录抱卵数并更新一半藻液,同时将已经抱卵的雌体挑出,并计算抱卵率。
1.7 半数效应浓度(Median effect concentration,EC50)的测定微塑料尼龙6对猛水蚤摄食率、滤水率、排粪率、粪便体积和沉降速率以及抱卵率的抑制率(Inhibition ratio,IR)按照公式IR(%)=(1-T/C)×100%计算,其中T和C分别为微塑料处理组和对照组(0 mg·L-1)的摄食率、滤水率、排粪率、粪便体积、粪便沉降速率或抱卵率,并利用概率单位法计算半数效应浓度EC50。
1.8 数据处理每个样品设3个平行样(粪便沉降速率为5个平行),取平均值±标准偏差。采用t—检验检测数据结果间的显著性差异。
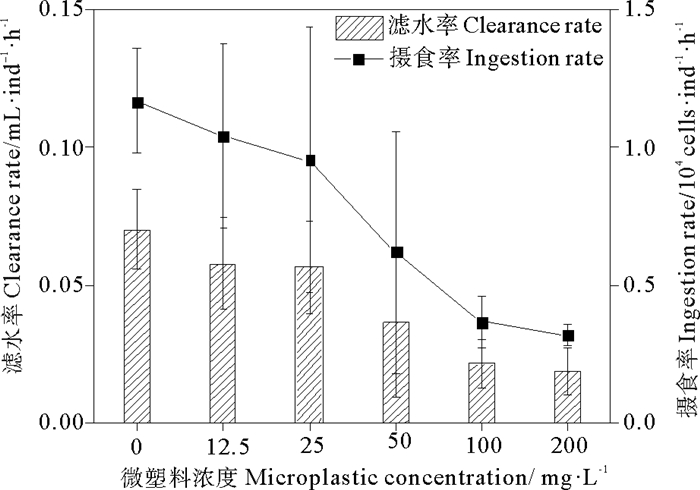
2 结果 2.1 摄食率和滤水率猛水蚤的摄食率(变化范围:0.317×104~1.169×104 cells·ind-1·h-1)和滤水率(变化范围:0.018 7~0.070 4 mL·ind-1·h-1)变化趋势类似,在暴露微塑料尼龙6 24 h后,摄食率和滤水率比对照组(无微塑料)降低,且均随着微塑料浓度的增大而逐渐降低(见图 2)。与对照组的摄食率和滤水率相比,微塑料浓度200 mg·L-1时的猛水蚤的摄食率和滤水率分别降低了72.9%和73.4%。微塑料尼龙6对猛水蚤摄食率和滤水率的24 h·EC50分别为67.7和62.2 mg·L-1。
|
图 2 不同浓度微塑料尼龙6对猛水蚤摄食率和滤水率的影响 Fig. 2 Effects of different concentrations of microplastic nylon 6 on ingestion rate and clearance rate of Harpacticus sp. |
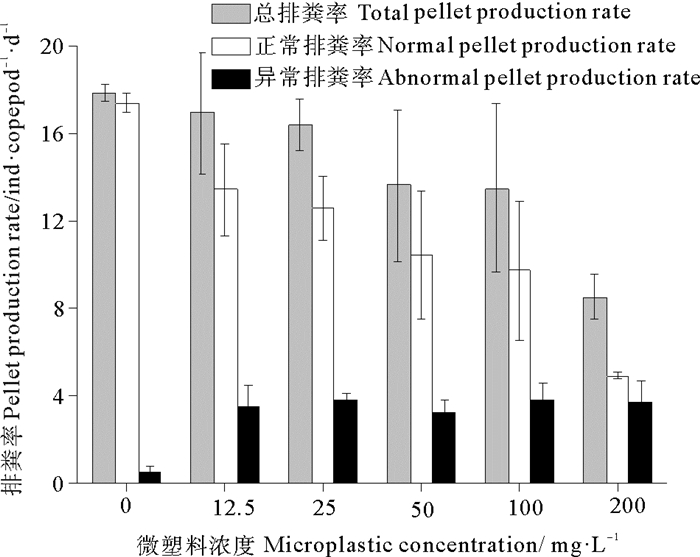
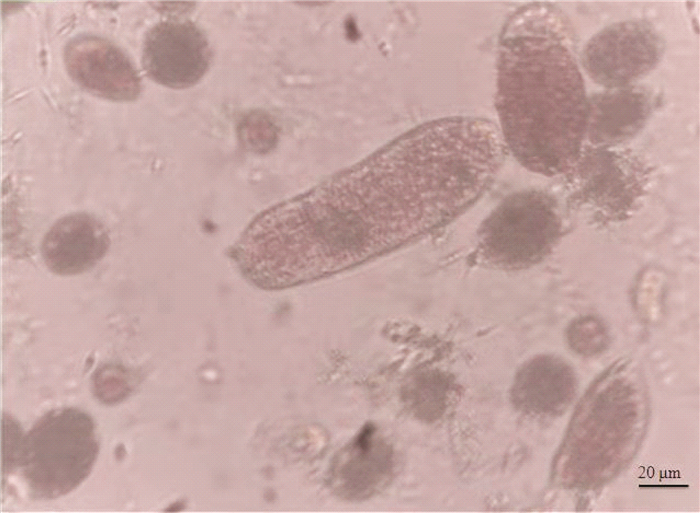
暴露微塑料24 h后,猛水蚤的总排粪率比对照组(无微塑料)降低,且随着微塑料浓度增加而逐渐降低(见图 3)。与对照组的总排粪率(17.8 ind·copepod-1·d-1)相比,暴露在微塑料浓度为200 mg·L-1的猛水蚤总排粪率(8.5 ind·copepod-1·d-1)降低了52%。另外,微塑料的存在使猛水蚤排出的粪便颗粒与对照组的粪便颗粒相比尺寸变小,正常粪便平均尺寸为220 μm× 25 μm,异常粪便平均尺寸为31 μm× 21 μm(见图 4)。形状由长椭球体变为短小椭球体(见图 4),且随着微塑料浓度的增大,每天每只猛水蚤排出的长椭球体的粪便数目越来越少(由17.4个降为4.9个),而异常粪便(短小椭球体状)数目逐渐增多(由0.4个升高到3.6个)(见图 3),随着微塑料浓度的升高,异常粪便占总粪便的百分比由2%逐渐升高到42%。微塑料尼龙6对猛水蚤总排粪率和正常排粪率的24 h·EC50分别为221.2和84.1 mg·L-1。
|
图 3 不同浓度微塑料尼龙6对猛水蚤排粪率的影响 Fig. 3 Effect of different concentrations of microplastic nylon 6 on pellet production rate of Harpacticus sp. |
|
图 4 暴露于200 mg·L-1微塑料尼龙6摄食24 h后猛水蚤的粪便颗粒 Fig. 4 Fecal pellets of Harpacticus sp. after exposure to 200 mg·L-1 microplastic nylon 6 for 24 h |
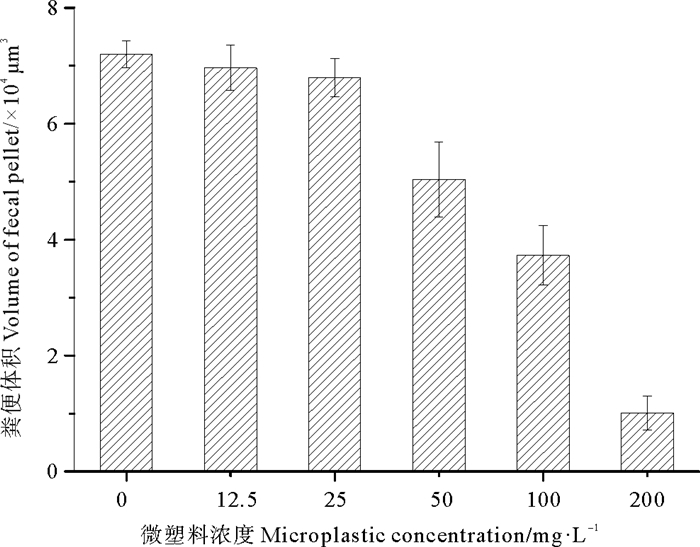
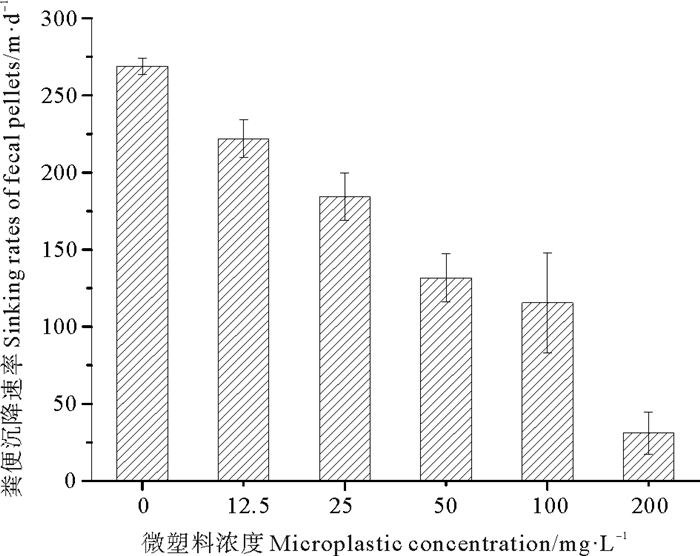
粪便颗粒的体积和沉降速率均随着微塑料尼龙6浓度的增大而降低,对照组中猛水蚤正常粪便的平均体积为7.2 × 104μm3,平均沉降速率为269 m·d-1,暴露于200 mg·L-1微塑料尼龙6中24 h后,异常粪便的平均体积为1.01 × 104 μm3,平均沉降速率为31 m·d-1(见图 5,6),后者的粪便体积和沉降速率分别比前者降低了86.5%和88.5%,均存在极显著差异(P < 0.01)。微塑料尼龙6对猛水蚤粪便体积和粪便沉降速率的24 h·EC50分别为86.4和50.2 mg·L-1。
|
图 5 暴露于微塑料尼龙6摄食24 h后猛水蚤的粪便体积 Fig. 5 Volume of fecal pellets in Harpacticus sp. after exposure to 200 mg·L-1 microplastic nylon 6 for 24 h |
|
图 6 暴露于微塑料尼龙6摄食24 h后猛水蚤粪便的沉降速率 Fig. 6 Sinking rate of fecal pellets in Harpacticus sp. after exposure to 200 mg·L-1 microplastic nylon 6 for 24 h |
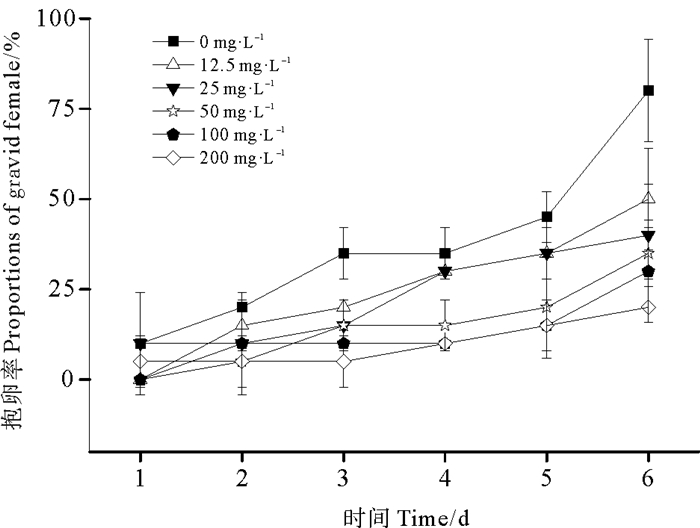
微塑料暴露使猛水蚤抱卵延迟导致抱卵率降低(见图 7),而且微塑料浓度越大,抱卵率降低幅度越大,在第6天,微塑料浓度为0、12.5、25、50、100和200 mg·L-1的猛水蚤的抱卵率分别为80%,50%,40%,35%,30%和20%。微塑料尼龙6对猛水蚤抱卵率的48、72、96、120、144 h EC50分别为35.3、20.9、63.1、61.3和30.3 mg·L-1。
|
图 7 不同浓度微塑料尼龙6对猛水蚤抱卵率的影响 Fig. 7 Effects of different concentrations of microplastic nylon 6 on the proportions of gravid female in Harpacticus sp. |
微塑料对海洋桡足类摄食的影响与微塑料的类型、尺寸以及桡足类的种类有关[1, 25]。微塑料对猛水蚤的摄食率和滤水率具有消极作用,且具有剂量-效应关系,即随着微塑料浓度的增大,摄食率和滤水率下降幅度越大。原因可能是由于微塑料对猛水蚤消化系统的机械阻塞,导致摄入微塑料后无法消化。微塑料会聚团或堆积在动物消化道内,“饱腹感”使其摄食率降低,从而摄入营养和能量不足,导致生殖能力等降低[13, 26]。另外,微塑料会附着在桡足类的触角、附肢、背甲、尾叉等部位,影响其活动能力,导致其有“不适感”,从而减少摄食率。除了被动滤食,海洋桡足类能够感知化学物质,当存在藻和微塑料时,桡足类表现为择食性,桡足类会避开摄食与微塑料大小、形状相似的藻[27]。Cole等[28]研究了尼龙对飞马哲水蚤摄食的影响,研究表明以不同藻作为饵料,尼龙纤维和尼龙微粒对飞马哲水蚤的摄食影响不同,飞马哲水蚤表现为选择性摄食,当饵料为圆海链藻、锥状克里普藻时,尼龙纤维显著抑制摄食率,而尼龙微粒对上述两种藻的摄食率没有明显影响。我们的结果显示尼龙6微粒对猛水蚤的摄食率有抑制作用,与Cole等[28]结果不同的原因主要是因为我们所用动物类型、微塑料类型及浓度不同,我们的微塑料浓度高于Cole等[28]所用的浓度。本实验所用的微塑料浓度12.5~50 mg·L-1大约为2.4×107~6.3×109 items·L-1,与饵料浓度1.5 ×108cells·L-1相近;微塑料浓度为100~200 mg·L-1大约为1.9×108~2.5×1010 items·L-1,高于所用的饵料浓度。随着微塑料浓度的增大,尽管桡足类对微塑料有化感作用,但低选择性滤食仍然导致桡足类对微塑料的摄食,并且微塑料浓度越大对摄食率和滤水率的有害作用越大。微塑料对海洋生物不利影响所表现出的剂量-效应关系在Rehse等[22]中已有报道。本实验中的PA 6对猛水蚤的24 h·EC50与Frydkjær等[29]的不规则微塑料聚乙烯(polyethylene,PE)对枝角类大型蚤Daphnia magna 48 h·EC50 (65 mg·L-1)比较相近。Rehse等[22]研究表明1 μm PE对大型蚤96 h·EC50为57.4 mg·L-1。目前已有一些微塑料对浮游动物EC50的报道[22, 29],但微塑料对浮游动物的急性致死效应尚未见报道,因此需要开展微塑料长期暴露对浮游动物的亚致死实验。
本文在摄食率实验测定时发现,在不添加桡足类的对照组中,添加微塑料与无添加微塑料的对照相比,微塑料尼龙6的暴露使三角褐指藻的生长速率降低。采用的尼龙6的浓度与Zhang等[30]的浓度相近,虽然所用的微塑料和藻的类型不同,但对藻的生长抑制效应相近。微塑料对藻可能会产生抑制细胞生长、破坏细胞膜结构、降低叶绿素含量和光合效率、引起细胞氧化损伤等毒性效应[30-31]。Zhang等[30]研究了微塑料对中肋骨条藻的生态影响,结果表明微塑料聚氯乙烯(polyvinyl chloride,PVC)抑制藻的生长和光合作用,电镜扫描结果表明,微塑料的吸附和聚团是造成抑制作用的原因。微塑料对微藻的致毒机理比较复杂,已提出的可能的致毒机理主要有机械损伤、遮蔽效应、氧化损伤、吸附团聚,并且这些致毒效应往往同时存在,致使藻细胞生长代谢异常甚至死亡[19]。微塑料影响藻细胞生长的同时,藻细胞也会产生应激反应以减小、修复微塑料对其造成的损伤[32]。微塑料对藻生理生化、营养的影响[32]推测也会对桡足类的摄食产生间接的影响,尚需进一步证实。
3.2 微塑料对桡足类排泄的影响摄食率的降低直接导致猛水蚤的排粪率随着微塑料浓度的升高而降低。微塑料尼龙6对猛水蚤总排粪率的24 h·EC50(221.2 mg·L-1)高于对正常排粪率的24 h·EC50(84.1 mg·L-1),这与总粪便颗粒中含有异常粪便颗粒有关。由于尼龙6对猛水蚤总排粪率的24 h·EC50仅涉及微塑料对排粪颗粒数量的抑制,无法代表对颗粒大小、密度的影响,因此不能全面衡量微塑料对猛水蚤排泄的消极影响。同时因为微塑料的摄入,猛水蚤排出体积小、短小椭球状的粪便颗粒,且随着微塑料浓度的升高,异常粪便在总粪便颗粒里所占百分比不断升高。微塑料的摄入使粪便颗粒的组成和密度发生改变,导致密度低于正常粪便的密度,而不同密度的微塑料也表现为不同的沉降速率[27]。本实验发现暴露微塑料的粪便不容易沉降,与正常粪便相比,其沉降速率显著降低。同时因为猛水蚤粪便中微塑料含量增大,而微塑料黏度较差,导致其粪便颗粒更易散开,而导致异常粪便的出现[24]。Coppock等[27]指出粪便颗粒的体积与微塑料的形状有关,而且粪便沉降速率与微塑料的类型有关。
3.3 微塑料对桡足类生殖的影响微塑料会降低海洋桡足类的生殖能力和存活率[25]。本实验中,微塑料延迟猛水蚤雌体的首次抱卵,微塑料浓度越高,抱卵率越低。这主要是由于微塑料的摄入导致桡足类摄入的能量和营养不足[33-34],所以延迟抱卵,抱卵率降低。Sussarellu等[26]研究表明微塑料聚苯乙烯对太平洋牡蛎的生殖功能具有伤害作用,卵母细胞的数量、直径显著下降。本实验所用的微塑料浓度暴露未导致桡足类死亡,但推测可能已经对猛水蚤的卵母细胞结构产生影响,并影响其孵化率。本实验数据未能得到微塑料尼龙6对猛水蚤抱卵率的24 h·EC50,随时间变化,48~144 h的EC50各不相同,因此,微塑料对猛水蚤生殖影响的作用机理及时间-效应还需进一步研究。
3.4 其他影响除了摄食、排粪、生殖,微塑料还会对桡足类其他方面产生影响,如代谢以及行为等。Deng等[35]研究表明,5和7 μm的微塑料微球均会引起鱼类肝部的局部感染及脂质积累,代谢组学分析显示,塑料微球会引起鱼类肝部代谢产物的变化并扰乱肝脏部分机制和能量的代谢。Cole等[13]研究表明微塑料聚苯乙烯(Polystyrene,PS)对桡足类Calanus helgolandicus的耗氧率没有明显影响。微塑料对桡足类代谢的影响与所用微塑料类型不同以及微塑料浓度有关。除了上述影响,微塑料对动物的行为还会有影响。丛艺等[36]研究10 μm聚苯乙烯微粒(PS)对沙蚕掘穴行为影响和细胞超微结构的改变,结果表明PS造成沙蚕掘穴行为延长、体壁表皮细胞凋亡和肌肉细胞线粒体水肿。目前,针对PS对海洋生物的研究较多,PS主要用于光学玻璃及仪器、灯罩、包装材料,其发泡塑料可作绝热材料、快餐盒等。与PS不同,尼龙6具有无毒、质轻、优良的机械强度、耐磨性及较好的耐腐蚀性,广泛应用于代替铜的机械、化工等工业中制造轴承、齿轮、泵叶,另外还用于头盔、输液管、医用缝线、渔网等。尼龙的分布也非常广泛,Alam等[37]对Ciwalengke河的微塑料进行了调查研究,结果表明表层海水平均微塑料颗粒为(5.85±3.28)个/L,主要微塑料类型为聚酯纤维(Polyester)和尼龙纤维。因此研究尼龙6对海洋桡足类的毒理效应对于研究微塑料污染对海洋食物网的影响具有重要意义。
4 结论(1) 微塑料尼龙6的短期暴露使猛水蚤摄食率、滤水率和排粪率降低,而且降低幅度与微塑料浓度有关,浓度越大,降低幅度越大。微塑料尼龙6对猛水蚤摄食率、滤水率、排粪率24 h·EC50分别为67.7、62.2、84.1 mg·L-1。另外,尼龙6使猛水蚤的粪便颗粒小型化,由长椭球体变为短小椭球体,可能与其粘度或物理结构的改变有关。微塑料尼龙6暴露导致粪便颗粒的沉降速率显著降低。
(2) 微塑料尼龙6暴露使猛水蚤抱卵延迟,相同培养时间的抱卵率降低。可能是微塑料的存在导致猛水蚤摄食率的降低,进而营养和能量摄入不足,进一步导致对生殖活动的影响。
本实验所用的微塑料浓度高于现场环境,因此用本结果推到现实海洋环境中时,还需考虑现场微塑料种类、浓度、作用时间及其不同的生态效应。
| [1] |
Cole M, Lindeque P, Fileman E, et al. Microplastic ingestion by zooplankton[J]. Environmental Science&Technology, 2013, 47(12): 6646-6655.
(  0) 0) |
| [2] |
Sun XX, Liu T, Zhu M L, et al. Retention and characteristics of microplastics in natural zooplankton taxa from the East China Sea[J]. Science of the Total Environment, 2018, 640-641: 232-242.
(  0) 0) |
| [3] |
孙承君, 蒋凤华, 李景喜, 等. 海洋中微塑料的来源、分布及生态环境影响研究进展[J]. 海洋科学进展, 2016, 34(4): 449-461. Sun C J, Jiang F H, Li J X, et al. The research progress in source, distribution, ecological and environmental effects of marine microplastic[J]. Advances in Marine Science, 2016, 34(4): 449-461. (  0) 0) |
| [4] |
Waller C L, Griffiths H J, Waluda C M, et al. Microplastics in the Antarctic marine system:An emerging area of research[J]. Science of the Total Environment, 2017, 598: 220-227.
(  0) 0) |
| [5] |
Browne M A, Crump P, Niven S J, et al. Accumulation of microplastic on shorelines woldwide:Sources and sinks[J]. Environmental Science&Technology, 2011, 45(21): 9175-9179.
(  0) 0) |
| [6] |
LusherA L, Burke A, O'Connor I, et al. Microplastic pollution in the Northeast Atlantic Ocean:Validated and opportunistic sampling[J]. Marine Pollution Bulletin, 2014, 88(1-2): 325-333.
(  0) 0) |
| [7] |
Browne M A, Dissanayake A, Galloway T S, et al. Ingested microscopic plastic translocates to the circulatory system of the mussel, Mytilus edulis(L.)[J]. Environmental Science & Technology, 2008, 42(13): 5026-5031.
(  0) 0) |
| [8] |
von Moos N, Burkhardt-Holm P, K hler A. Uptake and effects of microplastics on cells and tissue of the blue mussel, Mytilus edulis, L. after an experimental exposure[J]. Environmental Science & Technology, 2012, 46(20): 11327-11335.
(  0) 0) |
| [9] |
Watts A J R, Lewis C, Goodhead R M, et al. Uptake and retention of microplastics by the shore crab, Carcinus maenas[J]. Environmental Science & Technology, 2014, 48(15): 8823-8830.
(  0) 0) |
| [10] |
Sussarellu R, Suquet M, Thomas Y, et al. Oyster reproduction is affected by exposure to polystyrene microplastics[J]. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(9): 2430-2435.
(  0) 0) |
| [11] |
Dawson A, Huston W, Kawaguchi S, et al. Uptake and depuration kinetics influencemicroplastic bioaccumulation and toxicity in Antarctic krill (Euphausia superba)[J]. Environmental Science & Technology, 2018, 52(5): 3195-3201.
(  0) 0) |
| [12] |
武芳竹, 曾江宁, 徐晓群, 等. 海洋微塑料污染现状及其对鱼类的生态毒理效应[J]. 海洋学报, 2019, 41(2): 85-98. Wu F Z, Zeng J N, Xu X Q, et al. Status of marine microplastic pollution and its ecotoxicological effects on marine fish[J]. Haiyang Xuebao, 2019, 41(2): 85-98. (  0) 0) |
| [13] |
Cole M, Lindeque P, Fileman E, et al. The Impast of polystyrene microplastics on feeding, function and fecundity in the marine copepod Calanus helgolandicus[J]. Environmental Science & Technology, 2015, 49(2): 1130-1137.
(  0) 0) |
| [14] |
Ziajahromi S, Kumar A, Neale P A, et al. Impact of microplastic beads and fibers on waterflea (Ceriodaphnia dubia) survival, growth, and reproduction:Implications of single and mixture exposures[J]. Environmental Science & Technology, 2017, 51(22): 13397-13406.
(  0) 0) |
| [15] |
王超, 张德钧, 黄慧, 等. 海洋生物中微塑料的检测与危害研究进展[J]. 食品安全质量检测学报, 2018, 9(11): 2678-2683. Wang C, Zhang D J, Huang H, et al. Review of microplastics detection from marine organisms and their harms[J]. Journal of Food Safety and Quality, 2018, 9(11): 2678-2683. (  0) 0) |
| [16] |
冉文, 滕佳, 刘永亮, 等. 环渤海潮间带长牡蛎微塑料富集特征研究[J]. 海洋通报, 2018, 37(5): 106-113. Ran W, Teng J, Liu Y L, et al. Microplastic ingestion characteristics in the Pacific oysters collected from the intertidal zone of the Bohai Rim[J]. Marine Science Bulletin, 2018, 37(5): 106-113. (  0) 0) |
| [17] |
张石云, 宋超, 张敬卫, 等. 微塑料暴露对罗非鱼肌肉中磺胺甲唑残留的影响[J]. 生态与农村环境学报, 2018, 34(9): 857-864. Zhang S Y, Song C, Zhang J W, et al. Effects of micro-plastics on sulfamethoxazole (SMZ) residues in tilapia (Oreochromis niloticus) muscle[J]. Journal of Ecology and Rural Environment, 2018, 34(9): 857-864. (  0) 0) |
| [18] |
涂烨楠, 凌海波, 吴辰熙, 等. 淡水浮游动物摄食微塑料过程及影响研究[J]. 环境科学与技术, 2018, 41(11): 1-8. Tu Y N, Ling H B, Wu C X, et al. Ingestion and effects of microplastics on freshwater zooplankton[J]. Environmental Science & Technology, 2018, 41(11): 1-8. (  0) 0) |
| [19] |
王素春, 刘光洲, 张欢, 等. 微塑料对微藻的毒性效应研究进展[J]. 海洋环境科学, 2019, 38(2): 192-197. Wang S C, Liu G Z, Zhang H, et al. Toxicity research progress of microplastics on microalgae[J]. Marine Environmental Science, 2019, 38(2): 192-197. (  0) 0) |
| [20] |
Kim D, Chae Y, An Y J. Mixture toxicity of nickel and microplastics with different functional groups on Daphnia magna[J]. Environmental Science & Technology, 2017, 51(21): 12852-12858.
(  0) 0) |
| [21] |
李飞亚. 聚酰胺6产业国内外发展现状及经济应用研究[J]. 中国经贸导刊(中), 2018, 912(29): 18-19. Li F Y. Research on development status and economic application of polyamide 6 industry at home and abroad[J]. China Economic&Trade Herald, 2018, 912(29): 18-19. (  0) 0) |
| [22] |
Rehse S, Kloas W, Zarfl C. Short-term exposure with high concentrations of pristine microplastic particles leads to immobilisation of Daphnia magna[J]. Chemosphere, 2016, 153: 91-99.
(  0) 0) |
| [23] |
Frost B W. Effects of size and concentration of food particles on the feeding behavior of the marine planktonic copepod Calanus pacificus[J]. Limnology and Oceanography, 1972, 17(6): 805-815.
(  0) 0) |
| [24] |
Cole M, Lindeque P K, Fileman E, et al. Microplastics alter the properties and sinking rates of zooplankton faecal pellets[J]. Environmental Science & Technology, 2016, 50(6): 3239-3246.
(  0) 0) |
| [25] |
Lee K W, Shim W J, Kwon O Y, et al. Size-dependent effects of micro polystyrene particles in the marine copepod Tigriopus japonicas[J]. Environmental Science&Technology, 2013, 47(19): 11278-11283.
(  0) 0) |
| [26] |
Sussarellu R, Suquet M, Thomas Y, et al. Oyster reproduction is affected by exposure to polystyrene microplastics[J]. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(9): 2430-2435.
(  0) 0) |
| [27] |
Coppock R L, Galloway T S, Cole M, et al. Microplastics alter feeding selectivity and faecal density in the copepod, Calanus helgolandicus[J]. The Science of the Total Environment, 2019, 687: 780-789.
(  0) 0) |
| [28] |
Cole M, Coppock R, Lindeque P K, et al. Effects of nylon microplastic on feeding, lipid accumulation, and moulting in a coldwater copepod[J]. Environmental Science&Technology, 2019, 53: 7075-7082.
(  0) 0) |
| [29] |
Frydkjær C K, Iversen N, Roslev P. Ingestion and egestion of microplastics by the cladoceran Daphnia magna:effects of regular and irregular shaped plastic and sorbed phenanthrene[J]. Bulletin of Environmental Contamination and Toxicology, 2017, 99: 655-661.
(  0) 0) |
| [30] |
Zhang C, Chen X, Wang J, et al. Toxic effects of microplastic on marine microalgae Skeletonema costatum: Interactions between microplastic and algae[J]. Environmental Pollution, 2017, 220: 1282-1288.
(  0) 0) |
| [31] |
Besseling E, Wang B, Lürling M, et al. Nanoplastic affects growth of S. obliquus and reproduction of D. magna[J]. Environmental Science&Technology, 2014, 48(20): 12336-12343.
(  0) 0) |
| [32] |
Mao Y F, Ai H N, Chen Y, et al. Phytoplankton response to polystyrene microplastics:Perspective from an entire growth period[J]. Chemosphere, 2018, 208: 59-68.
(  0) 0) |
| [33] |
Ayukai T. Discriminate feeding of the calanoid copepod Acartia clausi in mixtures of phytoplankton and inert particles[J]. Marine Biology, 1987, 94(4): 579-587.
(  0) 0) |
| [34] |
Dagg M. Some effects of patchy food environments on copepods[J]. Limnology and Oceanography, 1977, 22(1): 99-107.
(  0) 0) |
| [35] |
Deng Y, Zhang Y, Lemos B, et al. Tissue accumulation of microplastics in mice and biomarker responses suggest widespread health risks of exposure[J]. Scientific Reports, 2017, 7: 1-10.
(  0) 0) |
| [36] |
丛艺, 周建行, 孙粒钧, 等. 荧光聚苯乙烯微粒在沙蚕体内的摄入、排出及其毒性效应[J]. 海洋环境科学, 2019, 38(2): 161-166. Cong Y, Zhou J H, Sun L J, et al. Ingestion, egestion and toxic effects of fluorescent polystyrene microspheres on the Polychaete, Perinereis aibuhitensis[J]. Marine Environmental Science, 2019, 38(2): 161-166. (  0) 0) |
| [37] |
Alam F C, Sembiring E, Muntalif B S, et al. Microplastic distribution in surface water and sediment river around slum and industrial area (case study:Ciwalengke River, Majalaya district, Indonesia)[J]. Chemosphere, 2019, 224: 637-645.
(  0) 0) |
2. Laboratory for Marine Ecology and Environmental Science, Pilot National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266237, China;
3. College of Food Science and Engineering, Qingdao Agricultural University, Qingdao 266109, China
 2020, Vol. 50
2020, Vol. 50


