2. 中国海洋大学化学化工学院,山东 青岛 266100
自2007年以来, 大规模的浒苔(Ulva prolifera)绿潮爆发已经成为青岛近海主要的生态环境问题之一。富营养化是近海绿潮爆发和发展的物质基础,而氮污染是导致绿潮爆发海域富营养化的关键因子[1]。氮作为浮游植物生长的必要生源要素和构成富营养化的重要因子,其含量和组成对海洋植物生物量和种群结构有重要影响[2]。目前,浒苔生物对氮营养物质吸收利用方面的研究,主要集中于溶解无机氮(DIN),而很少关注溶解有机氮(DON)[3-5]。实际上,作为海洋中氮素的最大储库,DON不仅能够被微生物转化成DIN后被浮游植物吸收利用,而且其中的多种小分子化合物包括尿素(urea)、氨基酸(AA)等都可以被浮游植物直接吸收利用,成为构成近海富营养化污染的重要物质基础[6-7]。因此,研究DON生物可利用性对探明浒苔绿潮爆发和维持过程中氮的供给机制具有重要意义。
溶解有机质(DOM)的生物可利用性与有机质来源、构成及海域多种环境因子密切相关[8]。传统的DOM的微生物可利用性,一般通过船基现场微生物降解培养实验来确定[9-10];但对于近岸海域,由于受陆源输入及地理、气象、动力等影响显著,导致海域DOM来源、构成、微生物种群和丰度以及盐度、温度等环境因子具有很大的时空变异性,应用个别站位的DOM微生物降解培养实验结果,很难代表整个海域DOM的生物可利用性的状况。氨基酸是构成有机质中多肽类、蛋白质的主要组成部分,是重要的可利用性组分之一,其丰度和构成,可以作为一种DOM的内在指示物,用来指征DOM生物可利用性的相对高低[9-10]。一般是总溶解态氨基酸(TDAA)中碳或氮占溶解态有机质(DOM)中碳或氮的摩尔分数[TDAA(%DOM)]来表征[9-10], 一般而言,[TDAA(%DOM)]值越大,表明DOM的生物可利用性越大,反之则表明DOM生物可利用性越小[8-11]。
本文通过2015年在青岛近海浒苔绿潮爆发期间和消亡后两个航次调查,对比分析了该海域绿潮爆发期和爆发后不同形态氮包括TDN、DIN、DON、TDAA以及溶解有机碳(DOC)的浓度和分布变化,以TDAA(%DOM)为指标评价该海域绿潮爆发期和爆发后DON的生物可利用性变化,结合同步调查得到的其他水文和化学参数,探讨浒苔绿潮氮的来源和供给机制。需要说明的是,碳和氮都是DOM的必要组成元素,因此,DOM既可以用DON也可以用DOC来表征;但鉴于DON的测定误差较DOC大,因此在本研究中采用TDAA (%DOC)为指标来评价调查海域水体DOM的生物可利用性。
1 材料与方法 1.1 调查区域和调查方法2015年青岛近海浒苔绿潮于7月10日左右形成。浒苔生物在风和潮流驱动下,在青岛东海岸滞留了约20 d,浒苔覆盖面积达到400 km2[12],于8月10日左右开始消亡,至8月19日左右完全消亡。
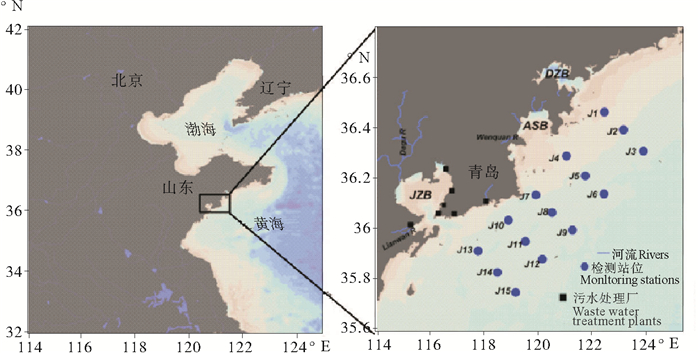
现场调查分别于绿潮爆发期的2015年7月18日和绿潮消亡后10 d的8月29日进行,调查范围在经度120.6°E~121.3°E,纬度35.9°N~36.5°N之间,垂直于岸线布设5个断面,共15个站位(见图 1)。应用Niskin采水器分别采集表、中、底层水样,同时应用多参数水质仪(manta Ⅱ, Eureka, USA)现场测定水温和盐度。水样经GF/F(0.7 μm)滤膜过滤后,于-20 ℃冷冻保存带回实验室进行测定。滤膜用洁净且烧好的锡纸密封包装,用于叶绿素a(Chl a)的测定。水样测定参数主要包括硝酸盐(NO3—N)、铵盐(NH4—N)、亚硝酸盐(NO2—N)、TDN、DOC、TDAA。DON为TDN和DIN的差值, 未鉴定的DON组分(U—DON)为DON与尿素和TDAA的差值。
|
图 1 青岛近海绿潮爆发期和爆发后监测站位 Fig. 1 The sampling station lacations in Qingdao coastal waters during and after Green Bloom |
NO3—N、NH4—N和NO2—N分别通过镉铜还原[13]、次溴酸钠[13]、重氮-偶氮方法测定[14]。DIN为NO3—N、NH4-N和NO2—N之和。NO3—N、NO2—N、NH4—N测定的检出限分别为1.2、0.2和0.7 μg·L-1。DOC、TDN根据高温催化氧化(HTCO)方法进行测定[15],所用仪器为TOC-VCPH(Shimadzu Corn., Tokyo, Japan),以邻苯二甲酸氢钾和硝酸钾分别作为DOC和TDN测定的标准品,每个样品平行测定6次,相对偏差小于0.5%,检出限为58.5 μg·L-1。DON含量等于TDN含量减去DIN含量,其测定误差小于10%。叶绿素用5 mL 90%丙酮溶液在暗处萃取12 h后用荧光分光光度法测定[13]。
尿素采用二乙酰一肟法[16]进行测定。氨基酸通过柱前邻苯二甲醛衍生后高效液相色谱法进行分离测定[17]。所用仪器为e2695型高效液相色谱仪(Waters Alliance,USA)并配置荧光检测器和Agilent分离柱(ZORBAX Eclipse AAA, 4.6 mm×150 mm,5 μm)。所用标准品为14种氨基酸混标(Fulka),共分离检测14种氨基酸, 包括天冬氨酸(Asp)、谷氨酸(Glu)、丝氨酸(Ser)、组氨酸(His)、甘氨酸(Gly)、苏氨酸(Thr)、精氨酸(Arg)、丙氨酸(Ala)、酪氨酸(Tyr)、缬氨酸(Val)、甲硫氨酸(Met)、苯丙氨酸(Phe)、异亮氨酸(Ile)、亮氨酸(Leu),相对标准偏差在3.0%~5.0%之间,每种氨基酸的检出限为10 nmol·L-1。所检测到的14种氨基酸之和为总溶解态氨基酸(TDAA)。
经碳归一化的TDAA在DOC中的占比[TDAA (%DOC)],应用公式(1)计算[9]:
| $ {\rm{TDAA}}\left( {\% {\rm{DOC}}} \right) = \frac{{\left[ {{\rm{TDAA}} - {\rm{C}}} \right]}}{{\left[ {{\rm{DOC}}} \right]}} \times 100。$ |
其中,[DOC]和[TDAA-C]分别表示DOC的浓度和TDAA中碳的浓度,单位都为μmol·L-1。
1.3 统计学分析通过SPSS 16.0软件进行样品差异性分析。通过单因素方法分析(one-way ANOVA)和t-检验方法分析样品之间是否存在显著性差异,显著性水平为p=0.05。相关性分析是利用皮尔森相关系数法进行相关性分析,若p<0.05(双边检验),说明参量之间具有明显相关性。
2 结果与分析 2.1 青岛近岸水体绿潮爆发期和绿潮爆发后水文和生物参数变化绿潮爆发期,受陆源淡水输入影响,调查海域水体呈现明显的层化现象(见表 1),水温由表层到底层逐步降低,而盐度则逐渐增大;同时,海水温度呈现从近岸到远岸逐渐降低,而盐度则呈现由近岸到远岸逐渐升高的分布趋势。绿潮消亡后,调查海域温度和盐度分布与绿潮爆发期类似,但由于受到大风搅拌影响,水体盐度层化现象不是很明显。绿潮爆发期水体Chl a含量显著低于绿潮消亡后,这一方面可能是由于大量浒苔生物体覆盖于水体表面,阻碍了光照的传输,限制了微型浮游植物的生长;另一方面可能是浒苔生物分泌的次级代谢物通过化感作用限制了微型浮游植物的生长[18](见表 1和图 2)。
|
|
表 1 青岛近海绿潮爆发期和消亡后各参数表层、中层、底层分布特征 Table 1 Physico-chemical parameters (mean±standard deviation) during and after Ulva prolifera green bloom in the three layers of the water column sampled in the present study in Qingdao coastal waters |
|
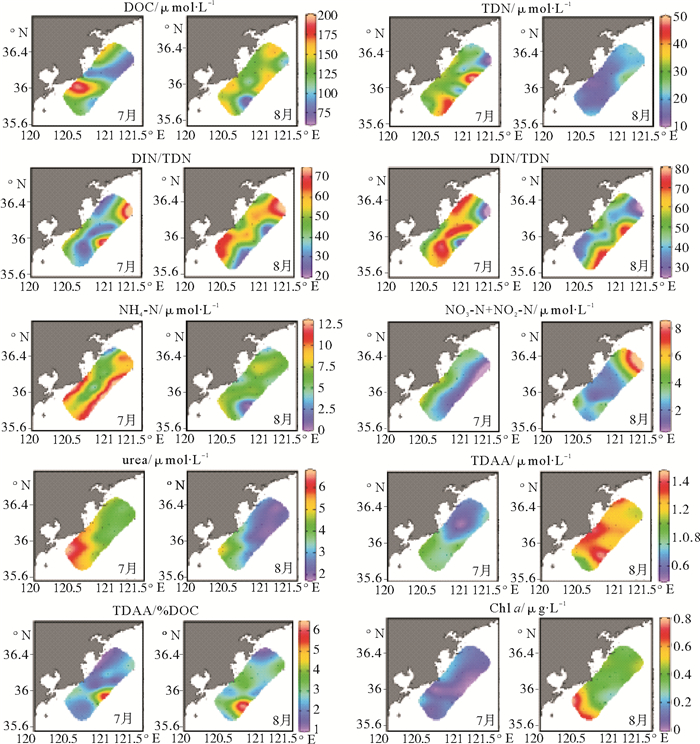
图 2 青岛近海绿潮爆发期和消亡后表层不同形态氮和叶绿素的分布特征 Fig. 2 Spatial distributions of bulk parameters and components of total dissolved nitrogen and Chl a in the surface layer of Qingdao coastal waters during and after Ulva prolifera green bloom |
绿潮爆发期,DOC总体上呈现从近岸到远岸逐渐降低的趋势,但受浒苔生物分布的影响,局部呈现不均匀的斑块状分布(见图 2),且表层和中层水体中DOC浓度高于底层(见表 1);绿潮消亡后,调查海域DOC分布与绿潮爆发期类似,总体上也呈现从近岸到远岸逐渐降低的趋势(见图 2),且呈现由表层到底层逐步降低的垂向分布特征(见表 1)。
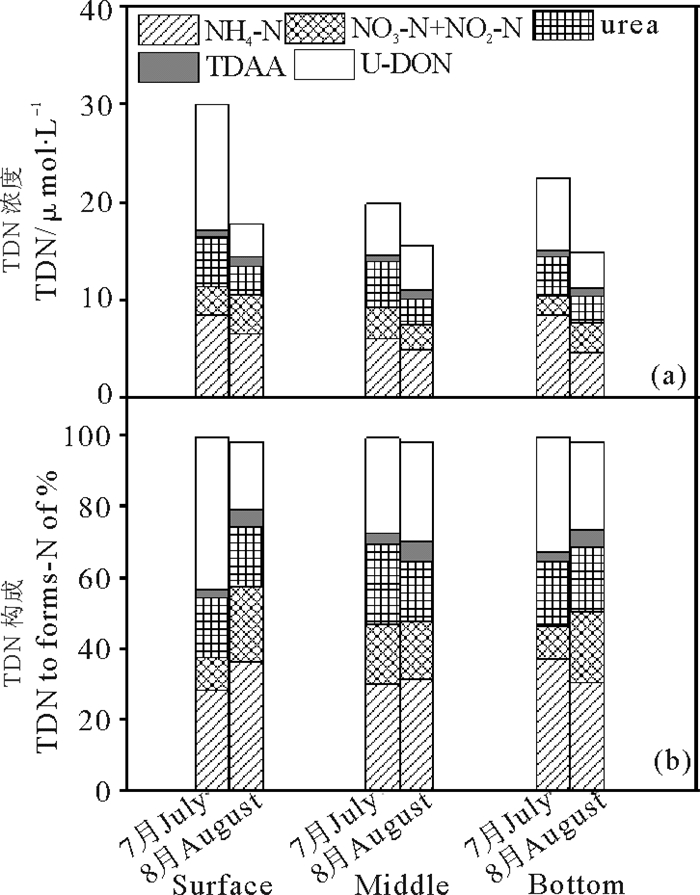
2.3 青岛近岸水体绿潮爆发期和绿潮消亡后氮的形态和分布绿潮爆发期,TDN局部呈现不均匀的斑块状分布,但总体上呈现从近岸到远岸逐渐升高的趋势(见图 2)。表层水体中TDN浓度明显高于中层和底层,DIN占TDN的比例从表层到底层逐渐升高(见表 1和图 3),而DON在TDN中的占比则由表层到底层逐渐降低,平均占比达到(54.9±15.4)%;绿潮消亡后,调查海域TDN分布与绿潮爆发期类似,总体上也呈现从近岸到远岸逐渐升高的趋势(见图 2),同时,表层水体TDN浓度均值明显高于中层和底层(见表 1和图 3)。表层水体中DIN和DON占TDN的比例明显高于中层和底层,DON在TDN中的平均占比为(46.1±15.0)%。绿潮消亡后,水体中TDN、DIN和DON浓度均值较绿潮爆发期分别下降33.5%、19.2%和44.6%。
|
图 3 绿潮爆发期和绿潮消亡后TDN的浓度和构成 Fig. 3 Mean concentration and composition of total dissoled nitrogen (TDN) in each of three sampled layers of the waters column in Qingdao coastal waters during and after Ulva prolifera green bloom |
对于DIN,在绿潮爆发期,NH4—N为DIN的主要存在形态,在DIN中占比均值达到(73.7±26.5)%,NH4—N浓度呈现出表层和底层高、中层低的变化趋势。NO3—N+NO2—N在DIN中占比均值为(26.4±12.6)%,而表层和中层浓度明显高于底层;绿潮消亡后,尽管NH4—N在DIN中占比较爆发前下降,但均值仍达到(62.8±12.4)%,(见表 1和图 3),且在上、中、下层水体中NH4—N在DIN中的占比均值差异不大(见图 3)。相应的,NO3—N+NO2—N在DIN中占比较绿潮爆发前增大,均值为(37.2±18.9)%。
对于DON,绿潮爆发期,尿素浓度分布在3.64~6.94 μmol·L-1,均值为(4.59±0.60)μmol·L-1, 在DON占比为(33.2± 4.3)%。TDAA浓度分布在0.45~0.98 μmol·L-1,均值为(0.74±0.14)μmol·L-1,在DON中的占比均值为(5.4±1.0)% (见图 3和图 4);绿潮消亡后,DON中尿素浓度较爆发前显著下降(t-test, p<0.05),分布在1.82~5.04 μmol·L-1,均值为(2.81±0.72)μmol·L-1,在DON占比为(36.6±9.4)%。而TDAA浓度较绿潮爆发有所增大,分布在0.75 ~1.54 μmol·L-1,均值为(1.14±0.20)μmol·L-1,在DON中占比均值为(14.9±2.6)%(见表 1和图 3)。
|
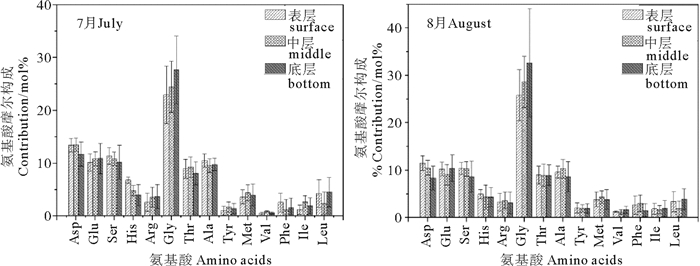
图 4 绿潮爆发期(左图)和消亡后(右图)氨基酸摩尔构成 Fig. 4 Average molar contribution of total dissolved amino acids (TDAA) in the surface, middle and bottom layers of Qingdao coastal waters during (left) and after (right) Ulva prolifera green bloom |
绿潮爆发期和消亡后水体中TDAA的摩尔构成如图 4所示。
尽管绿潮爆发期和绿潮消亡后氨基酸总浓度有所差异,但所检测出的14种氨基酸的摩尔分数基本一致。其中,绿潮爆发期,Gly占比最高,达到22.9%~27.7%,然后依次为Asp、Ser、Ala、Glu、Thr,摩尔占比在5%~15%之间,其他氨基酸摩尔占比都低于5%。从表层到底层,Gly、Glu和Arg占比增高,而Asp,Ser,His和Ala占比降低,表明前者较后者相比难以被降解;绿潮消亡后,TDAA构成与绿潮爆发期基本一致,其中Gly占比进一步增大,达到25.8%~32.6%。同样,从表层到底层,Gly占比增大而Asp、His、Ser和Ala占比减小。
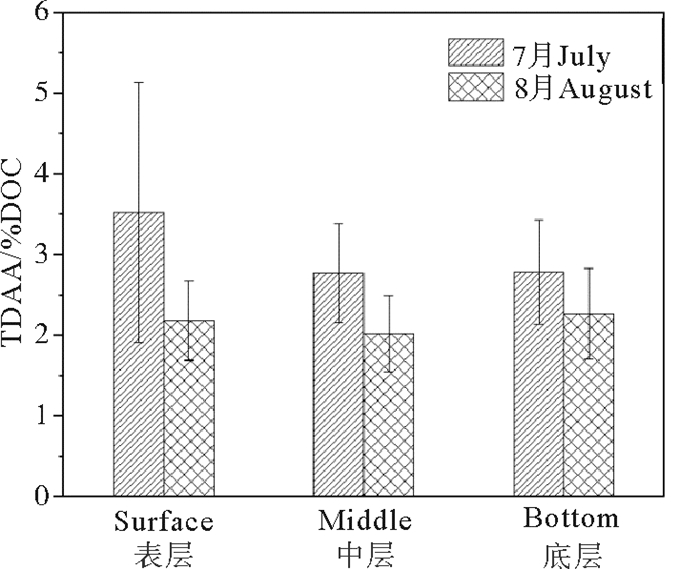
2.4.2 绿潮爆发期和消亡后TDAA(%DOC)变化特征绿潮爆发期和消亡后TDAA(%DOC)变化如图 5所示。绿潮爆发期的TDAA(%DOC)在1.40~6.59范围,均值为3.04±1.10,基本呈现从近岸到远岸逐渐降低的分布特征,并呈现由表层到底层逐渐降低的变化趋势,表明DON生物可利用性逐渐降低(见图 2);绿潮消亡后,TDAA(%DOC)仍呈现表层到底层逐渐降低的变化趋势,但整个调查海域均值较绿潮爆发期减小约25%。
|
图 5 绿潮爆发期和消亡后TDAA(%DOC)变化特征 Fig. 5 Carbon (C)-normalized yields of total dissolved amino acids (TDAA) in the surface, middle and bottom layers of Qingdao coastal waters during and after the Ulva prolifera green bloom |
应用有机质内在的分子构成作为指标,即TDAA(%DOC),可以可靠地指征DOM生物可易用性的相对大小[8-9]。该方法不仅可以避免传统的现场培养实验方法在评价DOM生物可降解性中的不确定性,而且可以方便的用于比较不同站位、不同水层和不同季节DOM生物可利用性的相对大小,近年来已经逐步应用于大洋、极地和近海生态系统中DOM的生物可利用性[8-11, 19]。
在绿潮爆发期,青岛近海水体中TDAA(%DOC)的值由表层到底层逐渐降低,表明DOM生物可利用性随水深的增加而逐步降低。这是由于在水体表层以浮游植物进行光合作用为主,浮游生物特别是浒苔在生长过程中同时释放出大量具有高生物可利用性的新鲜的DOM;而随水深增大,浮游植物光合作用减弱,而细菌或真菌的呼吸作用增强,DOM逐步被降解,生物可利用性减小,证明了浮游植物等生物合成和细菌等生物降解作用对DOM生物可利用性的调控作用[9-10]。
绿潮消亡后,青岛近海表层、中层和底层水体的TDAA(%DOC)的值较绿潮爆发期都显著减小,表明DOM的生物可利用性大大降低。这是由于绿潮爆发期浒苔的生物量及其分泌DOM作用大大高于浒苔消亡期。在绿潮爆发期,浒苔为近海生态系的主要物种,并通过营养盐、光照竞争作用而限制了微型浮游植物的生长[12]。浒苔具有生长速率快、分泌活动旺盛等特点[12, 20],生成大量新鲜的DOM,同时死亡的藻体能够通过水层沉降到底层,导致整个水体DOM都具有较高生物可利用性。而在浒苔消亡期,表层以微型浮游植物为主体,其光合作用和分泌代谢活动的强度大大小于浒苔生物,DOM生物可利用性相对较低。另一方面,绿潮消亡期,由于大风使得水体混合均匀,表层、中层和底层的溶解氧供给较为充足,DOM微生物降解速率快,生物可利用性低。而在绿潮爆发期,不仅浒苔生物覆盖阻碍了表层水体和底层大气的氧交换,而且水体层化现象明显,底层和表层水体交换受阻,导致DO含量相对较低,DOM微生物降解速率慢,生物可利用性较高。
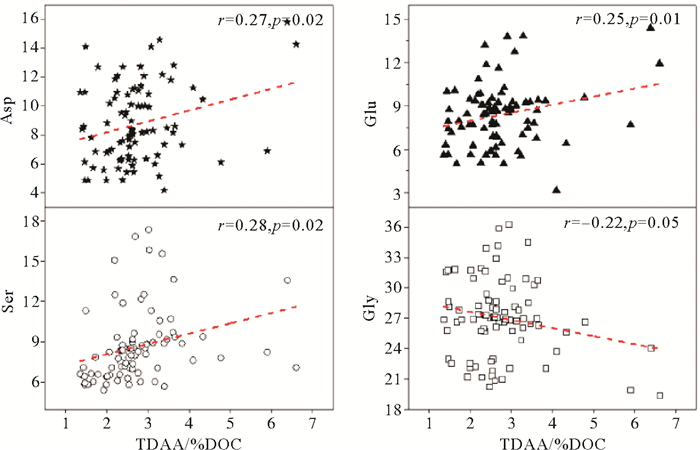
在有机质生物降解过程,TDAA的组成发生了显著变化,表明微生物对DOM的结构进行了改造。研究表明,某些特征氨基酸也可以用于指示DOM的有机质的降解程度[21-22]。青岛近海水体绿潮爆发期和消亡后,TDAA(%DOC)与Asp、Glu和Ser的摩尔占比呈正相关(p<0.05,n=90)(见图 6),表明这些氨基酸组分较其他组分更易被降解,而与Gly呈负相关(r=-0.22,p<0.05,n=90)(见图 6),表明其相对于其他氨基酸组分更难于被降解,因而在DOM降解过程中相对富集,这与其他海域的研究结果类似[22-23]。这是由于Asp、Glu等广泛存在于浮游植物细胞质中易于被降解吸收利用,而Gly则在微生物细胞壁中含量丰富较难被生物降解[23]。绿潮爆发期Gly摩尔占比显著低于绿潮消亡期,而Glu含量则高于绿潮消亡期,表明青岛近海水体绿潮爆发期的DOM生物可利用性高于绿潮消亡后。
|
图 6 不同种类氨基酸与TDAA(%DOC)相关性分析 Fig. 6 Correlation analysis between amino acid components and TDAA (%DOC) |
与绿潮爆发期相比,绿潮消亡后TDAA(%DOC)值显著下降,Gly摩尔占比显著增大,表明绿潮消亡后,青岛近海水体DON生物可利用性较低。绿潮消亡后,浒苔携带大量氮沉降或被打捞清理,水体中TDN、DIN和DON含量显著减小,生物活动减少,释放的新鲜DON较少,生物可利用性低。
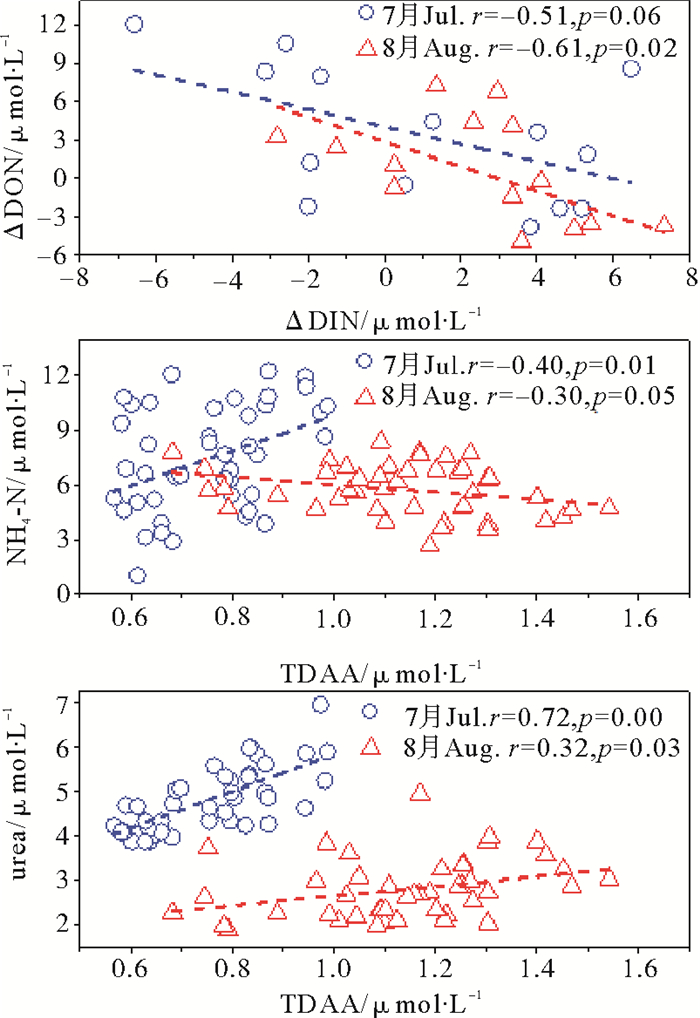
3.2 青岛近海绿潮爆发期氮的来源和供给机制探讨DON再生循环是供浮游植物生长的重要氮源之一[24]。尽管本研究没有直接测定DOM再生速率,但高TDAA(%DOC)值表明, 绿潮爆发期青岛近岸水体DON具有较高的生物可利用性,通过DON矿化可以有效提供N源供浒苔生长。实际上,近岸生态系统中DON再生后的吸收率占总无机氮吸收率的比例在20%~189%之间[25]。绿潮爆发期和消亡后,表、低层DIN的差值(ΔDIN)和与DON的差值(ΔDON)分别呈现弱的负相关性(r=-0.20,p<0.1,n=15)和一般相关性(r=-0.61,p<0.05,n=15)(见图 7),表明DON在水体中被转换成DIN(尤其是NH4—N)。实际上,DON向DIN的转化发生在水体各层,且随深度的增加而增加。
|
(ΔDIN和ΔDON分别表示底层水体和表层水体DIN浓度和DON浓度差值。ΔDIN and ΔDON er represents the difference of DIN or DON concentration in the surface water layer with that in the bottom, respectively.) 图 7 青岛近海绿潮爆发期和消亡后ΔDIN和ΔDON,TDAA和NH4-N及TDAA和urea的相关性 Fig. 7 Correlations between ΔDIN with ΔDON, TDAA and NH4-N and TDAA and urea during and after Ulva prolifera green bloom in Qingdao coastal waters |
绿潮爆发期和消亡后,TDAA与尿素分别呈现显著正相关性(r=0.72,p<0.01,n=45)和一般正相关性(r=0.32,p<0.05,n=45);同时,TDAA分别与NH4-N呈现弱正相关性(r=0.40,p<0.1,n=45)和一般负相关性(r=-0.30,p=0.05,n=45)(见图 7),表明这些还原态氮可能具有相同的来源及相似的生物地球化学过程。还原态氮主要来源有沉积物水界面交换、陆源输送以及浮游植物自身分泌[21, 26]。实际上,小分子量DON如尿素、DFAA等不仅可以通过微生物还原成NH4-N后被浒苔生物吸收利用,也可以被浒苔生物直接吸收利用,且通常浒苔生物对DFAA和尿素的吸收速率高于NO3—N[20],表明浒苔生物对小分子量DON的直接吸收同化也是其氮供给机制之一。
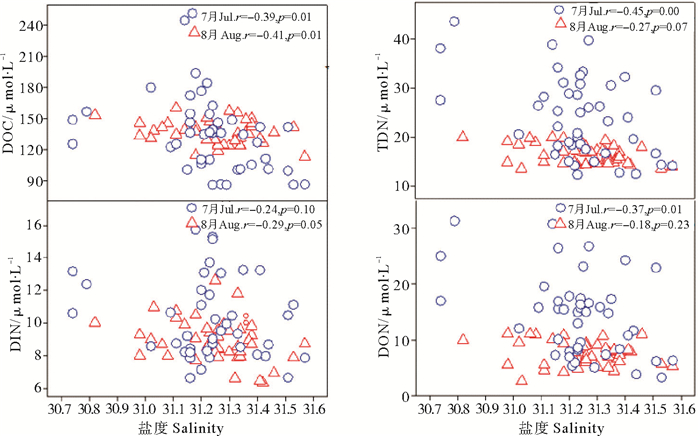
绿潮爆发期间,TDN、DOC、DIN与盐度呈现显著负相关(p<0.05,n=45)(见图 8),表明陆源输入是青岛近海绿潮爆发期间氮的主要来源之一。统计数据表明,近60年青岛近岸海域陆源氮排放通量增加10倍,近海水体中TDN浓度显著增加[27-28],这可能是近年来大规模绿潮爆发和维持的重要营养物质基础[29]。
|
图 8 青岛近海绿潮爆发期和消亡后DOC、TDN、DIN、DON与盐度的相关性 Fig. 8 Correlations between salinity and, DOC, TDN, DIN, DON during and after green bloom in Qingdao coastal waters |
绿潮爆发期青岛近海不同形态氮含量高于绿潮消亡期,DON为TDN的主要存在形态,其中,具有高生物可利用性组分包括尿素和TDAA在DON中具有相当高的占比。受浮游植物分泌和细菌降解生物作用调控影响,DON的含量和在TDN中的占比随水深增大而降低,DON生物可利用性也呈现由表层到底层逐步降低的变化特征。绿潮爆发期间,浒苔生物较微藻可分泌出较多新鲜的、高活性DON,导致其生物可利用性高于消亡后。陆源输入和DON在微生物作用下快速转化为DIN是绿潮爆发期间氮营养物的重要供给源。
| [1] |
李瑞香, 吴晓文, 韦钦胜, 等. 不同营养盐条件下浒苔的生长[J]. 海洋科学进展, 2009, 27(2): 211-216. Li Ruixiang, Wu Xiaowen, Wei Qinsheng, et al. Growth of enteromorpha prolifera under different untrient conditions[J]. Advances in Marine Science, 2009, 27(2): 211-216. DOI:10.3969/j.issn.1671-6647.2009.02.011 (  0) 0) |
| [2] |
Eatherall A, Naden P S, Cooper D M. Simulating carbon flux to the estuary: the first step[J]. Science of the Total Environment, 1998, 210: 519-533.
(  0) 0) |
| [3] |
Bronk D A, See J H, Bradley P, et al. DON as a source of bioavailable nitrogen for phytoplankton[J]. Biogeosciences, 2007, 4(3): 282-296.
(  0) 0) |
| [4] |
Berg G M, Glibert P M, Lomas M W, et al. Organic nitrogen uptake and growth by the chrysophyte Aureococcus anophagefferens during a brown tide event[J]. Marine Biology, 1997, 129(2): 377-387. DOI:10.1007/s002270050178
(  0) 0) |
| [5] |
Berman T, Bronk D A. Dissolved organic nitrogen: a dynamic participant in aquatic ecosystems[J]. Aquatic Microbial Ecology, 2003, 31(3): 279-305.
(  0) 0) |
| [6] |
Hu Z, Mulholland M R, Duan S, et al. Effects of nitrogen supply and its composition on the growth of Prorocentrum donghaiense[J]. Harmful Algae, 2012, 13: 72-82. DOI:10.1016/j.hal.2011.10.004
(  0) 0) |
| [7] |
Varela M M, Bode A, Femandez E, et al. Nitrogen uptake and dissolved organic nitrogen release in planktonic communities characterised by phytoplankton size-structure in the Central Atlantic Ocean[J]. Deep-Sea Research Part Ⅰ, 2005, 52: 1637-1661. DOI:10.1016/j.dsr.2005.03.005
(  0) 0) |
| [8] |
Shen Y, Fichot C G, Benner R. Dissolved organic matter composition and bioavailability reflect ecosystem productivity in the Western Arctic Ocean[J]. Biogeosciences Discussions, 2012, 9(7): 9571-9601. DOI:10.5194/bgd-9-9571-2012
(  0) 0) |
| [9] |
Davis J, Kaiser K, Benner R. Amino acids and amino sugar yields and compositions as indicators of dissolved organic matter diagenesis[J]. Organic Geochemistry, 2009, 40: 343-352. DOI:10.1016/j.orggeochem.2008.12.003
(  0) 0) |
| [10] |
Davis J, Benner R. Seasonal trends in the abundance, composition and bioavailability of particulate and dissolved organic matter in the Chukchi/Beaufort Seas and western Canada Basin[J]. Deep Sea Research Part Ⅱ: Topical Studies in Oceanography, 2005, 52(24): 3396-3410.
(  0) 0) |
| [11] |
Amon R M W, Benner R. Bacterial utilization of different size classes of dissolved organic matter[J]. Limnology and Oceanography, 1996, 41(1): 41-51. DOI:10.4319/lo.1996.41.1.0041
(  0) 0) |
| [12] |
Li H M, Zhang Y Y, Han X R, et al. Growth responses of Ulva prolifera to inorganic and organic nutrients: implications for macroalgal blooms in the southern Yellow Sea, China[J]. Scientific Reports, 2016, 6: 26498. DOI:10.1038/srep26498
(  0) 0) |
| [13] |
Grasshoff K. Methods of Seawater Analysis[M]. New York: Verlag Chemie, Weinheim, 1976: 276-281.
(  0) 0) |
| [14] |
Barnes H. Apparatus and Methods of Oceanography[M]. London: Part One: Chemical, George Allen and Unwin Ltd, 1959.
(  0) 0) |
| [15] |
Spyres G, Nimmo M, Worsflod P J, et al. Determination of dissolved organic carbon in seawater using high temperaturecatalytic oxidation technique[J]. Trends in Analytical Chemistry, 2000, 19(8): 498-506. DOI:10.1016/S0165-9936(00)00022-4
(  0) 0) |
| [16] |
钱佐国, 孙明昆, 杨炼锋, 等. 测定海水中尿素的双乙酰单肟法研究[J]. 海洋科学进展, 1984, 2(1): 66-71. Qian Zuoguo, Sun Mingkun, Yang Lianfeng, et al. On the diacetyl monnxime method for determination of urea in seawater[J]. Advances in Marine Science, 1984, 2(1): 66-71. (  0) 0) |
| [17] |
Kaiser K, Benner R. Hydrolysis-induced racemization of amino acids[J]. Limnology and Oceanography: Methods, 2005(3): 318-325.
(  0) 0) |
| [18] |
Wang J T, Zhang Y W, Li H, et al. Competitive interaction between diatom Skeletonema costatum and dinoflagellate Prorocentrum donghaiense in laboratory culture[J]. Journal of Plankton Research, 2012, 35(2): 367-378.
(  0) 0) |
| [19] |
Zhang G C, Liang S K, Shi X Y, et al. Dissolved organic nitrogen bioavailability indicated by amino acids during the succession of diatom bloom to dinoflagellate bloom in the Changjiang River estuary and its adjacent shelf[J]. Marine Chemistry, 2015, 176: 83-95. DOI:10.1016/j.marchem.2015.08.001
(  0) 0) |
| [20] |
Tarutani K, Niimura Y, Uchida T. Short-term uptake of dissolved organic nitrogen by an axenic strain of Ulva pertusa (Chlorophyceae) using[J]. Botanica Marina, 2004, 47(3): 248-250.
(  0) 0) |
| [21] |
Colombo J C, Silerberg N, Gearing J N. Amino acids biogeochemistry in the Laurentian Trough: vertical fluxes and individual reactivity during early diagenesis[J]. Organic Geochemistry, 1998, 29(4): 933-945. DOI:10.1016/S0146-6380(98)00113-2
(  0) 0) |
| [22] |
Hecky R E, Mopper K, Kilham P, et al. The amino acid and sugar composition of diatom cell-walls[J]. Marine Biology, 1973, 19(4): 323-331. DOI:10.1007/BF00348902
(  0) 0) |
| [23] |
Dauwe B, Middelburg J J. Amino acids and hexosamine as indicators of organic matter degradation state in North Sea sediments[J]. Limnology and Oceanography, 1998, 43(5): 782-798. DOI:10.4319/lo.1998.43.5.0782
(  0) 0) |
| [24] |
Bronk D A, Ward B B. Gross and net nitrogen uptake and DON release in the euphotic zone of Monterey Bay, California[J]. Limnology and Oceanography, 1999, 44: 573-585. DOI:10.4319/lo.1999.44.3.0573
(  0) 0) |
| [25] |
Dickson M L, Wheeler P A. Ammonium uptake and regeneration rates in a coastal upwelling regime[J]. Marine Ecology Progress, 1995, 121: 239-248. DOI:10.3354/meps121239
(  0) 0) |
| [26] |
Tyler A C, McGlathery K J. Uptake and release of nitrogen by the macroalgae graciaria vermiculophylla(rhodophyta)[J]. Journal of Phycology, 2006, 42(3): 515-525. DOI:10.1111/jpy.2006.42.issue-3
(  0) 0) |
| [27] |
Liang S K, Pearson S, Wu W, et al. Integrated coastal zone management of Jiaozhou Bay, China: Review of research and management with recommendations to sustain the Bay's functions[J]. Ocean & Coastal Management, 2015, 116: 470-477.
(  0) 0) |
| [28] |
Su Y, Wang X L, Li K Q, et al. Estimation methods and monitoring network issues in the quantitative estimation of land-based COD and TN loads entering the sea: a case study in Qingdao City, China[J]. Environmental Science and Pollution Research, 2014, 21: 10067-10082. DOI:10.1007/s11356-014-3047-9
(  0) 0) |
| [29] |
Liu D Y, Keesing J K, He P M, et al. The world's largest macroalgal bloom in the Yellow Sea, China: Formation and implications[J]. Estuarine, Coastal and Shelf Science, 2013, 129: 2-10. DOI:10.1016/j.ecss.2013.05.021
(  0) 0) |
2. College of Chemistry and Chemical Engineering, Ocean University of China, Qingdao 266100, China
 2018, Vol. 48
2018, Vol. 48


