2. 青岛海洋科学与技术试点国家实验室 海洋生态与环境科学功能实验室,山东 青岛 266237;
3. 青岛农业大学食品科学与工程学院,山东 青岛 266109;
4. 长江水利委员会水文局长江上游水文水资源勘测局,重庆 404002
β-二甲基巯基丙酸内盐(Dimethylsulfoniopropionate,DMSP,分子式(CH3)2S+CH2CH2COO-)是海洋生态系统中普遍存在的一种还原态有机硫化物,DMSP及其酶裂解产物二甲基硫(Dimethylsulfide,DMS,分子式CH3SCH3)对全球硫循环具有重要贡献。每年由海洋藻类产生的DMSP可达109 t,占细胞内有机硫的50%~90%[1]。每年由海洋排放到大气的DMS大约13~37 Tg,约占全球天然硫释放量的50%[2]。DMS作为痕量活性气体,通过海气交换进入大气,其氧化产物形成云凝结核,改变对阳光的折射率,从而影响全球的气候变化,即“CLAW假说”[3]。海洋中的DMSP和DMS的来源和归宿与海洋生物(浮游植物、浮游动物、珊瑚、异养细菌、病毒、鱼,等)密切相关。浮游植物、细菌或有机物经植食性浮游动物、肉食性浮游动物、各级肉食性动物,将物质和能量通过海洋食物链和食物网的各个环节进行转换和流动[4]。因此DMSP和DMS的分布与海洋食物网的多种营养级生物直接相关,并通过摄食活动在海洋食物链各营养级之间进行传递和转化[5]。浮游食物链在DMSP的传递和转化中具有重要地位:(1)一部分DMSP沿经典食物链(浮游植物→浮游动物→幼鱼、虾)传递和转化;(2)另一部分DMSP沿微食物环(DMSP→异养细菌→原生动物→后生动物)进入循环(见图 1)。因此,海洋食物网(如:经典食物链和微食物环)的组成、结构和动力学在DMSP的生物地球化学循环中发挥着重要的作用[6]。本文对DMSP的源和汇及其在海洋食物链中转移等方面进行阐述,着重讨论浮游食物链在DMSP传递和转化中的作用,对深入了解DMSP在浮游食物链的生物地球化学循环中的作用具有重要科学意义。
|
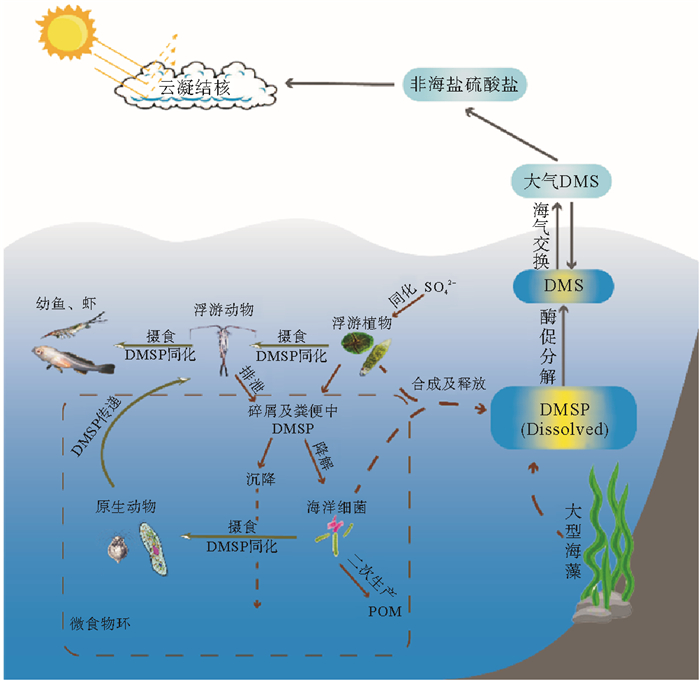
图 1 DMSP在食物链中的生物地球化学循环 Fig. 1 The biogeochemical cycling of DMSP in the food chain |
DMSP在海洋环境中普遍存在,是浮游植物体内的一种硫代谢产物,海洋微藻、大型藻类和盐生植物是海洋DMSP的主要来源[7-8]。1988—2018年的研究数据表明,DMSP含量具有种间差异性[9],不同浮游植物内的DMSP含量从纳摩尔到微摩尔不等,相差3个数量级。海水中DMSP浓度与调查海域、水层、季节有关,一般不超过1.78 μmol·L-1[10]。水平分布上,极地和亚极地地区具有相对较高的DMSP含量,而热带及亚热带海域DMSP含量相对偏低[11]。垂直分布上,海水中的DMSP通常表现出由表层水到深层水下降的趋势。2011年夏季中国黄、东海海水现场结果表明,海水DMSP浓度从表层到深层变化范围为7.6~234.9 nmol·L-1[12]。DMSP浓度的季节变化表现为:春季开始增加,夏末达到最高值,秋、冬季逐渐下降。中国黄、东海海水中,2006年夏季DMSP浓度较高,变化范围为14.0~45.0 nmol·L-1,2007年冬季DMSP的浓度相对较低,变化范围为6.5~18.0 nmol·L-1[13]。
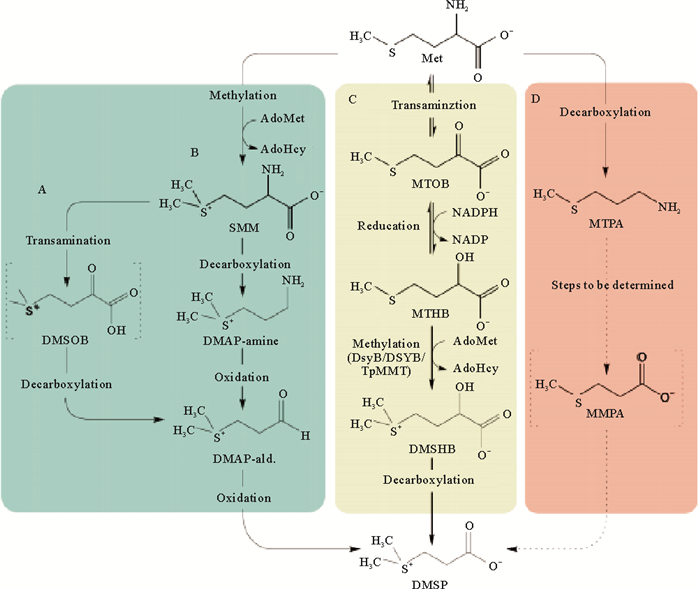
2 DMSP的生物合成 2.1 DMSP在浮游植物中的生物合成Keller和Maureen[14]对123个海洋浮游植物的研究发现,浮游植物中的甲藻纲(沟鞭藻dinoflagellates)和定鞭金藻纲(棕囊藻Phaeocystis sp.)是DMSP的主要生产者[10],一些金藻和绿藻也可产生一定量的DMSP,而褐藻和硅藻则是DMSP低产种[15]。海洋中的无机硫向有机硫的转化是一个耗能的过程,首先,浮游植物经硫酸盐同化还原过程,藻细胞吸收水体中的硫酸盐进入细胞质,随后进入叶绿体经一系列生化反应生成半胱氨酸。半胱氨酸一部分参与生物所需蛋白质的合成,另一部分反应得到高半胱氨酸经甲基化反应生成DMSP的前体甲硫氨酸。甲硫氨酸生物合成DMSP可能有4种不同的路径(见图 2)。Kocsis等[16]发现被子植物中有2种甲基化路径;硅藻、绿藻和珊瑚中发生转氨途径,还有一种脱羧途径,甲硫氨酸经转氨和脱羧途径分别生成中间体MTOB(4-methylthio-2-oxobu-tyrate)和MMPA(Methylmercaptopropionate),经氧化脱羧反应最终合成DMSP[17]。近年来利用分子生物学技术已经鉴定出涉及硫甲基化作用的DSYB基因[18],而其它途径涉及的关键基因还有待于进一步探究。
2.2 DMSP在海洋细菌中的合成Curson等[18, 20]发现海洋异养细菌中α-变形菌纲(Alphaproteobacteria)可以合成DMSP,打破了前人对DMSP高产者只有微型藻类、大型藻类和盐生植物等真核生物的认识,使人们对于DMSP生物合成的种类有了更加丰富的认识。这些海洋细菌的DMSP生物合成路径与许多藻类相似,都是甲硫氨酸通过转氨途径进一步合成。Curson等[20]也证实了DSYB基因是海洋细菌DMSP生物合成的关键基因,其作用是编码该途径关键的甲基转移酶。研究还发现,当盐度变化或氮的利用率降低时,海洋细菌可以通过合成DMSP以维持细胞正常的生命活动[18]。海洋细菌合成DMSP的发现有助于我们更加清晰了解DMSP的来源。
2.3 影响DMSP合成的环境因素DMSP合成是个复杂的过程,受多种环境因素(光照、盐度、温度、营养盐浓度、海水pH、紫外辐射等)的影响[21]。环境因素可以刺激或抑制初级生产力,从而间接影响DMSP的合成。
光照对DMSP合成的影响是间接的,光照强度和光照时间会影响浮游植物的光合作用,进而影响合成DMSP所需的能量[22]。Sunda等[23]研究表明,高光照强度会促进球石藻、大型绿藻的生长,并导致DMSP浓度的升高;另外,不同光照周期对DMSP的合成影响不同,短光照周期培养,光照强度对DMSP的合成没有影响,长光照周期培养,光照强度可使DMSP浓度增加一倍。盐度升高会导致细胞内DMSP浓度的增加[24],不同盐度下DMSP浓度的变化范围约为两个数量级,很多海域的现场调查发现,颗粒态DMSP(DMSPp)的含量与盐度变化呈正相关[25]。低温条件下的DMSP是细胞代谢作用的相容性溶质,对细胞组织的酶具有一定的保护作用[1]。Karsten等[26]对南极大藻的研究发现,0 ℃的DMSP含量比10 ℃的DMSP含量高5倍,表明低温可以刺激藻类DMSP含量升高。在营养盐对DMSP的影响研究中,营养盐氮的影响成为研究者关注的焦点[27]。在一些营养贫乏的海区(如马尾藻海),氮限制导致海水中的DMSP含量较高[27]。与此结果不同,Keller等[28]研究发现浮游植物DMSP浓度与氮浓度之间不存在明显相关性关系。鉴于目前研究结果的差异性,营养盐中氮限制对DMSP的影响需进一步证实。
除上述环境因素以外,海水pH和紫外辐射也会影响DMSP的合成[29-34]。海水pH降低引起的海洋酸化会对浮游植物的生长和光合作用产生影响,并改变海洋初级生产力和浮游植物群落结构,进一步导致DMSP和DMS的产量发生变化[30]。另外,海洋酸化对海水中的DMSP降解菌丰度的影响也会引起DMS产生的变化[31]。Jian等[32]研究表明,高浓度CO2(pH=7.7)条件下,DMSP和DMS浓度分别下降21%和35%,分析原因可能是浮游植物生物量、细菌代谢和酶活性综合作用的结果。Yang等[33]研究发现,紫外辐射抑制南极棕囊藻DMSP的产生,并且DMSP浓度与紫外辐射强度和暴露时间均呈负相关。与Yang等[31]的研究结果不同,Darroch等[34]研究发现高紫外线辐射下,球石藻的细胞内DMSP和溶解态DMSP(DMSPd)浓度分别增加了30%和100%,推测原因可能是紫外辐射胁迫促进了抗氧化剂DMSP的合成。海洋酸化和紫外辐射等环境因素并不是单独发挥作用,而是各个环境因素之间相互作用的结果[32],因此综合考虑多种因素才能更好地理解和解释环境对DMSP的影响机制。
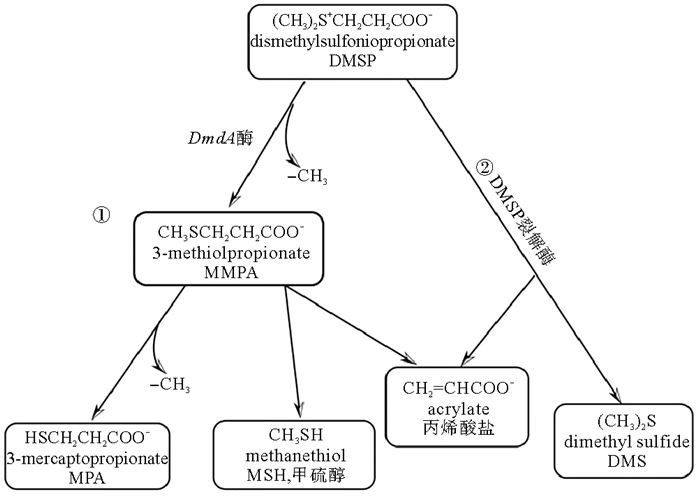
3 DMSP的分解代谢大多数生物合成的DMSP释放到水体后形成DMSPd,DMSPd来自于浮游植物主动分泌、细胞衰老、病毒感染以及浮游动物捕食。海洋中自由生长的浮游细菌和附着菌可以利用水体中的DMSP进行同化和降解[35]。海洋细菌分解代谢DMSP有两种途径,一种是去甲基化途径,该途径生成一种重要的挥发性硫化物甲硫醇和丙烯酸盐,该过程中一个关键的酶DmdA已被证实[36];另一种途径是在DMSP裂解酶的参与下,DMSP转化为DMS、丙烯酸和一个质子(见图 3)。大约30%~90%的DMSPd被细菌分解代谢,其中大部分通过脱甲基途径进行降解,少部分通过酶促裂解生成DMS[37]。低DMSPd浓度下,浮游细菌更喜欢脱甲基化途径,因为该途径提供了更多的能量,并且是吸收还原硫的一种比较经济的方式;而在高DMSPd浓度下,DMSP可采用酶促裂解途径[38]。目前从各种细菌类群中共鉴定出7种DMSP裂解基因(dddD、dddK、dddL、dddP、dddQ、dddY和dddW)[39-40],这些基因编码DMSP裂解酶促使DMSP向DMS的转化。除了细菌,浮游植物也可以产生DMSP裂解酶,将DMSP裂解产生DMS和丙烯酸。例如,Alcolombri等[41]在球石藻中发现了DMSP裂解酶基因(Almal)。虽然,关于DMSP的分解代谢途径已经有了一些研究,但这两个途径的各自贡献及其作用机理仍需进一步阐明。
|
( ①脱甲基途径;②裂解途径。①The demethylation pathway;②The cleavage pathway. ) 图 3 DMSP在海洋环境中的降解途径[42] Fig. 3 Pathways of DMSP metabolism in the marine environment[42] |
DMSP在海洋生物和海洋环境中,具有不同的生理、生物学功能。DMSP可为海洋细菌提供碳源和硫源[43],在浮游食物链中可充当捕食抑制剂、化学信号分子等生物学功能[44],在海洋生物体内可作为渗透压调节剂、抗冷冻剂、抗氧化剂等生理学功能[45-46]。
DMSP与其氮的类似物甜菜碱有类似的结构,都可以调控藻细胞内部渗透压。细胞内DMSP浓度较高的生物,DMSP可作为一种渗透液,有助于细胞克服渗透压变化下的不利环境,维持细胞的稳定。例如,在高盐度条件下,卡氏膜球藻(Hymenomonascarterae)细胞中DMSP的浓度高达300 mmol·L-1[46]。DMSP对渗透压的调节是长期的过程,并非真正的渗透压调节剂。Karsten等[47]研究表明DMSP可以保护乳酸脱氢酶(LDH)和苹果酸脱氢酶(MDH)的活性,添加DMSP后,这两种酶的活性和稳定性均得到了增加。此外,DMSP及其分解产物(DMS、丙烯酸、二甲基亚砜和甲烷磺酸)可作为抗氧化剂清除羟基自由基和其它活性氧[23]。
Stefels[21]提出的“overflow”机制很好地解释了DMSP在细胞代谢中的作用:DMSP的生产可以消耗多余能量和还原态硫以保证代谢的正常运行。DMSP可以为细胞生长储存氮,并加速对硫酸盐的吸收[48]。海洋微生物可以利用DMSP中的硫合成氨基酸并利用碳键部分能量,证明DMSP可作为海洋细菌的重要碳源和硫源[37]。与吸收硫酸盐相比,一些细菌(如SAR11)吸收DMSP中的还原硫只需消耗更少的能量,因此更倾向于利用DMSP中的还原硫[49]。
DMSP及其降解产物具有捕食抑制剂的作用[50]。Wolfe等[50]研究发现,球石藻产生的DMSP及其降解产物丙烯酸对许多生物具有毒害作用,使其能够逃避浮游动物的捕食。另外,DMSP可以作为一种信号分子,吸引对珊瑚有益的细菌,与珊瑚一起构建完整的微生物群落从而增强珊瑚自身的健康[51]。DMSP还可以吸引一些浮游植物、噬菌体和草食性微型浮游动物[52],也可以诱导细菌群体感应,如参与颗粒有机碳(POC)的降解。另外,Barak-Gavish等[53]揭示了一种独特的菌株特定性反应,富含DMSP的球石藻更容易受到感染,证明了DMSP还有一种新的功能,可作为细菌毒性的介质对球石藻水华的调节起到一定的作用。
4.2 经典食物链对DMSP循环的作用 4.2.1 浮游植物DMSP由浮游植物合成,经植食性浮游动物、肉食性浮游动物可以进入更高营养级。浮游植物的种类和丰度与DMSP浓度密切相关,在棕囊藻(Phaeocystis sp.)和球石藻(Emiliania huxleyi)水华期间DMSP浓度会大大提高[54]。研究表明,浮游植物丰度和叶绿素a(Chl a)含量均与DMSP浓度呈正相关性[13]。在格陵兰海和挪威海,Chl a含量是DMSP浓度的最重要影响因素,其次是海水温度和盐度[55]。也有部分研究结果显示,DMSP浓度与Chla含量相关性不明显,这主要是由于浮游植物种类和丰度不同造成的,不同浮游植物细胞含有的DMSP、Chl a含量各不相同,而单一浮游植物的Chl a含量与DMSP浓度呈显著正相关[56]。DMSP的释放量与浮游植物生长期有关,健康细胞DMSP释放很少,细胞衰亡或破裂会释放大量的DMSP[57]。藻细胞自溶被认为是DMSPp释放的主要途径,在水华末期,细胞破裂导致大量DMSP释放进入水体[58]。
4.2.2 浮游动物浮游动物是初级消费者的重要组成部分,每天大约消耗海洋初级生产力的10%~25%[59],浮游动物的丰度及分布对初级生产力和更高的营养级具有调控作用。Dacey和Wakeham[60]首次提出海洋桡足类摄食纳尔逊裸甲藻(Gymnodinium nelsoni)可以极大刺激DMS的产生。Leck等[61]在波罗的海的研究发现,海水DMS浓度与浮游动物总丰度呈正相关。Wolfe等[62]利用稀释法研究发现拉布拉多海(Labrador Sea)DMS产量与微型浮游动物摄食率成正比,并且推测可能是因为物理胁迫(摄食)激活棕囊藻DMSP的裂解并促进DMS的产生,可能是因为藻类裂解酶活性和浮游动物肠道和粪便中的异养细菌活性增加促进了DMS产量升高。一些中型和大型浮游动物(如桡足类、磷虾等)的摄食可以机械破裂藻细胞从而释放溶解有机物,DMSP与DMSP裂解酶混合进而促进DMS的释放[60]。桡足类可以通过摄食、渗透调节、保留在体内、重新包装成可以再循环或沉降到深水的粪便颗粒以达到DMSP的转移[63]。
现场和实验室数据表明,浮游动物DMSP的摄入量远大于DMS的产生量,可能是因为一部分摄入的DMSP被体内和水体环境中的细菌经脱甲基途径代谢,一部分在浮游动物体内积累进入细胞组织[64]或转移到粪便中(见表 1)。同化到桡足类体内的DMSP可以通过食物链转移到更高一级的营养级,而粪便中的DMSP可被细菌降解或沉降到更深的海水中[63]。中华哲水蚤是中国东海、黄海、胶州湾的优势种,实验室研究结果表明,DMS释放的增加量(与无桡足类的对照相比的增加量)与中华哲水蚤的摄食率呈正相关,并受饵料类型、饵料浓度和盐度的影响[65]。与上述桡足类摄食促进DMS释放的结果不同,胶州湾现场中华哲水蚤、浮游动物的丰度与DMS、DMSP浓度无显著相关性[65]。Cantin等[66]与Yu等[65]的现场结果类似,研究表明,圣劳伦斯湾飞马哲水蚤(Calanus finmarchicus)摄食对DMS和DMSPd产生的影响不大。原因主要是现场DMS、DMSP浓度是一个净生产结果,受浮游植物、浮游动物丰度以及种类组成(见表 1)的影响。浮游动物摄食在DMSP沿食物链传递中的作用,要考虑其他综合因素。截止目前为止,浮游动物摄食过程中的DMSP传递和转化的作用机制尚不明确,浮游动物在DMSP的生物地球化学循环中的作用有待于进一步的研究。
|
|
表 1 不同浮游动物体内DMSP的含量 Table 1 DMSP content in different zooplankton |
鱼类对浮游生物的摄食是海洋环境中的一个重要过程,影响DMSP在食物链中的传递和转化。Hill等[68]研究幼年大西洋短背黑鲷对DMSP的摄食过程发现,摄入的DMSP转移到DMSPd、粪便和体内的百分比分别为21%、10%、33%,而体内DMSP最终代谢转化成DMS或被大型肉食动物捕食进入高一级食物链。此外,DMSP是重要的信号分子,释放在水体中的DMSP会影响鱼类的觅食活动,鱼类可以利用DMSP的时空分布寻找觅食机会[69],食物中高浓度DMSP会增加鱼类的体重和群体活跃性[70]。因此,鱼类的DMSP摄食过程对它们生存海域DMSP的生物地球化学循环具有重要意义。
4.3 微食物环对DMSP循环的作用作为传统食物链的一个补充,微食物环在驱动海洋生态系统碳、硫循环中发挥着重要的作用。自20世纪80年代开始,Pomeroy等[71]发现了各种微生物在生产和消费过程中的重要作用,随后Azam等[6]首次提出了微食物环概念,引起了研究者的极大关注。按生物粒径,微食物环主要包含4个粒级(femto-,< 0.2 μm;pico-,0.2~2 μm;nano-,2~20 μm和micro-,20~200 μm),其中包括病毒、细菌、鞭毛虫和纤毛虫等[72]。微型食物链是连接碎屑食物链和后生动物食物链的关键,异养微生物经二次生产将DMSPd变成自身生长繁殖的颗粒有机质,原生动物(如纤毛虫和鞭毛虫)通过摄食异养微生物,使之变为更大的有机颗粒,为更高营养级的后生动物(如桡足类)所利用,传递返回主食物链(见图 1)。
4.3.1 Femto-级浮游生物Femto-级浮游生物主要是指粒径小于0.2 μm的病毒颗粒。不同海域病毒的丰度不同,沿岸和河口丰度略大于远洋丰度,其范围为3×108~2.8×1011 cells/L[73]。海洋病毒是细菌和真核生物死亡的主要来源,是细菌生产力的重要调控因子,约19%生产力被病毒消耗[74]。病毒可使宿主细胞裂解,将颗粒有机物转化为水体中的溶解有机物,促进营养盐和有机碳的循环利用。病毒裂解使浮游植物细胞内DMSP释放进入水体,加速DMSP的降解过程,促进DMS的产生[74]。Evans等[75]研究发现,病毒感染球石藻(Emiliania huxleyi)的过程中DMSP、DMS和丙烯酸均得到积累,证实了藻类的病毒感染可直接导致DMSP裂解。
4.3.2 Pico-级浮游生物Pico-级生物主要包括聚球蓝细菌、原绿球藻及异养细菌。Archer等[76]研究表明微微型光合真核生物(Picoeukaryotes, Euk.)和蓝细菌(cyanobacteria),如聚球藻(Synechoccus spp.),含有大量DMSP。微微型自养生物蓝细菌生物量大,代谢速度快,能量转换效率高,可贡献40%的总净生产力[77]。赵三军等[78]研究发现,聚球蓝细菌丰度最高值主要分布在表层及次表层,占浮游植物总生物量的4%~98%,温度和光照强度可能是限制其生物量的主要因子。原绿球藻是最小的超微型光合浮游生物,生物量极大,是微食物环的重要组成部分,也是碳、硫循环的主要贡献者。蓝细菌和原绿球藻在微食物环以及DMSP循环中的作用越来越受到海洋科学工作者的重视。
异养细菌在微食物环中扮演着主导角色,既是生产者,也是分解者。异养细菌的生产力相当于初级生产力的10%~30%,主要发生在真光层[79]。异养细菌也是水体中DMSP的主要分解者,大多数DMSP降解菌属于α-变形菌纲和β-变形菌纲,α-变形菌纲以SAR11类群和玫瑰杆菌类群为主要代表[80]。在微生物食物链中,异养细菌为浮游生物提供了丰富的饵料,将DMSPd代谢为利于自身生长的颗粒有机物,作为微食物环的起点进入微食物环进行物质循环和能量流动,增加了海洋生态系统的多样性和稳定性。DMSP可以为异养细菌提供碳源和硫源,可贡献表层海水中总碳需求的1%~15%,而且,DMSP的同化也可以满足大部分海洋细菌对硫的需求[81]。除此之外,异养细菌可以与初级生产者发生相互作用,通过特定的有机分子调节种间关系和促进生物生长。Johnson等[82]通过表征异养细菌Ruegeria pomeroyi DSS-3对浮游植物产生的DMSP的代谢反应证实了这种藻-菌相互作用。Kessler等[83]发现,石莼(Ulva)可以释放大量DMSP作为指示食物来源的化学信号,吸引异养细菌在石莼细胞周围聚集并形成保护性生物膜,石莼可直接在生物膜上生长,进而促进其生长发育和形态变化。不管是浮游食物链还是微食物环,海洋细菌在食物链的各个环节中都是普遍存在的,细菌对DMSP循环的影响也是不可忽视的一个因素。
4.3.3 微型浮游动物许多学者把micro-和nano-浮游动物合并为micro-浮游动物,微型浮游动物主要是指异养鞭毛虫和纤毛虫,主要摄食浮游细菌和病毒,同时又被中型浮游动物(如桡足类)所捕食,是微食物环与主食物链相互耦合的关键环节[84]。Christaki等[45]研究发现微型浮游食物网中的微型浮游动物对DMSP释放的作用:粒径小于10 μm的DMSPp需经草食性微型浮游动物摄食和细菌分解,才能被桡足类等中型浮游动物所利用。北海北部球石藻水华期间,91%浮游植物细胞内DMSP的传递受微型浮游动物的调控[85],微型浮游动物成为将DMSPp转化为DMSPd的主要媒介。Strom等[86]指出微型浮游动物的摄食会影响DMSP裂解酶的活性,进而加速DMSP向DMS的转化。Tang和Simó[5]计算出异养腰鞭毛虫摄入的DMSP中有30%同化为捕食者体内DMSP,并保留在原生动物体内随微食物环进入更高营养级。因此,原生动物(纤毛虫和鞭毛虫)在海洋生态系统的物质循环和能量流动中起关键作用,是将浮游植物中DMSP转移到食物链的重要营养纽带。
5 结论与展望海洋中DMSP的产生、迁移-转化和传递与海洋生物密切相关,经典食物链和微食物环在其中发挥着重要作用。目前,国内外学者已经开展了DMSP分布的现场调查,并对DMSP的合成和降解途径进行了研究,探讨了海洋食物网复杂相互作用中DMSP的源和汇,但对许多海洋硫化物(包括DMS、DMSP等)循环的各个途径仍然知之甚少,仍有许多关于DMSP从浮游植物进入食物链后的迁移、转化和传递的过程、途径及其机理的问题尚待明确。
(1) 海洋生物在DMSP的产生(如浮游植物、大型海藻、盐生植物、部分细菌等)和降解(如细菌、浮游动物、病毒等)中具有重要作用,因此DMSP在海洋食物网中通过捕食或降解消耗进行传递和转化的路径以及具体机理需要进一步深入研究。
(2) DMSP的产生和降解除了生物因素的影响,还受非生物因素(如温度、盐度、光照、氮浓度、紫外辐射、海水pH等)的影响。现场海水中的DMSP和DMS浓度是生物因素和非生物因素相互作用的净结果,不能仅考虑单一因素。紫外辐射及海水pH对DMS和DMSP产生和降解的影响目前虽然有少量报道,但最终是积极影响还是消极影响尚无定论,仍需开展一些现场模拟实验做进一步研究。
(3) 浮游动物摄食浮游植物这一浮游食物链在DMSP和DMS的生物地球化学循环中具有重要作用,可以通过摄食将浮游植物细胞内的DMSP裂解酶释放出来,从而促进DMS的产生。DMS的释放量要考虑浮游动物的类型、丰度及其饵料的类型和丰度。DMSP在摄食过程中实现了从初级生产者到初级消费者的转移,并进入浮游动物体内和粪便,从而进入下一级消费者。但浮游动物摄食能够促进DMS释放的作用机制(如DMSP裂解酶的作用)还需进一步揭示,并且浮游动物的研究种类仅限于几种(如桡足类、磷虾、海鳟等),研究种类的范围应进一步扩大。
(4) 微食物环中的微型浮游动物及异养细菌是传统食物链的重要补充,对DMSP和DMS的循环发挥着重要作用。目前,现场微型浮游动物的摄食主要是通过稀释法进行测定,而且只有少量相关报道,对于其在DMSP传递和转化中的作用仍需要开展一些室内实验以探讨其机理。
| [1] |
Matrai P, Vernet M. Dynamics of the vernal bloom in the marginal ice zone of the Barents Sea: Dimethyl sulfide and dimethylsulfoniopropionate budgets[J]. Journal of Geophysical Research, 1997, 102(C10): 22965-22980. DOI:10.1029/96JC03870
(  0) 0) |
| [2] |
Simó R, Pedrós-Alió C, Malin G, et al. Biological turnover of DMS, DMSP and DMSO in contrasting open-sea waters[J]. Marine Ecology Progress Series, 2000, 203(1438): 1-11.
(  0) 0) |
| [3] |
Charlson R J, Lovelock J E, Andreae M O, et al. Oceanic phytoplankton, atmospheric sulphur, cloud albedo and climate[J]. Nature, 1987, 326(6114): 655-661. DOI:10.1038/326655a0
(  0) 0) |
| [4] |
Simó R. Production of atmospheric sulfur by oceanic plankton: biogeochemical, ecological and evolutionary links[J]. Trends in Ecology & Evolution, 2001, 16(6): 287-294.
(  0) 0) |
| [5] |
Tang K, Simó R. Trophic uptake and transfer of DMSP in simple planktonic food chains[J]. Aquatic Microbial Ecology, 2003, 31: 193-202. DOI:10.3354/ame031193
(  0) 0) |
| [6] |
Azam F, Fenchel T, Field J, et al. The ecological role of water-column microbes in the sea[J]. Marine Ecology Progress Series, 1983, 10: 257-263. DOI:10.3354/meps010257
(  0) 0) |
| [7] |
Challenger F, Simpson M I. Studies on biological methylation; a precursor of the dimethyl sulphide evolved by Polysiphoniafastigiata; dimethyl-2-carboxyethylsulphonium hydroxide and its salts[J]. Journal of the Chemical Society, 1948, 3: 1591-1597.
(  0) 0) |
| [8] |
Ishida Y, Kadota H. Production of dimethyl sulfide from unicellular algae[J]. Nippon Suisan Gakkaishi, 1967, 33(8): 782-787. DOI:10.2331/suisan.33.782
(  0) 0) |
| [9] |
Matrai P A, Keller M D. Total organic sulfur and dimethylsulfoniopropionate in marine phytoplankton: Intracellular variations[J]. Marine Biology, 1994, 119(1): 61-68. DOI:10.1007/BF00350107
(  0) 0) |
| [10] |
Keller M D, Bellows W K, Guillard R R L. Dimethyl Sulfide Production in Marine Phytoplankton[M]. Biogenic Sulfur in the Environment, 1989: 167-182.
(  0) 0) |
| [11] |
Speeckaert G, Borges A V, Champenois W, et al. Annual cycle of dimethylsulfoniopropionate (DMSP) and dimethylsulfoxide (DMSO) related to phytoplankton succession in the Southern North Sea[J]. Science of the Total Environment, 2018, 622-623: 362-372. DOI:10.1016/j.scitotenv.2017.11.359
(  0) 0) |
| [12] |
Zhang S H, Yang G P, Zhang H H, et al. Spatial variation of biogenic sulfur in the south Yellow Sea and the East China Sea during summer and its contribution to atmospheric sulfate aerosol[J]. Science of the Total Environment, 2014, 488-489: 157-167. DOI:10.1016/j.scitotenv.2014.04.074
(  0) 0) |
| [13] |
Yang G P, Zhang H H, Zhou L M, et al. Temporal and spatial variations of dimethylsulfide (DMS) and dimethylsulfoniopropionate (DMSP) in the East China Sea and the Yellow Sea[J], 2011, 31(13): 1325-1335.
(  0) 0) |
| [14] |
Keller M D. Dimethyl sulfide production and marine phytoplankton: the importance of species composition and cell size[J]. Biological Oceanography, 1989, 6(5-6): 375-382.
(  0) 0) |
| [15] |
Rellinger A N, Kiene R P, Del Valle D A, et al. Occurrence and turnover of DMSP and DMS in deep waters of the Ross Sea, Antarctica[J]. Deep Sea Research Part Ⅰ: Oceanographic Research Papers, 2009, 56(5): 686-702. DOI:10.1016/j.dsr.2008.12.010
(  0) 0) |
| [16] |
Kocsis M, Nolte K, Rhodes D, et al. Dimethylsulfoniopropionatebiosynthesis in Spartina alterniflora1. Evidence that s-methylmethionine and dimethylsulfoniopropylamine are intermediates[J]. Plant Physiology, 1998, 117: 273-281. DOI:10.1104/pp.117.1.273
(  0) 0) |
| [17] |
Raina J B, Tapiolas D M, Forêt S, et al. DMSP biosynthesis by an animal and its role in coral thermal stress response[J]. Nature, 2013, 502(7473): 677-680. DOI:10.1038/nature12677
(  0) 0) |
| [18] |
Curson A R J, Williams B T, Pinchbeck B J, et al. DSYB catalyses the key step of dimethylsulfoniopropionate biosynthesis in many phytoplankton[J]. Nature Microbiology, 2018, 3(4): 430-439. DOI:10.1038/s41564-018-0119-5
(  0) 0) |
| [19] |
Zhang X H, Liu J, Liu J, et al. Biogenic production of DMSP and its degradation to DMS-their roles in the global sulfur cycle[J]. Science China Life Sciences, 2019, 62(10): 1296-1319. DOI:10.1007/s11427-018-9524-y
(  0) 0) |
| [20] |
Curson A R J, Liu J, Bermejo Martínez A, et al. Dimethylsulfoniopropionate biosynthesis in marine bacteria and identification of the key gene in this process[J]. Nature Microbiology, 2017, 2(5): 17009. DOI:10.1038/nmicrobiol.2017.9
(  0) 0) |
| [21] |
Stefels J. Physiological aspects of the production and conversion of DMSP in marine algae and higher plants[J]. Journal of Sea Research, 2000, 43(3): 183-197.
(  0) 0) |
| [22] |
Cuhel R, Lean D. Influence of light intensity, light quality, temperature, and daylength on uptake and assimilation of carbon dioxide and sulfate by lake plankton[J]. Canadian Journal of Fisheries and Aquatic Sciences, 1987, 44(12): 2118-2132. DOI:10.1139/f87-261
(  0) 0) |
| [23] |
Sunda W, Kieber D J, Kiene R P, et al. An antioxidant function for DMSP and DMS in marine algae[J]. Nature, 2002, 418(6895): 317-320. DOI:10.1038/nature00851
(  0) 0) |
| [24] |
Vairavamurthy A, Andreae M, Iverson R. Biosynthesis of dimethylsulfide and dimethylpropiothetin by Hymenomonas carterae in relation to sulfur cycle[J]. Limnology and Oceanography, 1985, 30(1): 59-70. DOI:10.4319/lo.1985.30.1.0059
(  0) 0) |
| [25] |
Iverson R L, Nearhoof F L, Andreae M O. Production of dimethylsulfonium propionate and dimethylsulfide by phytoplankton in estuarine and coastal waters[J]. Limnology and Oceanography, 1989, 34(1): 53-67. DOI:10.4319/lo.1989.34.1.0053
(  0) 0) |
| [26] |
Karsten U, Kirst G, Wiencke C. Dimethylsulphoniopropionate (DMSP) accumulation in green macioalgae from polar to temperate regions: interactive effects of light versus salinity and light versus temperature[J]. Polar Biology, 1992, 12(6): 603-607. DOI:10.1007/BF00236983
(  0) 0) |
| [27] |
Andreae M O. Ocean-atmosphere interactions in the global biogeochemical sulfur cycle[J]. Marine Chemistry, 1990, 30: 1-29. DOI:10.1016/0304-4203(90)90059-L
(  0) 0) |
| [28] |
Keller M D, Kiene R P, Matrai P A, et al. Production of glycine betaine and dimethylsulfoniopropionate in marine phytoplankton. Ⅱ. N-limited chemostat cultures[J]. Marine Biology, 1999, 135(2): 249-257. DOI:10.1007/s002270050622
(  0) 0) |
| [29] |
Hopkins F E, Turner S M, Nightingale P D, et al. Ocean acidification and marine trace gas emissions[J]. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(2): 760-765. DOI:10.1073/pnas.0907163107
(  0) 0) |
| [30] |
Boyd P W, Doney S C. Modelling regional responses by marine pelagic ecosystems to global climate change[J]. Geophysical Research Letters, 2002, 29(16): 53-54.
(  0) 0) |
| [31] |
Zhang S H, Yu J, Ding Q-Y, et al. Effect of elevated pCO2 on trace gas production during an ocean acidification mesocosm experiment[J]. Biogeosciences, 2018, 15(21): 6649-6658. DOI:10.5194/bg-15-6649-2018
(  0) 0) |
| [32] |
Jian S, Zhang J, Zhang H-H, et al. Effects of the interaction of ocean acidification, solar radiation, and warming on biogenic dimethylated sulfur compounds cycling in the Changjiang River Estuary[J]. Biogeosciences Discussions, DOI: 10.5194/bg-2017-453.
(  0) 0) |
| [33] |
Yang H F, Kirst G O. Effect of UV-radiation on DMSP content and DMS formation of Phaeocystis antarctica[J]. Polar Biology, 1997, 18(6): 402-409. DOI:10.1007/s003000050206
(  0) 0) |
| [34] |
Darroch L, Lavoie M, Levasseur M, et al. Effect of short-term light-and UV-stress on DMSP, DMS, and DMSP lyase activity in Emiliania huxleyi[J]. Aquatic Microbial Ecology, 2015, 74: 173-185. DOI:10.3354/ame01735
(  0) 0) |
| [35] |
Kiene R P, Linn L J, Bruton J A. New and important roles for DMSP in marine microbial communities[J]. Journal of Sea Research, 2000, 43(3): 209-224.
(  0) 0) |
| [36] |
Reisch C, Moran M A, Whitman W. Dimethylsulfoniopropionate-dependent demethylase (DmdA) from Pelagibacter ubique and Silicibacter pomeroyi[J]. Journal of Bacteriology, 2008, 190: 8018-8024. DOI:10.1128/JB.00770-08
(  0) 0) |
| [37] |
Reisch C R, Stoudemayer M J, Varaljay V A, et al. Novel pathway for assimilation of dimethylsulphoniopropionate widespread in marine bacteria[J]. Nature, 2011, 473(7346): 208-211. DOI:10.1038/nature10078
(  0) 0) |
| [38] |
Kiene R P, Linn L J, Gonzalez J, et al. Dimethylsulfoniopropionate and methanethiol are important precursors of methionine and protein-sulfur in marine bacterioplankton[J]. Applied & Environmental Microbiology, 1999, 65(10): 4549-4558.
(  0) 0) |
| [39] |
Johnston A W, Green R T, Todd J D. Enzymatic breakage of dimethylsulfoniopropionate-a signature molecule for life at sea[J]. Current Opinion in Chemical Biology, 2016, 31: 58-65. DOI:10.1016/j.cbpa.2016.01.011
(  0) 0) |
| [40] |
Sun J, Todd J D, Thrash J C, et al. The abundant marine bacterium Pelagibacter simultaneously catabolizes dimethylsulfoniopropionate to the gases dimethyl sulfide and methanethiol[J]. Nature Microbiology, 2016, 1(8): 16065. DOI:10.1038/nmicrobiol.2016.65
(  0) 0) |
| [41] |
Alcolombri U, Ben-Dor S, Feldmesser E, et al. Identification of the algal dimethyl sulfide-releasing enzyme: a missing link in the marine sulfur cycle[J]. Science, 2015, 348(6242): 1466-1469. DOI:10.1126/science.aab1586
(  0) 0) |
| [42] |
Visscher P T, Di az, Taylor B F. Enumeration of bacteria which cleave or demethylate dimethylsulfoniopropionate in the Caribbean Sea[J]. Marine Ecology Progress Series, 1992, 89(2-3): 293-296.
(  0) 0) |
| [43] |
Reisch C, Crabb W, Gifford S, et al. Metabolism of dimethylsulfoniopropionate by Ruegeria pomeroyiDSS-3[J]. Molecular Microbiology, 2013, 89(4): 774-791. DOI:10.1111/mmi.12314
(  0) 0) |
| [44] |
Wolfe G V, Steinke M. Grazing-activated production of dimethyl sulfide (DMS) by two clones of Emiliania huxleyi[J]. Limnology and Oceanography, 1996, 41(6): 1151-1160. DOI:10.4319/lo.1996.41.6.1151
(  0) 0) |
| [45] |
Christaki U, Belviso S, Dolan J, et al. Assessment of the role of copepods and ciliates in the release to solution of particulate DMSP[J]. Marine Ecology Progress, 1996, 141(1-3): 119-127.
(  0) 0) |
| [46] |
Kirst G O. Salinity tolerance of eukaryotic marine algae[J]. Annual Review of Plant Physiology, 1989, 41(1): 21-53.
(  0) 0) |
| [47] |
Karsten U, Kück K, Vogt C, et al. Dimethylsulfoniopropionate production in phototrophic organisms and its physiological functions as a cryoprotectant[M]. Springer US: Biological and Environmental Chemistry of DMSP and Related Sulfonium Compounds, 1996: 143-153.
(  0) 0) |
| [48] |
Gage D, Rhodes D, Nolte K, et al. A new route for synthesis of dimethylsulphoniopropionate in marine algae[J]. Nature, 1997, 387(6636): 891-894. DOI:10.1038/43160
(  0) 0) |
| [49] |
Tripp H, Kitner J, Schwalbach M, et al. SAR11 marine bacteria require exogenous reduced sulphur for growth[J]. Nature, 2008, 452: 741-744. DOI:10.1038/nature06776
(  0) 0) |
| [50] |
Wolfe G, Steinke M, Kirst G. Grazing-activated chemical defence in a unicellular marine alga[J]. Nature, 1997, 387(6636): 894-987. DOI:10.1038/43168
(  0) 0) |
| [51] |
Raina J B, Tapiolas D, Forêt S, et al. DMSP biosynthesis by an animal and its role in coral thermal stress response[J]. Nature, 2013, 502: 677-680. DOI:10.1038/nature12677
(  0) 0) |
| [52] |
Seymour J, Simó R, Ahmed T, et al. Chemoattraction to dimethylsulfoniopropionate throughout the marine microbial food web[J]. Science, 2010, 329(5989): 342-345. DOI:10.1126/science.1188418
(  0) 0) |
| [53] |
Barak-Gavish N, Frada M J, Lee P A, et al. Bacterial virulence against an oceanic bloom-forming phytoplankter is mediated by algal DMSP[J]. Science Advances, 2018, 4(10): 321-398.
(  0) 0) |
| [54] |
Kiene R, Slezak D. Low dissolved DMSP concentrations in seawater revealed by small-volume gravity filtration and dialysis sampling[J]. Limnology and Oceanography: Methods, DOI: 10.4319/lom.2006.4.80.
(  0) 0) |
| [55] |
厉丞烜, 王保栋, 杨桂朋. 挪威海和格陵兰海海水DMS分布特征及影响因素研究[J]. 海洋学报, 2015, 37(8): 9-25. Li C X, Wang B D, Yang G P. Spatial distributions of dimethylsulfide (DMS)and influencing factors in the Norwegian and Greenland Seas during summer[J]. Acta Oceanologica Sinica, 2015, 37(8): 9-25. (  0) 0) |
| [56] |
Yang J, Yang G, Zhang H, et al. Spatial distribution of dimethylsulfide and dimethylsulfoniopropionate in the Yellow Sea and Bohai Sea during summer[J]. Chinese Journal of Oceanology and Limnology, 2015, 33(4): 1020-1038. DOI:10.1007/s00343-015-4188-5
(  0) 0) |
| [57] |
Stefels J, Van Boekel W. Production of DMS from dissolved DMSP in axenic cultures of the marine phytoplankton species Phaeocystis sp[J]. Marine Ecology Progress Series, 1993, 97(1): 11-18.
(  0) 0) |
| [58] |
Nguyen B C, Belviso S, Mihalopoulos N, et al. Dimethyl sulfide production during natural phytoplanktonic blooms[J]. Marine Chemistry, 1988, 24(2): 133-141. DOI:10.1016/0304-4203(88)90044-8
(  0) 0) |
| [59] |
Kiørboe T. Population regulation and role of mesozooplankton in shaping marine pelagic food webs[J]. Hydrobiologia, 1997, 363(1): 13-27. DOI:10.1023/A%3A1003173721751
(  0) 0) |
| [60] |
Dacey J, Wakeham S. Oceanic dimethylsulfide: production during zooplankton grazing on phytoplankton[J]. Science, 1986, 233(4770): 1314-1316. DOI:10.1126/science.233.4770.1314
(  0) 0) |
| [61] |
Leck C, Larsson U, Bågander L, et al. Dimethyl sulfide in the Baltic Sea: annual variability in relation to biological activity[J]. Journal of Geophysical Research, DOI: 10.1023/A:1003173721751.
(  0) 0) |
| [62] |
Wolfe G V, Levasseur M, Cantin G, et al. DMSP and DMS dynamics and microzooplankton grazing in the Labrador Sea: application of the dilution technique[J]. Deep Sea Research Part Ⅰ: Oceanographic Research Papers, 2000, 47(12): 2243-2264. DOI:10.1016/S0967-0637(00)00028-5
(  0) 0) |
| [63] |
Kwint R L J, Irigoien X, Kramer K J M. Copepods and DMSP[M]. Springer US: Biological and Environmental Chemistry of DMSP and Related Sulfonium Compounds, 1996: 239-252.
(  0) 0) |
| [64] |
Tang K, Dam H, Visscher P, et al. Dimethylsulfoniopropionate (DMSP) in marine copepods and its relation with diets and salinity[J]. Marine Ecology Progress Series, 1999, 179: 71-79. DOI:10.3354/meps179071
(  0) 0) |
| [65] |
Yu J, Tian J Y, Zhang Z Y, et al. Role of Calanus sinicus (Copepoda, Calanoida) on dimethylsulfide and dimethylsulfoniopropionate production in Jiaozhou Bay[J]. Journal of Geophysical Research: Biogeosciences, 2019, 124(8): 2481-2498. DOI:10.1029/2018JG004721
(  0) 0) |
| [66] |
Cantin G, Levasseur M, Gosselin M, et al. Role of zooplankton in the mesoscale distribution of surface dimethylsulfide concentrations in the Gulf of St. Lawrence, Canada[J]. Marine Ecology Progress, 1996, 141(1-3): 103-117.
(  0) 0) |
| [67] |
Elliott D T, Tang K W, Shields A R. Mesozooplankton beneath the summer sea ice in McMurdo Sound, Antarctica: Abundance, species composition, and DMSP content[J]. Polar Biology, 2009, 32(1): 113-122. DOI:10.1007/s00300-008-0511-3
(  0) 0) |
| [68] |
Hill R W, Dacey J W H. Metabolism of dimethylsulfoniopropionate (DMSP) by juvenile Atlantic menhaden Brevoortia tyrannus[J]. Marine Ecology Progress Series, 2006, 322: 239-248. DOI:10.3354/meps322239
(  0) 0) |
| [69] |
Debose J, Nevitt G. Investigating the association between pelagic fish and dimethylsulfoniopropionate in a natural coral reef system[J]. Marine and Freshwater Research, 2007, 58(8): 720. DOI:10.1071/MF06195
(  0) 0) |
| [70] |
Debose J L, Nevitt G A, Dittman A H. Rapid communication: experimental evidence that juvenile pelagic jacks (Carangidae) respond behaviorally to DMSP[J]. Journal of Chemical Ecology, 2010, 36(3): 326-328. DOI:10.1007/s10886-010-9755-9
(  0) 0) |
| [71] |
Pomeroy L R, Wiebe W J. Energetics of microbial food webs[J]. Hydrobiologia, 1988, 159(1): 7-18. DOI:10.1007/BF00007363
(  0) 0) |
| [72] |
李洪波, 杨青, 周峰. 海洋微食物环研究新进展[J]. 海洋环境科学, 2012, 31(6): 927-932. Li H B, Yang Q, Zhou F. Research advances on microbial food loop in marine ecosystem[J]. Marine Environmental Science, 2012, 31(6): 927-932. (  0) 0) |
| [73] |
Wilhelm S W, Suttle C A. Viruses and nutrient cycles in the sea: viruses play critical roles in the structure and function of aquatic food webs[J]. Bioscience, 1999, 49(10): 781-788. DOI:10.2307/1313569
(  0) 0) |
| [74] |
Fuhrman J A. Marine viruses and their biogeochemical and ecological effects[J]. Nature, 1999, 399(6736): 541-548. DOI:10.1038/21119
(  0) 0) |
| [75] |
Evans C, Susanne V K, Louise J D, et al. The relative significance of viral lysis and microzooplankton grazing as pathways of dimethylsulfoniopropionate (DMSP) cleavage: an Emilianiahuxleyi culture study[J]. Limnology and Oceanography, 2007, 52(3): 1036-1045. DOI:10.4319/lo.2007.52.3.1036
(  0) 0) |
| [76] |
Archer S D, Tarran G A, Stephens J A, et al. Combining cell sorting with gas chromatography to determine phytoplankton group-specific intracellular dimethylsulphoniopropionate[J]. Aquatic Microbial Ecology, 2011, 62(2): 109-121. DOI:10.3354/ame01464
(  0) 0) |
| [77] |
Iturriaga R, Mitchell B G. Chroococcoid cyanobacteria: a significant component in the food web dynamics of the open ocean[J]. Marine Ecology Progress Series, 1986, 28(3): 291-297.
(  0) 0) |
| [78] |
赵三军, 肖天, 李洪波, 等. 胶州湾聚球菌(Synechococcusspp.)蓝细菌的分布及其对初级生产力的贡献[J]. 海洋与湖沼, 2005, 36(6): 534-540. Zhao S J, Xiao T, Li H B, et al. Distribution of Synechococcus spp. in Jiaozhou Bay[J]. Oceanologia Et Limnologia Sinica, 2005, 36(6): 534-540. (  0) 0) |
| [79] |
Cole J, Findlay S, Pace M. Bacterial production in fresh and saltwater ecosystems: a cross-system overview[J]. Marine Ecology Progress Series, 1988, 43: 1-10. DOI:10.3354/meps043001
(  0) 0) |
| [80] |
Curson A R, Rogers R, Todd J D, et al. Molecular genetic analysis of a dimethylsulfoniopropionatelyase that liberates the climate-changing gas dimethylsulfide in several marine α-proteobacteria and Rhodobacter sphaeroides[J]. Environmental Microbiology, 2008, 10(3): 757-767. DOI:10.1111/j.1462-2920.2007.01499.x
(  0) 0) |
| [81] |
Simó R, Archer S D, Pedrós-Alió C, et al. Coupled dynamics of dimethylsulfoniopropionate and dimethylsulfide cycling and the microbial food web in surface waters of the North Atlantic[J]. Limnology & Oceanography, 2002, 47(1): 53-61.
(  0) 0) |
| [82] |
Johnson W M, Kido Soule M C, Kujawinski E B. Evidence for quorum sensing and differential metabolite production by a marine bacterium in response to DMSP[J]. Isme Journal, 2016, 10(9): 2304-2316. DOI:10.1038/ismej.2016.6
(  0) 0) |
| [83] |
Kessler R W, Weiss A, Kuegler S, et al. Macroalgal-bacterial interactions: role of dimethylsulfoniopropionate in microbial gardening by Ulva(Chlorophyta)[J]. Molecular Ecology, 2018, 27(8): 1808-1819. DOI:10.1111/mec.14472
(  0) 0) |
| [84] |
张武昌, 王荣. 渤海微型浮游动物及其对浮游植物的摄食压力[J]. 海洋与湖沼, 2000, 31(3): 252-258. Zhang W C, Wang R. Microzooplankton and their grazing pressure on phytoplankton in Bohai Sea[J]. Oceanologia Et Limnologia Sinica, 2000, 31(3): 252-258. (  0) 0) |
| [85] |
Archer S D, Gilbert F J, Nightingale P D, et al. Transformation of dimethylsulphoniopropionate to dimethyl sulphide during summer in the North Sea with an examination of key processes via a modeling approach[J]. Deep Sea Research Part Ⅱ: Topical Studies in Oceanography, 2002, 49(15): 3067-3101. DOI:10.1016/S0967-0645(02)00072-3
(  0) 0) |
| [86] |
Strom S, Wolfe G, Holmes J, et al. Chemical defense in the microplankton I: feeding and growth rates of heterotrophic protists on the DMS-producing phytoplankter Emiliania huxleyi[J]. Limnology and Oceanography, 2003, 48: 217-229. DOI:10.4319/lo.2003.48.1.0217
(  0) 0) |
2. Laboratory for Marine Ecology and Environmental Science, Pilot National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266237, China;
3. College of Food Science and Engineering, Qingdao Agricultural University, Qingdao 266009, China;
4. Water Resources Bureau of the Upper Yangtze River, Bureau of Hydrology of the Yangtze River Water Resources Commission, Chongqing 404002, China
 2021, Vol. 51
2021, Vol. 51