随着海洋石油资源的大量开发利用,海上原油开采及运输过程中造成的泄漏问题愈发严重,对周边海洋环境造成了极大损害[1]。目前,石油类污染物已成为我国近海的第二大污染物[2]。石油类物质进入海洋后会形成漂浮油膜、溶解或分散乳化态和凝聚态残余物三种形式。漂浮油膜极不稳定,会受到环境因素、动力因素、油的数量以及油的性质等很多因素的影响而快速分解消失[3]。凝聚态残余物质不会对海洋生物产生明显的影响[4]。溶解或分散于水体的石油组分主要含有烷烃类、芳香烃类、酚类化合物及金属离子等多种复杂成分[5],对海洋生物产生直接危害,其组分性质及分散程度决定毒性的程度[6-7],通常会使生物发生组织改变,引起代谢异常的现象,从而进一步影响到物种的繁殖、群落结构,对整个生态系统产生影响。石油类水溶性组分还可以通过藻类、甲壳类和鱼类组成的食物链向人体转移,可能会导致生物发生可遗传的基因突变[8]。柴油是常用的石油类制品,广泛应用于轮船、货车和铁路机车等大型运输工具中,其水溶性组分中包含低分子量烷烃和多环芳烃(PAHs)、酚类、重金属等成分,是石油烃污染的主要形态。这些污染物能够通过船舱排污、城市径流以及海上船舶运输事故发生等途径进入到海洋环境中,对海洋生物产生影响。
海藻作为海洋生态系统中的初级生产者,对整个海洋生态系统的能量流动和物质循环都具有重要作用。大量研究表明,不同浓度的石油烃会通过影响色素含量、Rubisico酶活性、抗氧化酶活性等重要因子而对藻类的生长产生影响[9-12],由其毒性所产生的活性氧自由基会刺激海藻体内抗氧化系统启动生理应答[13-15],长期的石油烃污染还会使海洋藻类群落的多样性、均匀度以及优势种等发生变化[16-19]。
鼠尾藻(Sargassum thunbergii)是一种广泛分布于北太平洋潮间带的大型藻类,其对光照、温度、盐度等环境因子的适应性很强[20],是中国北方沿海潮间带生态系统中的重要组成部分,为很多潮间带动物提供了栖息、繁殖的场所。鼠尾藻具有较强的营养盐吸收能力和较强的重金属耐受能力[21-22],能够净化富营养水体,具有重要的生态价值。孔石莼(Ulva pertusa)主要分布在中、低潮区及大干潮线附近的岩礁,叶片膜状,仅由两层细胞构成。孔石莼对环境的敏感性较高,具有较强的抗逆境胁迫能力[23],在修复和保护海洋生态系统中也发挥着重要的作用,可以作为海洋环境监测和评价的一种新手段[24-25]。
本研究以鼠尾藻和孔石莼这两种处于相同生态位但具有不同形态结构的潮间带海藻为研究对象,探讨其生长、光合作用、呼吸作用和生化组分对不同浓度柴油水溶性组分的反应规律,以期探明石油烃类对大型海藻生长、生存的影响和藻体内部的生理应答机制,并为石油烃污染水域生物修复物种筛选提供科学依据。
1 材料与方法 1.1 实验材料 1.1.1 柴油水溶性组分母液制备柴油样品为在中国石化加油站购买的0#柴油,将过滤海水和0#柴油按照9∶1的比例混合,密封、避光、振荡24 h后转移到分液漏斗中静置3 h,取下层水相,即得0#柴油水溶性组分母液。将母液抽滤除菌后置于4 ℃环境中避光密封保存。参照国标法测定母液浓度为85.990 mg/L。
1.1.2 样品采集鼠尾藻、孔石莼采集自青岛太平角潮间带,置于低温避光容器中运回实验室。样品用海水清洗去除沉积物、附生植物、小型附生动物等。用手术刀切取鼠尾藻尖端2~3 cm,将藻段放在含1/4 PESI培养基的锥形瓶中,置于光照培养箱中暂养;用1 cm孔径打孔器打孔获得孔石莼藻片,将藻片放在含f/2培养基的锥形瓶中,置于光照培养箱中暂养。暂养条件为:温度13 ℃、光照强度90 μmol·m-2·s-1、光暗周期12L∶12D。连续充气暂养3 d。
1.2 实验方法 1.2.1 相对生长率测定分别选取暂养后健康的两种藻体进行实验,培养密度为1 g/L。将灭菌过滤海水和0#柴油水溶性组分母液按一定比例混合,得到5个不同浓度的处理组,量级及其中柴油水溶性组分浓度分别为0(0 mg/L)、10(8.599 mg/L)、30(25.770 mg/L)、50(41.285 mg/L)和100(85.990 mg/L),每组3个重复。光照培养箱设置条件与暂养相同。实验周期为96 h,分别于24、48、72和96 h收集样品,用吸水纸分别吸干藻体表面多余水分后称量鲜质量,计算相对生长速率(Relative growth rate, RGR)。计算公式如下:
| $R_{\mathrm{RGR}}=\ln \left(W_t / W_0\right) \times 100 \% / t$ |
式中:W0为初始藻体鲜质量;Wt为处理t小时后的藻体鲜质量;t为处理时间,单位为h。
1.2.2 析氧速率的测定分别于培养24、48、72和96 h后,随机挑选藻体置于污水瓶(330 mL)中,利用光纤测氧仪(Manual FireSting O2Ⅱ)分别测定在光照和黑暗条件下单位时间(h)每克藻体(鲜质量)所产生和消耗氧气的含量(μmol),以此来计算净光合速率和呼吸速率。每个处理测定3个生物学重复。
1.2.3 生化组分指标的测定1.2.1中的藻体称重后投入液氮中速冻,并转移至超低温冰箱中,用于生化组分指标的测定。鼠尾藻的叶绿素a含量测定参照Seely的方法进行[26],孔石莼叶绿素a含量的测定参照Alan等的方法进行[27];丙二醛(MDA)、超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)、总抗氧化能力(T-AOC)含量的测定均使用南京建成生物工程研究所的试剂盒进行测定,具体步骤按照试剂盒提供的方法进行。
1.3 数据分析通过Excel进行原始数据处理及绘图,SPSS 26.0进行时间与浓度组分的双因素方差分析,对数据进行正态分布和方差齐性检验,使用邓肯多重比较法(Duncan’s multiple range test)比较各组之间的差异,以P<0.05表示显著性差异。
2 结果与分析 2.1 柴油水溶性组分对鼠尾藻和孔石莼生长的影响柴油水溶性组分对鼠尾藻和孔石莼生长的影响如图 1所示。从图 1(A)可以看出,每个浓度处理组自身的鼠尾藻RGR在整个培养周期无显著差异。在96 h时,100量级处理组的鼠尾藻RGR要显著低于30和50量级处理组(P<0.05),所有处理组在整个培养周期未出现负增长。从图 1(B)可以看出,低浓度处理组(10、30量级)的孔石莼RGR在整个培养周期无显著差异,而高浓度处理组(50、100量级)在72 h后显著降低(P<0.05),且均出现负增长。
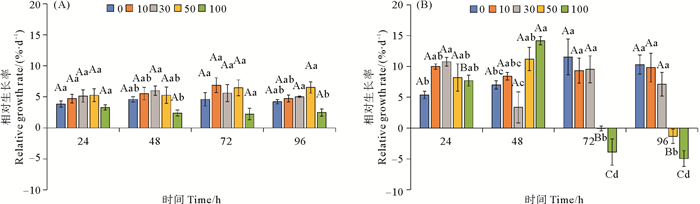
|
(图中大写字母不同表示不同时间相同处理组之间差异显著(P<0.05),小写字母不同表示相同时间不同处理组之间差异显著(P<0.05)。Capital letters indicate statistical difference (P < 0.05) in the same experimental treatments at different times, Lowercase letters indicate statistical difference (P < 0.05) among different experimental treatments at the same time.) 图 1 不同浓度柴油水溶性组分对鼠尾藻(A)和孔石莼(B)相对生长率(鲜质量)的影响 Fig. 1 Effect of different concentrations of diesel water accommodated fraction on relative growth rate of fresh weight in Sargassum thunbergii (A) and Ulva pertusa (B) |
柴油水溶性组分对鼠尾藻和孔石莼净光合速率的影响如图 2所示。从图 2(A)可以看出,每个浓度处理组自身的鼠尾藻净光合速率在整个培养周期无显著差异。在48 h时,100量级处理组的鼠尾藻净光合速率要显著低于其他浓度处理组(P<0.05);在96 h时,10量级处理组的鼠尾藻净光合速率要显著高于其他浓度处理组(P<0.05)。从图 2(B)可以看出,30量级处理组的孔石莼净光合速率在96 h要显著高于48和72 h(P<0.05),50量级处理组的孔石莼净光合速率在72 h要显著高于48和96 h。在96 h时,高浓度处理组(50、100量级)的孔石莼净光合速率要显著低于其他浓度处理组(P<0.05)。
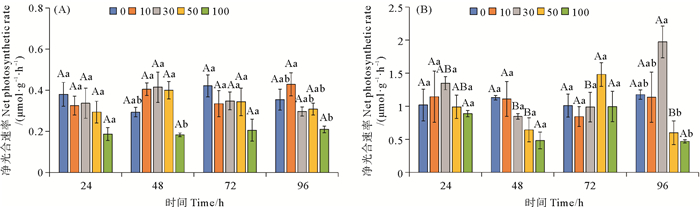
|
(图中大写字母不同表示不同时间相同处理组之间差异显著(P<0.05),小写字母不同表示相同时间不同处理组之间差异显著(P<0.05)。Capital letters indicate statistical difference (P < 0.05) in the same experimental treatments at different times, Lowercase letters indicate statistical difference (P < 0.05) among different experimental treatments at the same time.) 图 2 不同浓度柴油水溶性组分对鼠尾藻(A)和孔石莼(B)净光合速率的影响 Fig. 2 Effect of different concentrations of diesel water accommodated fraction on net photosynthetic rate in Sargassum thunbergii (A) and Ulva pertusa (B) |
柴油水溶性组分对鼠尾藻和孔石莼呼吸速率的影响如图 3所示。从图 3(A)可以看出,每个浓度处理组自身的鼠尾藻呼吸速率在72 h后显著增高(P<0.05)。在24、48和72 h时,100量级处理组的鼠尾藻呼吸速率要显著高于其他处理组(P<0.05);在96 h时,各浓度处理组的鼠尾藻呼吸速率无显著差异。从图 3(B)可以看出,100量级处理组的孔石莼呼吸速率在72 h要显著低于24和48 h(P<0.05),其他浓度处理组的孔石莼呼吸速率在整个培养周期无显著变化;在48 h时,30量级处理组的孔石莼呼吸速率要显著高于对照组(P<0.05),72 h时,100量级处理组的孔石莼要显著低于30和50量级处理组(P<0.05),其他时间各浓度处理组的孔石莼呼吸速率无明显变化。
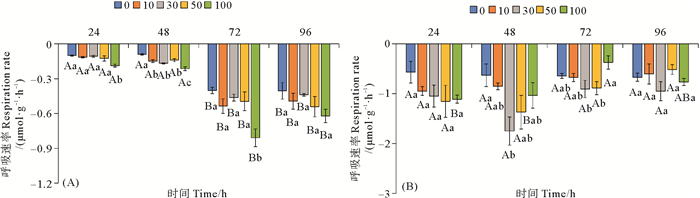
|
(图中大写字母不同表示不同时间相同处理组之间差异显著(P<0.05),小写字母不同表示相同时间不同处理组之间差异显著(P<0.05)。Capital letters indicate statistical difference (P < 0.05) in the same experimental treatments at different times, Lowercase letters indicate statistical difference (P < 0.05) among different experimental treatments at the same time.) 图 3 不同浓度柴油水溶性组分对鼠尾藻(A)和孔石莼(B)呼吸速率的影响 Fig. 3 Effect of different concentrations of diesel water accommodated fraction on respiration rate in Sargassum thunbergii (A) and Ulva pertusa (B) |
柴油水溶性组分对鼠尾藻和孔石莼叶绿素a含量的影响如图 4所示。从图 4(A)可以看出,每个浓度处理组自身的鼠尾藻叶绿素a含量在整个培养周期无显著差异。在48 h后,高浓度处理组(50、100量级)的鼠尾藻叶绿素a含量显著降低(P<0.05)。从图 4(B)可以看出,高浓度处理组的孔石莼叶绿素a含量在96 h时显著降低。在24 h时,10和100量级处理组的孔石莼叶绿素a含量显著低于对照组,而30量级处理组的孔石莼叶绿素a含量显著高于对照组(P<0.05);在48和72 h时,各浓度处理组的孔石莼叶绿素a含量与对照组相比无显著差异;在96 h时,高浓度处理组的孔石莼叶绿素a含量与其他浓度处理组相比显著降低(P<0.05)。
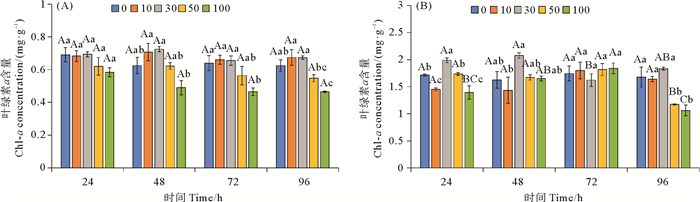
|
(图中大写字母不同表示不同时间相同处理组之间差异显著(P<0.05),小写字母不同表示相同时间不同处理组之间差异显著(P<0.05)。Capital letters indicate statistical difference (P < 0.05) in the same experimental treatments at different times, Lowercase letters indicate statistical difference (P < 0.05) among different experimental treatments at the same time.) 图 4 不同浓度柴油水溶性组分对鼠尾藻(A)和孔石莼(B)叶绿素a含量的影响 Fig. 4 Effect of different concentrations of diesel water accommodated fraction on the content of chlorophyll a in Sargassum thunbergii (A) and Ulva pertusa (B) |
柴油水溶性组分对鼠尾藻和孔石莼MDA的影响如图 5所示。从图 5(A)可以看出,10量级和30量级处理组的鼠尾藻MDA含量在48 h要显著低于其他时间(P<0.05),而高浓度处理组的鼠尾藻MDA含量在72和96 h要显著高于24和48 h(P<0.05)。在72 h后,100量级处理组的鼠尾藻MDA含量要显著高于对照组(P<0.05)。从图 5(B)可以看出,每个浓度处理组自身的孔石莼MDA含量在整个培养周期无显著变化。在24和96 h时,100量级处理组的孔石莼MDA含量要显著高于对照组(P<0.05)。
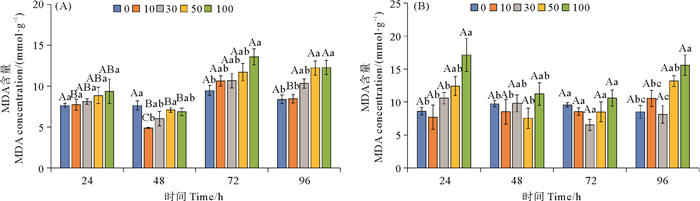
|
(图中大写字母不同表示不同时间相同处理组之间差异显著(P<0.05),小写字母不同表示相同时间不同处理组之间差异显著(P<0.05)。Capital letters indicate statistical difference (P < 0.05) in the same experimental treatments at different times, Lowercase letters indicate statistical difference (P < 0.05) among different experimental treatments at the same time.) 图 5 不同浓度柴油水溶性组分对鼠尾藻(A)和孔石莼(B)丙二醛含量的影响 Fig. 5 Effect of different concentrations of diesel water accommodated fraction on the content of MDA in Sargassum thunbergii (A) and Ulva pertusa (B) |
柴油水溶性组分对鼠尾藻和孔石莼SOD活性的影响如图 6所示。从图 6(A)可以看出,除对照组外,每个浓度处理组自身的鼠尾藻SOD活性在96 h要显著高于其他时间(P<0.05)。在24和48 h时,各浓度处理组的鼠尾藻SOD活性要显著低于对照组(P<0.05);而在96 h时,100量级处理组的鼠尾藻SOD活性要显著高于其他处理组(P<0.05)。从图 6(B)可以看出,10和30量级处理组的孔石莼SOD活性在48 h要显著高于其他时间(P<0.05)。在24 h时,各浓度处理组的孔石莼SOD活性要显著高于对照组(P<0.05);在48 h时,除100量级处理组外,其他浓度处理组孔石莼SOD活性要显著高于对照组(P<0.05);在72 h时,10量级处理组孔石莼SOD活性要显著低于其他浓度处理组(P<0.05);在96 h时,10量级处理组的孔石莼SOD活性要显著高于其他浓度处理组(P<0.05)。
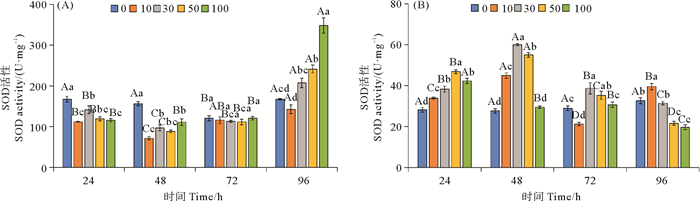
|
(图中大写字母不同表示不同时间相同处理组之间差异显著(P<0.05),小写字母不同表示相同时间不同处理组之间差异显著(P<0.05)。Capital letters indicate statistical difference (P < 0.05) in the same experimental treatments at different times, Lowercase letters indicate statistical difference (P < 0.05) among different experimental treatments at the same time.) 图 6 不同浓度柴油水溶性组分对鼠尾藻(A)和孔石莼(B)超氧化物歧化酶活性的影响 Fig. 6 Effect of different concentrations of diesel water accommodated fraction on SOD activity in Sargassum thunbergii (A) and Ulva pertusa (B) |
柴油水溶性组分对鼠尾藻和孔石莼CAT活性的影响如图 7所示。从图 7(A)可以看出,10量级处理组的鼠尾藻CAT活性在48 h要显著高于其他时间(P<0.05),其他各浓度处理组的鼠尾藻CAT活性在整个培养周期无显著变化。每个浓度处理组自身的鼠尾藻CAT活性在各时间无显著变化。从图 7(B)可以看出,10和30量级处理组的孔石莼CAT活性在72 h要显著高于其他时间(P<0.05)。在24和48 h时,30、50和100量级处理组的孔石莼CAT活性要显著低于对照组(P<0.05);在72 h时,10量级处理组的孔石莼CAT活性要显著高于其他浓度处理组(P<0.05),且100量级处理组的孔石莼CAT活性在72和96 h均出现负值。
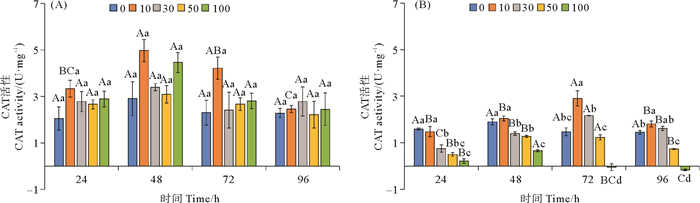
|
(图中大写字母不同表示不同时间相同处理组之间差异显著(P<0.05),小写字母不同表示相同时间不同处理组之间差异显著(P<0.05)。Capital letters indicate statistical difference (P < 0.05) in the same experimental treatments at different times, Lowercase letters indicate statistical difference (P < 0.05) among different experimental treatments at the same time.) 图 7 不同浓度柴油水溶性组分对鼠尾藻(A)和孔石莼(B)过氧化氢酶活性的影响 Fig. 7 Effect of different concentrations of diesel water accommodated fraction on CAT activity in Sargassum thunbergii (A) and Ulva pertusa (B) |
柴油水溶性组分对鼠尾藻和孔石莼POD活性的影响如图 8所示。从图 8(A)可以看出,100量级处理组的鼠尾藻POD活性在24和96 h要显著低于其他时间(P<0.05)。在96 h时,高浓度处理组的鼠尾藻POD活性要显著低于对照组(P<0.05),在其他时间各浓度处理组鼠尾藻POD活性与对照组相比无显著差异。从图 8(B)可以看出,30和50量级处理组的孔石莼POD活性在48 h要显著高于其他时间(P<0.05)。在24 h时,各浓度处理组的孔石莼POD活性要显著低于对照组(P<0.05);在48 h时,30和50量级处理组的孔石莼POD活性要显著高于其他浓度处理组(P<0.05);在72 h时,30量级处理组的孔石莼POD活性要显著高于其他浓度处理组(P<0.05);在96 h时,各浓度处理组间的孔石莼POD活性无显著差异。
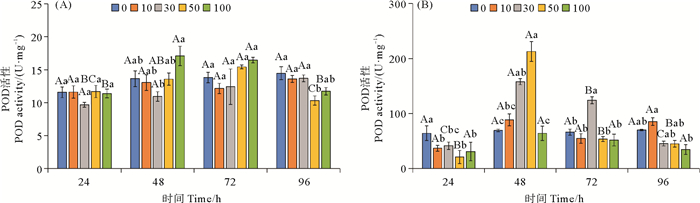
|
(图中大写字母不同表示不同时间相同处理组之间差异显著(P<0.05),小写字母不同表示相同时间不同处理组之间差异显著(P<0.05)。Capital letters indicate statistical difference (P < 0.05) in the same experimental treatments at different times, Lowercase letters indicate statistical difference (P < 0.05) among different experimental treatments at the same time.) 图 8 不同浓度柴油水溶性组分对鼠尾藻(A)和孔石莼(B)过氧化物酶活性的影响 Fig. 8 Effect of different concentrations of diesel water accommodated fraction on POD activity in Sargassum thunbergii (A) and Ulva pertusa (B) |
柴油水溶性组分对鼠尾藻和孔石莼总抗氧化能力的影响如图 9所示。从图 9(A)可以看出,30、50及100量级处理组的鼠尾藻总抗氧化能力在96 h要显著高于其他时间(P<0.05)。在96 h时,鼠尾藻的总抗氧化能力随着柴油水溶性组分浓度的增大而呈升高趋势(P<0.05),100量级处理组的鼠尾藻总抗氧化能力显著高于对照组(P<0.05),而其他时间各浓度处理组的鼠尾藻总抗氧化能力无显著变化。从图 9(B)可以看出,30量级处理组的孔石莼总抗氧化能力在48和72 h时要显著高于24和96 h(P<0.05),50量级处理组的孔石莼总抗氧化能力在48 h要显著高于其他时间(P<0.05)。在48 h时,50量级处理组的孔石莼总抗氧化能力要显著高于对照组(P<0.05),在96 h时,100量级处理组的孔石莼总抗氧化能力要显著低于对照组(P<0.05)。
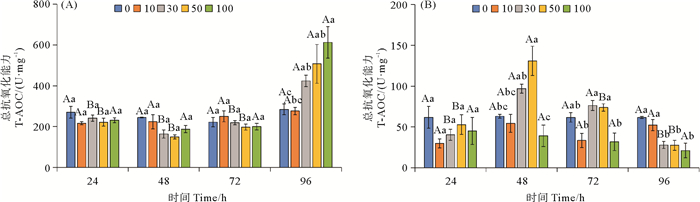
|
(图中大写字母不同表示不同时间相同处理组之间差异显著(P<0.05),小写字母不同表示相同时间不同处理组之间差异显著(P<0.05)。Capital letters indicate statistical difference (P < 0.05) in the same experimental treatments at different times, Lowercase letters indicate statistical difference (P < 0.05) among different experimental treatments at the same time.) 图 9 不同浓度柴油水溶性组分对鼠尾藻(A)和孔石莼(B)总抗氧化能力的影响 Fig. 9 Effect of different concentrations of diesel water accommodated fraction on T-AOC in Sargassum thunbergii (A) and Ulva pertusa (B) |
从相对生长率的结果来看,两种海藻对柴油水溶性组分的耐受能力不同。96 h内,孔石莼能够在0~30量级处理组中生存,而鼠尾藻能够在0~100量级处理组中生存。孔石莼与鼠尾藻同属于潮间带物种,具有类似的栖息环境条件,但是其耐受范围低于鼠尾藻,这可能与藻体的形态结构有关。鼠尾藻和孔石莼均为多细胞藻体,但是孔石莼的藻体仅由两层细胞构成,这样的细胞结构可能加快了有毒物质进入藻体的过程,进而导致了相对较差的适应性。此外,实验结果还表现出对鼠尾藻和孔石莼相对生长率的低促高抑现象。鼠尾藻在10、30和50量级处理组中相对生长率均高于对照组,100量级处理组出现抑制现象。24 h内各处理组对孔石莼生长均有促进作用,在处理72 h后50和100量级处理组的相对生长率开始显著下降,这可能是因为前期柴油水溶性组分被藻类吸收利用,为生长提供所需要的碳源和氮源,而长时间高浓度的柴油水溶性组分处理超出了藻体自身的防御能力,对内部细胞结构造成了不可逆的损伤,从而对生长产生抑制。王修林等认为,在低于0.5 mg/L的石油烃处理组中,旋链角毛藻(Chaetoceros curvisetus)与的生长受到显著的促进[28],王悠在研究多环芳烃蒽对球等鞭金藻(Isochrysis galbana)和中肋骨条藻(Skeletonema costatum)的影响中也发现类似的低促高抑现象[14]。赵红梅等的实验证明海带(Laminaria japonica)能够吸收和降解多环芳烃,在藻体内形成二硫二巯基物质,对机体进行解毒效应[29],但是目前关于藻类对石油烃类物质的吸收和代谢的机理并不完全透彻,该理论的证实还需要进一步的研究。
鼠尾藻和孔石莼的叶绿素a含量与相对生长率的变化趋势大致相同,高浓度的柴油水溶性组分会导致其叶绿素a含量下降,而低浓度柴油水溶性组分(10和30量级处理组)的作用,则会增加其细胞内叶绿素a的含量。这一结果与田继远发现的小新月菱形藻(Nitzschia closterium)在受到蒽胁迫时叶绿素a含量会下降[30]、徐梦发现的低浓度多环芳烃(小于等于10 μg/L)会增加裙带菜幼孢子体细胞内叶绿素的含量[11]的结果相一致。造成光合色素含量的下降的原因可能为以下两种情况:(1)柴油水溶性组分降低了藻体营养盐吸收速率,导致体内营养成分供应的不足。Reilley等认为陆生植物叶片色素含量下降的原因是由于多环芳烃类物质堵塞了植物根系上具有吸收能力的细胞,吸收养分和水分的能力受到破坏,造成色素合成能力下降[31]。(2)柴油水溶性组分透膜进入细胞后会直接对叶绿体结构造成损伤。在研究柴油对钩沙菜(Hypnea musciformis)的影响时通过透射扫描电镜以及荧光显微镜观察到叶绿体结构受损[32]。但本实验的具体影响因素有哪些还需要进一步研究。
本研究中净光合作用速率与色素含量、相对生长速率相对应,鼠尾藻在48 h时出现低促高抑的现象。陈莲花研究表面活性剂对铜绿微囊藻(Microcystis aeruginosa)光合作用的影响时,表明20 mg/L浓度的AEO9可以对铜绿微囊藻的光合作用产生明显的促进[33]。王珊研究三种石油烃种类对孔石莼光合速率影响的结果表明,在不同石油烃浓度下,孔石莼的光合速率表现出先增加后下降的趋势[10]。这些研究进一步验证了低浓度污染物可以刺激机体的自我防御系统,通过加快光合速率和呼吸速率的方式为机体制造有机物,加快能量供应。孔石莼在24 h表现出低浓度促进,在48 h表现出50和100量级处理组净光合作用速率下降,但随时间的延长有一定的恢复,这表明柴油水溶性组分在48 h内对孔石莼光合作用造成的损伤有可能是可逆转的。倪妍等在研究硝磺草酮对微囊藻(Microcystis sp.)细胞造成的影响时也出现类似的恢复现象,在硝磺草酮浓度为5 mg/L时,微囊藻细胞最大光化学量子产量在最初受到的损伤会随着时间的延长出现恢复现象,10 mg/L处理组的藻细胞则没有出现类似的现象[34]。本研究中高浓度处理组中孔石莼的净光合速率在96 h又出现了的显著下降,这表明高浓度的柴油水溶性组分作用较长时间所带来的胁迫加重了藻体的损伤程度。柴油水溶性组分除了对两种藻类净光合速率产生影响外,也对黑暗呼吸速率产生影响。本研究表明柴油水溶性组分的处理会促进藻体的呼吸速率。研究表明,当植物受到胁迫后,呼吸速率会增加,这可能与藻类自身的防御系统有关,当藻体遇到不利环境时,为了保证更好的生长,需要更多的能量来启用各种代谢活动,因此会导致呼吸速率升高。
在受到有机污染时,由于细胞膜具有磷脂双分子层结构,石油烃中的污染物质能够迅速地进入细胞,首先对植物体的第一道防线细胞膜造成损伤,发生膜脂过氧化作用,其产物丙二醛含量越高说明植物细胞膜受到的损伤程度越大[35]。张木清在研究低温影响甘蔗叶片的活性氧变化时发现丙二醛的含量与膜脂过氧化程度呈正相关[36]。吕娓娓研究发现条斑紫菜(Porphyra yezoensis)丝状体受到铜、镉胁迫时,铜、镉的浓度越高,MDA升高的幅度越大[37]。除了有机污染物胁迫,侯和胜等在进行高温对条斑紫菜的胁迫实验时也出现了相同的结果,温度越高,MDA的含量越高[38]。蔡恒江在研究UV-B辐射对孔石莼的影响时发现孔石莼在UV-B辐射处理第12天时MDA含量达到最高值,相对应的特定生长率显著低于对照组,说明MDA含量上升可能会抑制机体的生长[39]。同样地,朱琳在研究UV-B辐射对龙须菜(Gracilaria lemaneiformis)的影响时也发现辐射强度的增加会导致MDA含量升高,并引起生长率下降[40]。本实验中,高浓度的柴油水溶性组分均会引起两种藻类的丙二醛含量上升,表明高浓度的柴油水溶性组分对其长时间的处理加剧了藻类细胞膜脂质过氧化的程度,对细胞结构造成了损伤。在96 h高浓度组中藻体MDA含量大幅升高而相对生长率却下降,这表明细胞膜脂质过氧化程度过高会抑制藻体的生长。
鼠尾藻在应对柴油水溶性组分处理时,藻体中的SOD活性在96 h显著上升,CAT则在48 h显著上升,POD活性则变化不显著,总抗氧化能力在96 h时达到最高值。总抗氧化能力的变化能够调节MDA的含量,保证藻体的正常生长。孔石莼在应对柴油水溶性组分的逆境环境时,也会激活体内的抗氧化防御系统,但是高浓度的长期污染会造成CAT酶的失活,总抗氧化能力下降,与之对应的相对生长率也出现最低值。这些结果表明,抗氧化酶能够调节藻体的损伤,但是超过某个阈值后,调节能力便会降低,同时出现相对生长率下降的现象。王晓艳在研究温度对裙带菜(Undaria pinnatifida)幼孢子体的影响时也发现了类似的现象,裙带菜幼孢子体中的抗氧化酶在28 ℃的高温处理下,活性均处于较低水平[41]。侯和胜在研究条斑紫菜丝状体对高温的响应时,也发现适宜的高温刺激可以促进抗氧化酶活性,但是温度在28~30 ℃时抗氧化酶活性都处于较低水平[38]。赵宇瑛在研究机械损伤对黄瓜(Cucumis sativus)抗氧化系统的影响时也发现随着损伤时间的延长,抗氧化酶呈先升高后下降的趋势,与此相对应的是活性氧含量先升高后降低随后又升高的过程[42]。本研究中还发现不同的抗氧化酶对胁迫的响应程度不同。张莹等在研究硼胁迫对龙须菜生理的影响时表明体内的SOD与对照组无显著差异,CAT在受到影响后则会显著下降[43],崔相东研究发现裙带菜受到机械损伤后,三种抗氧化酶对机械损伤胁迫都具有强烈的反应[44],徐群在研究温度对鼠尾藻的影响时发现当温度为35 ℃时,CAT活性会显著上升,SOD活性会显著下降[45]。
鼠尾藻和孔石莼虽然对柴油水溶性组分表现出不同的耐受能力,但两种藻的生长和生化组分的变化趋势相同。低浓度的柴油水溶性组分能够被两种藻吸收利用,促进了藻体的生长、增加了叶绿素含量、光合作用速率升高。高浓度的柴油水溶性组分能够对藻体产生不可逆转的伤害,导致生长收到抑制、叶绿素含量减少、光合作用速率降低。而低浓度和高浓度的柴油水溶性组分均会造成两种藻的呼吸速率上升,以此抵御柴油水溶性组分所带来的影响。两种藻在应对柴油水溶性组分处理时所表现出的总抗氧化能力不同,鼠尾藻的总抗氧化能力随着柴油水溶性组分处理时间的增加而呈现增加的趋势,而孔石莼的抗氧化能力随着柴油水溶性组分处理时间的增加呈现先增加后降低的趋势,说明抗氧化酶只能在有限范围内调节柴油水溶性组分对藻体造成的损伤。
4 结语本文研究结果表明低浓度柴油水溶性组分对两种大型海藻的生长具有促进作用,高浓度则会产生抑制作用。藻体的抗氧化酶对柴油水溶性组分胁迫的响应也表现出了与浓度和作用时间的相关性。鼠尾藻与孔石莼均为潮间带大型海藻,所处生态位接近,鼠尾藻对高浓度的污染环境耐受性较强,适宜作为工具藻在污染早期开展生物修复,而孔石莼在低浓度条件下表现出更高的生长速度,可在修复后期与鼠尾藻协同应用。目前,在利用大型海藻修复石油烃污染的过程中还有许多未解释的问题,如大型海藻对石油烃的吸收方式,大型海藻对石油烃类物质的代谢通路,大型海藻对石油烃类物质基因水平上的响应等问题,这些将是今后利用大型藻类进行石油烃污染修复需要解决的问题。
| [1] |
Yang B L, Xiong D Q, Jiang L L, et al. The chronic toxic effect of water-accommodated fractions of 0# diesel oil on splox gene of sea urchin[J]. Applied Mechanics and Materials, 2012, 256-259: 1998-2003. DOI:10.4028/www.scientific.net/AMM.256-259.1998 (  0) 0) |
| [2] |
张军, 王修林, 韩秀荣, 等. 海洋浮游植物对0号柴油水溶组分的生物富集动力学模型[J]. 环境科学, 2004(1): 14-19. Zhang J, Wang X L, Han X R, et al. Kinetic model for bioconcentration of No.0 diesel water-accommodated fraction by phytoplankton[J]. Environmental Science, 2004(1): 14-19. (  0) 0) |
| [3] |
马帅. 原油和4种溢油分散剂对青岛大扁藻和小新月菱形藻毒性效应的研究[D]. 青岛: 中国海洋大学, 2013. Ma S. Toxicity of Crude Oil and Four Kinds of Dispersants to P. helgolandica and N. closterium[D]. Qingdao: Ocean University of China, 2013. (  0) 0) |
| [4] |
袁萍. 石油烃对四种微藻生长与生理生化特征及相关基因表达的影响[D]. 烟台: 烟台大学, 2014. Yuan P. Effects of Petroleum Hydrocarbon on Growth, Biochemical Characteristics and the Related Gene Expressions of Four Microalgae Species[D]. Yantai: Yantai University, 2014. (  0) 0) |
| [5] |
Zhang Y B, Tang X X. Effect of oil water-accommodated fraction on growth and chlorophyll-a of marine microalgae[J]. Advanced Materials Research, 2013, 726-731: 94-97. DOI:10.4028/www.scientific.net/AMR.726-731.94 (  0) 0) |
| [6] |
张艳林. 矿物油三维荧光谱识别技术及研究[D]. 秦皇岛: 燕山大学, 2010. Zhang Y L. Study of Oil Identification Technique Based on the Three-dimensional Fluorescence Spectra[D]. Qinhuangdao: Yanshan University, 2010. (  0) 0) |
| [7] |
吕福荣. 石油烃污染对马粪海胆的毒性效应及分子机制研究[D]. 大连: 大连海事大学, 2009. Lv F R. Study on Toxic Effect and Molecular Mechanism of Petroleum Hydrocarbon Pollution to Hemicentrotus pulcherrimus[D]. Dalian: Dalian Maritime University, 2009. (  0) 0) |
| [8] |
付怀洲. 原油及0#柴油对海洋微藻的急性毒性及遗传毒性研究[D]. 青岛: 中国海洋大学, 2012. Fu H Z. Acute Toxicity and Genetic Toxicity of Crude Oil and No. 0 Diesel Oil on Marine Microalgae[D]. Qingdao: Ocean University of China, 2012. (  0) 0) |
| [9] |
Stepaniyan O V. Effects of crude oil on major functional characteristics of macroalga of the barents sea[J]. Russian Journal of Marine Biology, 2008, 34(2): 131-134. DOI:10.1134/S1063074008020077 (  0) 0) |
| [10] |
王珊, 刘瑀, 张松. 石油烃对孔石莼生长及光合作用的影响[J]. 大连海洋大学学报, 2011, 26(5): 432-436. Wang S, Liu Y, Zhang S. Effects of petroleum hydrocarbon on growth and photosynthesis in sea weed macroalga Ulva pertusa[J]. Journal of Dalian Ocean University, 2011, 26(5): 432-436. DOI:10.3969/j.issn.1000-9957.2011.05.010 (  0) 0) |
| [11] |
徐梦. 多环芳烃(蒽、菲、芴)对裙带菜(Undaria pinnatifida)幼孢子体的毒性效应[D]. 大连: 辽宁师范大学, 2013. Xu M. The Toxic Effects of Polycyclic Aromatic Hydrocarbons (Anthracene, Phenanthrene, Fluorene) on Young Sporophytes of Undaria pinnatifida[D]. Dalian: Liaoning Normal University, 2013. (  0) 0) |
| [12] |
刘星辰, 鞠青. 原油水溶性组分对2种微藻的毒性效应及微藻对石油烃的降解研究初探[J]. 浙江海洋大学学报(自然科学版), 2018, 37(4): 362-368. Liu X C, Ju Q. The toxicity of water-accommodated fraction on two marine microalage and the degradation of water-accommodated fraction by microalage[J]. Journal of Zhejiang Ocean University (Natural Science), 2018, 37(4): 362-368. DOI:10.3969/j.issn.1008-830X.2018.04.013 (  0) 0) |
| [13] |
Ramadass K, Megharaj M, Venkateswarlu K, et al. Toxicity of diesel water accommodated fraction toward microalgae, Pseudokirchneriella subcapitata and Chlorella sp. MM3[J]. Ecotoxicology and Environmental Safety, 2017, 142: 538-543. DOI:10.1016/j.ecoenv.2017.04.052 (  0) 0) |
| [14] |
王悠, 唐学玺, 李永祺, 等. 低浓度蒽对两种海洋微藻生长的兴奋效应[J]. 应用生态学报, 2002, 13(3): 343-346. Wang Y, Tang X X, Li Y Q, et al. Stimulation effect of anthracene on marine microalage growth[J]. Chinese Journal of Applied Ecology, 2002, 13(3): 343-346. DOI:10.3321/j.issn:1001-9332.2002.03.021 (  0) 0) |
| [15] |
Abrahamsson K, Choo K S, Pedersen M, et al. Effects of temperature on the production of hydrogen peroxide and volatile halocarbons by brackish-water algae[J]. Phytochemistry, 2003, 64(3): 725-734. DOI:10.1016/S0031-9422(03)00419-9 (  0) 0) |
| [16] |
El-Sheekh M M, El-Naggar A H, Osman M E H, et al. Comparative studies on the green algae Chlorella homosphaera and Chlorella vulgaris with respect to oil pollution in the river Nile[J]. Water Air & Soil Pollution, 2000, 124(1-2): 187-204. (  0) 0) |
| [17] |
Gamila H A, Ibrahim M B M. Algal bioassay for evaluating the role of algae in bioremediation of crude oil: Ⅰ-Isolated Strains[J]. Bulletin of Environmental Contamination and Toxicology, 2004, 73(5): 883-889. DOI:10.1007/s00128-004-0509-7 (  0) 0) |
| [18] |
Hjorth M, Henriksen P, Forbes V, et al. Functional and structural responses of marine plankton food web to pyrene contamination[J]. Marine Ecology Progress, 2007, 338(12): 21-31. (  0) 0) |
| [19] |
黄逸君, 江志兵, 曾江宁, 等. 石油烃污染对海洋浮游植物群落的短期毒性效应[J]. 植物生态学报, 2010, 34(9): 1095-1106. Huang Y J, Jiang Z B, Zeng J N, et al. Short-term toxic effects of crude oil pollution on marine phytoplankton community[J]. Chinese Journal of Plant Ecology, 2010, 34(9): 1095-1106. DOI:10.3773/j.issn.1005-264x.2010.09.010 (  0) 0) |
| [20] |
王志芳, 张全胜, 潘金华. 烟台芦洋湾鼠尾藻种群生物量结构的季节变化[J]. 中国水产科学, 2008, 15(6): 992-998. Wang Z F, Zhang Q S, Pan J H. Seasonal variation of population structure in Sargassum thunbergii[J]. Journal of Fishery Science of China, 2008, 15(6): 992-998. (  0) 0) |
| [21] |
包杰, 田相利, 董双林, 等. 温度、盐度和光照强度对鼠尾藻氮、磷吸收的影响[J]. 中国水产科学, 2008(2): 293-300. Bao J, Tian X L, Dong S L, et al. Effects of temperature, salinity and light intensity on nitrogen and phosphorus uptake by Sargassum thunbergii[J]. Journal of Fishery Science of China, 2008(2): 293-300. DOI:10.3321/j.issn:1005-8737.2008.02.013 (  0) 0) |
| [22] |
吴海一, 詹冬梅, 刘洪军, 等. 鼠尾藻对重金属锌、镉富集及排放作用的研究[J]. 海洋科学, 2010, 34(1): 69-74. Wu H Y, Zhang D M, Liu H J, et al. Study on accumulation and degradation of heavy metals by the brown alga Sargassum thunbergii[J]. Marine Sciences, 2010, 34(1): 69-74. (  0) 0) |
| [23] |
张忠山, 王晓梅, 刘峰, 等. 石莼属绿藻应答环境胁迫的生理特征与机制研究进展[J]. 海洋环境科学, 2020, 39(3): 473-479. Zhang Z S, Wang X M, Liu F, et al. Analysis of physiology and regulation mechanism of Ulva under stress[J]. Marine Environmental Science, 2020, 39(3): 473-479. (  0) 0) |
| [24] |
刘瑀, 刘宇馨, 米雪娇, 等. 溢油胁迫下孔石莼碳氮稳定同位素的变化[J]. 海洋环境科学, 2020, 39(2): 283-287. Liu Y, Liu Y X, Mi X J, et al. Effect of oil spill stress on carbon and nitrogen stable isotope of Ulva pertusa[J]. Marine Environmental Science, 2020, 39(2): 283-287. (  0) 0) |
| [25] |
高雯欣. 两种多环芳烃对孔石莼的生物毒性及氧化胁迫研究[D]. 哈尔滨: 哈尔滨工业大学, 2010. Gao W X. Biological Toxicity and Oxidative Stress of Two Kinds of Polycyclic Aromatic Hydrocarbons on Ulva pertusa[D]. Harbin: Harbin Institute of Technology, 2010. (  0) 0) |
| [26] |
Seely G R, Duncan M J, Vidaver W E. Preparative and analytical extraction of pigments from brown algae with dimethyl sulfoxide[J]. Marine Biology, 1972, 12(2): 184-188. (  0) 0) |
| [27] |
Alan R W. The spectral determination of chlorophylls a and b, as well as total carotenoids, using various solvents with spectrophotometers of different resolution[J]. Journal of Plant Physiology, 1994, 144(3): 307-313. (  0) 0) |
| [28] |
王修林, 杨茹君, 祝陈坚. 石油烃污染物存在下旋链角毛藻生长的粒度效应初步研究[J]. 中国海洋大学学报(自然科学版), 2004, 34(5): 849-853. Wang X L, Yang R J, Zhu C J. Studies on size effect on Chaetoceros curvisetus in different concentrations of petroleum hydrocarbon[J]. Periodical of Ocean University of China, 2004, 34(5): 849-853. (  0) 0) |
| [29] |
赵红梅. 海带对多环芳烃的吸收及代谢研究[D]. 青岛: 中国科学院研究生院(海洋研究所), 2007. Zhao H M. Uptake and Degradation of Polycyclic Aromatic Hydrocarbons by Brown Seaweed, Laminaria joapnica[D]. Qingdao: Institute of Oceanology, Chinese academy of Sciences, 2007. (  0) 0) |
| [30] |
田继远, 唐学玺, 于娟, 等. 海洋微藻对UV-B辐射的生理生化响应[J]. 海洋科学, 2006, 30(4): 54-58. Tian J Y, Tang X X, Yu J, et al. The physiological and biochemical responses of marine microalgae to UV-B radiation[J]. Marine Sciences, 2006, 30(4): 54-58. (  0) 0) |
| [31] |
Reilley K A, Banks M K, Schwab A P. Dissipation of polycyclic aromatic hydrocarbons in the rhizosphere[J]. Journal of Environmental Quality, 1996, 25(2): 212-219. (  0) 0) |
| [32] |
Ramlov F, Carvalho T J G, Schmidt É C, et al. Metabolic and cellular alterations induced by diesel oil in Hypnea musciformis (Wulfen) J. V. Lamour. (Gigartinales, Rhodophyta)[J]. Journal of Applied Phycology, 2014, 26(4): 1879-1888. (  0) 0) |
| [33] |
陈莲花. 表面活性剂对铜绿微囊藻生长及光合作用的影响[D]. 南昌: 南昌大学, 2008. Chen L H. Effects of Surfactants on the Gowth and Photosynthesis in Microcystis aeruginosa[D]. Nanchang: Nanchang University, 2008. (  0) 0) |
| [34] |
倪妍, 赖劲虎, 陈连水, 等. 除草剂硝磺草酮对四尾栅藻和微囊藻的毒性研究[J]. 江西农业大学学报, 2014, 36(6): 1258-1263. Ni Y, Lai J H, Chen L S, et al. A study of the toxicity of mesotrione to Scenedesmus quadricauda and Microcystis sp.[J]. Acta Agriculturae Universitatis Jiangxiensis, 2014, 36(6): 1258-1263. (  0) 0) |
| [35] |
侯秀富, 郭沛涌, 张华想, 等. 水体悬浮颗粒物对斜生栅藻生理生化及光合活性的影响[J]. 环境科学学报, 2013, 33(5): 1446-1457. Hou X F, Guo P Y, Zhang H X, et al. Effects of water suspended particulate matter on the physiological and photosynthetic activity of Scenedesmus obliquus[J]. Acta Scientiae Circumstantiae, 2013, 33(5): 1446-1457. (  0) 0) |
| [36] |
张木清, 陈如凯, 吕建林, 等. 甘蔗苗期低温胁迫对叶绿素a荧光诱导动力学的影响[J]. 福建农业大学学报, 1999, 28(1): 1-7. Zhang M Q, Chen R K, Lv J L, et al. Effects of low temperature stress on the chlorophyll a fluorescence induction kinetics in the sugarcane[J]. Journal of Fujian Agricultural University, 1999, 28(1): 1-7. (  0) 0) |
| [37] |
吕娓娓, 佟少明, 侯和胜. Cu2+和Cd2+对条斑紫菜丝状体生长和生理的影响[J]. 安徽农学通报, 2008, 14(24): 20-21. Lv W W, Tong S M, Hou H S. Effects of Cu2+ and Cd2+ on growth and physiology of Conchocelis of Porphyra yezoensis[J]. Anhui Agricultural Science Bulletin, 2008, 14(24): 20-21. (  0) 0) |
| [38] |
侯和胜, 何文君, 李洪艳, 等. 高温胁迫对条斑紫菜丝状体的生长和生理影响[J]. 辽宁师范大学学报(自然科学版), 2008, 31(4): 487-490. Hou H S, He W J, Li H Y, et al. Effects of high temperature stress on growth and physiology of conchocelis of Porphyra yezoensis[J]. Journal of Liaoning Normal University (Natural Science Edition), 2008, 31(4): 487-490. (  0) 0) |
| [39] |
蔡恒江, 唐学玺, 张培玉, 等. UV-B辐射对孔石莼生长及其生理生化特征的影响[J]. 科学技术与工程, 2005, 5(5): 283-287. Cai H J, Tang X X, Zhang P Y, et al. Effects of UV-B radiation on the growth, physiological and biochemical characteristics of Ulva pertusa Kjellman[J]. Science Technology and Engineering, 2005, 5(5): 283-287. (  0) 0) |
| [40] |
朱琳. 龙须菜(Gracilariopsis lemaneiformis)生活史不同发育阶段对UV-B辐射的响应特征及机理研究[D]. 青岛: 中国海洋大学, 2014. Zhu L. Response Characteristics and Mechanisms of Life History of Gracilariopsis lemaneiformis to UV-B Radiation[D]. Qingdao: Ocean University of China, 2014. (  0) 0) |
| [41] |
王晓艳. 不同温度和光照强度对裙带菜(Undaria pinnatifida)幼孢子体叶绿素荧光参数和抗氧化系统的影响[D]. 青岛: 中国海洋大学, 2015. Wang X Y. Effects of Temperature and Light Intensity on the Chlorophyll Fluorescence Parameters and Antioxidant System of Undaria pinnatifida Young Sporophyte[D]. Qingdao: Ocean University of China, 2015. (  0) 0) |
| [42] |
赵宇瑛. 黄瓜磷脂酶D和抗氧化系统对采后机械损伤胁迫的响应[D]. 杭州: 浙江大学, 2011. Zhao Y Y. Responses of Phospholipase D and Antioxidant System to Mechanical Wounding in Postharvest Cucumber Fruits[D]. Hangzhou: Zhejiang University, 2011. (  0) 0) |
| [43] |
张莹, 王龙乐, 钟名其, 等. 硼胁迫对龙须菜生长及其生理特征的影响[J]. 南方水产科学, 2014, 10(4): 9-15. Zhang Y, Wang L L, Zhong M Q, et al. Influence of boron stress on growth and physiological characteristics of Gracilaria lemaneiformis[J]. South China Fisheries Science, 2014, 10(4): 9-15. (  0) 0) |
| [44] |
崔相东. 叶片切除后养殖裙带菜(Undaria pinnatifida)补偿生长机制和防御应答机制的初步研究[D]. 青岛: 中国海洋大学, 2013. Cui X D. The Primary Study of Compensation Mechanism and Defence and Respone Mechanism of Undaria pinnatifida After Thallus Excision Under Cultivation[D]. Qingdao: Ocean University of China, 2013. (  0) 0) |
| [45] |
徐群, 刘岩, 宫庆礼. 鼠尾藻hsp70基因的克隆及温度和盐度对其表达的影响[J]. 中国海洋大学学报(自然科学版), 2017, 47(11): 24-30. Xu Q, Liu Y, Gong Q L. Isolation of Sargassum thunbergii hsp70 gene and its expression analysis at different temperatures and salinities[J]. Periodical of Ocean University of China, 2017, 47(11): 24-30. (  0) 0) |
 2023, Vol. 53
2023, Vol. 53


